-
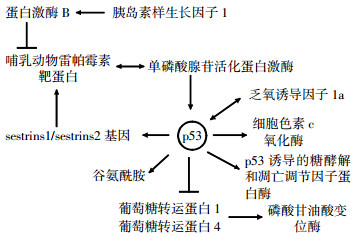
p53基因是迄今发现与人类肿瘤相关性最高的基因, 在短短的十多年里, 人们对p53基因的认识经历了癌蛋白抗原、癌基因、抑癌基因3个认识的转变。50%以上的恶性肿瘤会出现该基因的突变。最近的研究发现, p53基因在能量代谢方面具有重要的调节作用, 它可被单磷酸腺苷活化蛋白激酶(adenosine monophosphate activated potein kinase, AMPK)和哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)通路调节的代谢应激所激活, 在病理和正常的生理状况下通过平衡糖酵解和氧化磷酸化调节能量代谢、氧化应激和氨基酸代谢, 例如, p53基因可通过调节2, 6-双磷酸果糖激酶、p53诱导基因TP53诱导的糖酵解和凋亡调节因子(TP53-induced glycolysis and apoptosis regulator, TIGAR)和电子传递链上复合体IV的亚单位细胞色素C氧化酶转录来调节氧化磷酸化[1], 也可通过调节葡萄糖载体谷氨酰胺酶2和脂肪酸合酶的表达来间接地影响能量代谢。另一方面, p53基因的功能状态及其相应的能量代谢改变在电离辐射诱发肿瘤的过程中具有举足轻重的作用, p53基因状态的改变使得DNA受损细胞不能得到及时修复或清除, 成为诱发肿瘤的机制之一。本文对p53基因在能量代谢中的作用及其分子机制和与电离辐射生物效应的关系进行了简要综述。
-
葡萄糖的利用度对细胞增殖调节的影响是通过激活AMPK通路所介导的。代谢性应激通过AMPK依赖的磷酸化调节激活p53, 并受到mTOR的影响[2]。mTOR在细胞中有两个复合体:mTOR-C1和mTOR-C2, 它在调节细胞的增殖、存活和能量代谢方面起着非常重要的作用。代谢性应激激活AMPK通路, 反过来又磷酸化和激活结节性硬化症蛋白2(tuberous sclerosis complex protein 2, TSC2)。TSC2通过激活鸟苷三磷酸酶负向调节三磷酸鸟苷(guanosine triphosphate)结合蛋白, 此蛋白通过激活mTOR-C1可以直接或间接脱去15位丝氨酸的磷酸化p53来满足营养缺乏的需要。p53基因诱导许多p53靶基因在胰岛素样生长因子1/蛋白激酶B和mTOR途径的表达, 诱导表达的p53靶基因包括胰岛素生长因子结合蛋白3、人第10号染色体缺失的磷酸酶及张力蛋白同源的基因、TSC2、AMPK β1、PA26基因、乏氧诱导基因95和调控p63和p53基因转录的靶点[3-4], 这些基因都是通过应激负向调节胰岛素样生长因子1/蛋白激酶B和mTOR通路。最近的研究已经表明AMPK可以通过结合P53的靶基因sestrins1或sestrins2而激活, p53基因诱导sestrins1和sestrins2的表达, 通过和AMPK的α-亚基的相互作用导致AMPK在172位苏氨酸位点的磷酸化, 这导致了AMPK和TSC2通路的激活, 同时抑制了mTOR-C1的活性[3]。sestrins有降低细胞内活性氧的作用, p53通过具有遗传毒性的应激反应导致sestrins1和sestrins2的表达升高, 显示出抗氧化应激的作用[5-6], sestrins1和sestrins2与AMPK的催化亚基相互作用增加了AMPK的磷酸化, 并可诱导激活AMPK通路。此外, sestrins1和sestrins2可以优先激活AMPK向TSC2的磷酸化转化, 诱导AMPK转化为TSC2[3]。Budanov和Karin[3]的研究表明, 在p53存在的情况下, 代谢应激对mTOR-C1有重要的抑制作用。因此, 通过转录不同的目标基因, p53基因负向调控胰岛素样生长因子1/蛋白激酶B和mTOR途径, 建立了一个跨通路信号传导网络, 促使细胞在应激存在的情况下停止生长和分裂, 以避免细胞在生长和分裂的过程中发生错误。由此可见, p53基因在代谢性应激的调节过程中具有非常重要的作用。
在正常细胞中, P53通过泛素化降解维持在比较低的水平。细胞受到电离辐射及癌基因激活等应激时, P53的泛素化被抑制, 同时多种蛋白酶通过磷酸化或乙酰化修饰P53。这些翻译后的修饰使得P53保持在一个比较稳定的状态。当机体受到小剂量的电离辐射时, 通过代谢性应激可使细胞获得一定的修复能力, 说明初始的小剂量电离辐射可以使细胞在受到高剂量的电离辐射时获得很强的修复电离辐射损伤的能力。这一过程中的两个关键因子是P53和P38, P53和P38的相互作用起到了“分子开关”的作用, 决定了细胞在电离辐射损伤之后的命运。低剂量电离辐射作用时, P53和P38分别作用, 使受损的细胞得到修复; 而在高剂量的电离辐射作用时, P38直接与P53蛋白15位丝氨酸位点磷酸化结合, 促使细胞凋亡[7]。在各种代谢性应激(包括电离辐射、DNA损伤等)时, p53可以被不同的信号通路激活, 并通过增强其下游多种基因的转录而引起细胞周期阻滞、凋亡或衰老来保持细胞基因组的完整性并清除损伤细胞, 但p53通过代谢性应激调节电离辐射效应的具体分子机制目前还不是很清楚, 尚待进一步研究。这一具体机制的深入研究将为肿瘤放射治疗方案的制定提供更好的指导, 并为抗肿瘤药物的研发提供很好的参考依据。
-
葡萄糖通过糖酵解代谢途径生成丙酮酸, 同时生成ATP和还原型辅酶Ⅰ。在所有的生物族群中几乎都存在糖酵解途径, 这表明糖酵解是一个古老的代谢途径。有研究发现, p53通过调节果糖2, 6-双磷酸酶和TIGAR的表达来调节糖酵解[8-9]。TIGAR通过降解2, 6-双磷酸果糖下调糖酵解, 2, 6-双磷酸果糖是6-磷酸果糖激酶在糖酵解中强有力的变构效应因子[8]。TIGAR通过去磷酸化使2, 6-双磷酸果糖转化为6-磷酸果糖来降低糖酵解的活性, 促使葡萄糖进入糖酵解的替代途径——磷酸戊糖途径, 同时通过促进谷胱甘肽的生成来减少活性氧的产生, 进而抑制细胞凋亡。磷酸戊糖途径可以产生更多的还原型烟酰胺腺嘌呤二核苷酸磷酸[8], 烟酰胺腺嘌呤二核苷酸磷酸是脂质和核酸合成等一系列反应中的还原剂。p53突变能激活己糖激酶2和磷酸甘油酸变位酶(phosphoglyceratemutase, PGM)的表达, 己糖激酶2和PGM都参与糖酵解途径。这表明, 突变型p53可以上调己糖激酶2基因在肝癌细胞中的表达, p53在肿瘤细胞中具有增加糖酵解的作用, 而正常型p53通过抑制葡萄糖载体葡萄糖转运蛋白1和葡萄糖转运蛋白4的表达来抑制PGM的表达[10]。这对调节小鼠胚胎成纤维细胞的无限增殖具有非常重要的作用。p53基因通过调节糖酵解, 可以影响细胞内的活性氧水平。TIGAR和PGM都具有抗氧化作用[8], TIGAR通过使葡萄糖进入磷酸戊糖途径降低活性氧水平, 而PGM通过降低线粒体呼吸增强糖酵解, 以减少活性氧的产生。显然, p53能够诱导一些抗氧化基因(如TIGAR)的表达, 同时, 也激活了氧化应激基因的表达。因此, p53基因的氧化和抗氧化功能都有助于抑制肿瘤的发生和发展。
在p53正常型的细胞中, 能量的主要来源为细胞有氧氧化代谢产生的ATP, 但是在p53突变或者缺失的肿瘤细胞中, 在缺氧的条件下, 细胞的能量来源主要是糖酵解。乏氧诱导因子(hypoxia-indu-cible transcription factor, HIF)是目前发现的介导细胞缺氧条件下最关键的转录因子之一, 它可以和p53基因相互作用共同调节细胞的能量代谢[11], 还可以提高肿瘤细胞的糖酵解, 使肿瘤细胞有计划地对缺氧做出应答。HIF在缺氧条件下比有氧条件下的表达更高, 有研究发现, 肿瘤细胞在受到辐射后会产生大量的HIF-1а, HIF-1а可以减少血管内皮细胞的凋亡、促进血管生成, 同时在缺氧的条件下, 可以诱导血管内皮生长因子的表达[12], 促使肿瘤新生血管的形成, 从而使肿瘤细胞对辐射具有比较强的抵抗力, 这也是有些肿瘤对放射治疗不是很敏感的原因之一。乏氧诱导的辐射抵抗是引起放射治疗灵敏性减弱、化疗耐药及肿瘤扩散转移的重要原因, p53和HIF相互作用促使了糖酵解的一些变化, 同时导致了辐射抵抗, 因此, 利用乏氧诱导肿瘤靶向基因的治疗展现出了可喜的应用前景。
-
氧化磷酸化作用是指有机物(包括葡萄糖、脂类、氨基酸等)在分解过程中的氧化步骤所释放的能量驱动ATP合成的过程。在真核细胞中, 氧化磷酸化作用在线粒体中发生, 产生H2O和ATP, 相比糖酵解而言, 有更高的ATP生成效率, 位于线粒体中的参与三羧酸循环的酶催化丙酮酸氧化生成ATP[13]。在小鼠和人类肿瘤细胞中, p53通过一个重要的合成蛋白——细胞色素c氧化合成酶2(synthesis of cytochrome c oxidase, SCO2)来直接调节线粒体的耗氧量[9], 在哺乳动物细胞中, SCO2为细胞色素c氧化酶的合成所必需。细胞色素c氧化酶在细胞的能量代谢过程中起着关键作用, 可催化电子从还原性的细胞色素c转移至氧气。细胞的功能活动与细胞色素c氧化酶的活性密切相关, 细胞色素c氧化酶的活性和含量下降可直接干扰呼吸链的电子传递, 进而影响细胞的能量代谢, 细胞色素c氧化酶是一种氧化还原酶, 是一种存在于线粒体上的大型跨膜蛋白复合物, 主要通过氧化磷酸化为细胞提供能量。p53在正常组织中诱导SCO2的表达, 从而保证了细胞色素c氧化酶维持在一定的水平, 进而促进了线粒体的呼吸作用[9]。在p53缺失的细胞中, 氧化磷酸化水平的下降可以通过诱导SCO2的表达回归正常的生理水平[14]。例如, 在结肠癌细胞株DLD1和SW480中, p53基因突变存在的情况下, SCO2的表达可以增加氧消耗[9]。在结肠癌细胞株HCT116中, p53缺失导致SCO2的低表达, 进而导致了较低的氧化磷酸化水平, 此时需通过增加糖酵解来满足细胞能量代谢的平衡[14]。这表明, 没有了p53对SCO2的调控, 线粒体呼吸链受损, 导致ATP的产生途径从线粒体氧化磷酸化转向糖酵解。除SCO2外, 谷氨酰胺是一个新近发现的p53调节蛋白[15], 谷氨酰胺可以编码线粒体谷氨酰胺酶, 此酶可以催化谷氨酰胺水解为谷氨酸。谷氨酰胺通过增加谷氨酸和α-酮戊二酸的生成来调节细胞的能量代谢, 致使线粒体呼吸加强, ATP的生成增多。这表明p53对氧化磷酸化的调控具有重要作用。
p53基因正常型的细胞具有比较高的电离辐射敏感性, 但是一些p53基因突变的细胞对电离辐射具有很强的辐射抵抗, 同时, 在葡萄糖缺乏的条件下, 机体发生的辐射抵抗会明显增强[16]。p53和氧化磷酸化的综合作用导致了辐射敏感性的变化。另有研究表明, 线粒体DNA的突变可以影响细胞的氧化磷酸化, 致使ATP生成障碍, 进而导致细胞发生辐射超敏反应[17]。反过来, 电离辐射又可以引起氧化磷酸化的抑制, 使细胞线粒体的氧化磷酸化发生障碍, ATP的产生减少甚至停止, 导致机体电离辐射敏感性增强, 使蛋白质、DNA、RNA更容易受到损伤。这些研究结果对肿瘤临床放射治疗具有非常重要的指导意义, 在肿瘤的放射治疗过程中, 可以通过化疗药物抑制氧化磷酸化或者腺病毒载体转染p53基因的方式提高肿瘤放射治疗的敏感性, 增强放疗效果。p53和氧化磷酸化综合作用导致了放射敏感性的变化, 其具体机制尚待进一步研究, 这对肿瘤治疗方案的制定具有重要的指导意义。
-
Warburg效应由诺贝尔奖获得者德国生物化学家Warburg首次报道, 与正常细胞相比, 肿瘤细胞即使在氧气供应充足的情况下也仍然以糖酵解作为生产ATP的主要方式[18]。此现象是细胞恶变过程中最为基础的代谢性改变之一, 肿瘤细胞的这种现象被称为Warburg效应。事实上, 恶性肿瘤生长所需的能量主要由非氧化途径糖酵解所提供[18], 而正常细胞所需的能量, 主要来源于糖酵解的代谢产物丙酮酸在线粒体的氧化分解。Warburg同时指出, 肿瘤细胞中糖酵解的增强是由于肿瘤细胞中线粒体功能不可逆转的损伤所导致的[18]。Warburg效应在大多数肿瘤细胞中存在, 目前认为, 造成Warburg效应的原因包括线粒体功能缺陷、缺氧、肿瘤基因信号以及某些代谢酶的异常表达, 其中, 肿瘤细胞线粒体功能缺陷被认为是造成Warburg效应的主要原因[19]。最近的研究表明, p53缺失的肿瘤细胞在糖酵解增强的同时氧化磷酸化明显减弱, 说明p53的功能状态在Warburg效应分子机制的调节中具有非常重要的作用[20]。这些发现说明p53和Warburg效应在调节能量代谢的过程中具有非常重要的联系, 提供了一个新的解释Warburg效应的分子机制, 同时说明p53通过调节能量代谢发挥了抑制肿瘤生长的作用[21]。p53具有抑制肿瘤形成的重要作用且在肿瘤细胞中具有非常高的突变率(>50%), 这些研究结果说明, p53基因的突变以及由此产生的肿瘤细胞中P53蛋白功能的丧失是Warburg效应中一个非常重要的变化。
基于肿瘤的实验研究表明, 肿瘤细胞Warburg效应中通过糖酵解产生的乳酸和辐射抵抗呈正相关[22], 这种辐射抵抗的产生部分是由于乳酸本身所具有的抗氧化性而形成的。p53突变的肿瘤细胞具有明显的辐射抵抗性能, p53突变和Warburg效应相互作用会影响肿瘤细胞的辐射敏感性。在肿瘤的治疗过程中, 诸如放射治疗和化学药物治疗, 都诱发了肿瘤细胞的氧化应激, 导致了活性氧的产生, 进而促使DNA和RNA损伤、脂质过氧化反应和基因组的不稳定性。p53通过一系列的代谢通路可以影响活性氧的产生, 活性氧在辐射诱导的DNA损伤中具有非常重要的作用, 而Warburg效应中产生的一些抗氧化物(如乳酸)可以很好地中和活性氧, 因此, 抗氧化物的积聚能增强肿瘤细胞的辐射抵抗并降低化学药物治疗的疗效[23]。由于在肿瘤放射治疗和化学药物治疗后, 肿瘤细胞中的乳酸水平有了一定的降低[24], 因此, 检测肿瘤的代谢改变可以评估肿瘤治疗的疗效。总之, 通过控制糖酵解来改变乳酸和活性氧的水平可以达到更好的肿瘤治疗效果, 而p53和Warburg效应在这一过程中具有非常重要的调节作用, p53和Warburg效应影响辐射敏感性的一些具体分子机制尚待进一步研究, 这对深入探索肿瘤的发生发展, 肿瘤的临床治疗及对放射治疗疗效的评估具有重要意义。
-
放射治疗在肿瘤的治疗过程中有非常重要的作用, 肿瘤的放射治疗方案也在不断地改进, 研究p53和能量代谢的相互关系及其对辐射效应的影响, 可以更好地理解肿瘤的发生发展, 并可为肿瘤放射治疗方案的制定提供更好的临床指导, p53可通过多种途径在调节细胞的能量代谢中发挥重要作用(图 1)。并且p53和辐射生物效应的研究是现在放射生物学研究的热点, 最近的研究发现, p53通过调节应激诱导的转录程序和许多不同的机制感知能量代谢的改变去调节能量代谢通路, p53调控的能量代谢及其对辐射生物效应影响的具体机制尚待进一步研究。放射治疗技术为我们开辟了一个崭新的肿瘤治疗的时代, 而在21世纪, 肿瘤的放射治疗技术将成为更加有应用前景的科学。随着我们对辐射效应的一些分子机制的研究, 肿瘤放射治疗学将会以更快的发展速度推动肿瘤临床治疗的进步。更好地理解p53在能量代谢平衡调节及其辐射生物效应中的作用将有助于为靶向能量代谢的肿瘤治疗策略提供新的视野和契机, 并为肿瘤治疗方案的制定提供更好地参考。
p53调控的能量代谢对辐射效应的影响
Influence of p53-regulated energy metabolism in radiation effects
-
摘要: p53基因一直是肿瘤病因学、放射生物学的研究热点, 但受其调控的能量代谢在辐射生物效应中的作用还存在许多未知因素。了解p53基因调控的能量代谢对探讨肿瘤放射治疗疗效、辐射损伤、辐射致癌的早期筛选生物指标和分子流行病学调查均有着极其重要的意义。该文概述了此方面的研究进展。Abstract: p53 is a hot spot in the studies of tumor etiology and radiobiology, but the function of p53-reguated energy metabolism in radiation biological effects still remains many uncertainties. The in-depth study of p53-regulated energy metabolism is of great significance to investigate the tumor radiotherapy efficacy, radiation damage, carcinogenesis and even molecular epidemiology. The current research progress at this point was stated in this article.
-
Key words:
- Genes, p53 /
- Energy metabolism /
- Radiation effects /
- Neoplasms /
- Radiotherapy
-
[1] Shen L, Sun X, Fu ZH, et al. The fundamental role of the p53 pathway in tumor metabolism and its implication in tumor therapy. Clin Cancer Res, 2012, 18(6): 1561-1567. [2] Maddocks OD, Vousden KH. Vousden Metabolic regulation by p53. J Mol Med (Berl), 2011, 89(3): 237-245. [3] Budanov AV, Karin M. p53 target genes sestrin1 and sestrin2 connect genotoxic stress and mTOR signaling. Cell, 2008, 134(3): 451-460. [4] Feng Z, Zhang H, Levine AJ, et al. The coordinate regulation of the p53 and mTOR pathways in cells. Proc Natl Acad Sci USA, 2005, 102(23): 8204-8209. [5] Budanov AV, Shoshani T, Faerman A, et al. Identification of a novel stress-responsive gene Hi95 involved in regulation of cell viability. Oncogene, 2002, 21(39): 6017-6031. [6] Sablina AA, Budanov AV, Ilyinskaya GV, et al. The antioxidant function of the p53 tumor suppressor. Nat Med, 2005, 11(12): 1306-1313. [7] Gong X, Liu A, Ming X, et al. UV-induced interaction between p38 MAPK and p53 serves as a molecular switch in determining cell fate. FEBS Lett, 2010, 584(23): 4711-4716. [8] Bensaad K, Tsuruta A, Selak MA, et al. TIGAR, a p53-inducible regulator of glycolysis and apoptosis. Cell, 2006, 126(1): 107-120. [9] Matoba S, Kang JG, Patino WD, et al. p53 regulates mitochondrial respiration. Science, 2006, 312(5780): 1650-1653. [10] Schwartzenberg-Bar-Yoseph F, Armoni M, Karnieli E. The tumor suppressor p53 down-regulates glucose transporters GLUT1 and GLUT4 gene expression. Cancer Res, 2004, 64(7): 2627-2633. [11] Yeung SJ, Pan J, Lee MH. Roles of p53, MYC and HIF-1 in regulating glycolysis—the seventh hallmark of cancer. Cell Mol Life Sci, 2008, 65(24): 3981-3999. [12] Zhou H, Yang YH, Binmadi NO, et al. The hypoxia-inducible factor-responsive proteins semaphorin 4D and vascular endothelial growth factor promote tumor growth and angiogenesis in oral squamous cell carcinoma. Exp Cell Res, 2012, 318(14): 1685-1698. [13] Jones RG, Thompson CB. Tumor suppressors and cell metabolism: a recipe for cancer growth. Genes Dev, 2009, 23(5): 537-548. [14] Ma W, Sung HJ, Park JY, et al. A pivotal role for p53: balancing aerobic respiration and glycolysis. J Bioenerg Biomembr, 2007, 39(3): 243-246. [15] Hu WW, Zhang C, Wu R, et al. Glutaminase 2, a novel p53 target gene regulating energy metabolism and antioxidant function. Proc Natl Acad Sci USA, 2010, 107(16): 7455-7460. [16] Li J, Ayene R, Ward KM, et al. Glucose deprivation increases nuclear DNA repair protein Ku and resistance to radiation induced oxidative stress in human cancer cells. Cell Biochem Funct, 2009, 27(2): 93-101. [17] Kulkarni R, Marples B, Balasubramaniam M, et al. Mitochondrial gene expression changes in normal and mitochondrial mutant cells after exposure to ionizing radiation. Radiat Res, 2010, 173(5): 635-644. [18] Warburg O. On the origin of cancer cells. Science, 1956, 123(3191): 309-314. [19] Bayley JP, Devilee P. The Warburg effect in 2012. Curr Opin Oncol, 2012, 24(1): 62-67. [20] Johnson RF, Perkins ND. Nuclear factor-kappaB, p53, and mitochondria: regulation of cellular metabolism and the Warburg effect. Trends Biochem Sci, 2012, 37(8): 317-324. [21] Sun Y, Holley AK, St Clair DK. p53 regulation of energy metabolism and mitochondria regulation of p53 in cancer cells: an insight into the role of manganese superoxide dismutase[J/OL]. Curr Pharm Biotechnol, 2012[2012-06-20]. http://www.ncbi.nlm.nih.gov/pubmed/22201594[published online ahead of print June, 2012]. [22] Sattler UG, Meyer SS, Quennet V, et al. Glycolytic metabolism and tumour response to fractionated irradiation. Radiother Oncol, 2010, 94(1): 102-109. [23] Sattler UG, Mueller-Klieser W. The anti-oxidant capacity of tumour glycolysis. Int J Radiat Biol, 2009, 85(11): 963-971. [24] Plathow C, Weber WA. Tumor cell metabolism imaging. J Nucl Med, 2008, 49 Suppl 2: 43S-63. -






 下载:
下载: