-
霍奇金淋巴瘤(Hodgkin lymphoma, HL)是淋巴瘤中的一大类别, 常发生于一组淋巴结, 再扩散到其他淋巴结或结外器官和组织。HL的组织病理学特征为恶性Reed-Sternberg细胞的出现。近年来, 随着治疗手段的多样化, 手术、放化疗及生物治疗等方法的单纯或联合应用, 使HL的临床治愈率已达80%以上。尽管如此, 仍有部分患者因治疗后病灶残留或复发而致病情恶化。因此, 治疗后及时、灵敏地检测有无肿瘤残余灶及其他受侵组织, 准确评价治疗效果并制定下一步治疗方案, 对提高患者生存期至关重要。目前, 临床常用X射线、B超、CT等基于病灶大小、密度等形态学改变进行诊断的常规影像学方法来评价疗效, 但均存在一定的局限性[1]。18F-FDG PET-CT能从分子水平上反映肿瘤组织的生化变化和代谢状态, 并与精细解剖结构信息融合, 对HL的诊断、疗效监测和预后判断具有重要作用[2]。本研究通过总结分析31例HL患者治疗后的18F-FDG PET-CT结果, 并与单纯CT及同期血清乳酸脱氢酶(lactate dehydrogenase, LDH)、β2-微球蛋白(β2-microglobulin, β2-MG)检测结果进行统计分析, 探讨18F-FDG PET-CT对HL疗效评价的临床意义。
-
回顾性分析2011年7月至2012年6月在我院治疗的31例HL患者, 其中, 男性20例、女性11例, 年龄13~86岁, 中位年龄34岁, 所有患者均经手术或病理活检确诊, 根据Ann Arbor分期[3]划分:Ⅰ期6例、Ⅱ期10例、Ⅲ期10例、Ⅳ期5例; 根据2001年世界卫生组织关于淋巴造血系统肿瘤病理分型[3]划分:结节性淋巴细胞为主型4例、经典型27例(包括混合细胞型8例、富含淋巴细胞型1例、结节硬化型11例、淋巴细胞消减型1例、由于细胞量少不能再分型者6例)。
-
对Ⅰ、Ⅱ、Ⅲ期患者采用“多柔比星+博来霉素+长春花碱+达卡巴嗪(adriamycin-bleomycin-vinblastine-dacarbazine, ABVD)”方案化疗; 对IV期患者采用“博来霉素+足叶乙苷+多柔比星+环磷酰胺+长春新碱+丙卡巴肼+泼尼松(bleomycin-etoposide-adriamycin-cyclophosphamide-oncovin-procarbazine-prednisone, BEACOPP)”组成的强化方案化疗, 所有患者治疗后1~2个月行18F-FDG PET-CT进行疗效评价。
-
采用荷兰Philips公司生产的Gemini TF 64 PET-CT仪, 18F-FDG由日本住友公司HM-10回旋加速器生产, 放化纯度>95%。患者检查前禁食6 h以上, 控制血糖范围在3.9~7.5 mmol/L。经静脉注射185~370 MBq(5~10 mCi)18F-FDG后, 患者安静休息约60 min, 排尿后仰卧位上机扫描。先行CT扫描, 采集条件为:120 kV, 200 mA, 矩阵512×512, 层厚5 mm。然后以1.0 min/床位的速度采集从颅底至股骨上段的PET图像。采用三维模式采集, 应用CT数据进行衰减校正, 在EBW 2.0后处理工作站上将PET图像和CT图像进行融合, 分别得到横断面、矢状面及冠状面的PET、CT及PET-CT融合图像。
-
定性诊断:以病理或临床随访结果作为最终诊断结果, 统计病灶总数及病灶的良恶性。临床随访内容包括:症状观察、体格检查、CT、MRI、B超、血生化检查、99Tcm-MDP SPECT及临床治疗措施等, 随访时间为3~9个月。①临床随访判断良恶性标准:随时间延长, 若原发部位病灶或淋巴结较治疗前增大、增多, 或复查PET-CT发现病灶部位出现异常高代谢, 可考虑为恶性, 即治疗后病灶内仍有肿瘤细胞存活; 若原发部位病灶或淋巴结较治疗前大小无明显变化, 或体积减小, 可考虑为良性, 即治疗后病灶内纤维化、瘢痕组织形成。②治疗后PET-CT判断良恶性标准:若治疗后病灶内仍见异常高代谢, 或原发部位病灶、淋巴结较治疗前增大, 可考虑为恶性; 若原发部位病灶、增大淋巴结消失, 或CT图像上示局部仍有病灶残留但PET相应部位无异常高代谢, 可考虑为良性(肿瘤活性受抑制)。③单纯CT判断良恶性标准:若原发部位病灶、淋巴结较治疗前增大, 或治疗后局部仍有病灶残留, 可考虑为恶性; 若治疗后病灶或增大淋巴结消失, 或淋巴结缩小至正常大小, 可考虑为良性。④淋巴结增大判断标准[4]:纵隔内下气管旁组(4R区)及隆突下(7区)淋巴结直径>1.5 cm、全身其他部位淋巴结直径>1 cm。病灶代谢由肉眼对病灶与邻近组织对比并结合最大标准化摄取值(maximum standardized uptake value, SUVmax)进行判断。PET采用感兴趣区技术, 由计算机计算出SUVmax, 以SUVmax>2.5考虑为病灶具高活性, SUVmax为2.0~2.5考虑为仍有活性, SUVmax为1.5~2.0考虑为较低活性, 同时结合病变部位及形态加以判断。
定位诊断:按德国HL研究组推荐, 全身31个解剖部位可分为22个淋巴结区[左上颈(包括左颌下)、右上颈(包括右颌下)、左侧Waldeyer环、右侧Waldeyer环、左侧颈部、右侧颈部、左侧锁骨上下区、右侧锁骨上下区、左侧腋下、右侧腋下、纵隔、左侧肺门、右侧肺门、肠系膜、肝门、脾门、主动脉双侧、左侧髂部、右侧髂部、左侧腹股沟区、右侧腹股沟区、四肢淋巴结等]、8个结外区域[左侧肺部(包括胸膜)、右侧肺部(包括胸膜)、肝脏、脾脏、胰腺、胃、小肠及其他]、1个骨或骨髓浸润[5]。
本组图像分析均由两位以上有经验的核医学医师单独对PET图像、CT图像及PET-CT融合图像分别判读, 并与最终诊断结果进行比较。统计PET-CT及单纯CT诊断的假阴性及假阳性, 计算二者评价HL治疗效果的灵敏度、特异度、准确率、阳性预测值及阴性预测值。
-
全部患者均于PET-CT检查3 d内, 于清晨空腹经静脉采血, 立即分离血清检测LDH及β2-MG水平。检测时采用日本Roche公司Modular E170电化学发光免疫分析仪及其配套的试剂, LDH的正常参考值为90~180 U/L; β2-MG的正常参考值为1.0~3.0 mg/L。
-
采用SPSS 13.0软件进行统计学分析, 计数资料以率(%)表示, 采用χ2检验及确切概率法进行统计学分析, P<0.05表示差异有统计学意义。SUVmax和LDH、β2-MG的相关性分析采用多元线性回归分析。
-
31例HL患者中共发现病灶145处, 其中, 13处经再次活检或手术证实, 其余为随访确诊。所有病灶中, 恶性病灶94处, 包括16处结外区域或骨受累, 分别为:胸腺1处、心包2处、左肾上腺1处、脾3处、肝1处、肺5处以及骨3处, 另78处病灶分别为:左上颈4处、右上颈6处、左颈6处、右颈10处、左锁骨区7处、右锁骨区6处、左腋下2处、右腋下3处、纵隔13处、左肺门4处、右肺门3处、腹腔3处、腹膜后6处、左髂部1处、右髂部1处、左腹股沟1处和右腹股沟2处, 最小病灶为颈部淋巴结, 直径为0.6 cm, SUVmax为3.2;良性病灶51处, 分别为:肺3处、脾5处(均为脾肿大)、肝1处、骨1处、鼻咽部2处(均为炎症)、左上颈2处、右上颈3处、左颈5处、右颈4处、右锁骨区2处、左锁骨区1处、左腋下2处、右腋下7处、纵隔5处、腹膜后2处、左髂部1处、左腹股沟区3处、右腹股沟区2处。
-
145处病灶中, 18F-FDG PET-CT诊断真阳性92处、真阴性48处、假阳性3处(1处鼻咽病灶, 经随访证实为炎症; 右下颈及右甲状腺高代谢病灶, 经随访证实为甲状腺癌伴右颈淋巴结转移)、假阴性2处(1处为肺内直径约0.5 cm的低代谢小病灶, 半年后经CT复查, 结节增大, 证实为浸润病灶; 1处为肝内等密度结节, 低代谢, 半年后增强CT示肝浸润)。18F-FDG PET-CT对HL化疗后病灶的诊断效能为:灵敏度97.87%(92/94)、特异度94.12%(48/51)、阳性预测值96.84%(92/95)、阴性预测值96.00%(48/50)、准确率96.55%(140/145)。
145处病灶中, 单纯CT诊断真阳性80处、真阴性33处、假阴性14处、假阳性18处(图 1)。单纯CT对HL化疗后病灶的诊断效能为:灵敏度85.10%(80/94)、特异度64.70%(33/51)、阳性预测值81.63%(80/98)、阴性预测值70.21%(33/47)、准确率77.93%(113/145)。

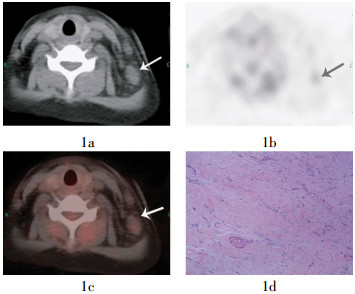
图 1 患者女性,26岁,霍奇金淋巴瘤(结节硬化型)Ⅳ期,采用“博来霉素+足叶乙苷+多柔比星+环磷酰胺+长春新碱+丙卡巴肼+泼尼松”化疗后,左下颈部淋巴结大小约2.2 cm伊1.5 cm,最大标准化摄取值为1.7,病理示左下颈淋巴结大部分纤维化伴胶原变性,其中仅见少量淋巴组织,未见明显肿瘤残留,符合化疗后改变。图中,1a为CT示左下颈淋巴结肿大;1b为PET示局部代谢与软组织本底同;1c为PET-CT融合图像;1d为左下颈淋巴结切除活检病理(苏木精-伊红染色,伊100),图中箭头所示为左下颈淋巴结。
18F-FDG PET-CT评价HL治疗效果的灵敏度、特异度、阳性预测值、阴性预测值及准确率均明显优于单纯CT检查(表 1)。
灵敏度 特异度 阳性预测值 阴性预测值 准确率 PET-CT 97.87
(92/94)94.12
(48/51)96.84
(92/95)96.00
(48/50)96.55
(140/145)单纯CT 85.10
(80/94)64.70
(33/51)81.63
(80/98)70.21
(33/47)77.93
(113/145)χ2值 9.83 13.49 11.50 11.69 22.58 P值 <0.01 <0.01 <0.01 <0.01 <0.01 表 1 18F-FDG PET-CT与单纯CT在霍奇金淋巴瘤化疗后疗效评价中诊断效能的比较(%)
-
31例HL患者中, 共有16例(51.61%)因18F-FDG PET-CT检查而更改治疗方案, 其中1例修正诊断后转科治疗, 其余15例的详细情况如下:
因显像后局部肿瘤仍残留活性, 8例追加局部放疗、2例追加鞘内化疗、1例追加细胞因子诱导的杀伤细胞过继免疫治疗。1例细胞消减型ⅡA期患者, 18F-FDG PET-CT示纵隔病灶大小为2.0 cm×1.1 cm, 仍有少许代谢, 立即追加化疗2周期(常规应3个月后视情况而定是否予以再次化疗)。1例ⅢA期患者修正诊断, PET-CT检查前诊断为混合细胞型ⅣAE期HL患者, 累及右侧甲状腺, 化疗后行PET-CT, PET-CT图像示甲状腺右叶上极见一低密度结节, 大小约1.9 cm×1.0 cm, SUVmax为6.0, 局部见数个点状、片状钙化灶; 右侧锁骨区见肿大淋巴结, 大小约1.5 cm×1.2 cm, SUVmax为12;右肺中叶见一斑片状磨玻璃样密度影, 范围约2.8 cm×1.7 cm, SUVmax为1.3, 提示肺部存在慢性炎性改变, 而ABVD方案中的博来霉素易导致肺部间质性改变, 为预防治疗后并发严重的肺部病变, 暂停博来霉素化疗, 更改为“多柔比星+长春花碱+达卡巴嗪”方案化疗, 并请外科治疗(图 2)。此外还有1例因PET-CT检查发现肺炎而更改治疗方案。1例ⅢAS期患者因治疗不理想, 改ABVD方案为“长春瑞滨+泽菲+奥沙利铂+地塞米松”并配合600 mg美罗华治疗。

图 2 患者男性,59岁,霍奇金淋巴瘤(混合细胞型)ⅢA期,治疗前诊断为霍奇金淋巴瘤ⅣAE期累及右侧甲状腺,治疗后PET-CT示甲状腺右叶上极见一低密度结节,大小约1.9 cm伊1.0 cm,SUVmax为6.0,局部见数个点状、片状钙化灶;右侧锁骨区见肿大淋巴结,大小约1.5 cm伊1.2 cm,SUVmax为12,修正诊断为:淤霍奇金淋巴瘤(混合细胞型)ⅢA期化疗后;于甲状腺癌伴锁骨区淋巴结肿大。图中,2a为化疗后首次PET- CT融合图像,示右颈淋巴结高代谢,右甲状腺上极高代谢;2b为再次化疗后PET-CT融合图像,仍示右颈淋巴结及右甲状腺高代谢灶;2c为首次化疗后PET- CT最大密度投影图像;2d为再次化疗后PET-CT最大密度投影图像。
-
31例患者中, 病灶SUVmax最低为0.5, 最高为19.7, 平均5.4±4.79;血清LDH水平最低为107.0 U/L, 最高为484.0 U/L, 平均(215.13±100.83) U/L; 血清β2-MG水平最低为0.6 mg/L, 最高为3.8 mg/L, 平均(1.82±1.33) mg/L。
简单相关分析显示, LDH水平与SUVmax间存在一定的相关性(r=0.411, P<0.05), β2-MG水平与SUVmax间也存在一定的相关性(r=0.481, P<0.01), 但相关性均较弱。
以SUVmax为因变量, β2-MG、LDH为自变量, 采用多元线性逐步回归分析, 最终结果如下:逐步回归最终将β2-MG纳入方程(t=2.956, P<0.01), 而未将LDH纳入方程, 回归方程为:Y=-0.636+3.116X(式中Y为SUVmax, X为β2-MG)。多元线性回归方程的方差分析结果:F=8.735, P<0.05, 说明逐步拟合的回归方程有统计学意义。决定系数R2=0.231, 说明逐步拟合的回归方程中的因变量(SUVmax)的变化能被自变量(β2-MG)解释的占23.1%, 但不是很理想。
-
在欧美国家, 恶性淋巴瘤的发病率高达(11~18)/10万人, HL的发病率高达25%甚至45%, 且发病年龄呈双峰性(15~34岁、50岁以后)。而在我国, 恶性淋巴瘤患者数相对较少, 年发病率约为(2.60~2.83)/10万人, 但近年来新发病例数逐年上升, 每年至少超过25 000例, 我国HL患者数仅占恶性淋巴瘤患者总数的8%~11%, 且峰性不明显。HL源于淋巴造血组织, 是治疗效果较好、治愈率较高的恶性肿瘤之一。在新近的世界卫生组织分类中, 根据形态学、免疫学表型、遗传特性、临床特征将HL分为结节性淋巴细胞为主型淋巴瘤和经典型HL两大类型, 其中, 前者占HL总数的4%~5%, 后者约占95%, 后者又包括淋巴细胞为主型、结节硬化型、混合细胞型和淋巴细胞消减型4种亚型[6]。
传统显像技术如CT、MRI、超声等利用病变大小、形态及密度等的改变对HL做出疗效评价, 18F-FDG PET-CT是一种功能性显像技术, 能正确判断CT可疑或正常的淋巴结是否为活性肿瘤组织, 且PET-CT进行全身扫描, 能发现远处转移病灶, 有助于肿瘤的临床分期、疗效判定及治疗计划的制定, 从而提高患者的生存期和生存质量。现今PET-CT已广泛应用于淋巴瘤疗效的评价, 有文献报道18F-FDG PET-CT对恶性淋巴瘤诊断的灵敏度为71%~100%、特异度为69%~100%[7-11]。国内文献更多集中于非HL的研究, 对HL的研究相对较少。Stumpe等[12]对50例淋巴瘤患者PET与全身相关部位CT结果进行对比研究发现, PET对HL诊断的灵敏度、特异度、准确率分别为86%、96%、91%, CT的对应值为81%、40%、60%。本研究显示18F-FDG PET-CT诊断HL化疗后病灶的灵敏度、特异度、阳性预测值、阴性预测值及准确率分别为97.87%、94.12%、96.84%、96.00%、96.55%, 与文献报道相近。有研究还认为18F-FDG PET-CT结果可作为淋巴瘤结束治疗的影像学评估标准[13]。
影响HL预后的因素较多, 德国HL研究组的研究认为, 大纵隔肿块、结外受侵、B症状、红细胞沉降率、侵及淋巴结区域数目都是预后不良的因素[14]。国外文献报道18F-FDG PET可用于HL的预后评估:Hutchings等[15]对88例HL患者进行回顾性分析发现, 经2~3周期ABVD化疗后, PET阳性患者的5年生存率达39%;PET阴性患者5年生存率达92%。这些结果后来也被一些前瞻性研究所证实[16-18]。Gallamini等[19]的研究重点在于进展期HL, 这些患者经过2个周期ABVD化疗后进行18F-FDG PET-CT检查, 结果:PET阳性患者的2年生存率为0~26%;而PET阴性患者则达94%, 该研究例数不断累积, 达260例, 研究结果表明早期18F-FDG PET对HL的预后价值超过了国际预后指数。
综上所述, 18F-FDG PET-CT对化疗后的HL是一种灵敏的疗效监测手段, 有助于临床进行再分期, 适时发现并存的其他病变, 以便采用更有效的治疗手段, 值得临床推广应用。需要注意的是, 炎性组织或者其他肿瘤因糖代谢增强也可导致18F-FDG高摄取而出现假阳性, 因此, 详细的病史和体检仍很重要。对考虑可能为假阳性的患者应尽可能做病理活检加以证实。
本研究中初步尝试将SUVmax与LDH及β2-MG水平进行相关性分析。LDH是一种糖酵解酶, 在机体内催化丙酮酸和乳酸之间的氧化还原反应, 是糖的无氧酵解及糖异生的重要酶系之一。肿瘤细胞内LDH的合成及释放增多, 活性相应增高, 在国际非霍奇金淋巴瘤预后指数中, LDH水平是最独立的重要预后因素之一[20]。β2-MG是一种相对分子质量较小的蛋白质, 是细胞膜上完整组织相容性抗原的一部分。人体血内β2-MG水平相当恒定, β2-MG与肿瘤负荷相关, 广泛病变者β2-MG水平高于局限性病变者[21]。在排除肝脏、肾脏疾病和自身免疫性疾病后, β2-MG水平明显增高提示骨髓可能发生浸润。多数学者认为β2-MG水平持续升高, 提示病情恶化, 肿瘤患者治疗后β2-MG水平明显下降者病情多稳定[22-24]。本研究中, SUVmax与β2-MG水平呈弱相关, 而与LDH水平无明显相关, 这可能遗漏掉存在线性关系的其他自变量, 需再寻找出可能与SUVmax相关的其他变量纳入一起分析。
18F-FDG PET-CT在霍奇金淋巴瘤疗效评价中的临床价值
A preliminary study on clinical value of 18F-FDG PET-CT in evaluation of efficacy of Hodgkin lymphoma
-
摘要:
目的 探讨18F-FDG PET-CT在霍奇金淋巴瘤(HL)疗效评价中的临床价值。 方法 回顾性分析31例HL患者化疗后的18F-FDG PET-CT图像资料, 最终结果经病理和临床随访证实, 并与治疗后单纯CT结果进行对比分析, 采用四格表χ2进行差异的显著性检验。 结果 ① 31例患者共发现病灶145处, 其中恶性94处、良性51处。18F-FDG PET-CT评价HL治疗效果的灵敏度、特异度、阳性预测值、阴性预测值及准确率分别为97.87%、94.12%、96.84%、96.00%和96.55%, 均明显优于单纯CT检查(χ2=9.83、13.49、11.50、11.69、22.58, P均<0.05)。②31例患者经PET-CT显像后, 16例(51.61%)更改治疗方案。 结论 18F-FDG PET-CT是HL疗效监测的有效手段。 -
关键词:
- 霍奇金病 /
- 治疗效果 /
- 氟脱氧葡萄糖F18 /
- 正电子发射断层显像术 /
- 体层摄影术, X线计算机
Abstract:Objective To explore the clinical value of 18F-FDG PET-CT in the evaluation of efficacy of Hodgkin lymphoma(HL). Methods Thirty-one cases of post-treatment patients with HL were studied retrospectively. 18F-FDG PET-CT images after chemotherapy were compared with CT post-therapy results. The final diagnosis was based on pathology or clinical follow-ups. Results ① A total of 94 malignant lesions and 51 benign lesions were found in 31 patients in the study. The sensitivity, specificity, positive predictive value, negative predictive value, and accuracy of 18F-FDG PET-CT in the evaluation of efficacy of HL were 97.87%, 94.12%, 96.84%, 96.00% and 96.55% respectively, which were significantly superior to CT examination alone(χ2=9.83, 13.49, 11.50, 11.69, 22.58, all P < 0.05). ②According to the results of PET-CT, therapeutic schedules of 16 cases(51.61%)had been changed. Conclusion 18F-FDG PET-CT is an effective method in the evaluation of efficacy of HL. -
图 2 患者男性,59岁,霍奇金淋巴瘤(混合细胞型)ⅢA期,治疗前诊断为霍奇金淋巴瘤ⅣAE期累及右侧甲状腺,治疗后PET-CT示甲状腺右叶上极见一低密度结节,大小约1.9 cm伊1.0 cm,SUVmax为6.0,局部见数个点状、片状钙化灶;右侧锁骨区见肿大淋巴结,大小约1.5 cm伊1.2 cm,SUVmax为12,修正诊断为:淤霍奇金淋巴瘤(混合细胞型)ⅢA期化疗后;于甲状腺癌伴锁骨区淋巴结肿大。图中,2a为化疗后首次PET- CT融合图像,示右颈淋巴结高代谢,右甲状腺上极高代谢;2b为再次化疗后PET-CT融合图像,仍示右颈淋巴结及右甲状腺高代谢灶;2c为首次化疗后PET- CT最大密度投影图像;2d为再次化疗后PET-CT最大密度投影图像。
表 1 18F-FDG PET-CT与单纯CT在霍奇金淋巴瘤化疗后疗效评价中诊断效能的比较(%)
灵敏度 特异度 阳性预测值 阴性预测值 准确率 PET-CT 97.87
(92/94)94.12
(48/51)96.84
(92/95)96.00
(48/50)96.55
(140/145)单纯CT 85.10
(80/94)64.70
(33/51)81.63
(80/98)70.21
(33/47)77.93
(113/145)χ2值 9.83 13.49 11.50 11.69 22.58 P值 <0.01 <0.01 <0.01 <0.01 <0.01 -
[1] Cerci JJ, Trindade E, Buccheri V, et al. Consistency of FDG-PET accuracy and cost-effectiveness in initial staging of patients with Hodgkin lymphoma across jurisdictions. Clin Lymphoma Myeloma Leuk, 2011, 11(4):314-320. [2] 邓瑾, 黄赖机, 张秀萍, 等. 18F-FDG PET-CT显像在霍奇金病诊断中的应用.实用医学杂志, 2010, 26(8):1455-1456. doi: 10.3969/j.issn.1006-5725.2010.08.084
[3] Jaffe ES, Harris NL, Stein H, et al. Pathology & Genetics:tumours of haematopoietic and lymphoid tissues. Lyon:IARC Press, 2001:239-244. [4] 李国珍.临床CT诊断学.北京:中国科学技术出版社, 1994:334.
[5] 应韶旭, 林果为, 管一晖, 等. 18F-DG PET显像在恶性淋巴瘤诊断和分期中的价值.上海医学, 2002, 25(3):146-149.
[6] Grossbard ML.恶性淋巴瘤.周立强, 李陶, 译.北京: 中国医药科技出版社, 2010: 330-352.
[7] 华逢春, 管一晖, 赵军, 等. 18F-FDG PET显像在淋巴瘤诊断和分期中的应用研究.中国医学计算机成像杂志, 2002, 8(3):198-202. doi: 10.3969/j.issn.1006-5741.2002.03.013
[8] Spaepen K, Stroobants S, Dupont P, et al. Early restaging positron emission tomography with 18F-fluorodeoxyglucose predicts outcome in patients with aggressive non-Hodgkin′s lymphoma. Ann Oncol, 2002, 13(9):1356-1363. [9] Wong CY, Thie J, Parling-Lynch KJ, et al. Glucose-normalized standardized uptake value from 18F-FDG PET in classifying lymphomas. J Nucl Med, 2005, 46(10):1659-1663. [10] 贾志云, 邓候富, 青春. 18F-FDG PET或PET/CT显像在淋巴瘤中的应用.中国临床医学影像杂志, 2008, 19(2):125-127. doi: 10.3969/j.issn.1008-1062.2008.02.013
[11] 张敬勉, 赵新明, 王建方, 等. 18F-FDG PET-CT显像对淋巴瘤疗效评价的意义.临床误诊误治, 2012, 25(1):71-74. doi: 10.3969/j.issn.1002-3429.2012.01.031
[12] Stumpe KD, Urbinelli M, Steinert HC, et al. Whole-body positron emission tomography using fluorodeoxyglucose for staging of lymphoma:effectiveness and comparison with computed tomography. Eur J Nucl Med, 1998, 25(7):721-728. [13] Jerusalem G, Hustinx R, Beguin Y, et al. Evaluation of therapy for lymphoma. Semin Nuel Med, 2005, 35(3):186-196. [14] Gisselbrecht C, Mounier N, André M, et al. How to define intermediate stage in Hodgkin′s lymphoma?. Eur J Haematol Suppl, 2005, (66):111-114. [15] Hutchings M, Mikhaeel NG, Fields PA, et al. Prognostic value of interim FDG-PET after two or three cycles of chemotherapy in Hodgkin lymphoma. Ann Oncol, 2005, 16(7):1160-1168. [16] Hutchings M, Loft A, Hansen M, et al. FDG-PET after two cycles of chemotherapy predicts treatment failure and progression-free survival in Hodgkin lymphoma. Blood, 2006, 107(1):52-59. [17] Zinzani PL, Tani M, Fanti S, et al. Early positron emission tomography(PET) restaging:a predictive final response in Hodgkin′s disease patients. Ann Oncol, 2006, 17(8):1296-1300. [18] Gallamini A, Rigacci L, Merli F, et al. The predictive value of positron emission tomography scanning performed after two courses of standard therapy on treatment outcome in advanced stage Hodgkin′s disease. Haematologica, 2006, 91(4):475-481. [19] Gallamini A, Hutchings M, Rigacci L, et al. Early interim 2-[18F]fluoro-2-deoxy-D-glucose positron emission tomography is prognostically superior to international prognostic score in advanced-stage Hodgkin′s lymphoma:a report from a joint Italian Danish study. J Clin Oncol, 2007, 25(24):3746-3752. [20] Alici S, Bavbek SE, Kaytan E, et al. Survival outcomes in aggressive non-Hodgkin's lymphoma according to the International Prognostic Index. J BUON, 2003, 8(2):121-126. [21] 江红, 李佩章, 劳明.血清LDH和β2-MG水平与非霍奇金淋巴瘤的预后关系.医学研究杂志, 2008, 37(10):91-92. doi: 10.3969/j.issn.1673-548X.2008.10.033
[22] 谭洁, 夏学鸣, 李汉冲, 等.非霍奇金淋巴瘤患者血清LDH、β2-MG、CD44、Npt水平的动态检测和临床相关研究.现代肿瘤医学, 2004, 12(5):417-420. doi: 10.3969/j.issn.1672-4992.2004.05.012
[23] Grewal JS, Smith LB, Winegarden JD, et al. Highly aggressive ALK-positive anaplastic large cell lymphoma with a leukemic phase and multi-organ involvement:a report of three cases and a review of the literature. Amm Hematol, 2007, 86(7):499-508. [24] Federico M, Guglielmi C, Luminari S, et al. Prognostic relevance of serum β2 microglobulin in patients with follicular lymphoma treated with anthracycline-containing regimens. A GISL study. Haematologica, 2007, 92(11):1482-1488. doi: 10.3324/haematol.11502 -





 下载:
下载: