-
卵巢癌的发病率在妇科恶性肿瘤中位居第一。由于多数患者在其发现时多属晚期, 导致卵巢癌患者的病死率一直居高不下, 5年生存率仅为30%左右。同其他肿瘤一样, 卵巢癌的复发是影响卵巢癌患者预后的主要因素之一[1]。PET具有优越的功能成像技术, 目前PET检查主要是以18F-FDG为示踪剂。PET-CT在卵巢癌的分期、远处转移灶显示、放化疗疗效检测、术后复发转移等方面的临床价值尤为显著。为了解PET-CT在探测和诊断卵巢癌术后复发、转移灶中的价值, 笔者对行PET-CT检查的65例卵巢癌原发灶患者进行了回顾性分析, 现报道如下。
-
选取我院2007年12月至2012年9月收治的65例经病理确诊为卵巢癌原发灶的患者, 年龄36~77岁, 中位年龄56.5岁。PET-CT检查时间距手术结束时间为3~57个月。所有患者至少有一次1个月内的肿瘤标志物糖类抗原125(carbohydrate antigen125, CA125)检测结果及B超或CT、MRI的影像学资料。65例患者中有13例进行了2次或2次以上PET-CT的复查随访。
-
显像仪器为美国GE公司生产的Discovery STE16型PET-CT仪。18F-FDG由美国GE公司的Minitrace回旋加速器及自动合成系统制备, 放化纯>95%。显像前禁食4~6 h, 在静息状态下经三通静脉注射18F-FDG(259~444 MBq/kg), 患者避光平卧休息40~60 min, 排尿后行PET-CT检查。PET发射扫描每床位扫描2 min, CT参数:管电压120 kV, 管电流100 mA, 层厚3.75 mm。图像重建方法采用有序子集最大期望值迭代法。将PET图像和CT图像传送至Xeleris工作站, 然后进行图像对位融合显示。
-
所有PET图像、CT图像及PET-CT融合图像均通过软件进行帧对帧对比分析。由2位以上有经验的核医学医师, 采用双盲法阅片诊断。
-
通过手术病理或血清CA125、B超、CT或MRI影像学检查随访结果作为病灶确诊依据。
-
根据再次手术的病理结果或根据临床随访结果包括病史资料、CA125等确定病灶是否复发或转移。随访时间为3~57个月。
-
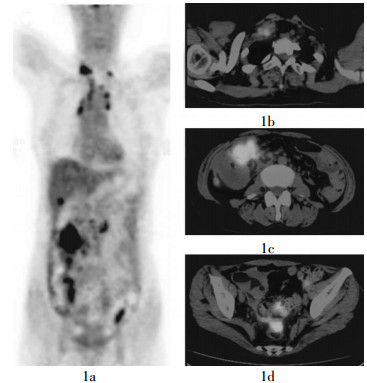
本研究中, PET-CT共显示阳性灶180个, 最后经手术病理或临床随访确诊为复发和转移的病灶为165个, 另外15个病灶为淋巴结反应性增生, PET-CT对卵巢癌病灶检出的准确率为91.7%;165个复发及转移病灶均表现为18F-FDG高摄取(图 1)。
-
165个复发和转移病灶中, 有47个腹腔淋巴结转移灶、31个腹膜后淋巴结转移灶、12个锁骨上淋巴结转移灶、12个纵隔淋巴结转移灶、4个腋窝淋巴结转移灶、2个腹股沟淋巴结转移灶、8个膜腹(大网膜、肠系膜)转移灶、6个胸腹壁转移灶、5个阴道残端复发灶、18个肝转移灶、8个脾脏转移灶、6个肺转移灶、2个骨转移灶(同机CT图像骨窗仅显示为成骨性骨质破坏病灶, PET阴性, 第2次PET-CT示骨质破坏病灶增大)、2个肾上腺转移灶和2个胸膜转移灶。
-
65例卵巢癌患者中, 18F-FDG PET-CT真阳性51例、假阳性1例、真阴性9例、假阴性4例。18F-FDG PET-CT对卵巢癌患者检出的灵敏度、特异度、准确率、阳性预测值和阴性预测值分别为92.7%(51/55)、90.0%(9/10)、93.8%(61/65)、98.1%(51/52)、69.2%(9/13)。
-
65例卵巢癌患者中, 47例患者的CA125升高, 其中, 45例患者PET-CT阳性, 2例PET-CT阴性。47例患者中, 30例患者的CA125持续升高, PET-CT均为阳性, 其中有10例常规影像学检查(B超、CT、MRI等)未见异常而PET-CT均发现了1处以上的转移病灶; 17例患者为单次检出CA125升高, 其中, 15例患者PET-CT阳性, 2例PET-CT阴性。45例PET-CT阳性患者均经病理或随访确诊, PET-CT阳性率为95.7%;2例PET-CT阴性患者, 经随访诊断证实皆为假阴性:其中1例在急性阑尾炎手术中证实为腹膜多发粟粒样转移灶; 另1例手术发现盆腔肠系膜有多处小淋巴结转移(可能与淋巴结<5 mm、显像剂摄取太少有关)。
-
65例卵巢癌患者中, 经手术病理或临床3~57个月的随访证实有肿瘤复发、转移的患者55例, 无肿瘤复发的患者10例。其中, 有13例患者进行了2次或2次以上PET-CT的复查随访。13例患者中, 9例在随访5~10个月中出现了复发或转移, 4例随访3个月~1年为完全缓解。PET-CT真阴性与假阳性的10例患者中, 6例临床随访4个月~1年结果为完全缓解; 3例PET-CT检查前血清CA125高于正常, 3~6个月随访中CA125持续升高, 经过PET-CT第2次复查仍未发现病灶, 目前仍在临床随访中; 1例PET-CT阴性者3个月后B超发现肝脏转移。
-
卵巢癌是女性生殖系统中最常见的恶性肿瘤之一。目前病死率居妇科恶性肿瘤的首位。卵巢癌病死率居高不下原因在于早期患者通常缺乏特异性临床症状, 导致就诊时约70%已属晚期, 并且病情发展非常迅速, 另外, 据文献报道, 对于临床Ⅲ~Ⅳ期的卵巢癌患者, 即使初始治疗有效, 仍有85%以上的患者会复发[2]。因此, 卵巢癌治疗之后的高复发率也是其病死率高的另一主要原因。
PET-CT技术为目前最先进的分子影像学融合新技术, 利用功能显像与解剖显像的同机融合, 在复发性卵巢癌的诊断及转移病灶的探测、疗效评估等方面均有明显优势。PET-CT能够在临床症状出现之前或解剖结构发生改变之前发现肿瘤功能及代谢信息的变化, 可以对可疑或18F-FDG低代谢病灶、腹膜、腹腔、盆腔等不易定性的软组织影病灶进行精确定位; 同时能够鉴别诊断人体内的正常生理性摄取与病变, 进而减少假阴性及假阳性, 优于单纯PET或CT。
65例卵巢癌患者中, 18F-FDG PET-CT显像发现复发或转移者55例。其中35例经手术及病理结果证实, 其余20例是根据临床及血清CA125、B超或CT、MRI影像学检查随访结果来判定的, 与PET-CT结果相符合。本研究结果提示, PET-CT发现的卵巢癌复发和转移灶最常见于淋巴系统, 如腹腔淋巴结47个、腹膜后淋巴结31个、纵隔淋巴结12个、锁骨上淋巴结12个, 腋窝淋巴结(4个)及腹股沟淋巴结(2个)较少见。这提示我们, 在卵巢癌的临床常规复查中, 应该高度重视对颈部(尤其是双侧锁骨上)及纵隔区域淋巴结的检测, 以防出现漏诊而影响下一步的临床诊治。在脏器等的转移方面, 以肝脏(18个)居首位, 在肝脏转移病例中66.7%(12/18)的患者为肝脏多发转移, 其中有10例通过介入治疗获得临床缓解。33.3%(6/18)的患者为肝脏单发转移, 其中5例通过根治手术切除了转移病灶, 为患者及时提供了有效治疗。脾脏、肺分别位居第2位和第3位。另外, 骨骼、肾上腺及胸膜等处较少出现转移。
本研究结果显示, 18F-FDG PET-CT探测卵巢癌复发和转移的灵敏度、特异度和准确率分别为92.7%(51/55)、90.0%(9/10)、93.8%(61/65), 这与国内吴湖炳等[3]及国外Havrilesky等[4]和Rubini等[7]的报道相近。
30例患者结合PET-CT结果符合再次手术指征, 最短者在PET-CT检查后3个月行再次手术, 手术结果均证实了绝大多数PET-CT发现的转移病灶。但手术病理结果显示, PET-CT对小病灶(盆腔小淋巴结、大网膜及肠系膜结节、肠系膜小淋巴结转移)的假阴性率较高, 这可能与病灶较小、仪器部分容积效应及自身分辨率有关。Sironi等[5]研究发现, 直径<1.0 cm的病灶易漏诊, 对直径<0.5 cm的微小病灶, 18F-FDG PET-CT显像也无法检出。这提示对PET-CT阴性者也应密切临床观察, 以免延误诊断和治疗。
55例患者中有2例PET-CT发现胸腰椎及盆骨的转移, 同机CT图像骨窗仅显示为成骨性骨质破坏病灶, PET显像呈阴性, 第2次PET-CT示骨质破坏病灶增大, 这说明卵巢癌转移病灶的确定不能仅仅依赖于PET显像, 有时需要结合CT图像, 否则可能会出现误诊。另外有1例患者PET-CT发现其胸膜多发转移, 这说明了在临床出现胸膜转移病灶时, 卵巢癌也应当列入考虑范围。
47例CA125升高的患者中30例为持续性升高(PET-CT均为阳性), 其中, 45例患者的PET-CT阳性, 由此可见, CA125水平尤其是CA125的持续性升高与18F-FDG PET-CT结果明显相关。另外, 在30例CA125持续性升高的患者中, 有10例常规影像学检查(B超、CT、MRI等)未见异常而PET-CT均发现了1处以上的转移病灶, 这足以体现出CA125水平持续升高时PET-CT的显著优势。这与国内赵军等[6]及国外Rubini等[7]和Palomar等[8]的研究结果相似。
13例患者进行了2次以上的PET-CT复查, 其中11例患者的PET-CT示多处转移病灶的完全缓解, 表现为转移病灶的消失或明显缩小。11例中的5例进行了二次手术, 随访至今尚未发现复发或转移, 这进一步证明PET-CT不仅能够有效监测临床治疗效果, 也能够为临床进一步的治疗提供有效依据。
12例患者为术后5年及以上再次发现转移, 其中1例为术后8年患者, 有11例出现了CA125的增高或持续增高。术后3年及3年以下的患者有47例, 其中CA125升高或持续升高者30例。这些结果提示我们:①对术后满5年的患者, 我们不能满足于临床治愈的概念, 更不能过于大意, 也要对患者进行定期检查; ②术后3年及以下为术后复发、转移的高发期, 在临床实践中我们要高度重视这段时期; ③CA125的检测具有十分重要的临床价值。
综上所述, 18F-FDG PET-CT能准确地检测出卵巢癌术后的复发和转移灶, 并能进行准确定位, 有助于对残存、复发和转移的病灶做出正确判断, 同时为临床个性化治疗和放化疗提供了客观依据, 在卵巢癌诊治中的价值将会越来越重要。
18F-FDG PET-CT在探测卵巢癌术后复发与转移中的应用价值
18F-FDG PET-CT imaging in the detection of recurrent and metastasis ovarian cancer
-
摘要:
目的 探讨18F-FDG PET-CT在探测和诊断卵巢癌术后复发、转移中的应用价值。 方法 回顾性分析65例卵巢癌术后患者的全身PET-CT结果。临床随访时间为3~57个月。确诊卵巢癌是否复发或转移的依据为手术病理学检查、多种影像学检查和临床随访。 结果 65例患者中, 55例有肿瘤复发、转移, 10例无肿瘤复发。65例卵巢癌患者中, PET-CT图像共显示阳性灶180个, 最后经手术病理或临床随访确诊为复发和转移的病灶为165个, 另15个病灶为淋巴结反应性增生; 18F-FDG PET-CT真阳性51例、假阳性1例、假阴性4例、真阴性9例, 18F-FDG PET-CT对卵巢癌患者检出的灵敏度、特异度、准确率、阳性预测值和阴性预测值分别为92.7%(51/55)、90.0%(9/10)、93.8%(61/65)、98.1%(51/52)、69.2%(9/13)。糖类抗原125(CA125)水平与18F-FDG PET结果有较高的相关性, 47例患者的CA125升高, 其中, 44例患者PET-CT阳性, PET-CT阳性率为93.6%。 结论 PET-CT全身显像在检测卵巢癌术后复发和转移病灶方面具有较高的灵敏度和准确率, 能够使卵巢癌术后再次分期更准确、更全面。同时, CA125升高时, PET-CT全身检查在发现隐匿及远处转移病灶方面具有明显优势, 可为临床进一步诊治提供依据。 -
关键词:
- 卵巢肿瘤 /
- 肿瘤复发, 局部 /
- 肿瘤转移 /
- 氟脱氧葡糖糖F18 /
- 正电子发射断层显像术 /
- 体层摄影术, X线计算机
Abstract:Objective To investigate the value of 18F-FDG PET-CT in the detection and diagnosis of recurrent and metastasis ovarian cancer. Methods Retrospective analysis of whole body PET-CT imaging data of 65 patients after operation for ovarian cancer. All the case were followed-up for 3-57 months. The diagnosis was confirmed by surgical pathological examination, imaging studies and clinical follow-up. Results Of the 65 patients, 55 cases developed tumor recurrence and metastasis, and 10 patients didn't show tumor recurrence and transfer. Of the 180 positive lesions displayed on 18F-FDG PET-CT images, 165 lesions were finally diagnosed as recurrence and metastasis, the remaining 15 lesions were identified as lymph node reactive hyperplasia. With 18F-FDG PET-CT, the accurate diagnosis were given in 60 patients(positive in 51 cases and negative in 9 cases), 1 given false positive diagnosis, and 4 cases of false negative diagnosis. As a result, the sensitivity, specificity, accuracy, positive-predictive value and negative-predictive value for detecting the ovarian lesions by 18F-FDG PET-CT were 92.7%(51/55), 90.0%(9/10), 93.8%(61/65), 98.1%(51/52), 69.2%(9/13)respectively. Carbohydrate antigen 125(CA125)levels had a positive relationships with the results of 18F-FDG PET-CT. The level of CA125 was increased in 47 cases, and positive images were found in 45 cases, the positive rate was 95.7%. Conclusion 18F-FDG PET-CT has a high sensitivity and accuracy in the detection of recurrent and metastasis ovarian cancer. It is recommend to perform 18F-FDG PET-CT, in particular when elevated CA125 is detected. -
[1] Son H, Khan SM, Rahaman J, et al. Role of FDG PET/CT in staging of recurrent ovarian cancer. Radiographics, 2011, 31(2):569-583. doi: 10.1148/rg.312105713 [2] Omura GA, Brady MF, Homesley HD, et al. Long-term follow-up and prognostic factor analysis in advanced ovarian carcinoma:the Gynecologic Oncology Group experience. J Clin Oncol, 1991, 9(7):1138-1150. doi: 10.1200/JCO.1991.9.7.1138 [3] 吴湖炳, 王全师, 王明芳, 等. PET/CT显像在探查卵巢癌术后复发、转移中的应用.中华核医学杂志, 2006, 26(4):197-200. doi: 10.3760/cma.j.issn.2095-2848.2006.04.001
[4] Havrilesky LJ, Kulasingam SL, Matchar DB, et al. FDG-PET for management of cervical and ovarian cancer. Gynecol Oncol, 2005, 97(1):183-191. [5] Sironi S, Messa C, Mangili G, et al. Integrated FDG PET/CT in patients with persistent ovarian cancer:correlation with histologic findings. Radiology, 2004, 233(2):433-440. [6] 赵军, 管一晖, 左传涛, 等. 18F-FDG PET/CT在探测卵巢癌术后复发和转移中的价值.中国肿瘤, 2007, 16(3):187-189. doi: 10.3969/j.issn.1004-0242.2007.03.012
[7] Rubini G, Altini C, Notaristefano A, et al. Peritoneal carcinomatosis from ovarian cancer:role of 18F-FDG-PET/CT and CA125. Recenti Prog Med, 2012, 103(11):510-514. [8] Palomar A, Nanni C, Castellucci P, et al. Value of FDG PET/CT in patients with treated ovarian cancer and raised CA125 serum levels. Mol Imaging Biol, 2012, 14(1):123-129. -






 下载:
下载: