-
肽核酸是20世纪80年代由有机化学家Ole Buchardt和生化学家Peter Nielsen共同研制合成的一种新型的序列特异性核酸制剂,是以不带电的、非手性的肽键(NH-CO)替代核酸的天然骨架3’,5’-磷酸二酯键的核酸类似物[1-2]。尽管肽核酸的骨架不同于天然核酸,但是它仍然遵守Watson-Crick原则,肽核酸与DNA或RNA的亲和力比DNA与DNA、DNA与RNA的亲和力强[3]。核酸在体内容易被核酸内切酶和核酸外切酶水解,而肽核酸不易被蛋白酶和核酸酶水解。有研究通过在肽核酸分子上连接正电荷基团,如赖氨酸或精氨酸残基,或通过配体、核定位信号(nuclear localization signal, NLS)提高细胞对肽核酸的通透性[4-6]。
自身免疫性甲状腺疾病(autoimmune thyroid disease, AITD)主要包括Graves病、桥本氏甲状腺炎和原发黏液性水肿,它们的临床表现为甲状腺功能亢进或低下,以及甲状腺组织的病理损伤。迄今为止,国内外学者对AITD的发病机理尚存在许多争议,但多数学者倾向于认为AITD是由与促甲状腺激素受体(thyroid stimulating hormone receptor, TSHR)结合的抗体所引起的[7]。这一论点不仅通过Graves病患者血清中检测到的高水平甲状腺刺激性抗体(thyroid stimulating antibody,TSAb)得到证明,而且新生儿Graves病是由母亲胎盘中的TSAb引发的事实也支持了这一论点。既然AITD是由于TSHR结合抗体引起的,我们可以通过减少TSHR的受体数目达到控制AITD进程的目的。
-
Fisher大鼠甲状腺细胞系(Fisher rat thyroid cell line, FRTL)由天津医科大学内分泌所李兰英教授赠送,FRTL以促甲状腺激素依赖和相应的腺苷酸环化酶活性为特征。细胞培养基为含5%小牛血清、5 ng/ml氢化可的松、5 μg/ml转铁蛋白、10 μg/ml胰岛素、1 mU/ml促甲状腺激素、谷氨酰胺、青链霉素各100 U/ml的Coon’s F-12培养基。将FRTL放在含5% CO2、37 ℃的培养箱内连续培养,每隔3 d换液一次。
-
根据Genebank公布的TSHR基因的mRNA序列(gi:575923和6981679的同源序列)设计两段asPNA。根据TSHR基因第一个翻译起始密码子ATG(-6 bp~7 bp)和5’非翻译区(-38 bp~-26 bp)设计asPNA1、asPNA2及干扰肽核酸(scramble peptide nucleic acid, scrPNA),为了提高细胞对肽核酸的通透性,分别在asPNA1、asPNA2和scrPNA上连接上NLS,得到NLS-asPNA1、NLS-asPNA2和NLS-scrPNA。肽核酸由北京奥科生物技术公司和美国PrimmBiotech公司合成。
-
根据Genebank中大鼠TSHR的mRNA序列,用Gene Runner软件设计合成了一对引物,其上游序列为:5’-AAGTTTCTTGGCATTTTCAATA-3’,下游序列为:5’-AGTGACGCTGGTGGAAG-3’。
-
将上述3种肽核酸分别标记上异硫氰酸胍(guandine throcyanate,GITC),得到NLS-asPNA1-GITC、NLS-asPNA2-GITC和NLS-scrPNA-GITC。本实验共分4组:A组:培养基内不加肽核酸;B组:培养基内加入NLS-asPNA1-GITC;C组:培养基内加入NLS-asPNA2-GITC;D组:培养基内加入NLS-scrPNA-GITC。首先接种细胞至96孔板,浓度为6×104个/100 μl,细胞贴壁2 d后,按照分组分别在细胞培养基内加入10 μM肽核酸,48 h后取出96孔板,细胞涂片后置于荧光显微镜下观察肽核酸是否进入到细胞中。
-
本实验共分4组,接种细胞至细胞培养板,每孔浓度为3×104个/200 μl,将NLS-asPNA1、NLS-asPNA2和NLS-scrPNA分别加入B、C、D 3组的培养基内,终浓度为10 μM,A组不加肽核酸,分别于24、48、72 h后取出上述4组细胞,吸出培养基,用磷酸缓冲溶液清洗一次后每孔再加入培养基100 μl和噻唑蓝10 μl(5 mg/ml),将细胞放入孵箱内继续培养4 h,每孔加入二甲基亚砜100 μl,在620 nm处测量光密度值,结果以T/C值表示(T代表B、C、D 3组在各个时间点的光密度值,C代表A组在各个时间点的光密度值)。
-
本实验分为A、B、C 3组,细胞培养基内分别加入NLS-asPNA1、NLS-asPNA2和NLS-scrPNA,终浓度为10 μM,接种细胞浓度为1.25×105个/ml,分别于0、12、24、48h后将培养皿取出,提取细胞总RNA,将RNA逆转录为cDNA,采用实时定量RT-PCR测定样品mRNA水平,反应条件:95℃ 10 min共1个循环;95℃ 10 s、58℃ 5 s、72℃ 15 s,共45个循环。
-
实验数据以均数±标准差(x±s)表示,组内均数比较采用方差分析,P < 0.05为差异有统计学意义。
-
细胞涂片后经荧光显微镜观察发现,单纯的FRTL细胞(即A组)经过碘化丙啶染色后细胞核为红色(图 1a)。而在B、C、D 3组中,由于肽核酸上标记的GITC所发出的荧光为黄绿色,在红色的细胞核周围即胞浆中,我们可以见到黄绿色荧光,提示NLS-asPNA可以进入到细胞中(图 1b)。
-
将3种肽核酸分别加入细胞培养基中与细胞一起培养,分别于24、48、72 h后测定T/C值(表 1),经统计学分析后发现,B、C、D 3组在不同时间的T/C值之间差异无统计学意义(F= 0.0006、0.0007和0.0004,P均 > 0.05),表明NLS-asPNA对细胞没有毒性作用。
组别 T/C值 24 h 48 h 72 h B组(NLS-asPNA1) 1.036±0.01 1.051±0.02 1.048±0.01 C组(NLS-asPNA2) 1.051±0.03 0.982±0.02 0.987±0.01 D组(NLS-scrPNA) 1.007±0.02 1.039±0.01 1.064±0.02 注:表中,T代表NLS-asPNA1、NLS-asPNA2和NLS-scrPNA组在各个时间点的光密度值,C代表对照组在各个时间点的光密度值;NLS:核定位信号;asPNA:反义肽核酸;scrPNA:干扰肽核酸。 表 1 3种肽核酸与细胞培养不同时间后的T/C值
-
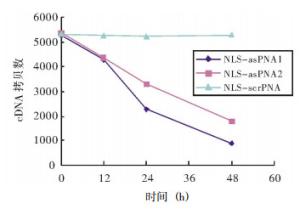
从图 3我们可以看出,NLS-asPNA1和NLS-asPNA2均可以抑制FRTL细胞TSHR mRNA的表达,NLS-asPNA1和NLS-asPNA2分别与细胞培养12、24、48 h后,TSHR cDNA的拷贝数与0 h相比逐渐降低,且呈现出时间依赖性。而NLS-scrPNA与细胞培养12、24、48 h后,TSHR cDNA的拷贝数与0 h相比,没有明显的变化。
-
近年来,asPNA已在生物学及亚临床研究中得到了广泛的应用,Rappozi等[8]研究证实,NLS-asPNA和asPNA均可以通过非受体依赖机制进入细胞,通过半定量RT-PCR发现,与对照组相比,10 μM asPNA和NLS-asPNA分别可以使人慢性粒细胞KYO-1内b2a2型bcr/abl原癌基因的mRNA表达量降低(20±5)%和(60±10)%,因此,可以通过asPNA抑制慢性粒细胞白血病的原癌基因bcr/abl mRNA的表达,从而抑制KYO-1细胞内P210蛋白的表达,对慢性粒细胞白血病的治疗起到指导作用。韩曙光等[9]研究表明,asPNA可以下调树突状细胞趋化因子受体7基因的表达,阻断树突状细胞的迁移和抗原提呈,有效抑制急性排斥反应,延长受试者存活时间。
本研究证实,NLS-asPNA可以进入FRTL细胞。噻唑蓝法的检测结果也显示,本研究中合成的3种肽核酸对正常的细胞没有毒性作用,因为肽核酸是一种基因治疗制剂,它可以通过碱基互补的原则与DNA和RNA结合,从而抑制目的基因的复制、转录和翻译,所以其效用和安全性非常重要。
本研究中实时定量RT-PCR结果显示,NLS-asPNA1和NLS-asPNA2分别与FRTL一起培养12、24、48 h后,TSHR cDNA的拷贝数与0 h相比逐渐降低,且呈现出时间依赖性。本研究中设计的一段非相关肽核酸(即NLS-scrPNA)则对TSHRmRNA的表达没有影响,因为NLS-scrPNA不能与TSHR mRNA序列互补结合,无论与细胞一起培养12 h、24 h还是48 h,TSHR mRNA的表达量与对照组相比均没有显著性的变化。对上述结果可能的解释为,当asPNA与目的基因的mRNA结合后,可以进入一种代谢途径,使mRNA降解;另一个原因可能是,从细胞中提取的总RNA也包括与肽核酸结合的一部分RNA,由于肽核酸与RNA的亲和力比较强,而且不易被DNA、RNA酶水解,所以这部分RNA在进行RT-PCR时,不能被扩增,导致最后测定的结果中mRNA减少。本研究结果证实,肽核酸可以进入细胞中,并且能够与目的基因的相应位点结合。由于我们设计的是asPNA,它可以和DNA的编码链结合,形成asPNA-DNA复合物,从而阻断DNA的复制过程,因此必然会导致转录产物mRNA的减少。
从以上的实验结果我们得出,NLS-asPNA可以在体内抑制TSHR的表达,因此可以对Graves病的治疗起到指导性的作用。
反义肽核酸对促甲状腺激素受体mRNA表达的影响
The effects of antisense peptide nucleic acid on the expression of thyroid stimulating hormone receptor mRNA
-
摘要:
目的 探讨反义肽核酸(asPNA)对大鼠甲状腺细胞的细胞膜表面促甲状腺激素受体(TSHR)表达的影响。 方法 设计两种与TSHR mRNA不同片段互补的asPNA,分别为核定位信号-asPNA1(NLS-asPNA1)和NLS-asPNA2,另外合成一段非相关的干扰肽核酸(NLS-scrPNA)序列,用荧光显微镜观察NLS-asPNA能否进入细胞,采用噻唑蓝法检测asPNA对细胞是否具有毒性作用,然后用实时定量RT-PCR检测NLS-asPNA对TSHR mRNA表达的影响。 结果 荧光显微镜观察发现,asPNA可以进入到细胞中去。噻唑蓝法检测发现asPNA对细胞没有毒性作用。实时定量RT-PCR结果显示,NLS-asPNA1和NLS-asPNA2可以抑制TSHR mRNA表达,表现为随着NLS-asPNA与细胞培养时间的延长,TSHR cDNA的拷贝数逐渐下降,且呈现时间依赖性,而NLS-scrPNA对TSHR mRNA的表达没有明显的影响。 结论 NLS-asPNA可以进入到细胞中去,并且能够下调TSHR mRNA的表达。 Abstract:Objective To study the effects of antisense peptide nucleic acid(asPNA)on thyroid stimulating hormone receptor(TSHR)of Fisher rat thyroid cells membrane. Methods Two kinds of asPNA which could hybridized to the TSHR mRNA named as nuclear localization signal-asPNA1(NLS-asPNA1) and NLS-asPNA2 were designed, and a control PNA with a scramble sequence named as NLS-scrPNA was synthetized. The cellular uptake of peptide nucleic acids were analyzed by fluorescence microscopy, and the toxic effect of asPNA to Fisher rat thyroid cells was evaluated by MTT assay. The effect of NLS-asPNA on the expression of TSHR mRNA was detected by realtime quantitative RT-PCR. Results Fluorescence microscopy indicated that asPNA were taken up by the cells. The results of MTT assay showed that all the asPNA had no toxic effect on the cells. The results of realtime quantitative RT-PCR showed that NLS-asPNA1 and NLS-asPNA2 could inhibit the expression of TSHR mRNA, the copies of TSHR cDNA decreased gradually along with the prolongation of culture time. But NLS-scrPNA had no significant effect on the expression of TSHR mRNA. Conclusion NLS-asPNA could be taken up by the cells and down-regulate the expression of TSHR mRNA. -
Key words:
- Peptide nucleic acids /
- Receptors, thyrotropin /
- RNA, messenger
-
表 1 3种肽核酸与细胞培养不同时间后的T/C值
组别 T/C值 24 h 48 h 72 h B组(NLS-asPNA1) 1.036±0.01 1.051±0.02 1.048±0.01 C组(NLS-asPNA2) 1.051±0.03 0.982±0.02 0.987±0.01 D组(NLS-scrPNA) 1.007±0.02 1.039±0.01 1.064±0.02 注:表中,T代表NLS-asPNA1、NLS-asPNA2和NLS-scrPNA组在各个时间点的光密度值,C代表对照组在各个时间点的光密度值;NLS:核定位信号;asPNA:反义肽核酸;scrPNA:干扰肽核酸。 -
[1] Nielsen PE, Egholm M, Berg RH, et al. Sequence-selective recogni-tion of DNA by strand displacement with a thymine-substituted polyamide. Science, 1991, 254(5037): 1497-1500. doi: 10.1126/science.1962210 [2] Egholm M, Buchardt O, Nielsen PE, et al. Peptide nucleic acids (PNA). Oligonucleotide analogs with an achiral peptide backbone. J Am Chem Soc, 1992, 114(5): 1895-1897. doi: 10.1021/ja00031a062 [3] Egholm M, Buchardt O, Christensen L, et al. PNA hybridizes to complementary oligonucleotides obeying the Watson-Crick hydro-gen-bonding rules. Nature, 1993, 365(6446): 566-568. doi: 10.1038/365566a0 [4] Filipovska A, Eccles MR, Smith RA, et al. Delivery of antisense peptide nucleic acids (PNAs) to the cytosol by disulphide conjuga-tion to a lipophilic cation. FEBS Lett, 2004, 556(1-3): 180-186. doi: 10.1016/S0014-5793(03)01403-0 [5] Boules M, Williams K, Gollatz E, et al. Down-regulation of amyloid precursor protein by peptide nucleic acid in vivo. J Mol Neurosci, 2004, 24(1): 123-128. doi: 10.1385/JMN:24:1:123 [6] Karras JG, Maier MA, Lu T, et al. Peptide nucleic acids are potent modulators of endogenous pre-mRNA splicing of the murine inter-leukin-5 receptor-alpha chain. Biochemistry, 2001, 40(26): 7853-7859. doi: 10.1021/bi010263l [7] Weetman AP. Autoimmune thyroid disease: propagation and pro-gression. Eur J Endocrinol, 2003, 148 (1) : 1-9. [8] Rapozzi V, Burm BE, Cogoi S, et al. Antiproliferative effect in chronic myeloid leukaemia cells by antisense peptide nucleic acids. Nucleic Acids Res, 2002, 30(17): 3712-3721. doi: 10.1093/nar/gkf451 [9] 韩曙光, 赵浩亮, 董胜利, 等.反义肽核酸下调树突状细胞CCR7基因表达抑制大鼠肝移植急性排斥反应.中华器官移植杂志, 2008, 29 (2): 73-77. doi: 10.3760/cma.j.issn.0254-1785.2008.02.002
-






 下载:
下载: