-
丙酮酸激酶是糖酵解途径的一个关键酶,它有4种不同的同工酶,分别为L型、R型、M1型和M2型。这4种同工酶的表达具有组织特异性。正常情况下,上述4种亚型都以高活性的四聚体形式存在。但在肿瘤细胞中,M2型丙酮酸激酶(M2-type pyruvate kinase,M2-PK)主要以低活性的二聚体形式存在,成为肿瘤细胞特征性的糖代谢酶,因此称为肿瘤M2-PK。
研究表明,在肾细胞癌、胃肠道癌等患者的血浆中,肿瘤标志物M2-PK水平明显升高[2-3]。但目前市场上检测M2-PK使用的都是进口试剂,检测成本很高,因此,开发国内自产的试剂盒十分必要,是广大医生的迫切需求。
-
SP2/0骨髓瘤细胞、兔抗鼠免疫球蛋白G和蛋白A亲和层析柱来自天健生物制药(天津)有限公司,BALB/c免疫缺陷小鼠购自北京维通利华实验动物技术有限公司,DMEM高糖培养基和胎牛血清购自美国Gibco公司,聚乙二醇1500、弗氏完全佐剂和弗氏不完全佐剂购自美国Sigma公司,M2-PK重组抗原购自美国Abbiotec公司,碱性磷酸酶标记的羊抗鼠抗体购自美国SouthernBiotech公司,125I-NaI委托中国同位素公司购自美国PerkinElmer公司。Multiscan MK3型酶标仪为芬兰雷勃公司产品,紫外分光光度计为北京普析通用仪器有限责任公司产品,GC-911型γ计数器为科大创新股份有限公司产品。
-
取5只6周龄的雌性BALB/c小鼠进行编号,首次免疫时将M2-PK抗原与弗氏完全佐剂乳化后进行腹腔注射,免疫剂量为50 μg/只,然后每间隔2周进行一次加强免疫,用弗氏不完全佐剂乳化抗原,免疫剂量为25 μg/只。加强免疫3次后,通过小鼠内眦静脉采血,用酶联免疫吸附法测定血清抗体的效价,当抗体效价达到1 : 72 000时,于细胞融合前3 d对小鼠进行腹腔注射,加强免疫1次,免疫剂量为50 μg/只。
-
选用目前最佳的标准细胞融合技术,用低分子质量的聚乙二醇诱导SP2/0小鼠骨髓瘤细胞的融合。将融合后的细胞接种在96孔细胞培养板上,每孔中的杂交瘤细胞克隆通过最优化的酶联免疫吸附检测程序进行筛选。将所有阳性的杂交瘤细胞克隆在24孔培养皿上进行扩大培养。将确定为阳性的细胞克隆进行亚克隆以获得能产生抗体并能准确表达的稳定的细胞系。
-
用兔抗鼠免疫球蛋白G包被96孔酶标板,在A~G孔中各加入50 μl杂交瘤细胞培养液上清,H孔作为空白对照,37 ℃孵育1 h后,在各孔中分别加入7种针对不同亚型的碱性磷酸酶标记的羊抗鼠抗体,37 ℃孵育30 min后,洗板,加底物显色30 min后,用酶标仪在340 nm处测定光密度值。
-
针对每株杂交瘤细胞进行一次小规模的腹水生产(3只小鼠/株),用蛋白A亲合层析柱从每个腹水样本中分离纯化单克隆抗体。通过紫外分光光度计测定抗体的浓度,采用十二烷基硫酸钠-聚丙烯酰氨凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis, SDS-PAGE)鉴定抗体的纯度。
-
采用氯铵T法进行单克隆抗体的碘化标记,将单克隆抗体按照5 μg/ml的浓度进行放免管的包被,将肿瘤M2-PK抗原稀释成0、5、15、30、45、60 U/ml的浓度梯度,加入放免管内,37 ℃孵育1 h后,加入125I标记的单克隆抗体,进行抗体的配对实验。
-
(1)操作步骤:首先确定包被抗体和125I标记抗体的工作浓度,配制一套肿瘤M2-PK标准品,浓度分别为0、5、15、30、45、60 U/ml,采用方阵滴定法,通过标准曲线的线性相关系数等指标确定二者的最佳工作浓度。用稀释好的包被抗体包被放免管,4 ℃放置48 h,然后用洗涤缓冲液洗管2次后加入封闭液,4 ℃放置24 h后将封闭液倒掉,将包被好的放免管放置在干燥室内过夜,再将包被管用铝箔袋真空包装。将M2-PK抗原稀释成浓度梯度后加入放免管内,37 ℃孵育1 h,洗管3次。将125I标记抗体稀释成工作浓度后加入放免管内,37 ℃孵育1 h,洗管3次,用γ计数器测定每管1 min内的放射性强度计数。
(2)分析灵敏度的检测:以一定浓度梯度的M2-PK抗原作为标准品,10孔平行测定零标准品的读数值,计算测定结果的平均值(x)与标准差(s),计算x+2s值,分析灵敏度为该数值在标准曲线上所对应的浓度值。
(3)正常参考值范围的确定:用免疫放射分析法获得的标准曲线测算200名正常人血浆中M2-PK的浓度,计算测定结果的平均值(x)与标准差(s),M2-PK浓度正常参考值的上限即为x+2s对应的浓度值,小于该浓度值为正常。
(4)临床灵敏度及特异度的检测:以建立的免疫放射分析法检测200例恶性肿瘤患者的血浆样本,计算检测结果的阳性率;同时,检测200名正常体检者的血浆样本,计算检测结果的阴性率。
(5)精密度的检测:10孔平行测定浓度为13.2、42.6 U/ml的两种血浆样品中M2-PK的浓度,计算测定结果的平均值(x)与标准差(s),代入公式计算:批内不精密度(%)=s / x×100%;测定不同浓度的血浆样品中M2-PK的浓度,重复3次,计算测定结果的平均值(x)与标准差(s),代入公式计算:批间不精密度(%)=s /x×100%。
-
通过免疫后小鼠血清抗体效价的测定结果,我们选取了3号和5号小鼠进行细胞融合,经筛选及亚克隆后,共获得了两株稳定分泌抗体的细胞株,分别为1A6和3F8,亚型测定结果显示均为免疫球蛋白G1。
-
上述1A6和3F8两株单克隆抗体分别接种3只小鼠后,各得到10 ml腹水,经蛋白A亲合层析柱纯化后,分别得到35 mg和38 mg抗体。
-
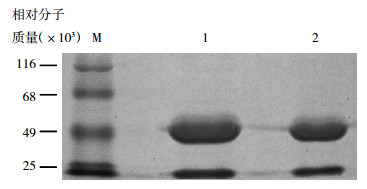
将1A6和3F8两株单克隆抗体同时进行SDS-PAGE(图 1),可以看到两株单克隆抗体的电泳结果均有两条带,分别为相对分子质量为25 000的轻链和50 000的重链。经扫描图谱分析后可以计算出两株单克隆抗体的纯度均 > 95%。
-
将1A6和3F8两株单克隆抗体分别进行125I标记及包被放免管后,经配对实验得出,以3F8为包被单抗,以1A6为标记单抗,进行后续的检测体系的建立。
-
采用方阵滴定法,通过标准曲线的线性相关系数等指标确定包被抗体的最佳工作浓度为5 μg/ml,125I标记抗体的最佳稀释比例为1: 8000,最终确定标准曲线(图 2)。
-
10孔平行测定零标准点,通过公式计算出检测体系的分析灵敏度为2 U/ml。
-
用上述标准曲线测算200名正常人血浆中M2-PK的浓度,计算得出x+2s值对应的浓度值为14.8 U/ml,因此,通过本研究建立的免疫放射分析的检测体系得到的M2-PK浓度的正常参考值范围为 < 14.8 U/ml。
-
200例恶性肿瘤患者的血浆样本检测结果中,141例肿瘤M2-PK为阳性,阳性率为70.5%(141/200),200名正常体检者的血浆样本检测结果中,178例为阴性,阴性率为89.0%(178/200)。由此得出,本研究建立的免疫放射分析的检测体系检测肿瘤M2-PK的灵敏度和特异度分别为70.5%和89.0%。
-
通过测定浓度为13.2、42.6 U/ml的两种血浆样本,计算出批内不精密度分别为3.6%和2.8%,批间不精密度分别为5.2%和6.7%。
-
目前,全世界每年死于癌症的患者数仅次于死于心血管病的患者。众所周知,癌症的早期诊断比较困难,一方面是因为临床上患者早期多无明显的症状体征,另一方面是由于目前的检测方法中缺乏理想的灵敏而特异的诊断指标。因此,对恶性肿瘤患者的早期诊断和早期治疗是提高疗效及患者生存质量的最有效的手段。近几年的研究发现,血浆中肿瘤M2-PK的检测可用于癌症的筛查、诊断及跟踪治疗。丁志祥等[4]的研究结果表明,血浆肿瘤M2-PK检测肺癌的灵敏度为89.1%,特异度为94.0%。Kumar等[5]对肿瘤M2-PK与其他肿瘤标志物对胃肠道肿瘤的诊断进行Meta分析,结果发现肿瘤M2-PK对胃癌、结直肠癌诊断的灵敏度高于传统的肿瘤标志物。禹立霞等[6]的研究表明,胃肠肿瘤根治术后无可测量病灶时,血浆肿瘤M2-PK浓度与时间呈负相关,即随着术后时间的延长,肿瘤M2-PK浓度趋于下降。动态检测血浆肿瘤M2-PK水平对于胃肠肿瘤的术后诊断、治疗效果和预后评价具有应用价值,是一个更为理想、新颖、灵敏的广谱肿瘤标志物。
本研究获得了一对高灵敏度及特异度的肿瘤M2-PK的单克隆抗体,并建立了免疫放射分析的检测方法,对该方法进行了灵敏度和特异度的分析,并参考了国内外其他厂家生产的试剂盒的检测指标,与目前文献报道的结果比较一致[5]。
目前,肿瘤M2-PK的检测在癌症患者中还没有得到广泛应用,本研究试剂盒由于检测成本较国外试剂盒降低,有望广泛地用于人群的体检筛查以及癌症患者的早期诊断,对患者做到早诊断、早治疗,减轻患者的痛苦,提高患者的生活质量。
肿瘤M2型-丙酮酸激酶单克隆抗体的制备及免疫放射分析方法的建立
Preparation of the monoclonal antibodies against tumor M2-type pyruvate kinase and establishment of immunoradiometric analysis for detection
-
摘要:
目的 制备肿瘤M2型-丙酮酸激酶(M2-PK)单克隆抗体,并建立免疫放射分析的检测方法。 方法 用肿瘤M2-PK抗原免疫小鼠,经细胞融合及筛选后得到一对单克隆抗体,建立免疫放射分析的方法,并评价该检测方法的灵敏度、特异度及精密度。 结果 获得了1A6和3F8两株效价高、特异度好的单克隆抗体,建立了双抗体夹心免疫放射分析方法。该检测方法的分析灵敏度为2 U/ml,临床灵敏度和特异度分别为70.5%和89.0%,提供的M2-PK的正常参考值范围是 < 14.8 U/ml,批内不精密度 < 5%,批间不精密度 < 10%。 结论 建立的双抗体夹心免疫放射分析法可用于体检筛查及肿瘤患者的早期诊断,做到尽早治疗,提高患者的生存质量。 Abstract:Objective To produce monoclonal antibodies against tumor M2-type pyruvate kinase(M2-PK), and to establish immunoradiometric analysis for detection. Methods The BALB/c mice were immunized with M2-PK antigen. Monoclonal antibodies were generated after cell fusion and screening. Established detection method of immunoradiometric analysis and then evaluated its sensitivity, specificity and coefficient of variation. Results Two monoclonal antibodies(1A6 and 3F8)with high-titer and high-specificity were generated and detection method of immunoradiometric analysis was established. The analytical sensitivity of immunoradiometric analysis was 2 U/ml, while its clinical sensitivity and specificity was 70.5% and 89.0% respectively. The reference value of M2-PK level was less than 14.8 U/ml according to immunoradiometric analysis. Intra-assay coefficient of variation was less than 5%, while inter-assay coefficient of variation was less than 10%. Conclusion This sensitive immunoradiometric analysis can be used in early diagnosis of tumor and physical examination. -
Key words:
- Pyruvate kinase /
- Antibodies, monoclonal /
- Immunoradiometric assay
-
[1] Mazurek S, Boschek CB, Hugo F, et al. Pyruvate kinase type M2 and its role in tumor growth and spreading. Semin Cancer Biol, 2005, 15(4): 300-308. [2] Hardt PD, Ewald N. Tumor M2 pyruvate kinase: a tumor marker and its clinical application in gastrointestinal malignancy. Expert Rev Mol Diagn, 2008, 8(5): 579-585. doi: 10.1586/14737159.8.5.579 [3] Weinberger R, Appel B, Stein A, et al. The pyruvate kinase isoenzyme M2(Tu M2-PK) as a tumour marker for renal cell carcinoma. Eur J Cancer Care (Engl), 2007, 16(4): 333-337. doi: 10.1111/j.1365-2354.2006.00753.x [4] 丁志祥, 解东涯, 杨春秀, 等.血浆TU M2-PK检测对肺癌的诊断价值.第二军医大学学报, 2006, 27(2): 219-220. doi: 10.3321/j.issn:0258-879X.2006.02.028
[5] Kumar Y, Tapuria N, Kirmani N, et al. Tumour M2-pyruvate kinase: a gastrointestinal cancer marker. Eur J Gastroenterol Hepatol, 2007, 19(3): 265-276. doi: 10.1097/MEG.0b013e3280102f78 [6] 禹立霞, 刘宝瑞, 王立峰, 等.胃肠肿瘤术后Tu M2-PK含量的变化.实用医技杂志, 2006, 13(3): 350-352. doi: 10.3969/j.issn.1671-5098.2006.03.013
-






 下载:
下载: