-
18F-FLT属于脱氧核苷类似物家族的一种,在这个家族中最有名的是3'-叠氮-3'-脱氧胸苷(3'-azido-3'-deoxythymidine, AZT),又名齐多夫定,是目前应用最广泛的抗人类免疫缺陷病毒(human immunodeficiency virus,HIV)药物。这类化合物经胸苷激酶(thymidine kinase,TK)磷酸化成单磷酸盐,并进一步磷酸化为三磷酸盐,这些产物或者进入DNA合成途径或者抑制病毒反转录酶。进入DNA合成途径的三磷酸盐通过阻止DNA链延长而抑制病毒复制。这些化合物中,以AZT的抗复制能力最强。
起初,FLT用18F标记的目的是监测HIV感染[1]。直到很多年后,Shields等[2]发现了一种合成18F-FLT的方法,并将之应用于肿瘤细胞增殖显像。有两篇关于18F-FLT作为PET显像剂剂量安全范围的报道,研究对象分别是20例肺癌和12例胶质瘤患者,两个研究结果均显示:静脉注射2.59 MBq/kg(总剂量不超过185 MBq)18F-FLT没有毒性或并发症出现;18F-FLT作为显像剂的注射剂量仅为AZT治疗性临床试验时最低毒性剂量的0.0001%~0.0009%[3-4]。此外,在人体的放射性测试表明其潜在放射性在安全范围内[5]。18F-FLT的有效剂量当量为0.031 mSv/MBq,与18F-FDG差不多(0.029 mSv/MBq)[5]。
除18F-FLT外,人们还开发过其他几种细胞增殖显像剂,比如11C-胸苷、11C-胆碱等。11C-胆碱参与细胞膜脂类合成,胆碱激酶与细胞摄取胆碱相关,在肿瘤细胞中摄取胆碱的活性上调。然而关于胆碱摄取程度和细胞增殖的关系仍有争议[6-7]。胸苷可以整合到DNA中,因此可以直接反映DNA合成。然而用11C标记的显像剂的特点是其半衰期太短(20 min),不适于临床应用[8]。
-
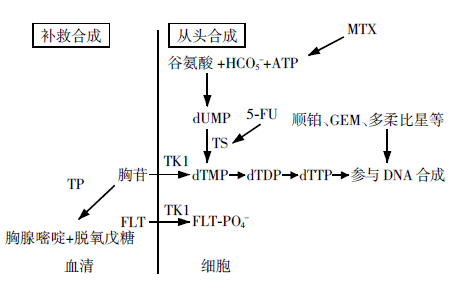
胸苷通过两种途径参与DNA合成:补救合成和从头合成(图 1)。嘧啶主要通过补救途径进入DNA合成。血液中的胸苷通过被动扩散和Na+依赖的载体进入细胞,正常组织中以后者为主,而在肿瘤细胞中以前者为主[9]。进入细胞的胸苷被细胞质内的胸苷激酶1(thymidine kinase 1,TK1)等磷酸化为三磷酸脱氧胸苷(deoxythymidine triphos-phate,dTTP),后者被整合到DNA中。
在从头合成途径中,先由谷氨酰胺和ATP合成单磷酸脱氧尿苷(deoxyuridine monophosphate,dUMP),再通过胸苷酸合酶(thymidylate synthase,TS)的甲基化作用合成二磷酸脱氧胸苷(deoxy-thymidine diphosphate,dTDP),之后步骤同补救合成途径。在快速增长的细胞中,可发现较高的TS水平[10]。
FLT进入细胞后,被补救合成途径的TK1磷酸化为单磷酸FLT(FLT-PO4-),至于其是否进一步磷酸化存在争议。由于3-羧基端被氟原子置换,其不能进一步参与DNA的合成,也不能通过细胞膜返回而滞留于细胞中。有关于3H-FLT的研究证明,在不同细胞系中,其只有0.2%被整合到DNA,表明FLT并不是直接反映DNA合成的标志物。另有关于A549肺癌细胞对3H-FLT和3H-脱氧胸苷摄取的体外研究表明,虽然与3H-脱氧胸苷相比只有极少量FLT整合入DNA(0.2% vs.90%),但是两者的摄取具有显著相关性(r=0.88,P < 0.001),表明FLT的摄取量可以反映整个补救合成途径[11]。
-
最简单和实用的评价18F-FLT摄取的方法是从静态PET图像获得半定量指标标准化摄取值(standardized uptake value,SUV)。复杂一些的方法是利用示踪剂摄取的动态图像和动力学模型。由于18F-FLT是一种相对较新的示踪剂,因此推荐用与FDG相似的两室模型(two compartmental models)研究其药代动力学(图 2)[12-13]:
FLT药代动力学二室模型的分析公式数据来自重复的动脉血采样或对大动脉感兴趣区活性计数,也叫图像源输入公式(image-derived input function)。FLT净流入细胞的速度常数(kFLT)及FLT磷酸化分数(Fraction)计算公式如下:
kFLT = k1·k3 / (k2 + k3);
Fraction = k3 /(k2 + k3)
式中,kFLT为FLT净流入细胞的速度常数,k1为FLT进入细胞的速度常数,k3为FLT磷酸化为单磷酸FLT的速度常数,k2为FLT流出细胞的速度常数。
值得注意的是,有研究发现,FLT-PO4-去磷酸化在注射后50 min开始,因此理论上要测量动态像120 min以得到较可靠的k4值[12],否则忽略k4
有低估流通量的可能[14]。然而120 min对于临床来说太长而不适用。采用3k模型[15],即k4取值为0,也就是假设FLT磷酸化作用不可逆,采集60 min即可。而且近期有研究证实,只有在60 min后才会有大量FLT甚至FLT-PO4-经人平衡型核苷转运体1(human equilibrative nucleoside transporter 1)流出细胞[16]。由代谢相关的动脉血浆曲线和感兴趣体积数据(volumes of interest)获得的Patlak流入速度常数(kPatlak)也可以定量分析原发肿瘤和对FLT热摄取的颈部淋巴结[17]。
Menda等[18]用kFLT、kPatlak、SUV三种方法评估了8例头颈癌患者对FLT的摄取(7例为放疗前后),结果表明动态采血或图像采集40~50 min即可反映肿瘤放疗前后摄取FLT的变化,而且三者显著相关(kFLT vs. kPatlak:r=0.90;kFLT vs. SUV:r=0.91;kPatlak vs. SUV:r=0.99)。
-
TK1是DNA补救合成中的关键酶之一,它的底物只有胸苷和脱氧尿苷,磷酸化时磷酸盐的供体来自ATP(辅助因子)。在ATP存在的情况下,TK1更稳定,且对底物的亲和性也更强。TK1的活性在G0/G1期很低,在S期很高,可增加近10倍,因此可以反映细胞增殖。有些细胞的M期也有很高的活性,细胞分裂完成后又降回到G1/G0时的低水平,并进一步发现TK1活性与18F-FLT摄取呈正相关[11, 19]。
有两组分别用不同药物治疗辐射诱发的纤维肉瘤小鼠的研究发现:治疗后24 h,TK1、FLT、增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)表达及ATP水平均下降;48 h后发现18F- FLT摄取、PCNA表达及ATP水平均继续下降,说明18F-FLT摄取和增殖活动相关;而TK1蛋白却意外上升[20-21]。Jensen等[22]用18F-FLT和18F-FDG评估荷卵巢癌小鼠化疗疗效的研究中也发现TK1基因表达与18F-FLT摄取不一致:18F-FLT的摄取早在治疗后2~6 h就开始降低,而TK1基因表达却在治疗后1 d开始降低。对此,推测其机制为药物使蛋白质变性或者影响了mRNA转录过程[23],从而使TK1蛋白不能降解或者表达增加,并且由于ATP水平下降,即使TK1蛋白增加,也不能发挥酶的催化活性[24]。
由于各种物种的异质性,也可能会影响TK1、18F-FLT摄取和细胞增殖的关系。有研究表明,啮齿类动物血胸苷水平比人类高10倍,而胸苷可以与FLT竞争TK1的结合位点,所以啮齿类动物细胞的18F-FLT摄取水平很低,因此对啮齿类动物进行18F-FLT研究时应先进行预处理,常用的方法是在实验前注射胸苷磷酸化酶,使胸苷降解为胸腺嘧啶和脱氧戊糖(图 1),从而增加组织对18F-FLT的摄取[25]。
有人研究了22种不同肿瘤细胞株对3H-FLT摄取与处于S期细胞分数(S phase fraction of cells,SPF)的关系,这些细胞都已被证明受不同增殖基因调控,结果表明:18F-FLT摄取与SPF显著正相关(r= 0.76, P < 0.0001),说明18F-FLT摄取可以反映不同细胞的增殖而不受基因影响;研究者还测定了其同工酶线粒体胸苷激酶2(thymidine kinase 2,TK2),发现TK2与SPF没有相关性(r=0.19,P = 0.39)[26]。另有关于TK2的研究发现,它主要在静止细胞中表达,在分裂细胞中它的活性只占TK总活性的1%~5%[24]。
-
对于不同的恶性肿瘤,临床上的治疗方案不尽相同,较常用的是化疗。
各种化疗药物通过不同的途径影响DNA合成(图 1),现将临床常用的化疗药作用机制介绍如下:5-氟尿嘧啶(5-fluorouracil,5-FU)的活性代谢产物单磷酸脱氧尿苷能抑制TS的活性,导致从头合成途径中DNA的必需前体三磷酸胸苷耗竭,从头合成途径被阻断;肿瘤启动或上调补救途径,以满足生长对胸苷的需要。甲氨蝶呤也是通过耗竭核苷酸前体阻断从头合成途径。顺铂不影响合成途径,属非细胞周期依赖性药物,它是通过共价键与DNA结合,使DNA链间或链内交链,形成顺铂-DNA复合物,干扰DNA复制。吉西他滨是细胞周期特异性抗代谢类药物,主要作用于DNA合成期的肿瘤细胞,即S期细胞,在一定条件下可以阻止G1期向S期推进,进入细胞后被转化为5'-三磷酸盐形式,插入至DNA链中的脱氧胞苷位点,使DNA链合成停止,进而DNA断裂、细胞死亡。Dittmann等[27]用不同浓度的四种化疗药物孵育食管肉瘤细胞,发现用5-FU和甲氨蝶呤处理过的细胞均阻滞在S期初始阶段,因为这两种药都是阻断从头合成途径,因此由补救合成途径上调来弥补从头合成的不足,使18F-FLT摄取增加;用顺铂处理过的细胞被阻滞在S期,18F-FLT摄取降低;吉西他滨处理过的细胞对18F-FLT的摄取则轻度增加,可能是因为激活了补救合成途径。另有国内学者将5-FU、顺铂和多柔比星(具有强烈的细胞毒性,能嵌入DNA抑制核酸的合成)分别与肺腺癌A549细胞孵育不同时间后测定细胞摄取18F-FDG和18F-FLT的变化,结果:与对照组(未与化疗药物孵育)比较,5-FU治疗后1 h、4 h,18F-FLT摄取增加(145%±12%,150%±14%),24 h后显著减少(43%±4%), 72 h较对照组降低(60%±4%),但较24 h略有升高;多柔比星和顺铂引起18F-FLT摄取变化趋势基本相同,治疗后1h就观察到18F-FLT摄取迅速减少(70%±6%,85%±4%),24 h时几乎全部被抑制(26%±2%,15%±4%),72 h摄取较对照组仍降低(35%±1%,30%±2%) [28]。
对于放疗和光疗的疗效评估,Sugiyama等[29]发现,在荷鳞细胞肉瘤小鼠研究中,放疗后18F-FLT摄取迅速降低;对HeLa小鼠光疗后也发现相同的结果。
蛋白酶抑制剂是一种新近发展的靶向治疗模式,主要应用于实体瘤。Waldherr等[30]用ErbB蛋白的抑制剂治疗荷ErbB蛋白过表达的A431移植瘤小鼠后发现,18F-FLT摄取在一周内降低79%;对细胞进行PCNA染色,在组织学上评价细胞增殖与18F-FLT摄取的关系,发现二者正相关,说明18F-FLT摄取研究为临床提供了一种评价ErbB蛋白抑制剂效果的检查方法。
对于激素治疗的疗效评估,有人对有雄激素依赖的肿瘤鼠进行去势手术或己烯雌酚治疗发现,18F-FLT摄取能正确反映疗效,因为去势手术或己烯雌酚治疗能使肿瘤鼠血清内的睾酮水平降低,从而影响TK1活性,导致18F-FLT摄取变化[31]。
综上所述,FLT在体内代谢时间长短及不同治疗的方案都会影响18F-FLT摄取。因此,当评估肿瘤治疗疗效时,18F-FLT摄取不一定与肿瘤增殖呈正相关或负相关,还应考虑各种因素的综合影响。
18F-FLT增殖显像机制及前期临床研究
The basis of 18F-3'-deoxy-3'-L-fluorothymidine as a proliferation tracer and preclinical study
-
摘要: 18F-3'-脱氧-3'-L-氟代胸苷(18F-FLT)作为一种增殖示踪剂,利用PET可将细胞增殖活动可视化并进行量化评估,为临床提供了一种非侵入性监测抗肿瘤疗效的检查方法。该文讨论了18F-FLT作为增殖示踪剂的机制,并回顾了目前18F-FLT PET临床前期研究的状况。虽然18F-FLT是一种可以反映细胞增殖活动的示踪剂,但也有很多限制:在大部分病例中,其摄取率显著低于目前临床广泛应用的18F-FDG,而且受化疗方案和肿瘤类型的影响,18F-FLT摄取与细胞增殖活动并不总是一致。
-
关键词:
- 细胞增殖 /
- 18F-脱氧氟代胸苷 /
- 氟脱氧葡萄糖F18 /
- 正电子发射断层显像术 /
- 胸苷激酶
Abstract: 18F -3'-deoxy-3'-L-fluorothymidine(18F-FLT)has been developed as a proliferation tracer in recent years. Imaging and measurement of proliferation with PET could provide clinicians with a non-inva-sive tool to monitor the response to anticancer treatment. In this review, the basis of 18F-FLT as a proliferation tracer is discussed. And reviewed the current status of 18F-FLT preclinical researches. Although 18F-FLT is a tracer that visualizes cellular proliferation, it also has certain limitations, for example, in comparison with the most widely used PET tracer 18F-FDG, 18F-FLT uptake is significant lower in some tumors, and 18F-FLT up-take does not always reflect the tumor cell proliferation rate cause of the different chemothe-rapy regimens. -
[1] Wilson IK, Chatterjee S, Wolf W. Synthesis of 3'-fluoro-3'-deoxy-thymidine and studies of its 18F-radiolabeling, as a tracer for the noninvasive monitoring of the biodistribution of drugs against AIDS. J Fluorine Chem ,1991, 55(3): 283-289. [2] Shields AF, Grierson JR, Dohmen BM, et al. Imaging proliferation in vivo with [F-18]FLT and positron emission tomography. Nat Med,1998, 4(11): 1334-1336. [3] Turcotte E, Wiens LW, Grierson JR, et al. Toxicology evaluation of radiotracer doses of 3'-deoxy-3'-[18F]fluorothymidine (18F-FLT) for human PET imaging: Laboratory analysis of serial blood samples and comparison to previously investigated therapeutic FLT doses. BMC Nucl Med , 2007, 7 : 3. [4] Spence AM, Muzi M, Link JM, et al. NCI-sponsored trial for the evaluation of safety and preliminary efficacy of FLT as a marker of proliferation in patients with recurrent gliomas: safety studies. Mol Imaging Biol, 2008, 10(5): 271-280. [5] Vesselle H, Grierson J, Peterson LM, et al. 18F-Fluorothymidine radiation dosimetry in human PET imaging studies. J Nucl Med, 2003, 44(9): 1482-1488. [6] Al-Saeedi F, Welch AE, Smith TA. [methyl-3H]Choline incorpora-tion into MCF7 tumour cells: correlation with proliferation. Eur J Nucl Med Mol Imaging , 2005, 32(6): 660-667. [7] Breeuwsma AJ, Pruim J, Jongen MM, et al. In vivo uptake of [11C]choline does not correlate with cell proliferation in human prostate cancer. Eur J Nucl Med Mol Imaging , 2005, 32(6): 668-673. [8] Wells P, West C, Jones T, et al. Measuring tumor pharmacodynamic response using PET proliferation probes: the case for 2-[(11)C]-thymidine. Biochim Biophys Acta , 2004,1705(2): 91-102. [9] Mier W, Haberkorn U, Eisenhut M. [18F]FLT; portrait of a prolifera-tion marker. Eur J Nucl Med Mol Imaging, 2002, 29(2):165-169. [10] Seitz U, Wagner M, Neumaier B, et al. Evaluation of pyrimidine metabolising enzymes and in vitro uptake of 3'-[(18)F]fluoro-3'-deoxythymidine ([18F]FLT)in pancreatic cancer cell lines. Eur J Nucl Med Mol Imaging, 2002, 29(9):1174-1181. [11] Rasey JS,Grierson JR,Wiens LW,et al.Validation of FLT uptake as a measure of thymidine kinase-1 activity in A549 carci-noma cells. J Nucl Med, 2002, 43(9): 1210-1217. [12] Muzi M, Mankoff DA, Grierson JR, et al. Kinetic modeling of 3'-deoxy-3'-fluorothymidine in somatic tumors: mathematical studies. J Nucl Med, 2005, 46(2): 371-380. [13] Schiepers C, Chen W, Dahlbom M, et al. 18F-fluorothymidine kinet-ics of malignant brain tumors. Eur J Nucl Med Mol Imaging, 2007, 34(7): 1003-1011. [14] Muzi M, Vesselle H, Grierson JR, et al. Kinetic analysis of 3'-deoxy-3'-fluorothymidine PET studies: validation studies in patients with lung cancer. J Nucl Med, 2005, 46(2): 274-282. [15] de Langen AJ, Klabbers B, Lubberink M, et al. Reproducibility of quantitative 18F-3'-deoxy-3'-fluorothymidine measurements using positron emission tomography. Eur J Nucl Med Mol Imaging, 2009, 36(3): 389-395. [16] Plotnik DA, McLaughlin LJ, Chan J, et al. The role of nucleoside/nucleotide transport and metabolism in the uptake and retention of 3'-fluoro-3'-deoxythymidine in human B-lymphoblast cells. Nucl Med Biol, 2011,38(7): 979-986. [17] Patlak CS, Blasberg RG, Fenstermacher JD. Graphical evaluation of blood-to-brain transfer constants from multiple-time uptake data. J Cereb Blood Flow Metab, 1983, 3(1): 1-7. [18] Menda Y, Boles Ponto LL, Dornfeld KJ, et al. Kinetic analysis of 3'-deoxy-3'-18F-fluorothymidine (18F-FLT) in head and neck cancer patients before and early after initiation of chemoradiation therapy. J Nucl Med, 2009, 50(7): 1028-1035. [19] Barthel H, Perumal M, Latigo J, et al. The uptake of 3'-deoxy-3'-[18F]fluorothymidine into L5178Y tumours in vivo is dependent on thymidine kinase 1 protein levels. Eur J Nucl Med Mol Imaging, 2005, 32(3): 257-263. [20] Barthel H, Cleij MC, Collingridge DR, et al. 3'-deoxy-3'-[18F]fluo-rothymidine as a new marker for monitoring tumor response to anti-proliferative therapy in vivo with positron emission tomography. Cancer Res , 2003, 63(13): 3791-3798. [21] Leyton J, Latigo JR, Perumal M, et al. Early detection of tumor response to chemotherapy by 3'-deoxy-3'-[18F]fluorothymidine posi-tron emission tomography: the effect of cisplatin on a fibrosarcoma tumor model in vivo. Cancer Res, 2005, 65(10): 4202-4210. [22] Jensen MM, Erichsen KD, Bjürkling F, et al. Early detection of res-ponse to experimental chemotherapeutic Top216 with [18F]FLT and [18F]FDG PET in human ovary cancer xenografts in mice. PLoS One, 2010, 5(9): e12965. [23] Leyton J, Alao JP, Da Costa M, et al. In vivo biological activity of the histone deacetylase inhibitor LAQ824 is detectable with 3'-deoxy-3'-[18F]fluorothymidine positron emission tomography. Cancer Res ,2006, 66(15): 7621-7629. [24] Munch-Petersen B, Cloos L, Jensen HK, et al. Human thymidine kinase 1. Regulation in normal and malignant cells. Adv Enzyme Regul, 1995, 35: 69-89. [25] van Waarde A, Cobben DC, Suurmeijer AJ, et al. Selectivity of 18F-FLT and 18F-FDG for differentiating tumor from inflammation in a rodent model. J Nucl Med, 2004, 45(4): 695-700. [26] Toyohara J, Waki A, Takamatsu S, et al. Basis of FLT as a cell pro-liferation marker: comparative uptake studies with [3H]thymidine and [3H]arabinothymidine, and cell-analysis in 22 asynchronously growing tumor cell lines. Nucl Med Biol , 2002, 29(3): 281-287. [27] Dittmann H, Dohmen BM, Kehlbach R, et al. Early changes in [18F]FLT uptake after chemotherapy: an experimental study. Eur J Nucl Med Mol Imaging , 2002, 29(11):1462-1469. [28] 谭业颖,田嘉禾,汤义军,等. 18F-FLT与18F-FDG评估化疗早期反应的细胞学研究. 中国医学影像学杂志,2009,17(6):442-444.
[29] Sugiyama M, Sakahara H, Sato K, et al. Evaluation of 3'-deoxy-3'-18F-fluorothymidine for monitoring tumor response to radiotherapy and photodynamic therapy in mice. J Nucl Med, 2004, 45(10):1754-1758. [30] Waldherr C, Mellinghoff IK, Tran C, et al. Monitoring antiprolifera-tive responses to kinase inhibitor therapy in mice with 3'-deoxy-3'-18F-fluorothymidine PET. J Nucl Med , 2005, 46(1):114 -120. [31] Oyama N, Ponde DE, Dence C, et al. Monitoring of therapy in androgen-dependent prostate tumor model by measuring tumor proliferation. J Nucl Med, 2004, 45(3): 519-525. -






 下载:
下载: