-
孤立性肺结节(solitary pulmonary nodule, SPN)是指肺内孤立的、单发的、直径小于或等于3 cm、长径与短径之比≤1.5的实质性病灶, 周围无与病灶关联的肺不张、炎症、局部淋巴结肿大[1-2]。SPN的诊断一直是胸部影像学诊断的难点和热点, PET-CT能从功能代谢和解剖形态两方面来判断病变性质, 对于肺结节的诊断与鉴别诊断具有很高的灵敏度、特异度和准确率, 但仍有一定的假阴性和假阳性, 而常规PET-CT加高分辨率CT(high resolution CT, HRCT)能降低假阴性率, 提高肺结节的检出率和诊断正确率[3], 本研究探讨18F-FDG PETCT双时相显像结合HRCT对SPN的鉴别诊断价值, 报告如下。
-
2007年3月至2011月3月在本院就诊、经CT证实为SPN的患者173例, 其中男性103例、女性70例, 年龄30~86岁, 平均(55.6±13.3)岁。SPN病例的纳入标准(同时具备下列条件): ①肺内孤立的、单发的结节; ②结节直径≤3 cm; ③结节长径与短径之比≤1.5;④结节周围无肺不张、炎症及局部淋巴结肿大。SPN病例的排除标准(符合下列条件之一者即被排除): ①近1个月内病灶做过CT引导下穿刺活检术; ②近1个月内做过胸腔镜活检术; ③3个月内做过化疗、放疗等肿瘤相关治疗; ④经降糖处理后空腹血糖仍 > 11.1 mmol/L。
-
Discovery ST型PET-CT仪由美国GE公司生产。18F离子由Mintrace回旋加速器产生, FDG由全自动计算机控制的化学处理控制模块合成, 得到的18F-FDG经高效液相层析测定, 放化纯度 > 95%。
-
PET-CT检查前患者禁食4 h以上, 末梢血糖控制在3.1~6.7 mmol/L。按患者体重静脉注射18F-FDG 4.81 MBq/kg(0.13 mCi/kg), 早期显像于静脉注射18F-FDG后50~60 min进行, 并行HRCT, 延迟显像于注射18F-FDG后2~2.5 h进行。PET-CT全身显像范围从头到股骨上段, 先行CT透射扫描, 扫描电流80 mA, 电压120 kV; 后行PET采集, 每个床位3.5 min。肺HRCT扫描参数为120~140 kV, 240~260 mA, 层厚1~3 mm, 尽量用小显示野包括全部肺组织。延迟扫描每个床位6 min。将CT图像和PET图像自行融合, 获得横断面、矢状面、冠状面三维断层图像。
所有病例均行18F-FDGPET-CT双时相显像加同机胸部HRCT, 最后由手术病理或临床随访确诊。
-
PET-CT图像及HRCT图像由3名核医学科医师独立阅片, 观察是否存在异常18F-FDG摄取, 根据计算机软件在横断面、矢状面、冠状面等3个不同断面确定异常18F-FDG摄取病灶的位置。对照CT所示肺部病灶勾画ROI, 根据受检者体重、注射剂量和时间、ROI内放射性计数, 由计算机自动计算出病灶早期显像SUV(SUV的良恶性界值为2.5), 然后将同样大小ROI置于延迟显像的相应层面, 计算滞留指数(retention index, RI)作为半定量指标, RI=(SUV延迟-SUV早期)/SUV早期×100%。应用HRCT观察结节内部及周围结构的细节。
-
应用SPSS13.0对两组资料进行分析, 计量资料采用t检验, 计数资料采用χ2检验, P < 0.05为差异有统计学意义。
-
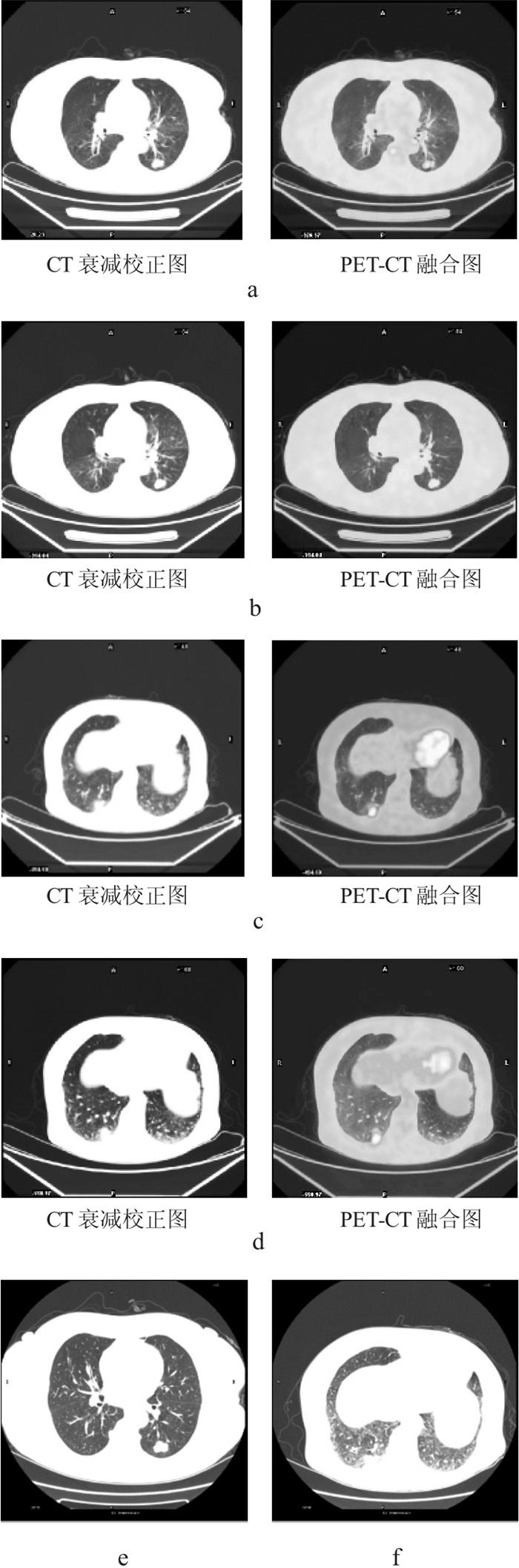
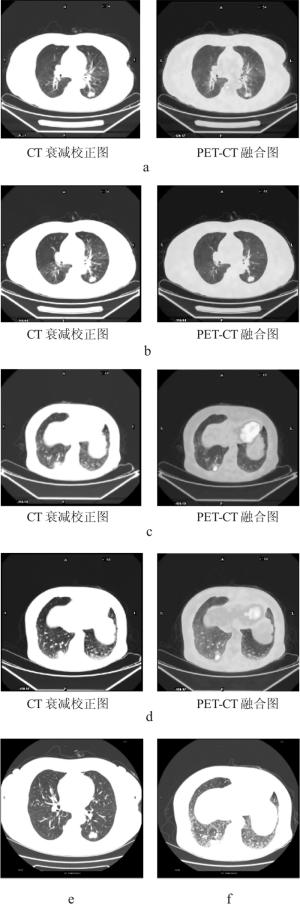
173例SPN患者经病理或随访证实恶性病变41例, 良性病变132例。其中, 18F-FDG PET-CT双时相显像和18F-FDG PET-CT双时相+HRCT对SPN良恶性的鉴别诊断结果见表 1。结果显示: 18F-FDG PET-CT双时相+HRCT对SPN诊断的灵敏度、特异度、准确率、阳性预测值及阴性预测值均显著高于18F-FDG PET-CT双时相显像(χ2=8.2, P < 0.05;χ2=19.7, P < 0.01;χ2=20.1, P < 0.01;χ2=20.8, P < 0.001;χ2=10.8, P < 0.01)。因HRCT能详细显示组织解剖和病理改变细节, 故对SPN定性诊断具有一定的价值(图 1)。
方法 灵敏度 特异度 准确率 阳性预测值 阴性预测值 PET-CT 91.3 42.6 77.4 51.8 60.6 PET-CT+HRCT 97.7 93.5 96.8 97.9 93.7 表 1 18F-FDGPET-CT双时相显像与同机高分辨率CT对孤立性肺结节鉴别诊断的价值
(%) -
良恶性SPN的18F-FDG PET-CT双时相显像SUV结果见表 2。由表 2数据分析显示, 良性结节SUV早期与SUV延迟比较, t=2.92, P < 0.05;恶性结节SUV早期与SUV延迟比较, t=3.14, P < 0.01。恶性病变组的SUV变化率(即: RI)[(42.50±3.87)%]显著高于良性病变组[(26.90±7.23)%](t=6.03, P < 0.01)。采取延迟显像可以更好地区别良恶性, 尤其是延迟显像大大提高了SUV在2.5附近的结节的诊断准确率。
良性结节 恶性结节 SUV早期 2.84±0.41 6.26±0.72 SUV延迟 2.73±0.36 6.88±0.72 滞留指数 42.50±3.87 26.90±7.23 表 2 18F-FDG PET-CT双时相显像SUV对孤立性肺结节良恶性的鉴别诊断价值
-
HRCT显示SPN病灶的最大径为3 cm, 最小径为0.4 cm, 平均(2.2±0.5)cm。HRCT对SPN病灶本身及其周围诸多阳性征象的检出率较同机得到的CT图像高(表 3), 进一步从解剖形态上增加了PET-CT对SPN的诊断信息, 尤其是区分良、恶性结节。
CT征象 PET-CT同机CT 同机高分辨率CT 分叶 66(38.2) 86(49.7) 毛刺 62(35.9) 77(44.5) 胸膜牵拉 24(13.8) 32(18.5) 血管集束 15(8.7) 20(11.6) 磨玻璃样 3(1.7) 23(13.3) 空泡征 3(1.7) 5(2.9) 表 3 18F-FDGPET-CT中的CT及高分辨率CT对孤立性肺结节内部及周围征象检出率
[病灶数(%)] -
18F-FDG PET-CT可通过观察组织内18F-FDG摄取量来确定其占位性病变的性质, 恶性肿瘤高摄取18F-FDG是因为高表达的葡萄糖转运、高水平的己糖激酶和低水平的葡萄糖-6-磷酸化酶等因素导致18F-FDG聚集并滞留在肿瘤细胞内而使肿瘤得以显像。由于肿瘤细胞的生物化学特性, 静脉注射18FFDG后, 大多数恶性肿瘤表现为SUV较高, 故其在肺部恶性病变的诊断中有重要作用[4-5]。但SUV本身只是18F-FDG摄取的一个相对标准, 作为PET检查仅有的量化指标时, 除血糖浓度影响机体对18F-FDG的摄取外, 葡萄糖转运蛋白1的水平、乏氧、不同分化程度和增殖能力的细胞、肿瘤细胞内葡萄糖-6-磷酸酶水平、组织内肿瘤细胞密度、病变大小和部位等均影响SUV。此外, 显像剂注射、仪器质控、重建算法、衰减校正、散射校正、采集时间等也可影响SUV。其中, 最重要的影响因素可能就是注射显像剂后的采集时间, 因此, 仅用单次显像的SUV来判断各个器官肿瘤的良恶性有一定局限性, 导致良恶性病灶之间存在着明显的交叉[6]。已经证明, 采取延迟显像可以更好的区别良恶性, 尤其是延迟显像大大提高了SUV在2.5附近的结节的诊断准确率[7]。
本研究显示, 恶性病变组的SUV变化率[(42.50±3.87)%]显著高于良性病变组[(26.90± 7.23)%](t=6.03, P < 0.01)。显像阳性的良性病灶往往是增殖性病变或以增殖性病变为主的结核结节, 含有大量的类上皮细胞、郎罕巨细胞和淋巴细胞等, 这些细胞代谢旺盛, 对18F-FDG摄取可很高, 因而有6例良性者误诊为恶性。本研究结果提示, 双时相显像方法简便, 在临床上具有一定的实用价值, 肺恶性病变延迟显像呈SUV升高的幅度高于良性病变; 对SUV为2.5的病灶进行双时相显像更有意义, 如果延迟显像SUV不变或下降, 则支持良性病变。
18F-FDGPET-CT诊断恶性结节主要依据以下几点综合判定: ①SUV > 2.5;②显像剂放射性浓聚呈结节状、团块状, 高代谢灶边界较清楚; ③结节本身或外周可见恶性肿瘤的CT征象, 如细毛刺、分叶、空泡征、血管集束症等。良性结节主要依据以下几点综合判定: ①SUV < 2.5;②显像剂浓聚程度低, 尤其是分布明显不均匀者, 部分结节甚至无浓聚征象; ③结节的CT表现呈片状、条状楔形、絮状或边缘模糊, 无细毛刺、分叶、空泡征、血管集束症等恶性肿瘤的CT征象。虽然18F-FDG PET-CT在诊断SPN方面具有较高的灵敏度和准确率, 但SUV作为鉴别良、恶性病变的一个重要指标, 也存在一定的不足, 如假阴性。病灶的SUV与肿瘤倍增时间高度相关, 肿瘤生长快、倍增时间短, 则SUV高; 而肿瘤生长慢、倍增时间长者则SUV较低[8]。对于SPN, 不能以单纯常规显像及延迟显像获得的SUVmax作为判定肺部病灶的良恶性的惟一标准, 需要结合病灶的位置、大小、形态、病变的数量及病灶内放射性分布情况等综合判断, 但小于0.7 cm的病灶, 由于仪器分辨率的局限和部分容积效应, 常出现假阴性[9]。
PET-CT中的CT主要作用为定位, 可以满足精确定位的需要, 但是在平静呼吸状态下和低剂量下获得的图像, 层厚为5.0 mm, 无法清晰显示病灶及周围结构的细节[10]。相对于PET-CT中衰减校正CT而言, 胸部HRCT重建至厚度1.25 mm, 可多层面重建、多角度显示病灶细节, 清晰显示病灶内部及周围结构的细微改变, 有效降低了部分容积效应的影响, 提高了空间分辨率, 使我们能更好地评价肺结节的界面和内部结构[11], 进一步从解剖形态上增加了PET-CT对SPN的诊断信息, 尤其是区分良、恶性结节[12]。并且, 结节的边缘征象一直是SPN鉴别诊断的一个重要依据, HRCT能够显示肺小叶水平的细微结构和病变, 从我们的研究结果中可以看到, PET-CT+HRCT与单纯PET-CT比较, 对SPN诊断的灵敏度、特异度、准确率及阴性预测值均具有显著性差异, 由此可以看出, HRCT对病灶本身及其周围诸多阳性征象的检出率较同机得到的CT图像高。Zwirewich等[13]报道, 结节大小的增加以及分叶、毛刺、胸膜牵拉征、血管集束征、磨玻璃样变、空泡征、中心密度不均匀的出现, 高度提示恶性肿瘤, 这些征象在HRCT中表现的更清晰。由于HRCT具有极佳的空间分辨率, 可直接显示叶间胸膜以及具有更清晰显示肺胸膜壁界面的能力, 故有助于发现轻微的胸膜病变, 有助于对胸膜病变、胸腔内病变和贴胸膜肺内病变的鉴别[14]。
总之, PET-CT+HRCT可以作为SPN的首选无创性检查方法, 我们应发掘PET-CT的多种功能, 充分利用好现代影像学技术提供给我们的各种清晰图像及征象, 提高对SPN的准确诊断, 避免不必要的穿刺活检和开胸手术。
18F-FDGPET-CT双时相显像结合高分辨率CT诊断孤立性肺结节的价值
Dual phase time scan combine high resolution CT to diagnose solitary pulmonary nodule by 18F-FDGPET-CT
-
摘要:
目的 探讨18F-FDG PET-CT双时相显像结合高分辨率CT(HRCT)对孤立性肺结节(SPN)的鉴别诊断价值。 方法 经CT证实符合SPN的病例173例,应用PET-CT技术对SPN病例进行双时相显像及同机HRCT,早期显像于注射18F-FDG后50~60 min,并行HRCT,延迟显像于注射后2~2.5 h进行。测定病灶两次显像的SUV,并计算两次显像SUV的变化率,根据病灶HRCT的形态学特征, 进行综合诊断判断良恶性, 所得结果与随访结果作对照比较。 结果 173例SPN患者经病理或随访证实恶性病变41例、良性病变132例。恶性病变组早期显像的SUV为6.26±0.72,延迟显像的SUV为6.88±0.74,滞留指数为(42.50±3.87)%;良性病变组早期显像的SUV为2.84±0.41,延迟显像的SUV为2.73±0.36,滞留指数为(26.90±7.23)%。 结论 18F-FDG PET-CT双时相显像结合HRCT鉴别诊断SPN的方法简便、准确率高,具有广泛的临床实用价值。 -
关键词:
- 硬币病变, 肺 /
- 氟脱氧葡萄糖F18 /
- 正电子发射断层显像术 /
- 体层摄影术, X线计算机
Abstract:Objective To evaluate the role of dual phase scan combine high resolution computerized tomography(HRCT)by 18F-FDG PET-CT imaging in the diagnosis of solitary pulmonary nodule(SPN). Methods 173 patients with SPN demonstrated by CT, All these patients underwent dual time point combine HRCT 18F-FDG PET/CT imaging.The imaging protocol included the early imaging combine HRCT of PETCT at 50-60 min and delayed imaging of PET at 2-2.5 h post injection 18F-FDG.The standardized uptake value(SUV)was calculated for both time points.All results were expressed as the percentage change in SUV. According to characteristic in focal morphology by HRCT found, general inspection and diagnosis were benign or malignant, It was compared the result and following up result. Results Histopathology demonstrated or following up result 41 patients with malignant lesions and 132 patients with benign lesions.The SUV of malignant lesions was SUV 6.26±0.72 in early imaging, ,and 6.88±0.74 in delayed imaging.The retention index of malignant lesions was(42.50±3.87)%.The SUV of benign lesions was 2.84±0.41 in early imaging, and 2.73±0.36 in delayed imaging.The retention index of benign lesions was(26.90±7.23)%. Conslusions 18F-FDG PET-CT dual time point imaging combine HRCT is a simple practical method and accurate ratio high for the diagnosis of SPN.The method will be widely clinically practised. -
表 1 18F-FDGPET-CT双时相显像与同机高分辨率CT对孤立性肺结节鉴别诊断的价值
(%) 方法 灵敏度 特异度 准确率 阳性预测值 阴性预测值 PET-CT 91.3 42.6 77.4 51.8 60.6 PET-CT+HRCT 97.7 93.5 96.8 97.9 93.7 表 2 18F-FDG PET-CT双时相显像SUV对孤立性肺结节良恶性的鉴别诊断价值
良性结节 恶性结节 SUV早期 2.84±0.41 6.26±0.72 SUV延迟 2.73±0.36 6.88±0.72 滞留指数 42.50±3.87 26.90±7.23 表 3 18F-FDGPET-CT中的CT及高分辨率CT对孤立性肺结节内部及周围征象检出率
[病灶数(%)] CT征象 PET-CT同机CT 同机高分辨率CT 分叶 66(38.2) 86(49.7) 毛刺 62(35.9) 77(44.5) 胸膜牵拉 24(13.8) 32(18.5) 血管集束 15(8.7) 20(11.6) 磨玻璃样 3(1.7) 23(13.3) 空泡征 3(1.7) 5(2.9) -
[1] Islam S, Roustan Delatour NL, Salahdeen SR, et al. Cytologic features of benign solitary pulmonary nodules with radiologic correlation and diagnostic pitfalls: a report of six cases. Acta Cytol, 2009, 53(2): 201-210. doi: 10.1159/000325126 [2] Alzahouri K, Velten M, Arveux P, et al. Management of SPN in France. Pathways for definitive diagnosis of solitary pulmonary nodule: a multicentre study in 18 French districts. BMC Cancer, 2008, 8: 93. [3] Juergens KU, Weckesser M, Stegger L, et al. Tumor staging using whole-body high-resolution 16-channel PET-CT: does additional low-dose chest CT in inspiration improve the detection of solitary pulmonary nodules?. Eur Radiol, 2006, 16(5): 1131-1137. doi: 10.1007/s00330-005-0080-6 [4] Hashimoto Y, Tsujikawa T, Kondo C, et al. Accuracy of PET for diagnosis of solid pulmonary lesions with 18F-FDG uptake below the standardized uptake value of 2.5. J Nucl Med, 2006, 47(3): 426-431. [5] Simon GR, Wagner H, American College of Chest Physicians. Small cell lung cancer. Chest, 2003, 123(1 Suppl): 259S-271S. [6] Ioannidis JP, Lau J. 18F-FDG PET for the diagnosis and grading of soft-tissue sarcoma: A meta-analysis. J Nucl Med, 2003, 44(5): 717-724. [7] Kubota K, Itoh M, Ozaki K, et al. Advantage of delayed whole-body FDG-PET imaging for tumour detection. Eur J Nucl Med, 2001, 28(6): 696-703. doi: 10.1007/s002590100537 [8] Coleman RE. PET in lung cancer. J Nucl Med, 1999, 40(5): 814-820. [9] 潘中允. PET诊断学. 北京: 人民卫生出版社, 2005: 218.
[10] 刘庆伟, 刘奇. PET/CT肿瘤学. 北京: 科学出版社, 2006: 113-125.
[11] 张兴华, 张雪林, 熊伟, 等. 孤立型细支气管肺泡癌的HRCT表现. 中国医学影像技术, 2006, 22(11): 1672-1674. doi: 10.3321/j.issn:1003-3289.2006.11.019
[12] Erasmus JJ, Connolly JE, McAdams HP, et al. Solitary pulmonary nodules: Part 1. Morphologic evaluation for differentiation of benign and malignant lesions. Radiographics, 2000, 20(1): 43-58. [13] Zwirewich CV, Vedal S, Miller RR, et al. Solitary pulmonary nodule: high-resolution CT and radiologic-pathologic correlation. Radiology, 1991, 179(2): 469-476. doi: 10.1148/radiology.179.2.2014294 [14] 高彦平, 辛英. 高分辨率螺旋CT扫描对肺部病变的诊断价值. 山西医药杂志, 2005, 34(2): 119-120.
-





 下载:
下载: