-
近年来, 肿瘤的临床诊断和治疗得到了极大的改进。在肿瘤诊断上, 除CT、MRI及超声可对肿瘤进行形态学显像外, SPECT、PET还可对其进行功能学显像。在肿瘤治疗上, 除手术治疗外, 放化疗的方式也有极大的改善: 放疗包括适形调强放疗(intensity-modulated radiotherapy)和影像引导放射治疗(image-guided radiotherapy)等; 化疗包括分子靶向化疗(molecular targeted chemotherapy)和新辅助化疗(neoadjuvant chemotherapy)等; 同时还可以进行放疗和化疗联合治疗。然而, 由于肿瘤细胞生物学行为的多样性, 它对各种治疗的疗效的反应表现各异, 即使是同一种类型的肿瘤用同一方式治疗, 也会产生不同的治疗效果。因此, 能够早期监测肿瘤的疗效从而及时改变治疗方案, 实现个体化治疗显得尤为重要。
PET-CT已被认为能够早期检测肿瘤治疗疗效以及是否复发的有效工具。目前, 用PET-CT对肿瘤疗效的监测主要是通过注射放射性显像剂后对各参数进行定性和定量的分析, 从而判定肿瘤在治疗前、治疗中及治疗后的变化情况, 其中, 18F-FDG的应用非常广泛, 但其对肿瘤放化疗后疗效的评价还存在缺陷。3′-脱氧-3′-18F-氟胸腺嘧啶(3′-deoxy-3′-18F-fluorothymidine, 18F-FLT)则是近年来受到重视的显像剂, 对肿瘤的诊断具有特异性。就此, 很多学者将这两种放射性显像剂对多种肿瘤放化疗后疗效评价进行了研究和比较, 发现18F-FDG PET-CT和18F-FLTPET-CT都能够对多种类型的肿瘤进行诊断、分期及疗效的评价, 且比常规显像具有更好的敏感性和特异性[1-6]。本文主要对18F-FDG和18FFLT这两种显像剂对肿瘤治疗后疗效监测的有关实验研究进行综述。
-
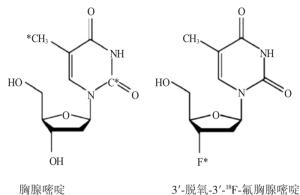
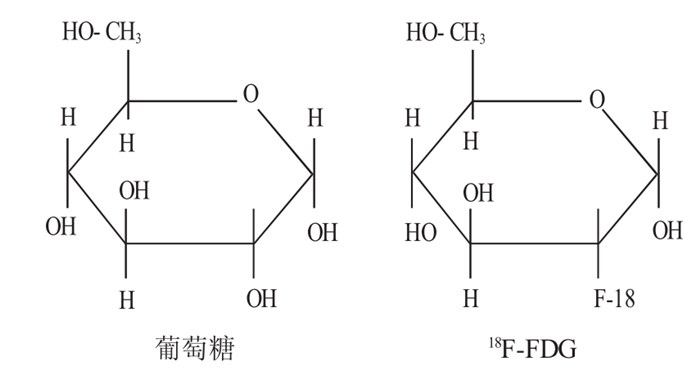
肿瘤组织是机体内一种异常的新生物, 其细胞的代谢增生异常活跃, 因此, 肿瘤细胞中葡萄糖转运蛋白和细胞内酶水平及基因表达均较正常细胞明显异常。18F-FDG为葡萄糖代谢显像剂的典型代表。它的结构类似于葡萄糖(图 1), 在己糖激酶的作用下磷酸化, 生成FDG-6-PO4, 后者不能参与进一步的糖代谢过程, 被滞留在细胞中作为示踪剂进行显像, 从而反映机体内细胞的葡萄糖代谢过程。肿瘤组织对18F-FDG的摄取主要是因为其葡萄糖代谢旺盛, 与机体正常组织形成一个鲜明的对比, 从而得以在体内观测肿瘤代谢[7-8]。18F-FLT是一种胸腺嘧啶类似物(图 2), 能和胸腺嘧啶一样进入细胞内, 并被细胞质内的胸腺嘧啶核苷激酶1(thymidine kinase-1, TK-1)磷酸化后滞留于细胞内。肿瘤细胞在增殖过程中, DNA的合成需要TK-1上调, 18FFLT PET通过反映TK-1的活性而间接反映肿瘤细胞的增殖状况[9-12]。FLT最早应用于艾滋病的治疗, 其主要作用是能够抑制DNA的合成, 但由于其不良反应比较大, 在常规药量(约100 mg/d)时便能抑制骨髓功能和产生严重的肝脏毒性而被弃用。20世纪90年代末, Shields等[13]研究发现, 用18F-FLT作为显像剂时能够检测肿瘤或处于增殖状态的组织。Turcotte等[14]也证实了18F-FLT在作为放射性示踪剂时不会产生不良反应。
-
细胞周期可分为间期(G1期、S期、G2期)和分裂期(M期)。细胞对18F-FDG的摄取与细胞周期没有直接的相关性, 它对18F-FDG的摄取主要是根据细胞代谢的能力。若细胞代谢旺盛, 其摄取量则高; 反之, 则低。正因为如此, 18F-FDG并非肿瘤特异性显像剂, 在区分炎性组织和肿瘤组织时18FFLT则显得更具有特异性[15]。实验研究表明, 细胞对18F-FLT的摄取主要是根据处于S期细胞数的多少, 若S期细胞数较多, 则细胞摄取18F-FLT则高。TK-1为DNA补救合成的关键酶, 在S期具有很强的酶活性[16], 18F-FLT通过反映TK-1的活性来间接反映细胞的增殖状态。Direcks等[17]研究了肿瘤行放疗或化疗后细胞周期的变化与肿瘤对18F-FDG和18F-FLT摄取量之间的关系: 通过5-氟尿嘧啶、多柔比星及紫杉醇这3种化疗药物研究乳腺癌细胞对18F-FDG和18F-FLT摄取量的变化情况, 其中5-氟尿嘧啶主要增加细胞周期中G1期细胞的百分比而减少处于G2/M期的细胞数量, 多柔比星则明显增加G2/M期的细胞数量而减少处于G1期和S期细胞的数量, 紫杉醇则是轻微增加G2/M期; 在给药后72 h, 5-氟尿嘧啶治疗组对18F-FDG和18F-FLT的摄取量分别减少50%和54%, 多柔比星治疗组则分别增加71%和173%, 而紫杉醇治疗组对18F-FDG摄取量增加100%以上, 但对18F-FLT的摄取基本上没什么变化。因此, 不同的化疗药物影响细胞周期的不同时期而导致肿瘤组织对18F-FDG和18F-FLT摄取量之间存在很大的变化, 在临床中以PET监测肿瘤化疗后的疗效时要充分考虑这种因素的影响。Wang等[18]对结直肠癌SW480和SW620两种细胞行放疗后研究细胞周期的变化与18F-FDG和18F-FLT摄取量之间的关系, 结果表明: 用20 Gy照射SW480细胞株, 24 h后G1期细胞数量明显增加, S期、G2/M期细胞则减少, 同时对18F-FLT的SUV则从3.65±0.51显著减少到2.87±0.47, 而对18FFDG的摄取量虽有减少但无统计学意义; 对SW620细胞株做同样的实验发现, 处于G1期和G2/M期的细胞减少, S期的细胞明显增加, 同时18F-FLT的SUV则从2.22±0.42显著减少到1.76±0.45, 对18FFDG摄取量有减少但也无统计学意义。以上结果表明, 不同细胞株对同一放疗的反应情况是不同的。因此, 我们在监测肿瘤放化疗后的疗效时既要考虑肿瘤本身的特性, 还要考虑放化疗的作用机制, 只有综合考虑后才可得出客观的评价。
-
目前, 临床上用18F-FDG和18F-FLT PET监测肿瘤时, 主要是根据肿瘤组织摄取18F-FDG和18FFLT的多少, 观察指标有SUV、靶组织与非靶组织(T/N)比值等, 若肿瘤组织对18F-FDG和18F-FLT摄取量多, 在图像中表现出阳性结果, 说明肿瘤代谢旺盛或增殖能力比较强; 若放化疗有效, 则肿瘤对18F-FDG和18F-FLT的摄取都会减少。但是, 也有研究结果发现, 肿瘤组织在放疗或化疗后对18FFDG和18F-FLT摄取量的增多并非因为放疗或化疗的无效, 而是由于放化疗后引起组织炎性改变或改变了细胞代谢的途径。Brepoels等[6]对具有免疫缺陷的小鼠植入淋巴瘤模型后, 用环磷酰胺治疗淋巴瘤并早期监测其对18F-FDG和18F-FLT的摄取情况, 结果表明: 在给药后2 d, 与对照组相比, 肿瘤对18F-FDG和18F-FLT的摄取量分别减少29%和25%;但随后肿瘤对18F-FDG的摄取量便上升, 7 d时摄取最多, 而对18F-FLT的摄取量基本保持不变; 病理分析表明, 肿瘤在化疗后便出现细胞坏死和凋亡, 同时还有炎性细胞渗入, 由此也可表明18FFLT对肿瘤疗效的监测更具有特异性。因此, 我们在监测肿瘤放化疗疗效时, 不能仅从肿瘤摄取18FFDG和18F-FLT的多少来判断放化疗是否有效, 应同时兼顾放化疗后引起机体组织的改变情况, 如炎性改变、凋亡或坏死等。
-
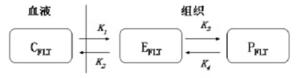
肿瘤细胞在放疗或化疗的早期都有一个加速再生的过程, 尽管在治疗过程中会有大量的细胞死亡, 但是细胞为了生存也会有效激发这种再生能力, 这种再生是影响肿瘤疗效的一个重要原因, 甚至导致治疗的失败[19-20]。如何才能有效抑制肿瘤细胞的这种再生能力或及时监测肿瘤细胞再生能力, 单从图像分析或静态测量18F-FLT的摄取值是不够的。Muzi等[21-23]通过建立动力学数学模型分析了肿瘤细胞的再生能力与肿瘤摄取18F-FLT的关系(图 3), 这种模型主要是通过18F-FLT进出血浆和组织中的各个速率(K1、K2、K3、K4、KFLT等)建立起来的, 研究结果表明, 增殖能力较强的骨髓中KFLT[指18FFLT从血浆中转入组织中被磷酸化的速率, KFLT=K1×K3/(K2+K3)]最高, 而没有增殖能力的骨骼肌中KFLT最低; 在肿瘤组织中, KFLT与Ki-67(一种增殖细胞核抗原)之间具有很好的相关性(r=0.92, P < 0.001)。以上研究可以说明, 通过动态分析18FFLT进出组织的速率能更好的反映细胞增殖情况, 对肿瘤增殖显像也可提供更加可靠的信息。Menda等[4]则通过18F-FLT的动态显像来研究头颈部肿瘤对放化疗后的疗效, 结果表明, 在放化疗后45~60 min时, 肿瘤对18F-FLT的SUV与KFLT之间也有极好的相关性(r=0.91), 通过动力学分析后可以更准确地评价肿瘤放化疗的疗效。
-
在细胞增殖显像中, 18F-FDG和18F-FLT到底谁能更准确地反映细胞增殖状况, 引起了不少学者的兴趣。Buck等[24]通过对患有肺结节的26例患者处于增殖状态的细胞百分比与18F-FDG和18F-FLT的SUV进行线性回归分析, 结果: 肿瘤摄取18F-FLT的SUV与Ki-67有很好的相关性(r=0.92, P < 0.001), 而肿瘤摄取18F-FDG的SUV与Ki-67之间的相关性稍差(r=0.59, P < 0.05)。由此表明, 18F-FLT比18FFDG能更好地反映肿瘤细胞的增殖情况。然而Cobben等[25]通过对喉癌患者进行研究的结果却表明, 18F-FDG和18F-FLT检测喉癌的效果是等同的, 没有什么区别, 只是喉癌对18F-FDG的摄取量比18F-FLT高。van Westreenen等[26]比较18F-FDG和18FFLT对食管癌患者的监测发现, 18F-FDG SUVmax与Ki-67的相关性r=0.14, 18F-FLT SUVmax与Ki-67的r=-0.76;18F-FDGSUVmean与Ki-67的r=0.13, 18F-FLT SUVmean与Ki-67的r=-0.74。这种结果甚至说明18FFDG和18F-FLT与细胞增殖之间没有任何联系。不过更多学者还是倾向于18F-FLT与细胞增殖之间有更好的相关性[27-28]。在体外实验研究中, Apisarnthanarax等[29]对食管癌小鼠模型进行放化疗, 24 h后监测肿瘤疗效时发现, 18F-FLT与Ki-67之间比18FFDG与Ki-67之间具有更好的相关性(r=0.89, P < 0.001比r=0.39, P > 0.05)。Wang等[30]对裸鼠植入结直肠癌模型进行放疗后发现, 18F-FLT和18F-FDG与Ki-67之间都无统计学意义。总之, 在用18FFLT和18F-FDG监测肿瘤细胞增殖状态时, 既要考虑肿瘤本身的特性, 还要考虑放射性显像剂检测的作用机制。看来, 有必要针对某种特定的肿瘤乃至某类亚型肿瘤来描述该肿瘤的增殖情况与18F-FLT和18F-FDG之间的关系。
-
肿瘤放化疗前后的反应会发生不同的变化, 如何才能够更好地预测这种变化成为研究的热点, 18F-FDGPET和18F-FLTPET在肿瘤的诊断、分期方面都被证明是有效的。目前, 研究者们更加注重对治疗前后反应的早期评价。传统显像(如CT、MRI等)对肿瘤治疗前后反应的评价主要是通过比较治疗前后的形态学改变, 但肿瘤要发生形态学改变一般都要数周甚至数个月的时间, 这样就达不到早期评价的效果。Troost等[31]报道, 通过CT测量大体肿瘤靶区(gross tumor volume ofCT, GTVCT)范围的结果表明, 在放疗早期GTVCT没有明显变化, 治疗4周后才发现GTVCT减少; 而肿瘤在放疗后的第1周便有18F-FLT的SUV减少, 并且在第4周减少得更加明显, 这表明18F-FLT摄取信号的改变是在肿瘤形态学的改变之前。Jensen等[28]通过18F-FLT PET来监测Top216(一种治疗乳腺癌的化疗药物, 此处用于治疗卵巢癌)抗卵巢癌疗效时发现, 在注射Top216后2 h就可检测到18F-FLT摄取的减少, 6 h后检测到18F-FDG摄取量的减少, 而肿瘤体积的改变则在数日之后, 表明18F-FDG和18F-FLT对肿瘤行放化疗后的疗效可以达到较早的监测和评价。
-
临床上, 多数肿瘤摄取18F-FDG的SUV比18FFLT的要高很多[24, 32]。尽管大脑、纵膈及小肠等在生理情况下摄取18F-FLT的量都明显低于18F-FDG, 但用18F-FLT来描述肿瘤的生物学特性比18F-FDG更具有优势[33]。然而, 正常生理情况下, 18F-FLT在肝脏和骨髓内的代谢比较旺盛, 摄取量比较高, 很难将肝脏和骨髓正常组织与病变组织区分开来, 从而影响18F-FLT的应用[32, 34]。在肝脏内, 18F-FLT PET检测肝癌的敏感性甚至不如传统的CT、MRI等, 但18F-FLT仍然可以反映肝癌细胞的增殖状态, 若联合CT和MRI对肝脏进行检测, 可能会提高检出的特异性和对良恶性肿瘤的区分提供有效的帮助。在骨髓方面, 用18F-FDG评估肿瘤疗效可能比18F-FLT更加具有优势[32]。因此, 临床检测肿瘤或对肿瘤疗效进行监测时要考虑肿瘤的部位和性质, 同时在条件允许的情况下, 最好能够多种辅助检查同时进行并综合分析, 这样能够提高检测的敏感性和特异性[35]。
-
在监测肿瘤治疗后的疗效时, 18F-FDG和18FFLT已逐步显示出其潜在的优越性, 为较早的监测肿瘤放化疗后的疗效提供了可能。但在研究中有以下几个方面值得考虑: ①同一肿瘤对不同化疗药物的疗效是不同的, 因为不同化疗药物的作用机制不同, 对细胞周期影响不同, 对显像剂的摄取量当然也不一样, 而不同肿瘤对同一放射治疗的反应也是不一样的, 因为不同肿瘤对放疗的敏感性不同, 同一放射治疗对不同肿瘤细胞周期的影响也不同, 对显像剂的摄取量也存在差别; ②肿瘤组织经过放疗或化疗后的短期内都有一个加速再生的过程, 此时肿瘤对显像剂的摄取可能比正常情况下都要高, 因此在判断放化疗的疗效时要充分考虑到这一点, 最好结合组织病理或相关辅助检查; ③18F-FDG和18F-FLT检测肿瘤的机制不同, 而不同肿瘤对它们又具有各自的特性, 因此, 对于不同部位、不同类型的肿瘤要合理选择显像剂, 同时可以结合显像剂各自的特点进行综合分析, 从而获得更佳的敏感性和特异性。
18F-FDG和18F-FLT PET对肿瘤放化疗疗效评价的实验研究
The experimental study on 18F-FDG and 18 F-FLTPET in assessing the outcome of cancer chemotherapy
-
摘要: PET可从分子水平观察细胞生物学行为。目前,临床上最常用的葡萄糖代谢显像剂是18F-FDG,而最常用的细胞增殖显像剂是3′-脱氧-3′-18F-氟胸腺嘧啶(18F-FLT)。这两种显像剂在肿瘤的诊断和分期方面已有深入广泛的研究,而在治疗后疗效评价方面的研究近年也很受重视,特别是肿瘤在放化疗前后对18F-FDG和18F-FLT摄取值的变化与肿瘤体积及细胞增殖和细胞周期之间的关系。该文就18F-FDG和18F-FLT在肿瘤放化疗疗效评价中的实验研究进行综述。
-
关键词:
- 肿瘤 /
- 氟脱氧葡萄糖F18 /
- 氟胸腺嘧啶F18 /
- 正电子发射断层显像术
Abstract: PET can observe the biological behavior of cell at the molecular level.18F-FDG is the most widely used glucose metabolic imaging agent.3'-Deoxy-3'-[18F]fluorothymidine(18F-FLT)is the most commonly used cell proliferation imaging agent.They both have been deeply researched in the diagnosis and staging of tumor.In recent years, researchers have paid more attention to monitoring the outcome of tumor therapy, especially to the relation between the uptake value variation of 18F-FDG, 18F-FLT before and during radiochemotherapy and tumor volume, cell proliferation, and cell cycle.This article was a research summary of the assessment of 18F-FDG and 18F-FLT in the outcome of cancer chemotherapy.-
Key words:
- Neoplasms /
- Fluorodeoxyglucose F18 /
- Fluorothymidine F18 /
- Positron-emission tomography
-
[1] Molthoff CF, Klabbers BM, Berkhof J, et al. Monitoring response to radiotherapy in human squamous cell cancer bearing nude mice: comparison of 2′-deoxy-2′-〔18F〕fluoro-D-glucose(FDG)and 3′-〔18F〕fluoro-3′-deoxythymidine(FLT). Mol Imaging Biol, 2007, 9(6): 340-347. doi: 10.1007/s11307-007-0104-5 [2] Agool A, Slart RH, Thorp KK, et al. Effect of radiotherapy and chemotherapy on bone marrow activity: a18F-FLT-PET study. Nucl Med Commun, 2011, 32(1): 17-22. doi: 10.1097/MNM.0b013e328340798c [3] Yue J, Chen L, Cabrera AR, et al. Measuring tumor cell proliferation with18F-FLT PET during radiotherapy of esophageal squamous cell carcinoma: a pilot clinical study. J Nucl Med, 2010, 51(4): 528-534. doi: 10.2967/jnumed.109.072124 [4] Menda Y, Laura L, Dornfeld K, et al. Kinetic analysis of 3′-deoxy-3′-18F-fluorothymidine(18F-FLT)in head and neck cancer patients before and early after initiation of chemoradiation therapy. J Nucl Med, 2009, 50(7): 1028-1035. doi: 10.2967/jnumed.108.058495 [5] Song SL, Liu JJ, Huang G, et al. Changes in 18F-FDG uptake within minutes after chemotherapy in a rabbit VX2 tumor model. J Nucl Med, 2008, 49(2): 303-309. doi: 10.2967/jnumed.107.044206 [6] Brepoels L, Stroobants S, Verhoef G, et al. 18F-FDG and18F-FLT uptake early after cyclophosphamide and mTOR inhibition in an experimental lymphoma model. J Nucl Med, 2009, 50(7): 1102-1109. doi: 10.2967/jnumed.109.062208 [7] Dose SJ, Bader M, Jenicke L, et al. Early prediction of response to chemotherapy in metastatic breast cancer using sequential 18F-FDG PET. J Nucl Med, 2005, 46(7): 1144-1150. [8] Benz MR, Evilevitch V, Allen-Auerbach MS, et al. Treatment monitoring by 18F-FDG PET/CT in patients with sarcomas: interobserver variability of quantitative parameters in treatment-induced changes in histopathologically responding and nonresponding tumors. J Nucl Med, 2008, 49(7): 1038-1046. doi: 10.2967/jnumed.107.050187 [9] Sugiyama M, Sakahara H, Sato K, et al. Evaluation of 3′-deoxy-3′-18F-Fluorothymidine for monitoring tumor response to radiotherapy and photodynamic therapy in mice. J Nucl Med, 2004, 45(10): 1754-1758. [10] Waldherr C, Mellinghoff IK, Tran C, et al. Monitoring antiproliferative responses to kinase inhibitor therapy in mice with 3′-deoxy-3′-18F-fluorothymidine PET. J Nucl Med, 2005, 46(1): 114-120. [11] Oyama N, Ponde DE, Dence C, et al. Monitoring of therapy in androgen-dependent prostate tumor model by measuring tumor proliferation. J Nucl Med, 2004, 45(3): 519-525. [12] Pan MH, Huang SC, Liao YP, et al. FLT-PET imaging of radiation responses in murine tumors. Mol Imaging Biol, 2008, 10(6): 325-334. doi: 10.1007/s11307-008-0158-z [13] Shields AF, Grierson JR, Dohmen BM, et al. Imaging proliferation invivowith[F-18]FLTandpositron emission tomography. Nat Med, 1998, 4(11): 1334-1336. doi: 10.1038/3337 [14] Turcotte E, Wiens LW, Grierson JR, et al. Toxicology evaluation of radiotracer doses of 3'-deoxy-3'-[18F]fluorothymidine(18F-FLT)for human PET imaging: Laboratory analysis of serial blood samples and comparison to previously investigated therapeutic FLT doses. BMC Nucl Med, 2007, 7: 3. doi: 10.1186/1471-2385-7-3 [15] Waarde AV, Cobben DCP, Suurmeijer AJH, et al. Selectivity of 18F-FLT and 18F-FDG for differentiating tumor from inflammation in a rodent model. J Nucl Med, 2004, 45(4): 695-700. [16] Rasey JS, Grierson JR, Wiens LW, et al. Validation of FLT uptake as a measure of thymidine kinase-1 activity in A549 carcinoma cells. J Nucl Med, 2002, 43(9): 1210-1217. [17] Direcks WG, Berndsen SC, Proost N, et al. [18F]FDG and[18F]FLT uptake in human breast cancer cells in relation to the effects of chemotherapy: an in vitro study. Br J Cancer, 2008, 99(3): 481-487. doi: 10.1038/sj.bjc.6604523 [18] Wang H, Liu B, Tian JH, et al. Monitoring early responses to irradiation with dual-tracer micro-PET in dual-tumor bearing mice. World J Gastroenterol, 2010, 16(43): 5416-5423. doi: 10.3748/wjg.v16.i43.5416 [19] Withers HR, Taylor JM, Maciejewski B. The hazard of accelerated tumor clonogen repopulation during radiotherapy. Acta Oncol, 1988, 27(2): 131-146. doi: 10.3109/02841868809090333 [20] Langen AJ, Klabbers B, Lubberink M, et al. Reproducibility of quantitative 18F-3′-deoxy-3′-fluorothymidine measurements using positron emission tomography. Eur J Nucl Med Mol Imaging, 2009, 36(3): 389-395. doi: 10.1007/s00259-008-0960-5 [21] Muzi M, Mankoff DA, Grierson JR, et al. Kinetic modeling of 3′-deoxy-3′-fluorothymidine in somatic tumors: mathematical studies. J Nucl Med, 2005, 46(2): 371-380. [22] Muzi M, Vesselle H, Grierson JR, et al. Kinetic analysis of 3′-deoxy-3′-fluorothymidine PET studies: validation studies in patients with lung cancer. J Nucl Med, 2005, 46(2): 274-282. [23] Muzi M, Spence AM, Sullivan F, et al. Kinetic analysis of 3′-deoxy-3′- 18F-fluorothymidinein patients with gliomas. J Nucl Med, 2006, 47(10): 1612-1621. [24] Buck AK, Halter G, Schirrmeister H, et al. Imaging proliferation in lung tumors with PET: 18F-FLT versus 18F-FDG. J Nucl Med, 2003, 44(9): 1426-1431. [25] Cobben DC, van der Laan BF, Maas B, et al. 18F-FLT PET for visualization of laryngeal cancer: comparison with 18F-FDG PET. J Nucl Med, 2004, 45(2): 226-231. [26] van Westreenen HL, Cobben DC, Jager PL, et al. Comparison of 18FFLT PET and 18F-FDG PET in esophageal cancer. J Nucl Med, 2005, 46(3): 400-404. [27] Leyton J, Latigo JR, Perumal M, et al. Early detection of tumor response to chemotherapy by 3′-deoxy-3′-[18F]fluorothymidine positron emission tomography: the effect of cisplatin on a fibrosarcoma tumor model in vivo. Cancer Res, 2005, 65(10): 4202-4210. doi: 10.1158/0008-5472.CAN-04-4008 [28] Jensen MM, Erichsen KD, Bjorkling F, et al. Early detection of response to experimental chemotherapeutic Top216 with[18F]FLT and[18F]FDG PET in human ovary cancer xenografts in mice. PLoSONE, 2010, 5(9): e12965. doi: 10.1371/journal.pone.0012965 [29] Apisarnthanarax S, Alauddin MM, Mourtada F, et al. Early detection of chemoradioresponse in esophageal carcinomaby3′-deoxy-3′-3H-fluorothymidine using preclinical tumor models. Clin Cancer Res, 2006, 12(15): 4590-4597. doi: 10.1158/1078-0432.CCR-05-2720 [30] Wang H, Zhang JM, Tian JH, et al. Using dual-tracer PET to predict the biologic behavior of human colorectal cancer. J Nucl Med, 2009, 50(11): 1857-1864. doi: 10.2967/jnumed.109.064238 [31] Troost EG, Bussink J, Aswin L, et al. 18F-FLT PET/CT for early response monitoring and dose escalation in oropharyngeal tumors. J Nucl Med, 2010, 51(6): 866-874. doi: 10.2967/jnumed.109.069310 [32] Dittmann H, Dohmen BM, Paulsen F, et al. [18F]FLT PET for diagnosis and staging of thoracic tumours. Eur J Nucl Med Mol Imaging, 2003, 30(10): 1407-1412. doi: 10.1007/s00259-003-1257-3 [33] Chen W, Cloughesy T, Kamdar N, et al. Imaging proliferation in brain tumors with 18F-FLT PET: comparison with 18F-FDG. J Nucl Med, 2005, 46(6): 945-952. [34] Ecke F, Herrmann K, Schmidt S, et al. Imaging of proliferation in hepatocellular carcinoma with the in vivo marker 18F-fluorothymidine. J Nucl Med, 2009, 50(9): 1441-1447. doi: 10.2967/jnumed.109.065896 [35] Tian JH, Yang XF, Yu LJ, et al. A Multicenter clinical trial on the diagnostic value of dual-tracer PET/CT in pulmonary lesions using 3-deoxy-3-18F-fluorothymidine and 18F-FDG. J Nucl Med, 2008, 49(2): 186-194. doi: 10.2967/jnumed.107.044966 -





 下载:
下载: