-
PET是可以反映人体组织细胞血流、功能、代谢且可以进行分子成像研究的先进分子影像设备, 它的出现使核医学显像诊断进入了新的时代, 也使影像诊断真正进入了分子水平。然而, PET只能提供疾病的代谢和功能的变化, 在疾病的结构和病灶定位上尚有缺陷。近年来, PET-CT的出现在很大程度上解决了这个问题, 在多年的临床诊断中, 尤其对肿瘤的诊断、分期及疗效监测上, PET-CT发挥了重要作用[1]。现在, PET-CT已经成为临床实践和基础生物医学研究常用的检查方法, 技术日益成熟。但是, 由于CT提供的是相对有限的软组织对比度, 而且在显像过程中必要的辐射剂量可能会给患者或者实验动物带来一定的辐射损伤, 因此, 有必要应用其他清晰显示解剖结构的显像技术来弥补CT的不足。相对而言, MRI的软组织对比度清晰, 对人和动物没有辐射损伤, 成像序列丰富, 所以PET和MRI两种系统的融合一直是图像融合技术努力研究的前沿领域。
-
PET又称湮没光子断层成像, 采用共线对置探测器, 并采用快符合探测技术来探测正负电子湮没事件中释放的两个511 keV光子, 由计算机将收集到的数据进行处理, 用以重建图像, 再现衰变核素的放射性分布。PET仪是正电子成像中先进和高级的仪器, 具有图像质量好、灵敏度和分辨率高、适用面广的优势, 且可做身体冠状面、矢状面和横断面三维显示的图像。世界上第一台PET仪是由Phelps于1973年在华盛顿大学制造的, 但由于缺乏正确的衰减校正和图像重建技术, 没有获得真实的横断面图像。第一台真正意义上的PET仪于1974年制造, 并进行了第一次扫描。随着PET仪的技术发展, 现在PET仪探头所用的晶体已经从最初的碘化钠(NaI)晶体发展到锗酸铋、硅酸镥和硅酸钆晶体, 后3类晶体对511 keV高能探测的效率高于NaI晶体。模块状结构探测器(block detector system)的发明对PET仪器性能的提高和造价的降低有着重要意义。许多模块结构的探测器排列在360°的圆周上, 可以构成不同直径、不同环数的PET, 机械稳定性大大提高, 探头的维修也很方便。由于三维采集的灵敏度是二维的4~5倍, 新的PET机型均采用固定的三维采集模式。至于三维采集时散射和随机计数较高的问题, 可通过采用硅酸镥及硅酸钆这类能量分辨率高、延迟时间短、缩小符合探测时间窗以及进行准确的散射校正等技术得到补偿。近年来, PET-CT的出现和发展是PET技术发展的一大亮点, 而且目前所用的PET机型和CT机型均是高端机型, 因此, 两者所提供的功能性和解剖性图像的质量优异, 对临床诊断有明显的帮助[1]。
-
MRI是一项新的无创性技术, 主要应用于描绘人体内部结构, 可获得人体内部结构的高质量图像, 完全没有电离辐射, 目前看来无任何明显的危害。从20世纪40年代起, 磁共振作为一种物理现象就已应用于物理、化学和医学领域。近年来, 随着MRI技术的日益成熟, 其在临床诊断中发挥着越来越重要的作用, 目前常用的MRI技术有自旋回波成像程序、翻转复原成像程序、磁共振快速成像序列。磁共振快速成像除了缩短检查时间外, 还可以在一些特殊的场合使用, 其中比较常用的有: 磁共振血管造影(magnetic resonance angiography)、磁共振波谱分析(magnetic resonance spectroscopy, MRS)、弥散加权成像(diffusion-weighted imaging)、灌注成像(perfusion imaging)、血氧饱和水平监测(blood oxygen level dependent)和脑功能磁共振成像(functional magnetic resonance imaging)等。脑功能MRI技术是近年来MRI硬件和软件技术迅速发展后出现的一项新的检查技术, 这说明MRI已经不单单是形态学水平的检查技术, 而是从分子水平提供组织功能信息的检查技术。现在, MRI又应用于原发肿瘤的分期, 检测新生的肿瘤疾病, 尤其可以对无症状患者提供早期诊断, 提高患者的治愈率。全身MRI不仅应用于肿瘤系统的疾病, 对于非肿瘤性疾病, 如各种炎性疾病(类风湿性关节炎、长期慢性疾病等)、肌肉骨骼系统疾病(多发性软骨性外生骨疣和系统性肌营养不良)等均有广泛的应用[2]。
-
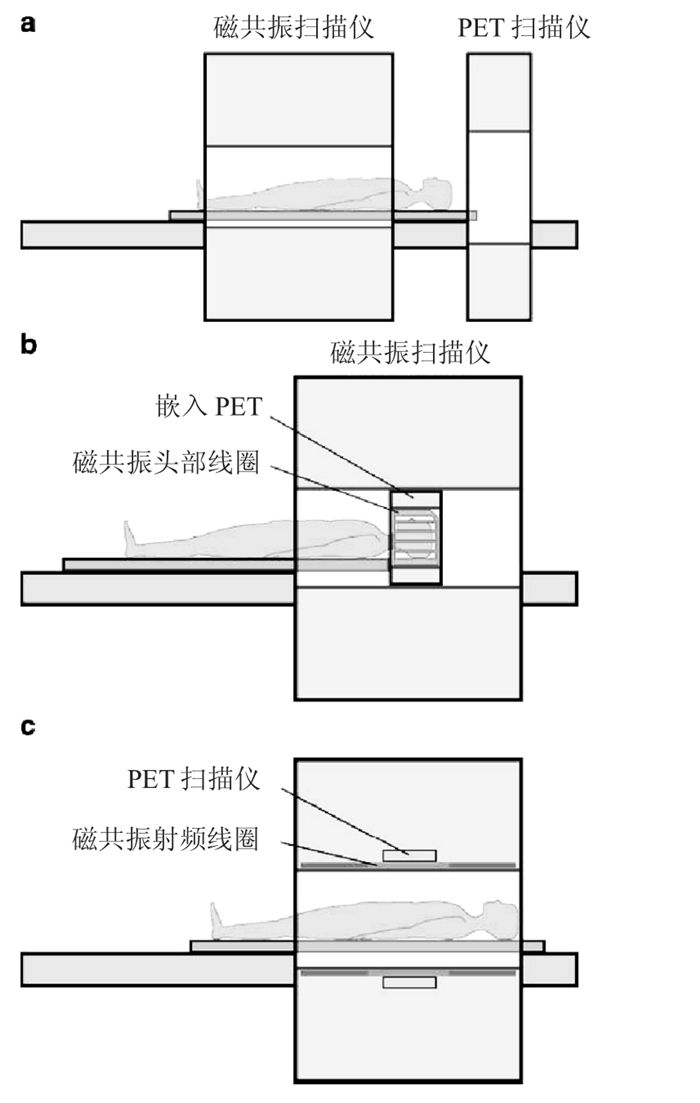
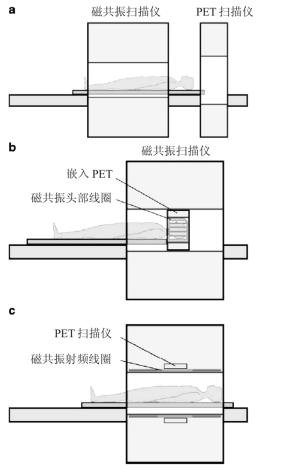
PET和MRI相结合共同检查疾病的想法追溯至20世纪90年代。最初, 两种显像仪器也是按照PET-CT设备的连接方式, 顺序相连, 但事实证明, 这样虽然未使PET探测器暴露在磁场中, 但是延长了检查时间、占用了较大空间, 最重要的是, 两者之间的数据并不是同时采集的, 配准难度增大。接着, 是将PET探测仪嵌在MRI系统中, 这样可以使两者的扫描视野(fields ofview)相匹配, 同时得到两者的显像数据, 但是由于孔径的限制, 只能用来做头部和动物的PET-MRI。目前, 研究最热门的领域是PET-MRI一体机, 既可以同时获得图像, 又能相对缩短时间[3]。图 1就是以上3种连接方式的基本模式。
应用PET-MRI融合技术, Shao等[4]曾将闪烁晶体(scintillation crystals)与光纤耦联起来, 通过光纤连接到应用于临床1.5 T场强的磁场边缘, 用此种一体机对动物模型进行研究; Pichler等[5]利用新型的雪崩型二极管(avalanche photodiode)为基础的PET探测仪与9.4 T场强的MRI系统融合, 对实验动物进行研究; 2008年, Catana等[6]利用小动物PET-MRI一体机得到小鼠脑的显像图; 同年, Judenhofer等[7]将PET与7.0 T场强的MRI系统相融合, 得到大鼠的肿瘤显像图。但是, 这些早期的PET-MRI系统一直专注于研究小动物模型, 一直到2008年, Pichler等[8]利用PET-MRI系统得到了第一幅人脑的融合图像, 这也是第一幅具有实际诊断价值的融合图像。从此, PET-MRI作为一种新型的显像技术, 为临床诊断提供了更加丰富的检查信息。全身PET-MRI一体机的研究仍在继续, 继分体的PET+MRI系统后, 近期全身PET-MRI的研制获得了突破性进展, 2010年, 北美放射协会第96届年会上, Siemens公司推出了一款Biograph mMRI系统, 该系统为3T场强的MRI和PET所组成的一体化架构, 在图像采集上实现了全身MRI和PET数据的同步采集, 被认为是全球首款全身型PET-MRI一体机。目前为止, PET-MRI是最具挑战性, 也是花费最高的图像融合技术。全身PET-MRI系统可能会对临床常规诊断产生重大的影响, 尤其是肿瘤治疗方面。
-
PET-MRI仪不同于PET-CT仪, 主要是CT与MRI的不同。虽然CT可以直接观察肿瘤的部位、大小、数目、形态、肿瘤内出血、坏死、囊变和钙化及肿瘤周围水肿的情况, 肿瘤与正常组织密度差异较小时还可以通过注射对比剂后扫描使肿瘤信号发生强化, 从而提高肿瘤的检出率, 并可根据肿瘤的形态、部位以及强化特点推断肿瘤的可能类型和性质, 为手术提供可靠地依据, 但是相对于CT, MRI有更好的软组织对比度, 能够清晰显示脑部、腹部器官和肌肉骨骼系统, 而且, 一般不需要注射对比剂就可以得到清晰的图像, 不用担心造影剂对所研究组织产生的不良反应。
对于PET-CT, 要达到显像所需分辨率和显像的对比程度, 人类或者实验动物都必须接受CT必要的辐射剂量, 这样在很大程度上会影响自身的免疫系统, 增加肿瘤发生的危险。2007年, Brenner和Hall[9]在“N Engl J Med”上发表综述称, 每单次CT将使成人受到15 mSv、新生儿受到30 mSv的辐射, 而一次CT检查一般需进行2~3次扫描, 这个剂量大约相当于一组(25 000名)日本核弹爆炸后幸存者所受到的照射剂量(< 50 mSv), 他们认为, CT(辐射剂量在30~90 mSv)会增加肿瘤风险的流行病学证据是“直接”的, 随着CT在临床的使用越来越广泛(美国每年有6200万人次做CT检查), 它所带来的辐射伤害不可忽视——美国每年1.5%~2%的肿瘤患者可能由于CT检查所致。与CT不同, PET-MRI中的MRI对人和动物没有辐射损伤。
PET-CT系统只是PET和CT硬件系统之间的融合, 不能采集到同时显像的数据, 这样就很可能使图像失真; 而PET和MRI并不是简单的硬件系统的融合, 而是两个系统软件之间的融合, 所以图像的获得可以达到同时性, 使PET-MRI的配准更加准确。
MRI有着非常灵活的扫描技术和多功能成像技术, 包括磁共振血管造影、弥散加权成像、MRS、灌注成像、血氧饱和水平监测、脑功能成像等, 这些技术与PET结合, 就可以得到更多的组合方式, 可以有效检测各种肿瘤的分期和进展速度, 尤其是与血流相关的脑部肿瘤显像[3, 8, 10], 提高临床的诊断价值。例如, 将1H-MRS与18F-FDG结合起来, 可以更好的判定胶质瘤的临床分期分级。
-
MRI对磁场的强度、稳定性和均匀性均有严格的要求。均匀、稳定的磁场是得到高质量图像的决定因素, 波动的磁场不仅会使图像质量下降, 还可能使图像失真; PET系统产生的射频噪音可以被MRI系统的射频线圈接收, 使MRI图像出现伪影; 另外, 在MRI系统中, MRI的数据反映的是组织质子密度的信息, 而质子密度并不一定反映光子的衰减, 不能通过简单的衰减校正图的对应关系用MRI对PET进行衰减校正。这些问题是PET-MRI技术主要面对的挑战。
-
(1) MRI的孔径增大, 维持磁场的稳定性的难度加大, 设备消费也相应增加。在最初的PET-MRI设备中, 闪烁晶体放置在磁场的边缘, 通过光纤与MRI设备相连来避免磁场对PET设备的干扰, 但是这种方法并不实用, 因为光纤占据了MRI孔径的一部分, 加大了MRI直径; 其次, 光纤在传输过程中会造成光能的损失, 这样会使PET信号的能量和时间分辨率下降, 而且两者在数据上的采集会有一定的时间差, 很难校正。但是, 由于小动物PET-MRI系统受空间影响较小, 这种方法还是可以应用的。随着雪崩型二极管和盖革模式二极管(geiger-mode diodes)的问世, 为PET-MRI融合系统的研制打下了基础。实验证实, 雪崩型二极管在超过9.0 T的磁场内运作时, 并不影响其固有的性能, 目前依赖此项技术的新型PET-MRI设备已经研制成功, 并且会在将来投入到临床应用中去[11-13]。
(2) 当磁体边缘杂散磁场的场强达到一定程度时, 就可能干扰周围环境中那些对磁场敏感性强的设备, 使其不能正常工作, 甚至造成损失, 即: MRI设备对其周边环境及设备的使用存在磁影响, 因此, 它们之间必须保持一定的安全距离。PET设备中, γ光子可以直接到达晶体表面, 经过晶体能量的转换过程, 把γ射线转换成荧光, 由光电倍增管接收, 经过光电转换和放大过程得到可以测量的电信号, 该信号包含了线性分辨率信息和能量信息, 这些信号就构成了PET的原始扫描数据。在这个过程中, 即使有微弱的磁场信号影响到光电倍增管的放大作用, PET图像质量也会受到影响。
(3) 根据迈克尔·法拉第的电磁感应定律, 变化的梯度磁场将在其周围的金属体内产生感应电流, 这种电流的“流动路径”在金属内自行闭合, 故称涡流(eddy current)。涡流的强度与磁场变化率呈正比, 而且它所消耗的能量最后均转化为热量散发, 涡流的存在不仅会影响梯度磁场波形的输出质量, 更重要的是会影响PET信号, 使PET图像的质量下降。
(4) 磁体周围铁磁环境的变化也会干扰主磁场的均匀程度, 造成MRI图像质量下降。所以, 我们需要研究出电磁兼容的PET-MRI仪器。近年来的研究发现, 碘化钠(Tl)(thallium-doped sodium iodide)、碘化铯(Tl)(thallium-doped caesiumiodide)、锗酸铋和硅酸镥(Ce)(ceriumdoped lutetium oxyorthosilicate)等晶体的磁化率与人体很接近, 所以这些晶体很可能适用于PET-MRI设备。
(5) 维持主磁场的稳定性固然重要, 但是维持外加磁场B1[实际上是一个射频波(radiofrequency)]的稳定也不可忽视。射频波激发而吸收的能量通过发射与激发射频波频率相同的电磁波来实现能量释放, 这个电磁波就是MRI的信息来源, 也称为回波, 是MRI的基础。B1磁场的不稳定会使局部信号发生改变, 引起自旋回波改变, 从而导致图像质量下降。但是, 所有导电材料都会使射频波脉冲发生变化, 进而使B1磁场发生改变。
对于MRI磁场对PET-MRI产生的干扰, 可以通过磁场屏蔽来减少。磁屏蔽不仅可以防止外部磁性物质对磁体内部磁场均匀性的影响, 还能大大削减磁体外部杂散磁场的空间分布范围, 是最有效的磁场隔离措施。首先, 需采取磁体自屏蔽措施, 将磁体产生的边缘杂散磁场缩减到尽可能小的空间区域; 其次, 可以通过增加磁体间的面积和高度, 将其自然被动地包含在磁体间内; 此外, 也可以采用磁屏蔽方法将其完全彻底地屏蔽于磁铁间。
-
PET系统产生的射频噪音可以被MRI系统的射频线圈接收, MRI信号极易受到干扰而被淹没, 使MRI图像出现伪影。因此, MRI设备的磁体间必须安装有效的射频屏蔽, 防止射频发射单元的射频输出泄露到磁体之外, 又要防止磁体外空间中的电磁波“窜进”磁体间干扰磁共振信号[3-4]。
-
在PET-CT中, 为提高PET图像质量, CT以衰减校正图的形式为PET提供衰减校正。但是在MRI系统中, MRI的数据反映的是组织质子密度的信息, 而质子密度并不一定反映光子的衰减, 如骨骼, 由于其本身的密度很高, 故衰减因子也很高, 但是它的质子密度却很低, 所以在MRI图像上表象为没有信号或者与空气信号相近。因此, 不能通过简单的衰减校正图的对应关系用MRI对PET进行衰减校正。由于MRI仪的空间受限, 数据的传输过程中会增加检查时间, 所以在PETMRI中, PET的衰减校正需要新的方法解决。人们曾通过图像切分的方法, 将图像切分成人体局部组织器官, 但是这仅对刚性的器官和组织结构清楚区域适用, 如头部[14-15], 对于腹部和咽喉, 这种方法就不适用了。这种简单的分割提供了不包括受MRI扫描视野限制的截断伪影的衰减校正图。此外, 还可以应用图集与先验信息相匹配, 对局部区域进行研究, 但是这种精密的数集非常耗时, 还需要来自数集的多因素分析; 不同的人, 由于性别、年龄、身高和体重的不同, 有不同的图集来对应。还有一种新的方法, 称为“支持向量设备(support vector machine)”[16], 是通过利用既定统一模板的算法, 与来自同一物体的CT或者MRI传输过来的数据相匹配, 进行衰减校正。这种方法主要是寻找某种组织的MRI图像数据与特定的衰减校正值相匹配, 对PET进行衰减校正。
但是, 不同的方法都有其优缺点, 也许将所有的方法结合起来才会形成更加完美和自动的衰减校正。所以, 为了达到更加精确地图像校正, 新的衰减校正方法仍在研究。
-
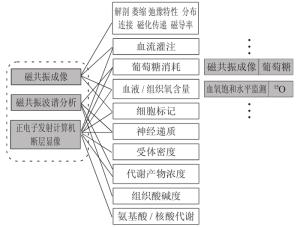
PET-MRI设备不仅是同机硬件系统之间的融合, 也是将解剖、功能、代谢与多参数序列软件系统之间的融合, 所以在不远的将来, PET-MRI系统会成为最有前景的影像学技术。图 2是Wehrl等[11]对PET和MRI融合系统中可以共同应用的显像功能所做的总结, 清晰地说明了PET-MRI一体机的融合不是简单的硬件系统的连接, 而是将两者的解剖成像和功能成像结合起来, 得到对临床更有诊断价值的显像。所以我们可以预测, PET-MRI融合系统将比PET-CT的应用潜力更大, 尤其是在肿瘤、心脏和神经系统等方面。
-
传统的影像学方法如X线片、超声、CT、MRI等主要显示解剖上肿瘤的侵犯范围, 对肿瘤的诊断及分期有重要意义, 其局限性在于单纯根据形态表现有时难以确定肿物的良、恶性, 难以确定肿大的淋巴结内有无转移灶, 难以预测肿瘤治疗后的疗效。18F-FDG PET-CT可以无创性地在活体中探究疾病早期的生物学变化、基因异常、代谢高低等, 在肿瘤学中承担着越来越重要的角色, 尤其是在肺癌、乳腺癌、结直肠癌、胰腺癌、卵巢癌淋巴瘤及黑色素瘤等中的应用。但是, CT对软组织的分辨率明显低于MRI, 而且行CT时会有一定的辐射剂量, 难以应用于儿童和孕妇。MRI具有三维成像的特点, 无骨伪影, 分辨率高、对比度好, 可以更加清楚地了解肿瘤与周围组织的关系及肿瘤病灶的内部情况, 从而根据肿瘤的信号特点、边缘、血供、增强情况等来确定肿瘤的性质、类型, 为手术方案的制订、放疗计划的确定以及立体针吸活检的入路等提供更多的信息。MRI对软组织的分辨率高, 不需要注射造影剂, 无辐射损伤, 所以在软组织丰富的区域, 包括骨骼肌肉系统疾病、头颈部肿瘤、颅内肿瘤、乳癌和肝癌等方面用MRI诊断比较占优势。
目前出现的新的融合影像技术PET-MRI, 在PET中融入了MRI的诊断功能, 包括磁共振血管造影、MRS、弥散加权成像、灌注成像、血液氧饱和水平监测和脑功能成像等。2009年, Antoch和Bockisch[17]通过回顾文献和他们所作的研究总结得出: PET-MRI在肿瘤分期上可能比PET-CT更准确; 在结节分期上, 两者基本一致; 对于转移灶分期, 由于两者的PET部分成像相同, 主要区别在于CT和MRI, 所以两者主要由肿瘤转移的地点的不同而定: 如果肿瘤转移到肺部, 由于CT检测肺部结节的敏感性高于MRI, 所以PET-CT检测肺部损伤的敏感性高于PET-MRI。但是, Schmidt等[2]发现, MRI对脑部、脊柱、腹部和骨盆这些区域的敏感性很高, 是最合适最客观的检查方法。MRI作为惟一可以使骨髓及其组成部分显示的仪器, 能够尽早显示出诸如椎管内肿瘤的病变。由于骨髓对T1加权回波序列和快速短期反转回波序列序列敏感, 可以通过两种不同的序列分辨出骨髓疾病的良恶性, 进而对其进行筛查。全身MRI对于转移到肝脏、骨骼和脑部的肿瘤, 尤其是动态三维梯度回波序列成像, 可以显示出5 mm以下的转移到肝脏的肿瘤。2006年, Seemann等[18]通过实验证实, PET在反映淋巴结转移和骨转移方面很灵敏, 而MRI对于反映肝脏转移的检出具有很高的准确性。此外, 正在研制的超高磁场又提高了MRI的空间分辨率, 可以更加清晰显示其组织结构, 使肿瘤的定位诊断更加精确。现在应用的快速T2加权回波序列融合灌注成像技术可以减小MRI对于肺部疾病检查的误差, Eustace等[19]发现, 增强MRI能够检出微小的颅内转移瘤, 其敏感性高于CT和PETCT。由于受上腹部呼吸运动的影响, PET不能对上腹部器官很好成像, 而MRI却可以很好显示上腹部器官。
-
心脏是一个结构复杂、不断跳动的脏器, 获得清晰的心脏图像需要较高的空间分辨率和时间分辨率。PET是无创性评估心肌活性的金标准, 并能通过心肌灌注评估冠状动脉疾病; 同时, 18F-FDG是具有特定的生物活性的示踪剂, 可以从不同角度反映心血管生理生化信息, 具有较高的敏感性和可重复性。但是, 由于受时间和空间分辨率的限制, 传统的心脏18F-FDG PET主要针对心肌, 特别是左室心肌的血流灌注、代谢和神经受体显像。MRI可以为心脏提供清晰的解剖结构, 可以清晰显示心室结构, 提高检测心肌梗死的准确性; 同时, 结合心电门控及屏气技术, 可用于心脏形态结构、心室功能、心肌灌注及冠状动脉的形态和血流检查。所以, PET与MRI融合成像技术已经成为人们关注的焦点。
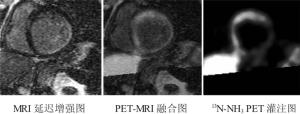
Nekolla等[20]通过研究心脏PET-MRI的一些方案后指出, PET-MRI可使心脏疾病的诊断迈入一个全新的时期; PET与心脏MRI融合或者与全身的磁共振血管造影融合可能会发现早期的硬化斑块。将MRI的心脏延迟增强图像和PET图像融合起来, 可以在同一心脏图像上显示出更多的信息。两个系统采用相同的成像参数可以帮助评估不同的采集技术, 如将用于MRI的自旋标记或者磁共振造影的放射性标记的水或者氨用于PET灌注显像; 而且, PET和MRI数据的同时获得有利于对运动器官的精确校正, 更适用于心脏疾病(图 3)。
-
由于正电子核素标记的药物直接参与中枢神经系统的代谢, 因此, PET在脑肿瘤、脑血管疾病、脑退行性病变、癫
 、老年性痴呆等方面的研究中有独特的作用, 其功能是CT、MRI无法替代的。脑肿瘤的葡萄糖代谢率与肿瘤的恶性程度呈正比, PET可对脑肿瘤的良恶性鉴别和恶性程度分级, 对癫病灶的定位及范围的确定优于CT和MRI, 所以, 当PET与软组织对比度较高、解剖结构清晰的MRI相融合时, 可以确保手术切除癫
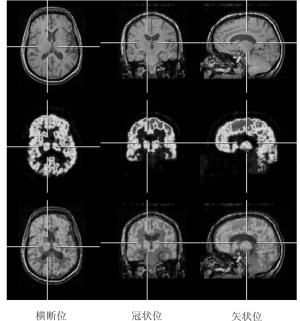
、老年性痴呆等方面的研究中有独特的作用, 其功能是CT、MRI无法替代的。脑肿瘤的葡萄糖代谢率与肿瘤的恶性程度呈正比, PET可对脑肿瘤的良恶性鉴别和恶性程度分级, 对癫病灶的定位及范围的确定优于CT和MRI, 所以, 当PET与软组织对比度较高、解剖结构清晰的MRI相融合时, 可以确保手术切除癫 病灶的成功和诊断脑部疾病的准确。从图 4我们可以看到, PET和MRI系统的融合为脑内结构的显示提供了清晰的图像, 两种影像技术的融合将会为大大提高临床诊断准确率[21]。Jack等[22]将2-(4’-N-11C-甲胺苯基)-6-羟基苯并噻唑和磁共振提供的解剖信息融合在一起, 两者为阿尔茨海默病的诊断和治疗提供了详尽的信息。Boss等[23]最近用11C-甲硫氨酸和68Ga-奥曲肽分析颅内转移肿瘤后指出, 用PET-MRI得出来的数据与PET-CT相近。Ungerleider等[24]在研究中发现, 血流量和血氧饱和度能够用PET-MRI设备来测量, 可以得到器官不同时期代谢的活性参数。同样, MRS可以和18F-FDG一起来监测葡萄糖的代谢率。我们知道, 胶质瘤的MRS通常表现为乙酰天冬氨酸峰值及肌酸峰值降低, 胆碱峰值升高, 故胆碱/肌酸和胆碱/乙酰天冬氨酸值升高, 乙酰天冬氨酸/肌酸、乙酰天冬氨酸/胆碱值降低; 高级别胶质瘤的乙酰天冬氨酸水平的降低较低级别胶质瘤明显, 在肿瘤的中心部位常明显降低甚至缺乏。高、低级别胶质瘤的1H-MRS表现不相同, 在临床工作中可借助1H-MRS的表现对胶质瘤进行分级。PET对脑胶质瘤的诊断主要是应用18FFDG在脑内的代谢状况: 代谢活跃的区域, 显像就明显; 代谢减低的区域, 显像就相对减弱; 坏死的病灶基本不显影, 加上PET的其他显像剂如氨基酸类、胆碱或乙酸等, 对脑肿瘤的生物学行为、镜下亚临床的侵润和生物靶区的设定等有极大的帮助[25-27]。由于MRI有着多功能成像技术, 能够分析复杂的神经网络功能, PET-MRI在临床应用的潜能将比PET-CT更大, 尤其是在分子和细胞成像方面又开辟了新的领域, 在基因转移、细胞移植方面也有很大的、潜在的应用价值[21]。
病灶的成功和诊断脑部疾病的准确。从图 4我们可以看到, PET和MRI系统的融合为脑内结构的显示提供了清晰的图像, 两种影像技术的融合将会为大大提高临床诊断准确率[21]。Jack等[22]将2-(4’-N-11C-甲胺苯基)-6-羟基苯并噻唑和磁共振提供的解剖信息融合在一起, 两者为阿尔茨海默病的诊断和治疗提供了详尽的信息。Boss等[23]最近用11C-甲硫氨酸和68Ga-奥曲肽分析颅内转移肿瘤后指出, 用PET-MRI得出来的数据与PET-CT相近。Ungerleider等[24]在研究中发现, 血流量和血氧饱和度能够用PET-MRI设备来测量, 可以得到器官不同时期代谢的活性参数。同样, MRS可以和18F-FDG一起来监测葡萄糖的代谢率。我们知道, 胶质瘤的MRS通常表现为乙酰天冬氨酸峰值及肌酸峰值降低, 胆碱峰值升高, 故胆碱/肌酸和胆碱/乙酰天冬氨酸值升高, 乙酰天冬氨酸/肌酸、乙酰天冬氨酸/胆碱值降低; 高级别胶质瘤的乙酰天冬氨酸水平的降低较低级别胶质瘤明显, 在肿瘤的中心部位常明显降低甚至缺乏。高、低级别胶质瘤的1H-MRS表现不相同, 在临床工作中可借助1H-MRS的表现对胶质瘤进行分级。PET对脑胶质瘤的诊断主要是应用18FFDG在脑内的代谢状况: 代谢活跃的区域, 显像就明显; 代谢减低的区域, 显像就相对减弱; 坏死的病灶基本不显影, 加上PET的其他显像剂如氨基酸类、胆碱或乙酸等, 对脑肿瘤的生物学行为、镜下亚临床的侵润和生物靶区的设定等有极大的帮助[25-27]。由于MRI有着多功能成像技术, 能够分析复杂的神经网络功能, PET-MRI在临床应用的潜能将比PET-CT更大, 尤其是在分子和细胞成像方面又开辟了新的领域, 在基因转移、细胞移植方面也有很大的、潜在的应用价值[21]。 -
影像学技术从最初的X线片到CT、MRI, 再到SPECT、PET, 从显示人体的解剖结构到人体各组织的功能成像和分子成像, 为疾病的检查和诊断打下了很好的基础, 有助于疾病的早期诊断和早期治疗, 提高患者的生存率和生活质量。但单一的影像技术有它固有的缺点, 不能满足人们对疾病的检查和诊断, 所以就出现了将两种或多种影像技术融合在一起的影像学技术, 如SPECT-CT、PET-CT、PET-MRI等, 尤其是PET-MRI, 是目前研究的热点之一。MRI是多参数成像, 其成像原理和信号表现复杂多样, 成像技术发展很快, 其中磁共振血管成像可无创地显示血管结构并提供血流动力学参数, 灌注成像反映疾病早期和病变血液灌注, 扩散加权成像和扩散张量成像从分子水平探讨细胞内外水分子运动的改变, 血氧水平依赖成像、MRS等功能成像技术从细胞、分子水平乃至基因水平反映靶器官的物质代谢和功能活动状况。此外, MRI无电离辐射, 迄今为止也没有磁场和射频脉冲对人体造成显著损害的报道。
但是, 我们也不可否认, MRI在应用过程中存在一些缺点: 对于一些有金属植入物或异物的患者, 不能做MRI检查; 扫描时间比较长, 致使检查过程中的运动伪影增加; 它的强大的磁场会影响PET的成像等。因此, 两个系统之间的匹配问题有待解决。随着雪崩型二极管代替传统的二极管, 减少了磁场对PET探测器的影响, 并且PET-MRI采用的是同机融合模式, 大大缩短了两者的检查时间, 使PET-MRI的时间分辨率和空间分辨率进一步提高, 形成了两种先进技术的优势互补, 具有极高的诊断性能与临床应用价值。并且, 将高分辨率的MRI与PET相结合, 在脑神经受体的研究中具有重要价值, 为帕金森病、阿尔茨海默病的治疗和诊断提供更好的显像方式。此外, PET-MRI融合图像在软组织肿瘤的诊断、早期诊断和疗效观察中优于PET-CT, 可以为临床提供PET-MRI T1加权、PET-MRI T2加权的融合图像, 这对临床的诊断具有更高的价值。在对病灶范围的判定上, 精确性更高, 尤其对于神经系统的肿瘤放射治疗, 将提供更准确的信息, 提高放疗的精确性, 并最大限度的保护肿瘤周围的正常组织。PET-MRI可以提供多参数成像, 为分子影像学的发展建立一个全新的平台。将先进的分子成像技术与经典的解剖结构形态相融合, 产生的效果往往是“1+1 > 2”的。但是, 我们也应该看到, PET-MRI的优越性在临床上尚未充分发挥出来; 目前常用的显像剂还主要是18FFDG, 更加灵敏和专一的显像剂还有待研制; 其他的融合图像如SPECT-MRI、MRI-光显像(optical)、PET-光显像等技术正在研究。不管怎样, 融合图像技术奠定了未来的发展方向。PET-MRI一体机在临床和科研中具有非常大的潜力, 随着PET-MRI一体机渐渐投入市场, PET-MRI将为我们开辟一个崭新的分子影像未来。而在21世纪, 分子影像学技术将成为更加有前景的科学。随着我们对PET-MRI的认识和问题的解决, PET-MRI将会以更快的发展速度推动影像医学的进步。
PET-MRI的临床研究进展
Clinical research of PET-MRI
-
摘要: 多模式显像技术PET-CT和SPECT-CT已经成为临床实践和基础生物医学研究常用的检查方法,并且技术日益成熟。但PET-CT作为有效的临床基本检查工具,仍然受到许多限制,为克服这些困难,目前研究的热点集中在PET和MRI融合技术上。PET-MRI是综合了多参数功能成像和高分辨率的显像技术,尤其适用于对软组织要求较高、受照射剂量限制的小动物成像实验研究和人体临床研究,初步的研究结果显示,PET-MRI技术可在多方面优于PET-CT,PET和MRI在临床应用的互补作用将会使分子影像学进一步发展。
-
关键词:
- 正电子发射断层显像术 /
- 磁共振成像 /
- 体层摄影术, X线计算机 /
- 图像处理, 计算机辅助
Abstract: Multimodality imaging with PET-CTand SPECT-CT has become commonplace in clinical practice and in preclinical and basic biomedical research.Although PET-CT is already an established clinical tool it still bears some limitations.To overcome these limitations, recent research concentrates on the combination of PET and MRI into one single machine.Combined PET-MRI allows for multi-parametric imaging and reveals one or more functional processes simultaneously along with high-resolution morphology.Especially in small-animal research, where high soft tissue contrast is required, andthescantimeaswellasradiation dose are critical factors, the combination of PET and MRI would be beneficial compared with PET-CT. -
[1] 冯晓源. 现代医学影像学进展. 上海: 复旦大学出版社, 2005: 1-21.
[2] Schmidt G, Dinter D, Schoenberg S, et al. Whole-body MRI. Clin MR Imaging, 2010: 763-790. http://www.springerlink.com/content/x2r2371614618000/. [3] Delso G, Ziegler S. PET/MR system design. Eur J Nucl Med Mol Imaging, 2009, 36(Suppl 1): S86-S92. [4] Shao Y, Cherry SR, Farahani K, et al. Simultaneous PET and MR imaging. Phys Med Biol, 1997, 42(10): 1965-1970. doi: 10.1088/0031-9155/42/10/010 [5] Pichler B, Lorenz E, Mirzoyan R, et al. Performance test of a LSOAPD PET module in a 9.4 tesla magnet. IEEE Nucl Sci Symp Med Imaging Conf, 1998, 2: 1237-1239. [6] Catana C, Prociss D, Wu Y, et al. Simultaneous in vivo positron emission tomography and magnetic resonance imaging. Proc Natl Acad Sci USA, 2008, 105(10): 3705-3710. doi: 10.1073/pnas.0711622105 [7] Judenhofer MS, Wehrl HF, Newport DF, et al. Simultaneous PETMRI: a new approach for functional and morphological imaging. Nat Med, 2008, 14(4): 459-465. doi: 10.1038/nm1700 [8] Pichler BJ, Judenhofer MS, Pfannenberg C, et al. Multimodal imaging approaches: PET/CT and PET/MRI. Handb Exp Pharmacol, 2008, 185(Pt1): 109-132. [9] Brenner DJ, Hall EJ. Computed tomography--an increasing source of radiation exposure. N Engl J Med, 2007, 357(22): 2277-2284. doi: 10.1056/NEJMra072149 [10] Cherry SR. Multimodality imaging: beyond PET/CT and SPECT/CT. Semin Nucl Med, 2009, 39(5): 348-353. doi: 10.1053/j.semnuclmed.2009.03.001 [11] Wehrl HF, Judenhofer MS, Wehr S, et al. Pre-clinical PET/MR: technological advances and newperspectivesinbiomedical research. Eur J Nucl Med Mol Imaging, 2009, 36(Suppl 1): S56-S68. [12] Raylman RR, Hammer BE, Christensen NL. Combined MR-PET scanner: a monte carlo evaluation of the improvements in PET resolution due to the effects of a static homogeneous magnetic field. IEEE Trans Nucl Sci, 1996, 43(4): 2406-2412. doi: 10.1109/23.531789 [13] Garliek PB, Marsden PK, Cave AC, et al. PET and NMR dual acquisition(PANDA): applications to isolated, perfused rat hearts. NMR Biomed, 1997, 10(3): 138-142. doi: 10.1002/(SICI)1099-1492(199705)10:3<138::AID-NBM474>3.0.CO;2-H [14] Zaidi H, Hasegawa B. Determination of the attenuation map in emission tomography. J Nucl Med, 2003, 44(2): 291-315. [15] Zaidi H, Montandon ML, Slosman DO. Magnetic resonance imaging-guided attenuation and scatter corrections in threedimensional brain positron emission tomography. Med Phys, 2003, 30(5): 937-948. doi: 10.1118/1.1569270 [16] Zien A, Ratsch G, Mika S, et al. Engineering support vector machine kernels that recognize translation initiation sites. Bioinformatics, 2000, 16(9): 799-807. doi: 10.1093/bioinformatics/16.9.799 [17] Antoch G, Bockisch A. Combined PET/MRI: a new dimension in whole-body oncology imaging?. Eur J Nucl MedMol imaging, 2009, 36(Suppl 1): S113-S120. [18] Seemann MD, Meisetschlaeger G, Gaa J. Assessment of the extent of metastases of gastrointestinal carcinoid tumors using whole-body PET, CT, MRI, PET/CT and PET/MRI. Eur J Med Res, 2006, 11(2): 58-65. [19] Eustace SJ, Walker R, Blake M, et al. Whole-body MR imaging. Practical issues, clinical applications, and future directions. Magn Reson Imaging Clin N Am, 1999, 7(2): 209-236. [20] Nekolla SG, Martinez-Moeller A, Saraste A. PET and MRI in cardiac imaging: from validation studies to integrated applications. Eur J Nucl Med Mol Imaging, 2009, 36(Suppl 1): S121-S130. [21] Heiss WD. The potential of PET/MRI for brain imaging. Eur J Nucl Med Mol Imaging, 2009, 36(Suppl 1): 105-112. [22] Jack CR Jr, Lowe VJ, Senjem ML, et al. 11C PiB and structural MRI provide complementary information in imaging of Alzheimer's disease and amnestic mild cognitive impairment. Brain, 2008, 131(Pt3): 665-680. [23] Boss A, Bisdas S, Kolb A, et al. Hybrid PET/MRI of intracranial masses: initial experiences and comparison to PET/CT. J Nucl Med, 2010, 51(8): 1198-1205. doi: 10.2967/jnumed.110.074773 [24] Ungerleider LG, Doyon J, Karni A. Imaging brain plasticity during motor skill learning. Neurobiol Learn Mem, 2002, 78(3): 553-564. doi: 10.1006/nlme.2002.4091 [25] JacobsAH, KrachtLW, GossmannA, etal. Imaging in neurooncology. NeuroRx, 2005, 2(2): 333-347. doi: 10.1602/neurorx.2.2.333 [26] Chen W. Clinical applications of PET in brain tumors. J Nucl Med, 2007, 48(9): 1468-1481. doi: 10.2967/jnumed.106.037689 [27] Thiel A, Habedank B, Herholz K, et al. From the left to the right: How the brain compensates progressive loss of language function. Brain Lang, 2006, 98(1): 57-65. doi: 10.1016/j.bandl.2006.01.007 -





 下载:
下载: