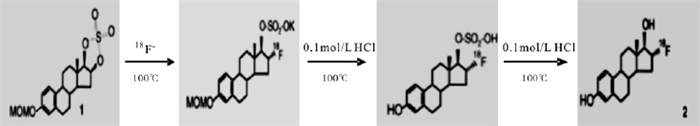
-
乳腺癌是常见的恶性肿瘤, 其早期诊断对治疗方案的选择具有重要意义。雌激素受体(estrogen receptor, ER)是乳腺癌发生、发展过程中最为重要的分子生物学标志物[1]。目前, 测定ER的方法主要以肿瘤标本免疫组化法为代表, 但该法为有创、离体测定, 存在取材难等诸多因素的影响和限制, 其对临床内分泌治疗疗效的预测也不够完美。18F-16α-17β-氟雌二醇(18F-16α-17β-fluoroestradiol, 18FFES)是一种雌激素类似物, 能够特异性地与ER结合, 能动态、定量、无创地反映肿瘤ER的生物活性[2-3], 因此, 18F-FES受体显像可为临床提供乳腺癌组织及转移灶内癌细胞的ER分布、密度变化及活动状态等方面的信息, 对于乳腺癌患者的早期诊断、是否采用激素治疗方案及其疗效评估等具有非常重要的价值。18F-FES PET受体显像有望成为比18F-FDG肿瘤代谢显像技术更具有特异性的方法。国外已有文献报道18F-FES的合成过程和方法, 但其步骤较为繁琐复杂[4-6]; 国内也有少量相关报道, 但未见高产率自动化合成的报道[7]。本研究对18FFES的自动化合成进行了探索。
-
MINItrace回旋加速器、Tracelab FXFN全自动合成装置、Discovery LS PET-CT扫描仪(GE公司, 美国), Mini-Scan型放射性薄层扫描仪(Bioscan公司, 美国), CRC-15PET型放射性活度计(CAPINTEC公司, 美国)。
H218O(丰度97%, Isotec公司, 美国), Kryptofix 2.2.2、无水乙腈(药物级)、碳酸钾(ABX公司, 德国), HCl(Sigma-Aldrich公司, 德国), 3-O-(甲氧甲基)-16, 17-O-磺酰基-16-表雌二醇(3-O-methoxymethyl-16, 17-O-sulfuryl-16-epiestriol, MMSE)(江苏华益埃索托公司), Sep-Pak QMA柱、Sep-Pak Al2O3柱(Waters公司, 美国), Silicagel60TLCplasticsheets(Merck公司, 德国), 鲎试剂(灵敏度为0.5 EU/ml)、细菌内毒素工作标准品(10 EU/支)、细菌内毒素检查用水(内毒素 < 0.015 EU/ml)(福州新北生化工业有限公司)。
-
雌性昆明小鼠(体质量为18~22 g)和雌性家兔(体质量为2.3~2.5 kg), 由福建省医学科学研究所动物实验中心提供。
-
(1) 生产18F-: 18F-由MINItrace回旋加速器通过18O(p, n)18F反应生产。
(2) 收集和转移18F-: 18F-经QMA柱捕获后, 使用碳酸钾(3 mg溶于0.5 mlH2O)和Kryptofix 2.2.2 (15 mg溶于1 ml无水乙腈)的混合溶液将其洗脱并收集到反应瓶中, 溶液经氦气和真空干燥, 水汽由置于液氮中的冷肼吸收。
(3) 亲核取代反应: 将1 mg MMSE溶于1 ml无水乙腈中, 加入反应瓶中, 100℃加热反应10 min。
(4) 在生成物中加入6 ml 0.1 mol/L HCl(0.6 ml 1mol/LHCl加入5.4ml无水乙腈), 100℃下水解3min, 重复两次。
(5) 粗产品通过Al2O3柱, 分离未反应的18F-和碳酸根离子。
(6) 将初步纯化后的产品溶解于50%的乙醇淋洗液中, 用高效液相色谱法(high-performance liquid chromatography, HPLC)分离产物并进一步纯化(淋洗液为50%的乙醇溶液, 流速为4 ml/min), 紫外检测波长为280 nm, 用HPLC γ探头和紫外探头同时监测放射性峰), 收集25 min左右的放射性峰洗脱液。
(7) 洗脱液经0.2 μm无菌滤膜过滤, 得到18FFES注射液。
18F-FES合成示意图见图 1。
-
(1) 一般理化性质: 用精密pH试纸测定18FFES注射液的pH值, 目测其颜色和澄清度。
(2) 放射性浓度: 用放射性活度计测定18F-FES的放射性活度, 根据放射性活度和注射液体积计算放射性浓度。
(3) 放射化学纯度测定: 用放射性薄层扫描仪测定18F-FES的放射化学纯度。扫描仪分析条件为: 硅胶60塑板, 层析液为乙腈: 水(体积比为95: 5的混合液)。
(4) 细菌内毒素实验: 取装有0.1 ml鲎试剂的安瓿6支, 分为3组, 每组2只。其中, 第一组各加入0.1 ml18F-FES注射液, 作为供试品管; 第二组各加入0.1 ml用水溶解的细菌内毒素工作标准品, 制成浓度为2.0 λ的内毒素溶液, 作为阳性对照管; 第三组各加入0.1 ml细菌内毒素检查用水, 作为阴性对照管。将以上6支安瓿中的溶液轻轻混匀后封闭管口, 垂直放入(37±1)℃的恒温器中保温(60±2)min。
(5) 无菌实验: 将18F-FES注射液送细菌室进行24 h细菌培养。
-
(1) 异常毒性实验: 取5只小鼠, 分别经尾静脉注射37 MBq18F-FES注射液, 其剂量相当于体重为60 kg的人用剂量的300倍, 对照组小鼠(5只)注射等体积的15%乙醇溶液; 将实验组小鼠与对照组小鼠共同饲养, 观察其生长情况, 48 h后处死小鼠并解剖, 观察其脏器损伤[8]。
(2) 初步动物体内分布实验: 将2只家兔麻醉, 分别经家兔耳缘静脉注射14.8 MBq18F-FES注射液(2只兔注射时间间隔30 min), 1 h后将其固定于纸板上, 用PET-CT仪进行扫描, 获得家兔体内18F-FES的分布图像。
-
18F-FES的合成总时间约90 min, 放射性浓度为60.5 MBq/ml, 放化产率约为10%(未经衰变校正), 放射化学纯度大于95%, 室温放置6 h后性状稳定, 放化纯未见明显变化。
-
(1) 异常毒性实验: 与对照组相比, 实验组小鼠生长正常, 48 h内未见死亡及不良反应。解剖后观察, 未见脏器损伤。
(2) 初步动物体内分布实验: 2只家兔的18FFES体内分布基本相似。18F-FES主要在肝脏代谢, 然后经胆道、肠道排泄, 在腋窝淋巴结、纵隔等与乳腺癌及其转移灶有关的部位本底较低, 18F-FES的体内分布与相关文献报道基本符合[9]。
-
18F-FES注射液的24 h细菌培养结果呈阴性, 细菌内毒素含量符合中国药典标准[8]。
-
自动化生产是取得快速、有效、可靠及符合药品生产质量管理规范标准的PET显像剂的重要保证, 并可减少工作人员在生产过程中接受的放射性照射剂量。国外已有文献报道18F-FES的合成过程和方法, 但其步骤较为繁琐复杂[4-6], 国内也有少量相关报道, 但无高产率自动化合成的报道[7]。因此, 研究18F-FES的高产率、自动化生产工艺具有一定的意义。
本研究工艺合成步骤较简单, 反应过程中不需要分离中间产物, 可使用自动合成装置TracelabFXFN自动化合成, 但是由于生产中需经3次水解过程, 最终可能产生较多的中间产物, 导致目标产物的产率偏低。因此, 在生产中要严格控制水解条件, 特别是控制反应温度, 要在较短的时间内完成加热过程, 并将水解的过程维持在一定的温度范围内; 其次, 要保证水解中使用的HCl的浓度; 另外, 可适当增加前体的量, 使产率得到一定的提高。
由于在使用HPLC纯化产物的过程中使用了50%的乙醇溶液作为淋洗液, 导致最终产物无法直接注射入人体, 需用生理盐水稀释至15%以下后才能使用(一般需加入13 ml以上的生理盐水), 这便造成了给患者注射的药液体积偏大, 可能引起患者疼痛或不适。为此, 可通过适当降低淋洗液的浓度(一般应在40%以上, 否则产物无法洗脱), 同时适当增加18F-的用量, 用以减少用药体积, 降低患者不适的可能性。另外, 为了避免较高浓度的淋洗液对HPLC纯化产物过程造成过大的压力, 淋洗液流速调节得较慢(1.5 ml/min), 这将导致出峰时间的延迟(一般在30 min左右), 延长了生产时间。为此, 可以在不对HPLC纯化产物过程造成过大压力的前提下, 适当地将流速调快, 使出峰时间提前至15~20 min, 本研究将其调整为3~4 ml/min, 缩短了生产时间。
18F-FES的异常毒性实验结果表明, 18F-FES注射液毒性小, 对人安全; 体外稳定性实验表明, 其在体外较稳定, 有利于进一步的临床应用; 无菌和细菌内毒素实验结果表明, 其可安全地应用于临床。
-
18F-FES的整个合成过程自动化完成, 操作简便, 所得注射液的各项指标均符合中国药典标准, 体外稳定性较好, 毒性小, 对人安全。但在生产中需进一步改进反应条件及操作方法以提高放化产率。初步动物体内分布实验结果表明, 18F-FES在乳腺癌常见的转移灶的本底较低, 有望成为安全、有效的ER显像剂。
雌激素受体显像剂18F-16α-17β-氟雌二醇的自动化合成
Automated synthesis of the estrogen receptors imaging agent 18F-FES
-
摘要:
目的 使用自动化合成装置Tracerlab FXFN,制备雌激素受体显像剂18F-16α-17β-氟雌二醇(18F-FES)。 方法 通过两步反应制备18F-FES:①18F-和3-O-(甲氧甲基)-16, 17-O-磺酰基-16-表雌二醇发生亲核取代反应;②生成物经HCl水解,重复两次后得到产物18F-FES。 结果 18F-FES的合成总时间约80 min,放化产率约为10%,放化纯度大于95%。 结论 整个合成过程自动化完成,操作简便,18F-FES毒性小,对人安全,体外较稳定,有望成为安全、有效的雌激素受体显像剂。 -
关键词:
- 18F-16α-17β-氟雌二醇 /
- 自动化合成
Abstract:Objective 18F-16α-17β-fluoroestradiol(18F-FES), an estrogen receptors imaging agent, is synthesized with Tracerlab FXFNsystem. Methods 18F-FES is obtained by two steps reactions, including the nucleophilic displacement reaction of no-carrier-added18F-fluoride with 3-O-methoxymethyl-16, 17-O-sulfuryl-16-epiesteriol, then the intermediate is evaporated and hydrolyzed with HCl and finally gives18F-FES. Results The synthesis of18F-FES can be completed in about 80 min.The radiochemical yield and radio-chemical purity are about 10%and 95%respectively. Conclusion The procedure ofsynthesis is simple and automatical.18FFES has an extremely lowtoxicity, which suggests that18F-FES may be a safe and effective estrogen receptors imagingagent. -
Key words:
- 18F-16α-17β-fluoroestradiol /
- Automated synthesis
-
[1] 陈道宝, 杨红健. 乳腺癌ER与FES-CT. 中国肿瘤, 2008, 17(7): 588-592.
[2] Mortimer JE, Dehdashti F, Siegel BA, et al. Positron emission tomograpgy with 2-[18F]fluoro-2-deoxy-D-glucose and 16α-[18F]fluoro-17β-estradiol in breast cancer: correlation with estrogen receptor status and response to systemic therapy. Clin Cancer Res, 1996, 2(6): 933-939. [3] Peterson LM, Mankoff DA, Lawton T, et al. Quantitative imaging of estrogen receptor expression in breast cancer with PET and18F-fluorosetradiol. J Nucl Med, 2008, 49(3): 367-374. doi: 10.2967/jnumed.107.047506 [4] Oh SJ, Chi DY, Mosdzianowski C, et al. The automatic production of 16α-[18F]fluoroestradiol using a conventional[18F]FDG module with a disposable cassette system. Appl Radiat Isot, 2007, 65(6): 676-681. doi: 10.1016/j.apradiso.2006.06.016 [5] Kumar P, Mercer J, Doerkson C, et al. Clinical production, stability studies and PET imaging with 16-α-[18F]fluoroestradiol([18F]FES)in ER positive breast cancer patients. J Pharm Pharm Sci, 2007, 10(2): 256s-265s. [6] Mori T, Kasamatsu S, Mosdzianowski C, et al. Automatic synthesis of 16alpha-[18F]fluoro-17beta-estradiol using a cassettetype[18F]fluorodeoxyglucose synthesizer. Nucl Med Biol, 2006, 33(2): 281-286. doi: 10.1016/j.nucmedbio.2005.11.002 [7] 王明伟, 张勇平, 章英剑, 等. 乳腺癌雌激素受体分子影像探针16α-[18F]氟-17β-雌二醇的自动化合成. 核技术, 2009, 32(11): 839-844.
[8] 国家药典委员会. 中华人民共和国药典. 2005版二部. 北京: 化学工业出版社, 2005.
[9] Aliaga A, Rousseau JA, Ouellette R, et al. Breast cancer models to study the expression of estrogen receptors with small animal PET imaging. Nucl Med Biol, 2004, 31(6): 761-770. doi: 10.1016/j.nucmedbio.2004.02.011 -






 下载:
下载: