-
放射性粒子组织间植入治疗肿瘤是将放射性核素直接种植到肿瘤内或者肿瘤周围, 通过放射性核素持续释放的射线达到杀伤肿瘤的目的[1]。1965年, 美国纽约Memorial Sloan-Kettering医院肿瘤中心进行了第一例前列腺癌 125I粒子治疗, 之后的数十年来, 125I粒子植入治疗进展十分迅速, 在国外广泛应用于治疗前列腺癌, 国内许多医院将此技术进一步扩展, 应用于头颈部癌、肝癌、肺癌、胰腺癌及妇科肿瘤等的综合治疗[2-7], 也取得一定的近期疗效。尽管如此, 125I粒子组织间植入治疗肿瘤的单独疗效至今尚处于试验研究阶段, 其中一个重要的原因是对 125I粒子植入如何以持续低剂量率照射方式杀伤细胞的作用和机制的研究尚不够深入, 因此进行基础研究十分必要, 近年来体外实验研究正在逐步进行。
-
125I是一种人工合成的放射性核素, 由124Xe吸收1个中子并以电子俘获方式变为 125I, 释放能量为27~31 keV的X射线和35 keV的γ射线。 125I粒子是由内含吸附有活性 125I的钯丝, 外壳为钛合金管并经激光焊接而成的微小颗粒。与其他放射治疗方法相比, 125I粒子具有剂量率较低、治疗比增加、相对生物效应高的优势。这些优势是由其物理特性所决定的: ① 125I半衰期为59.6 d, 可提供200 d左右的持续照射, 便于运输、保存和临床使用; ② 125I属于低能放射性核素, 具有穿透到局部组织间的作用, 疗效好且损伤小; ③半价层为0.003 cm的铅, 操作人员易于防护; ④外壳为钛合金管, 辐射距离为1.7 cm, 靶治疗体积外的辐射剂量迅速衰减。
-
“Manchester”模型是最早的低剂量率照射体外实验模型[8], 其所用的放射性物质是226Ra和198Au。根据Manchester系统理论, 模型放射性物质以环形分布在一平面上, 放射性分布取决于D/h比值(其中, D为放射环的直径, h为放射源平面和治疗平面之间的距离)。为使治疗平面所接受的射线更加均匀, 放射源按照以下原则排列: 当D/h < 3时, 放射源以一个单环形式排列; 当3 < D/h < 6时, 除一个单环外, 还需将总剂量5%的放射源置于圆心; 当D/h > 6时, 需要两个同心圆放射环, 并在圆心放置一部分放射源, 才能达到剂量均匀分布。Goldhagen等[9]于1982年设计了放射性粒子体外照射模型, 用于研究137Cs及 125I的相对生物效应。1995年, Ling等[10]设计的放射性粒子体外照射模型使得受照细胞可以获得较均匀的照射剂量。
-
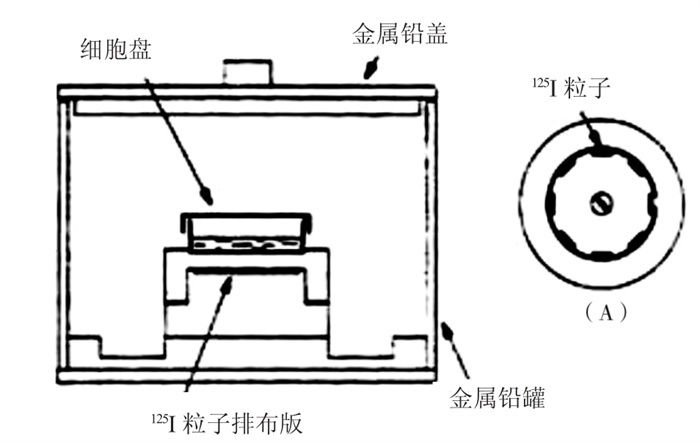
根据“Manchester”模型, 为了使体外实验简单易行, 并达到更均匀分布的照射剂量, 英国的格雷实验室研制了一种专为研究 125I粒子持续低剂量率照射活细胞株的体外实验系统(图 1), 该实验系统包括三部分: 125I粒子排布板、细胞盘、辐射防护装置。 125I粒子排布板为直径50 mm、高约5 mm的聚苯乙烯圆盘, 在距圆心30 mm处环形等距离排布8颗 125I粒子, 粒子置于1 mm深的凹槽内(图 1A); 细胞盘与 125I粒子排布板直径相当, 位于粒子上方约6 mm处; 辐射防护装置为直径116 mm、高80mm的圆柱形有盖金属铅罐, 125I粒子排布板及细胞盘均置于其中心[11]。
岳麓等[12]对 125I粒子体外照射细胞的剂量分布研究表明, 1 mm厚的聚苯乙烯材料对 125I粒子在水中的剂量率衰减无影响。采用1 mm厚聚苯乙烯材料制成的培养皿培养的体外细胞在接受多粒 125I粒子照射时, 可以采用美国医学物理协会第43号报告推荐的公式计算细胞平面的剂量率, 以理论计算值代替实际测量值, 分析细胞的受照剂量[13]。如果在细胞接受照射时间的半程, 旋转细胞培养皿22.5°, 则能够使细胞平面剂量率分布更加均匀。
目前有更简单的实验方法是直接将粒子置入已接种有肿瘤细胞的培养板内, 培养一定时间后用比色法检测细胞增殖抑制率。此种方法简便易行, 可进行较大样本量的实验, 但每孔细胞受照不均匀, 不能避免空间照射的相互影响, 而且由于培养板孔板中的癌细胞(尤其是对照组癌细胞)很快长满小孔, 实验观察时间受到限制。
-
国外研究显示, 凋亡可能是低剂量率辐射抑制肿瘤生长的主要机制[14-17], 近年来国内许多学者做了相关研究, 证实凋亡是 125I粒子持续低剂量率照射抑制肿瘤细胞的重要途径, 并且其抑制作用与 125I粒子照射的时间和剂量有关。
邵文博等[18]通过体外实验模拟 125I粒子在体内插植的照射模式, 观察了 125I粒子照射对肝癌BEL-7402细胞的早期影响, 结果表明, 125I粒子对肝癌BEL-7402细胞的增殖有抑制作用, 且抑制作用随着照射时间的延长、剂量的累积而增强; 流式细胞仪观察照射后细胞周期的变化表明, 125I粒子照射可改变细胞周期的分布, 使细胞周期阻滞于G2/M期。肖建等[19]采用流式细胞术检测 125I粒子诱导体外培养的人食管癌Eca-109的细胞凋亡及对细胞周期影响, 结果表明, 各实验组凋亡细胞阳性指数值均显著高于对照组, 随着粒子剂量的增加, G2/M期细胞相应增多, S期细胞逐渐减少, 而G0/G1期细胞数量变化不大, 因此认为 125I粒子诱导凋亡的能力可能是通过把细胞阻滞在G2/M期而实现的。陈祎阳等[20]观察 125I粒子对体外培养的人脑恶性胶质瘤细胞系SHG-44的生长抑制及诱导其凋亡的作用, 结果证实, 125I粒子以剂量、时间依赖性方式通过凋亡来抑制胶质瘤细胞的增殖, 促进细胞向凋亡方向转化; 125I粒子诱导下的细胞系中还存在非凋亡调控的细胞程序性死亡(自噬); 胶质瘤细胞凋亡过程中有相关基因如p53/突变性共济失调性毛细血管扩张症基因通路的基因、c-myc家族、p16、Bcl-2家族等参与。
另有研究显示, 125I粒子持续低剂量率照射较分次或单次射线照射对肿瘤细胞的抑制作用更有效。Zhuang等[21]将结肠癌CL187细胞分别暴露于单次高剂量率60Co辐射和持续低剂量率 125I粒子辐射, 评价不同剂量和剂量率辐射的效应, 结果表明, 125I粒子对CL187细胞的抑制作用较60Co更明显, 将细胞阻滞于G2/M期而诱导的凋亡是 125I粒子持续低剂量率辐射杀伤肿瘤细胞的主要机制, 125I持续低剂量率照射可以通过丝裂原活化蛋白激酶信号转导机制影响肿瘤细胞的增殖。Wang等[22]亦分别以 125I粒子和60Co分别照射人胰腺癌PANC-1细胞, 结果显示, 125I粒子照射细胞的存活分数明显低于60Co, 125I粒子持续低剂量率照射可致细胞阻滞于G2/M期, 并且诱导细胞凋亡。
众所周知, 肿瘤生长过程中, 只有处于活跃期的小部分细胞在持续繁殖, 在细胞G2期及M期阶段, 辐射敏感性最高, 而其他阶段的肿瘤细胞对射线敏感性较差。 125I粒子照射时, 细胞周期进行到G2/M期容易形成阻滞, 而放射性粒子的持续照射也就增加了G2/M期的总照射剂量, 故而有助于提高射线对肿瘤细胞的杀伤效果, 提高凋亡指数。可见, 凋亡是 125I粒子持续性低剂量率照射导致细胞死亡的主要机制, 而照射引起的G2/M期阻滞是细胞凋亡的主要原因。
-
辐射诱导的旁效应是指在受照细胞周围未接受照射的细胞受到受照细胞影响而出现诸如细胞死亡、基因突变、染色体不稳定等类似于直接受照细胞所引起的反应。1992年, Nagasawa等[23]用α粒子照射中国仓鼠卵巢细胞时发现, 在仅有1%的细胞核直接受到单个α粒子的作用时, 却有30%的细胞呈现出姊妹染色体交换, 从而发现了辐射旁效应现象。这一现象在以后的许多实验中都得到证实并进行了深入研究, 但关于放射性粒子通过诱导辐射旁效应抑制肿瘤生长的研究甚少。
Chen等[24]将不同辐射敏感的人肺癌A549细胞和NCL-H446细胞直接暴露于 125I粒子低剂量辐射, 之后与未受照射细胞共同孵育, 结果: 接受照射细胞的微核形成率和凋亡率增高, 辐射敏感性高的NCL-H446细胞微核形成率和凋亡率是A549细胞的2.1~2.8倍, 而且使未受照射NCL-H446细胞微核形成率和单个细胞磷酸化的H2AX焦点形成明显高于对照组, 证实 125I粒子持续低剂量率辐射诱导的旁效应具有潜在杀伤肿瘤细胞的作用, 并且补偿了辐射剂量不均匀分布对治疗的影响。
-
125I粒子近距离疗法在肿瘤治疗中取得了非常理想的局部控制率, 引起了国内外许多学者的关注。与其他肿瘤治疗方法一样, 其进展需临床和基础许多领域的研究和合作。在 125I粒子治疗肿瘤的临床病例研究广泛报道的同时, 相关体外实验基础研究显得较少。随着基础研究的不断深入、 125I粒子照射抑制肿瘤细胞的机制不断明了, 这一新方法将会得到更好的应用。
125I粒子持续低剂量率杀伤肿瘤细胞体外实验研究进展
Advances in the experimental study on continuous low-dose-rate irradiation by 125I seeds killing cancer cell in vitro
-
摘要: 125I粒子组织间植入治疗肿瘤因其手术创伤小、疗效好、对正常组织辐射损伤小等优点受到了国内外越来越多学者的关注。随着 125I粒子抑制肿瘤作用临床研究的深入,相关体外实验研究也在逐步开展。该文就 125I粒子持续低剂量率照射杀伤肿瘤细胞的体外实验研究进展及其实验模型设计进行综述。Abstract: More and more researchers pay close attention to the treatment of cancer with 125I seeds implantation because of the advantages of little surgical trauma, good curative effect and little radiation damage tonormal tissue.As the clinical studyon 125I seeds killing cancer has been performed profoundly, the correlated experimental study in vitro was carried out gradually.This review will focus on the recent advances in the experimental study and model design on continuous low-dose-rate irradiation by 125I seeds killing cancer cell in vitro.
-
Key words:
- Iodine radioisotopes /
- Brachytherapy /
- Neoplasms
-
[1] 王俊杰, 唐劲天, 黎功. 放射性粒子近距离治疗肿瘤. 北京: 北京医科大学出版社, 2001: 66-69.
[2] 易慧明, 况光仪, 谭亦农, 等. 碘-125放射性粒子在头颈部恶性肿瘤中的应用. 中国热带医学, 2005, 5(4): 667-668. doi: 10.3969/j.issn.1009-9727.2005.04.005
[3] Zhang FJ, Li CX, Wu PH, et al. Radioactive seed 125I implantation in treating recurrence and metastasis after liver transplantation in hepatoma. Zhonghua Yi Xue Za Zhi, 2007, 87(14): 956-959. [4] 柴树德, 郑广钧, 毛玉权, 等. CT引导下经皮穿刺种植放射性 125I粒子治疗晚期肺癌. 中华放射肿瘤学杂志, 2004, 13(4): 291-293. doi: 10.3760/j.issn:1004-4221.2004.04.013
[5] 钟晓捷, 李高. 电视胸腔镜辅助手术及 125I粒子植入治疗外周型非小细胞肺癌. 中华医学杂志, 2005, 85(47): 3376-3377. doi: 10.3760/j:issn:0376-2491.2005.47.017
[6] Zhang FJ, Wu PH, Zhao M, et al. CT guided radioactive seed 125I implantation in treatment of pancreatic cancer. Zhonghua Yi Xue Za Zhi, 2006, 86(4): 223-227. [7] 麻富卯, 张继东, 郭瑞嵩, 等. 125I粒子植入法治疗放疗后未控与复发的妇科肿瘤21例. 肿瘤研究与临床, 2009, 21(1): 47-48. doi: 10.3760/cma.j.issn.1006-9801.2009.01.016
[8] Meredith WJ. Radium dosage: The Manchester systern. Edinburgh and London: E & S Livingstone Ltd., 1947. [9] Goldhagen PE, Freeman ML, Hall EJ. Studies with encapsulated 125I sources. I. Apparatus and dosimetry for determination of relative biological effectiveness. Int J Radiat Oncol Biol Phys, 1982, 8(8): 1347-1353. [10] Ling CC, Li WX, Anderson LL. The relative biological effectiveness of I-125 and Pb-103. Int J Radia Oncol Biol Phys, 1995, 32(2): 373-378. doi: 10.1016/0360-3016(95)00530-C [11] Aird EG, Folkard M, Mayes CR, et al. A purpose-built iodine-125 irradiation plaque for low dose rate low energy irradiation of cell lines in vitro. Br J Radiol, 2001, 74(877): 56-61. doi: 10.1259/bjr.74.877.740056 [12] 岳麓, 程文英, 罗伟华, 等. 125I籽源离体照射细胞平面剂量率分布研究. 中华放射肿瘤学杂志, 2005, 14(5): 435-438. doi: 10.3760/j.issn:1004-4221.2005.05.015
[13] Nath R, Anderson LL, Luxton G, et al. Dosimetry of interstitial brachytherapy sources: recommendations of the AAPM Radiation Therapy Committee Task Group No. 43. American Association of Physicists in Medicine. Med Phys, 1995, 22(2): 209-234. [14] Murtha AD. Radiobiology of low-dose-rate radiation relevant to radioimmunotherapy. Cancer Biother Radiopharm, 2000, 15(1): 7-14. doi: 10.1089/cbr.2000.15.7 [15] Rupnow BA, Murtha AD, Alarcon RM, et al. Direct evidence that apoptosis enhances tumor responses to fractionated radiotherapy. Cancer Res, 1998, 58(9): 1779-1784. [16] Macklis RM, Beresford BA, Humm JL. Radiobiologic studies of low-dose rate 90Y-lymphoma therapy. Cancer, 1994, 73(3 Suppl): 966-973. [17] Mirzaie-Joniani H, Eriksson D, Johansson A, et al. Apoptosis in HeLa Hep2 cells is induced by low-dose, low-dose-rate radiation. Radiat Res, 2002, 158(5): 634-640. doi: 10.1667/0033-7587(2002)158[0634:AIHHCI]2.0.CO;2 [18] 邵文博, 宋金龙. 125I粒子近距离照射对BEL-7402肝癌细胞增殖和细胞周期的影响. 中国医学物理学杂志, 2005, 22(4): 567. doi: 10.3969/j.issn.1005-202X.2005.04.003
[19] 肖建, 曹秀峰, 龚涌灵, 等. 125I粒子对食管癌Eca-109细胞凋亡及细胞周期的影响. 标记免疫分析与临床, 2008, 15(3): 167-170. doi: 10.3969/j.issn.1006-1703.2008.03.012
[20] 陈祎阳, 黄海燕, 杨树源. 碘-125对胶质瘤SHG-44细胞的细胞程序性死亡作用及相关基因表达的影响. 吉林大学学报(医学版), 2010, 36(3): 456-460.
[21] Zhuang HQ, Wang JJ, Liao AY, et al. The biological effect of 125I seed continuous low dose rate irradiation in CL187 cells. J Exp Clin Cancer Res, 2009, 28(1): 12. doi: 10.1186/1756-9966-28-12 [22] Wang J, Wang J, Liao A, et al. The direct biologic effects of radioactive 125I seeds on pancreatic cancer cells PANC-1, at continuous low-dose rates. Cancer Biother Radiopharm, 2009, 24(4): 409-416. doi: 10.1089/cbr.2008.0563 [23] Nagasawa H, Little JB. Induction of sister chromatid exchanges by extremely low doses of alpha-particles. Cancer Res, 1992, 52(22): 6394-6396. [24] Chen HH, Jia RF, Yu L, et al. Bystander effects induced by continuous low-dose-rate 125I seeds potentiate the killing action of irradiation on human lung cancer cells in vitro. Int J Radiat Oncol Biol Phys, 2008, 72(5): 1560-1566. doi: 10.1016/j.ijrobp.2008.07.038 -






 下载:
下载: