-
据美国国家卫生统计中心统计报告, 平均每4 min就会有一人死于脑卒中, 其病死率仅次于心脏病和癌症[1]。大部分脑卒中是由动脉粥样硬化斑块破裂形成的血栓而致[2]。近年来, 国内脑卒中的发生率及病死率也有所增加, 因此能够在斑块破裂前发现病灶, 采取积极合理的治疗方法, 不但能挽救患者生命, 而且能减少国家和个人的负担。
-
在人类血管中, 内膜最易受损, 其形成粥样斑块的过程大致如图 1所示。
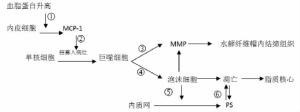
图 1 血管壁粥样硬化斑块的形成过程 图中,MCP-1为单核细胞化学趋附蛋白1;MMP为基质金属蛋白酶;PS为磷脂酰丝氨酸。当各种原因导致的血脂蛋白过多时,可刺激内膜细胞产生黏附的化学趋附因子,如MCP-1。单核细胞进入血管壁成为巨噬细胞,巨噬细胞分泌MMP,水解纤维帽内的结缔、纤维组织,使帽变薄。巨噬细胞表达清道夫受体吞噬氧化的脂蛋白,从而变成富含脂质的泡沫细胞,将发展成斑块的脂质核心。泡沫细胞刺激内质网,使其分泌PS,PS促进泡沫细胞凋亡,同时泡沫细胞的凋亡使内质网分泌PS更多,凋亡后的泡沫细胞成为脂质核心。
脂质核心所含的氧化脂蛋白大部分为胆固醇, 体温下以液体形式存在。随着损害的进展, 脂质核心变大、变软[3], 越来越薄的纤维帽受力加大, 在血流切应力及血管内压力调控的变化中会突然破裂而形成栓子[4], 受损部位也启动一系列病例生理反应而形成血栓, 导致脑卒中。即使斑块初次破裂时不造成严重的临床后果, 但如果该过程反复发生, 使斑块不断进展, 最终将导致闭塞性血栓。现在, 国内外一般将这种易于形成血栓或可能迅速进展为病变使动者的斑块称为易损斑块或不稳定性斑块, 最早于1992年由Muller提出[5]。经过近20年的发展, 人们对其病理特征已初步形成共识: ①大的脂质核心; ②薄而弱的纤维帽; ③大量炎性细胞(巨噬细胞、T淋巴细胞等)[6]。
基于上述易损斑块形成的病理机制特点, 可将目前的相关检查方法分为三大类: 检验血液中的特殊标志物、探测斑块的形态变化和观察斑块的炎性代谢活度。检验血液中的标志物虽然简单易行, 但患有动脉粥样硬化的患者一般会并存其他系统的疾病, 影响因素较多, 分子机制错综复杂, 稳定性差, 因此该种检查方法现已逐渐呈弱势。后两类按照检查方法是否为创伤性又可分为有创性的血管内超声、血管内镜、血管内光谱分析、血管内MRI、温度检查等和无创性的超声、免疫荧光显像、CT、MRI、PET等, 前者除了其有创性的固有缺点, 对技术、设备的要求也较高, 实施起来有一定难度。相对来讲, 无创性检查简单易行, 发展空间大, 将来可以用作疗效监测等, 现将其特点总结见表 1[7-9]。
检查方法 原理 优点 缺点 超声 形态和成分变化 简单易行,可测最颈动脉内膜厚度、管径、斑块形态、大小,并可测定血流速度 只能显示血管纵切面;陈旧出血与血栓不易鉴别; 皮肤、肌肉或钙化有时吋造成干扰 螺旋CT 形态和成分变化 扫描快,可对钙化容积定量,评价血管重构,可分辨脂质、纤维、钙化成分 有放射性,需要对比剂,可重复性差 MRI 形态变化和部分代谢变化 多序列成像,测量动脉粥样硬化斑块体积和管腔狭窄率,区分斑块内各组成成分 特异度和灵敏度不够高,扫描时间长 免疫荧光显像 代谢变化 灵敏度高,成本低,成像范围广 操作步骤复杂,结果可靠性差 PET 代谢变化 灵敏度、特异性高,分辨率显著提高,成像范围广 成本髙,不能精确定位 表 1 各种无创性检测斑块方法的优缺点比较
由表 1可知, 在表现斑块形态、成分变化方面最有优势的是MRI, 在提供代谢信息方面最好的则是PET。
-
目前针对易损斑块形成的病理机制所开发的标记药物大致有四类: ①用于单核细胞募集显影, 如125I-单核细胞化学趋附蛋白1[10]; ②用于氧化脂蛋白的吞噬显影, 如 99Tcm-氧化型低密度脂蛋白[11]; ③用于斑块中细胞凋亡显影, 如 99Tcm-Annexin-A5(一种膜联蛋白)[12-13]; ④用于斑块内活性炎性细胞显影, 如 18F-FDG。这些药物均有一定的发展前景, 但前三种都是用SPECT, 分辨率等性能不及PET, 而且有的有效半衰期较长, 不适于临床应用, 有的制备费时, 有的只是出于动物实验阶段, 还没有应用到临床, 因此我们在此重点讨论目前应用广泛的 18F-FDG PET方法。
有炎症的斑块巨噬细胞的葡萄糖代谢相当活跃, 因此, 理论上用 18F-FDG可以监测到斑块的炎症进展情况, 然而具体实施起来还要考虑到以下几个问题: ① 18F-FDG摄取反映血管内斑块炎症的特异性如何; ②用哪个指标可以更好的反映 18FFDG的摄取与巨噬细胞活性的关系。
-
机体大部分代谢都是以消耗葡萄糖为主, 即 18F-FDG显像的特异性很低, 那么, 是否有其他组织摄取 18F-FDG从而影响与炎症的相关性呢?
首先考虑的就是组成血管壁的主要成员平滑肌细胞, 如果它摄取 18F-FDG, 那么其摄取量应与内膜厚度正相关, 然而Ogawa等[14]用遗传性高血脂症的家兔进行研究, 没有发现有意义的相关性。Tawakol等[15]先用新西兰兔证明, 易损斑块的高 18FFDG摄取与血管炎症(巨噬细胞染色)相关, 而与血管壁厚度、斑块厚度或平滑肌细胞染色无关。接着该小组又以17例患重度颈动脉狭窄的患者为研究对象, 经动脉环切术将高 18F-FDG摄取的斑块取下后, 用巨噬细胞特异的抗体(抗CD-68单克隆抗体)和平滑肌细胞特异的抗体(抗平滑肌细胞α-肌动蛋白抗体)进行免疫组化分析, 发现平滑肌细胞与 18F-FDG摄取确实没有明显相关性(r=0.15;P= 0.40), 而巨噬细胞相关性明显(r=0.88;P=0.001)[16]。
Laurberg等[17]以载脂蛋白E基因缺陷小鼠为实验对象, 用苯巴比妥麻醉处死后进行PET检查, 也观察到了主动脉弓处粥样斑块的高 18F-FDG摄取信号; 然而当把肩胛间的棕色脂肪除去后信号也随之消失; 接着将主动脉去除后再行PET, 发现信号前后没有变化。他们分析认为, 斑块无 18F-FDG摄取信号可能是由于斑块的乏细胞性--大部分为无活性的脂质核心所占据, 即使巨噬细胞代谢活跃, 但其分散密度较低, 使信号强度减弱。至于为什么信号来源于棕色脂肪, 该实验并没有进一步进行分析。虽然在成年人类大血管周围只存在单个的棕色脂肪细胞或细胞岛[18], 但功能活跃的棕色脂肪可以表达葡萄糖载体, 提高 18F-FDG的摄取率[19], 这提示我们还需进一步研究, 以排除血管外周是否有信号干扰。
总之, 根据目前的研究, 用 18F-FDG摄取量作为衡量粥样硬化斑块炎性程度的特异性还是比较高的。
-
目前用来评价 18F-FDG摄取的指标有标准化摄取值(standardized uptake value, SUV)或微分/剂量摄取比值(differential/dose uptake ratio, DUR)、ΔSUV(即: SUVmax-SUVmin)、靶/本底比值(target-to-backgroundratio, TBR)、SUVmax、SUVmean等。Tawakol等[15]研究了SUV、ΔSUV、TBR三者之间的关系, 结果表明TBR能更好的反映 18F-FDG摄取与炎症的关系(可以利用高分辨率的MRI指导ROI的放置), 见表 2。Gr be等[20]则研究了SUVmax、SUVmean、TBR三者间的关系, 也是TBR更胜一筹, 而SUVmean相关性则较弱(r=0.36, P=0.30; r=0.64, P=0.04; r=0.71, P=0.02)。
CD68染色百分率 巨噬细胞面积 SUV r =0.58, P < 0.0001 r =0.49, P < 0.0001 ASUV r = 0.88, P < 0.001 r =0.80, P < 0.001 TBR r = 0.85, P < 0.0001 r =0.76, P < 0.0001 注:表中,SUV为标准化摄取值;△SUV为标准化摄取值最大值和最小值之差;TBR为粑/本底比值。 表 2 SUV、ΔSUV、TBR与炎症的相关性比较
-
MRI由于分辨率高、成像序列多、无辐射、无创而成为检测易损斑块形态特点的佼佼者。
目前, 用于检测斑块的非对比增强MRI技术包括黑血自旋回波序列和亮血自旋回波序列, 前者主要包括T1加权像、T2加权像、质子密度加权像(proton densityweightedimaging, PDWI), 后者主要是时间飞跃-磁共振血管成像(time of flight-magnetic resonance angiography, TOF-MRA)法。利用高分辨率的黑血回波序列可以很好的显示斑块的形态和组织成分; 亮血回波序列可以提高斑块内钙化和富含胶原的纤维帽的显示效果。
用TOF采集后可用最大强度投影法重建出血管影像, 根据处理模式的不同其又可分为二维TOF和三维TOF两种。二维TOF不易饱和, 对慢血流的显示较好, 适用于颅内静脉和小动脉的显示; 三维TOF具有较高的空间分辨率, 扫描速度快, 对血流中的涡流、加速度等复杂因素造成的失相位影响小, 但由于是同时采集一个层面或一个容积, 容易产生饱和效应而使血流信号减弱, 对慢血流尤为明显, 而且采集时间长, 容易产生运动伪影, 因此适用于较快血流的大血管显示, 而且, 三维TOF后重建效果优于二维TOF。
此外, 血管MRI还有相位对比法, 不过TOFMRA被认为是目前最有效的血管MRI方法, 因为它主要与血液流动速度有关, 对动脉系统特别有效, 血管与周围组织的对比度好, 重建出来的血管图像清晰。
所以, 我们在对血管斑块显影时可选三维TOF、T1加权像、T2加权像、PDWI等参数成像。
-
通过大量病理对照研究, 已对斑块内各成分的信号特点形成初步认识[21-23], 总结见表 3。
斑块成分 Tl 加权像 T2 加权像 PDWI TOF Tl 增强 纤维帽 低 等 等 低 +++ 脂质核心 低或髙 低 等或高 等 -/+ 钙化 低 低 低 低 - 出血 <1周 高 等或低 等或低 髙 - 1-6周 高 高 高 高 - >6周 低 低 低 低 - 血流 低 低 低 高 ++ 注:表中,PDWI为质子密度加权; T0F为时间飞跃法;信号高低以同侧胸锁乳突肌为参照。 表 3 斑块成分MRI信号特点
Cai等[24]根据MRI性能, 对美国心脏病协会病理分型进行了改良, 并用1.5 T MRI对60例患者初步应用, 然后再做病理对照比较, 发现除Ⅰ-Ⅱ型和Ⅷ型的灵敏度较低外, 其余各型斑块应用MRI进行分型均具有良好的灵敏度和特异度(表 4)。不过, 有研究发现, Ⅳ-Ⅴ型和Ⅵ型斑块对脑卒中发生的相对危险度高于其他类型, 尤其是Ⅵ型斑块, 为其他型斑块比数比的5~16倍, 提示脑卒中风险性相当高[25]。
MRI特征 灵敏度(%) 特异度(%) Ⅰ-Ⅱ型:血管内膜中层厚度接近正常,无钙化 67 100 Ⅲ型:弥散性内膜增厚或小的非钙化性偏心斑块 81 98 Ⅳ-Ⅴ型:斑块内有脂质或坏死核心,被覆纤维组织,可合并钙化 84 90 Ⅵ型:复合斑块,可合并與血、血栓或表面溃疡 82 91 Ⅶ型:钙化斑块 80 94 Ⅷ型:纤维斑块,无脂质核心,可合并小钙化灶 56 100 注:表中的分型是根据改良的美国心脏学会标准分型.由于mri目前的分辨率还不足以区分Ⅰ型中散在的泡沫细胞和Ⅱ型中多发的泡沫细胞,因此被合并为Ⅰ-Ⅱ型;而区分Ⅳ型和Ⅴ型的能力还未被证实,因此合并为Ⅳ-Ⅴ型。 表 4 斑块损伤MRI分型
值得注意的是, 理论上讲, 3.0 T MRI的信噪比是1.5 T的2倍, 采集时间更短, 分辨率更高, 然而高场强组织的T1弛豫时间增长, 使组织对比信号发生改变[26], 因此在使用Cai等改良的标准做参考时应注意该差别。
-
易损斑块破裂是引发脑卒中的主要原因, 而且发病率有逐年上升的趋势。因此, 在破裂前检测出易损斑块, 临床医生就可以采取积极、有效措施, 预防临床事件的发生。但是, 由于斑块并不是进展到纤维帽厚度、脂质核心所占面积或 18F-FDG摄取量达到某个特定阈值才破裂, 而是随着损害的进展, 破裂的危险性增加[27]。因此, 我们可以用PET行血管的大范围显像, 对易损斑块可疑灶进行筛选, 然后用MRI具体定位、分析, 获得巨噬细胞 18F-FDG摄取量和斑块形态、成分两方面的信息, 缩小易损斑块诊断的重叠区间, 更早、更准确的找到易损斑块。
此外, PET联合MRI还可以在颈动脉内膜切除术前判断斑块稳定性, 为防止术中斑块不稳定化和术后再狭窄提供参考, 并可检测疗效。
大量临床实验表明, 对有轻度症状或无症状颈动脉严重狭窄的患者进行血管再通术收效甚微[28-29], 因此还可以对该类患者进行术前危险度分级, 从而减少不必要的手术。
综上所述, PET联合MRI在易损斑块检测方面展现了巨大的应用潜力, 不过, 实验样本都相对较小, 因此, 需要更广范围的大样本进一步确定不同 18F-FDG摄取值与斑块破裂的危险度相关性, 为其进入临床应用提供可靠标准。
18F-FDG PET与MRI联合检测颈动脉易损斑块的应用前景
Potential application of detection vulnerable plaque with 18F-FDG PET and MRI
-
摘要: 颈动脉粥样硬化斑块的破裂是导致脑卒中发生的主要原因。利用 18F-FDG PET联合MRI的方法可以同时提供斑块代谢、形态及成分方面的信息,大大提高诊断的灵敏度和特异性。
-
关键词:
- 氟脱氧葡萄糖F18 /
- 正电子发射断层显像术 /
- 磁共振成像 /
- 颈动脉 /
- 易损斑块
Abstract: The rupture of the vulnerable carotid artery plaque is the main reason of brain stroke.The combination of 18F-FDG PET and MRI providing the information about metabolism, morphology and composition at the same time, and this method will greatly improve the sensitivity and specificity of diagnosis. -
表 1 各种无创性检测斑块方法的优缺点比较
检查方法 原理 优点 缺点 超声 形态和成分变化 简单易行,可测最颈动脉内膜厚度、管径、斑块形态、大小,并可测定血流速度 只能显示血管纵切面;陈旧出血与血栓不易鉴别; 皮肤、肌肉或钙化有时吋造成干扰 螺旋CT 形态和成分变化 扫描快,可对钙化容积定量,评价血管重构,可分辨脂质、纤维、钙化成分 有放射性,需要对比剂,可重复性差 MRI 形态变化和部分代谢变化 多序列成像,测量动脉粥样硬化斑块体积和管腔狭窄率,区分斑块内各组成成分 特异度和灵敏度不够高,扫描时间长 免疫荧光显像 代谢变化 灵敏度高,成本低,成像范围广 操作步骤复杂,结果可靠性差 PET 代谢变化 灵敏度、特异性高,分辨率显著提高,成像范围广 成本髙,不能精确定位 表 2 SUV、ΔSUV、TBR与炎症的相关性比较
CD68染色百分率 巨噬细胞面积 SUV r =0.58, P < 0.0001 r =0.49, P < 0.0001 ASUV r = 0.88, P < 0.001 r =0.80, P < 0.001 TBR r = 0.85, P < 0.0001 r =0.76, P < 0.0001 注:表中,SUV为标准化摄取值;△SUV为标准化摄取值最大值和最小值之差;TBR为粑/本底比值。 表 3 斑块成分MRI信号特点
斑块成分 Tl 加权像 T2 加权像 PDWI TOF Tl 增强 纤维帽 低 等 等 低 +++ 脂质核心 低或髙 低 等或高 等 -/+ 钙化 低 低 低 低 - 出血 <1周 高 等或低 等或低 髙 - 1-6周 高 高 高 高 - >6周 低 低 低 低 - 血流 低 低 低 高 ++ 注:表中,PDWI为质子密度加权; T0F为时间飞跃法;信号高低以同侧胸锁乳突肌为参照。 表 4 斑块损伤MRI分型
MRI特征 灵敏度(%) 特异度(%) Ⅰ-Ⅱ型:血管内膜中层厚度接近正常,无钙化 67 100 Ⅲ型:弥散性内膜增厚或小的非钙化性偏心斑块 81 98 Ⅳ-Ⅴ型:斑块内有脂质或坏死核心,被覆纤维组织,可合并钙化 84 90 Ⅵ型:复合斑块,可合并與血、血栓或表面溃疡 82 91 Ⅶ型:钙化斑块 80 94 Ⅷ型:纤维斑块,无脂质核心,可合并小钙化灶 56 100 注:表中的分型是根据改良的美国心脏学会标准分型.由于mri目前的分辨率还不足以区分Ⅰ型中散在的泡沫细胞和Ⅱ型中多发的泡沫细胞,因此被合并为Ⅰ-Ⅱ型;而区分Ⅳ型和Ⅴ型的能力还未被证实,因此合并为Ⅳ-Ⅴ型。 -
[1] Lloyd-Jones D, Adams RJ, Brown TM, et al. Executive summary: heart disease and stroke statistics--2010 update: a report from the American Heart Association. Circulation, 2010, 12(17): 948-954. [2] 管阳太. 动脉粥样硬化血栓形成与脑卒中的抗血小板治疗. 上海医学, 2009, 32(4): 271-275. doi: 10.3969/j.issn.1673-8640.2009.04.008
[3] Libby P. Current concepts of the pathogenesis of the acute coronary syndromes. Circulation, 2001, 104(3): 365-372. doi: 10.1161/01.CIR.104.3.365 [4] Cheng C, Tempel D, van Haperen R, et al. Atherosclerotic lesion size and vulnerability are determined by patterns of fluid shear stress. Circulation, 2006, 113(23): 2744-2753. doi: 10.1161/CIRCULATIONAHA.105.590018 [5] Muller JE, Tofler GH. Triggering and hourly variation of onset of arterial thrombosis. Ann Epidemiol, 1992, 2(4): 393-405. doi: 10.1016/1047-2797(92)90088-8 [6] Muller JE, Kaufmann PG, Luepker RV, et al. Mechanisms precipitating acute cardiac events: review and recommendations of an NHLBI workshop. National Heart, Lung, and Blood Institute. Mechanismsprecipitatingacutecardiaceventsparticipants. Circulation, 1997, 96(9): 3233-3239. [7] Matter CM, Stuber M, Nahrendorf M. Imaging of the unstable plaque: how far have we got?. Eur Heart J, 2009, 30(21): 2566-2574. doi: 10.1093/eurheartj/ehp419 [8] 宋桂芹, 王拥军. 识别易损斑块的影像技术. 中华老年心脑血管病杂志, 2008, 10(11): 875-877. doi: 10.3969/j.issn.1009-0126.2008.11.031
[9] Budoff MJ, Achenbach S, Blumenthal RS, et al. Assessment of coronary artery disease by cardiac computed tomography: a scientificstatementfromtheAmericanHeartAssociation Committee on Cardiovascular Imaging and Intervention, Council on Cardiovascular Radiology and Intervention, and Committee on Cardiac Imaging, Council on Clinical Cardiology. Circulation, 2006, 114(16): 1761-1791. doi: 10.1161/CIRCULATIONAHA.106.178458 [10] Ohtsuki K, Hayase M, Akashi K, et al. Detection of monocyte chemoattractant protein-1 receptor expression in experimental atherosclerotic lesions: an autoradiographic study. Circulation, 2001, 104(2): 203-208. doi: 10.1161/01.CIR.104.2.203 [11] Iuliano L, Signore A, Vallabajosula S, et al. Preparation and biodistribution of 99m technetium labelled oxidized LDL in man. Atherosclerosis, 1996, 126(1): 131-141. doi: 10.1016/0021-9150(96)05888-1 [12] Johnson LL, Schofield L, Donahay T, et al. 99mTc-annexin V imaging for in vivo detection of atherosclerotic lesions in porcine coronary arteries. J Nuel Med, 2005, 46(7): 1186-1193. [13] KietselaerBL, ReutelingspergerCP, HeidendalGA, etal. Noninvasive detection of plaque instability with use of radiolabeled annexin A5 patients with carotid-artery atherosclerosis. N Engl J Med, 2004, 350(14): 1472-1473. [14] Ogawa M, Ishino S, Mukai T, et al. (18)F-FDG accumulation in atherosclerotic plaques: immunohistochemical and PET imaging study. J Nucl Med, 2004, 45(7): 1245-1250. [15] Tawakol A, Migrino RQ, Hoffmann U, et al. Noninvasive in vivo measurement of vascular inflammation with F-18 fluorodeoxyglucose positron emission tomography. J Nucl Cardiol, 2005, 12(3): 294-301. doi: 10.1016/j.nuclcard.2005.03.002 [16] Tawakol A, Migrino RQ, Bashian GG, et al. In vivo 18F-fluorodeoxyglucose positron emission tomography imaging provides a noninvasive measure of carotid plaque inflammation in patients. J Am Coll Cardiol, 2006, 48(9): 1818-1824. doi: 10.1016/j.jacc.2006.05.076 [17] Laurberg JM, Olsen AK, Hansen SB, et al. Imaging of vulnerable atherosclerotic plaques with FDG-microPET: No FDG accumulation. Atherosclerosis, 2007, 192(2): 275-282. doi: 10.1016/j.atherosclerosis.2006.07.019 [18] Manieri M, Murano I, Fianchini A, et al. Morphological and immunohistochemical features of brown adipocytes and preadipocytes in a case of human hibernoma. Nutr Metab Cardiovasc Dis, 2010, 20(8): 567-574. doi: 10.1016/j.numecd.2009.04.020 [19] Nedergaard J, Bengtsson T, Cannon B. Unexpected evidence for active brown adipose tissue in adult humans. Am J Physiol Endocrinol Metab, 2007, 293(2): E444-E452. doi: 10.1152/ajpendo.00691.2006 [20] Graebe M, Pedersen SF, Borgwardt L, et al. Molecular pathology in vulnerable carotid plaques: correlation with [18]-fluorodeoxyglucose positron emission tomography (FDG-PET). Eur J Vasc Endovasc Surg, 2009, 37(6): 714-721. doi: 10.1016/j.ejvs.2008.11.018 [21] Yuan C, Kerwin WS, Yarnykh VL, et al. MRI of atherosclerosis in clinical trials. NMR Biomed, 2006, 19(6): 636-654. doi: 10.1002/nbm.1065 [22] Yuan C, Oikawa M, Miller Z, et al. MRI of carotid atherosclerosis. J Nucl Cardiol, 2008, 15(2): 266-275. doi: 10.1016/j.nuclcard.2008.02.001 [23] Chu B, Kampschulte A, Ferguson MS, et al. Hemorrhage in the atherosclerotic carotid plaque: a high-resolution MRI study. Stroke, 2004, 35(5): 1079-1084. doi: 10.1161/01.STR.0000125856.25309.86 [24] Cai JM, Hatsukami TS, Ferguson MS, et al. Classification of human carotid atherosclerotic lesions with in vivo multicontrast magnetic resonance imaging. Circulation, 2002, 106(11): 1368-1373. doi: 10.1161/01.CIR.0000028591.44554.F9 [25] 赵辉林, 许建荣. 3.0 T高分辨MRI对颈动脉斑块分型的研究. 中国医学计算机成像杂志, 2007, 13(3): 158-162.
[26] Yarnykh VL, Terashima M, Hayes CE, et al. Multicontrast blackblood MRI of carotid arteries: comparison between 1.5 and 3 tesla magnetic field strengths. J Magn Reson Imaging, 2006, 23(5): 691-698. [27] Redgrave JN, Gallagher P, Lovett JK, et al. Critical cap thickness and rupture in symptomatic carotid plaques: The oxford plaque study. Stroke, 2008, 39(6): 1722-1729. doi: 10.1161/STROKEAHA.107.507988 [28] No authors listed. Endarterectomy for asymptomatic carotid artery stenosis. Executive Committee for the Asymptomatic Carotid Atherosclerosis Study. JAMA, 1995, 273(18): 1421-1428. [29] European Carotid Surgery Trialists' Collaborative Group. Randomised trial of endarterectomy for recently symptomatic carotid stenosis: final results of the MRC European Carotid Surgery Trial(ECST). Lancet, 1998, 351(9113): 1379-1387. doi: 10.1016/S0140-6736(97)09292-1 -





 下载:
下载:

