-
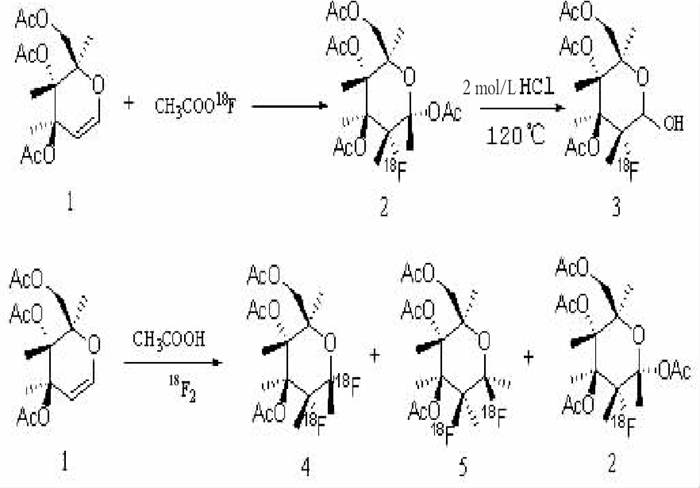
Brookhaven工作小组[1]在1976年首次应用亲电加成的方法合成了FDG, 采用的反应物为F2与3, 4, 6-O-三乙酰基-D-谷氨醛, 从此引出了 18F-FDG合成的研究。
-
亲电氟代反应所用的亲电试剂主要有两种: F2和CH3COOF。底物为1、2位存在双键的3, 4, 6-三乙酰基-D-葡萄烯糖。合成 18F-FDG的亲电氟代反应如图 1所示。
-
目前应用最广泛的亲核氟代试剂主要是 18F-, 该离子可由高产率且低质子粒子能量消耗的 18O(p, n)18F核反应制备。此外, 相转移催化剂如四烷基铵、氨基聚醚等在亲核反应中的成功应用为无载体的亲核取代反应提供了必要条件, 因此, 制备18FFDG的研究主要集中在底物的选择上。选择底物时主要考虑F取代的位置, 葡萄糖的2位C原子上的H被F取代后, 产物即可替代葡萄糖作为底物与六糖激酶相互结合作用。曾被讨论应用的底物包括: 2-三氟-1, 3-二甲氧基-4, 6-苯亚甲氧基-β-D-甘露糖、2, 3-环硫内酯-1-甲氧基-4, 6-苯亚甲氧基-β-D-甘露糖、1, 3, 4, 6-四乙酰基-2-三氟甘露糖, 在这些底物中, 1, 3, 4, 6-四乙酰基-2-三氟甘露糖因易制备、易水解, 反应条件温和等优点而被广泛应用, 并进一步被改进为1, 3, 4, 6-四乙酰基-2-三氟磺酰甲基-β-D-甘露糖(简称三氟甘露糖)[2]。
-
应用亲电氟代反应法合成 18F-FDG的效率低下, 18F-FDG的放射化学产率只有10%左右, 反应时间长达90 min。1987年, Brodack等[3]采用亲核氟代反应法将放射化学产率提高到12%~17%, 时间缩短为70 min, 使放射化学产率有了质的提高。后来又对制备工艺进行了改造, 使放射化学产率达到60~70%。目前, 最新的微流体数字化控制的微化学反应在制备 18F-FDG方面的应用又大大提高了 18F-的标记效率。亲核氟代反应法合成 18F-FDG的一般工艺包括: 18F-的生产、离子交换、相转移催化、除水、除乙腈、水解中间体、分离、中和纯化等过程。
-
无载体的 18F-的生产方法有多种, 如18O(p, n)18F亲核反应法、20Ne(d, α)18F亲核反应法等。用质子束照射H218O是目前生产无载 18F-的最有效方法, 即用回旋加速器将氢气电离成H-后, 再经射频系统加速使其能量达到16.5 MeV, 又被碳箔脱掉2个电子, 形成质子束。质子束照射富含18O的靶水, 发生18O(p, n)18F核反应, 产生 18F-, 由氦气推动靶水传输至 18F-FDG合成箱。作为高速粒子束轰击的靶目标, H218O比18O2更具有可操纵性, Kilbourn等[4-5]分别在1984年和1985年解决了反应中存在的辐射分解和溅射的问题。
-
18F-需从轰击后的靶水中分离、富集, 其基本思路是通过离子交换树脂来捕获 18F-。离子交换树脂的种类较多, 常用的包括: ①干Dowex IX8 (CO32-)离子交换树脂, 其捕获效率达99.9%以上, 此外该离子交换树脂还可以去除淋洗液如氨基聚醚的残留, 因此不用再过硅胶柱, 节省了时间与步骤[6]; ②4-(4-甲基哌啶)吡啶阳离子树脂, 其捕获效率在95%以上, 在此树脂上还可进行亲核反应, 但其捕获效率与靶水的质量相关, 当靶水中阴阳离子的含量较高时, 其捕获效率明显下降[7]; ③阴离子交换柱(如Sep-pak QMA), 该柱的捕获效率较高且影响因素较少, 但在使用前需活化。
18F-被捕获或交换下来后, 因水分子的存在将影响亲核取代反应, 除水的方法一般有两种: ①当 18F-被捕获到4-(4-甲基哌啶)吡啶阳离子树脂上后, 用乙腈洗脱除去水分; ② 18F-被交换下来到反应管后, 可通过乙腈共沸除水。另有报道称通过电化学电池技术或不除水的 18F-溶液作为中间介质, 都可不经过除水就能高效合成 18F-FDG。在电化学电池里, 被吸附在电极上的18F-可被释放到乙腈溶液中进行氟化反应[8]; 而不除水的18F-溶液主要靠离子液作为媒介来催动反应, 即使有微量的水存在也不影响产率[9]。
-
过去, 18F-FDG的合成过程是完全暴露在环境中的, 工作人员会受到很大的辐射伤害; 后来逐步发展为在半封闭的“黑匣子”里进行合成反应, 但是“黑匣子”自动合成系统成本非常高, 且无法排除热源干扰, 该系统被认为是全自动合成与柱型“黑匣子”系统的起点[10]; 合成工艺再演变到现在, 即是模块箱里的全自动合成, 它比“黑匣子”更灵活, 用计算机和机械臂来完成实验操作, 可完全避免人员受到辐射。自动化合成模块采用了压力传感器、热电耦和辐射探测反应器等技术来完成自动化操作[11]。1986年, 首台 18F-FDG自动合成模块研发成功, 该模块不但缩短了合成时间, 还减少了辐射剂量的暴露[12]。在自动化合成的基础上, “一锅法”、“两R锅法”和“微流体数字化技术的微化学反应法”相继问世[13]。“一锅法”比“两锅法”减少了一个反应管和一根硅胶柱, 因此减少了辐射剂量的损失。微流体数字化技术通过脉冲惯性力来驱动和扰动微流体, 实现了微流体的均匀离散和微喷射, 具有数字可控性[14], 通过这项技术实现了 18F-微液滴与前体微液滴间的混合反应, 大大提高了合成效率。然而, 以下条件还可影响 18F-FDG自动合成模块的合成效率: ①反应中有氧气存在的条件下, 18F-FDG的产量会大幅度降低, 因此, 反应时向反应管中不断通入氮气是必需的; ②前体质量在不低于15 mg时即可满足反应要求, 增加三氟甘露糖的量不能明显提高合成效率; ③反应温度和反应程度呈正相关, 但当外部加热温度高于83℃后, 反应温度并不会改变, 外部温度升高反而会使反相C18柱和反应管的放射性残留增加[15]。
-
通过水解反应除去产物中间体的保护基是成功合成 18F-FDG的关键步骤。关于水解方法的探讨和研究十分深入, 常用的水解方法包括: 液相酸水解、固相酸水解、液相碱水解、固相碱水解、阳离子交换树脂水解、微波水解、超声水解等。总体而言, 固相水解要远优于液相水解, 阳离子交换树脂水解法的优点在于完全避免了与酸液直接接触带来的不便, 并能与程序很好的结合, 使水解用时缩短到10 min, 但该水解方法的缺点是产品在树脂上的残留无法完全被洗脱下来[16]。 18F-FDG的水解反应最初是在盐酸溶液中或在Dowex 50硫磺酸阳离子交换树脂上进行的, 110℃下持续水解15 min [12] 。后来研究发现, 在一定浓度的碱液中, 去保护基的反应更迅速(大约1 min), 且在室温条件下就可完成水解过程, 室温条件下FDG可在一定浓度(2 mol/L)的NaOH溶液中稳定存在20 min, 同时避免了2-脱氧-2-氯-D-脱氧葡萄糖的生成[17]。目前, 18F-FDG合成中的保护基水解主要是应用固相碱水解的方法, 以反相C18柱为载体, 捕获反应产物后, 在C18柱上纯化, 加入2 mol/L NaOH溶液在室温下水解2 min即可完成去保护基的过程。此外, 固相碱水解法通过控制条件还可完全避免同分异构体氟脱氧甘露糖醇生成的风险[12]。
-
亲核取代反应结束后, 反应液中主要存在的化合物有催化剂(如氨基聚醚)、F-、 18F-O-四乙酰基-甘露糖, 反应液经过反相C18固相水解柱分离, 反应产物被吸附到柱子上, 经NaOH碱液的水解后, 再经过IC-H柱(氢离子交换柱)中和多余的碱液, 再经Al2O3柱和C18柱纯化, 通过微孔滤膜过滤即可得到最终纯化产品 18F-FDG。为了在物理鉴别、化学鉴别和生物鉴别上达到药典标准, 产品还必须通过相应的质量控制。
-
18F-FDG的质量控制包括3个方面:
(1) 物理鉴别: 包括外观鉴别、核素鉴别和活度测量。在合适的灯光下, 在铅玻璃后观察18FFDG注射液应为无色、透明状。因 18F-的半衰期为105.5~115.0 min, 故可用活度计测量10 min后的活度改变来反推核素的半衰期, 误差应在5%以内。
(2) 化学鉴别: 包括pH值测量、化学纯度测量和放化纯度测量。用精密pH试剂测量, 18F-FDG注射液的pH值应在4.5~7.5 [18] 。用薄层层析法测量其放化纯度, 该纯度应大于90%[19]。化学纯度测量主要检测氨基聚醚的残留(残留量应 < 50 μg/ml), 测量方法有很多, 包括显色法、液相层析法-质谱测定法等, 其中, 液相层析法-质谱测定法是目前灵敏度最高的检测方法, 灵敏度可达1 ng/ml[20-21]。美国26版药典对 18F-FDG的有机溶剂残留已有限定, 其中, 乙腈应低于0.04%, 乙醇应低于0.5%, 其检测方法为带氢火焰检测器气相色谱。对于有机溶剂残留的检测, 现在广泛采用的方法是气相色谱法, 用火焰离子检测器, 载气为氦气, 流速为10 ml/min。
(3) 生物鉴别: 18F-FDG注射液的无菌和细菌内毒素检测在制备后24h进行, 培养后第3、7和14d观察结果。美国26版药典规定, 18F-FDG注射液中细菌内毒素的量不高于175/V, 其中V为 18F-FDG失效前推荐使用剂量的最大体积(ml)[22]。
-
18F-FDG的药代动力学符合三室模型[23]。 18F-FDG是葡萄糖的结构类似物, 故其在体内的代谢途径与葡萄糖相似, 但 18F-FDG通过与葡萄糖相同的代谢途径生成6-磷酸-脱氧葡萄糖后, 便无法像葡萄糖一样参与有氧和无氧代谢, 而是停留、聚集在细胞质内[24]。在小鼠体内的药物代谢研究发现, 18F-FDG在心肌的摄取率最高, 其次是脑, 放射性在心肌和脑中持续时间较长; 血、肝及肾的摄取率也较高, 但放射性清除快。 18F-FDG注入小鼠体内30 min后, 血药浓度达到高峰, 45 min后各组织器官放射性分布逐渐达到平衡, 60 min后放射性基本消除[25]。
18F-FDG属于糖代谢型显像剂, 适合于心、脑、肿瘤的PET检查。肿瘤细胞的葡萄糖代谢水平高于正常组织, 故 18F-FDG会在肿瘤细胞内的积聚增加, 这也是应用 18F-FDG PET鉴别良、恶性病灶的基础。 18F-FDG PET的临床应用主要表现在: ①非小细胞型肺癌、乳腺癌、黑色素瘤以及直肠癌等的诊断; ②肿瘤分期、术后复发的早期诊断及疗效; ③评估缺血心肌的活力, 定位癫痫病灶等[26]。该显像剂虽敏感性高, 但其特异性较差, 容易导致假阴性和假阳性现象[27]。例如, 部分原发性肝癌及肾透明细胞癌对 18F-FDG摄取并不增高, 从而出现假阴性; 当存在炎症、活动性结核或肉芽组织时, 会使 18F-FDG摄取增高, 造成一定假阳性。
-
18F-FDG的自动化合成为其商业化奠定了基础。然而, 18F-FDG药物的合成效率和放射化学产率还有待进一步的提高。此外, 虽然 18F-FDG在临床应用的各个方面已经相对成熟, 但还是不能完全满足临床诊断的要求, 因此, 通过总结 18F-FDG的制备和临床应用也有利于其他F标药物的发展。F标药物比C标药物的半衰期长, 在临床诊断不受影响的条件下, 考虑用F标药物取代C标药物是未来示踪剂发展的趋势。交叉学科和新技术在制备正电子放射性药物方面的应用, 也为示踪剂的发展提供了技术保证, 如微流体数字化技术在微化学反应中的应用、毛细管电泳分离技术在纯化工艺中的应用等。
正电子放射性显像剂 18F-FDG的研究进展
The progress of reserch on positron radioactive 18F-FDG
-
摘要: 18F-FDG是PET-CT影像诊断重要的示踪剂之一,采用亲核取代反应制备 18F-FDG比亲电取代反应更优越,因此,前者取代后者将势在必行。全自动合成模块工艺对放射性药物的规模化生产以及临床上的广泛应用起到了推动作用。近年来,新技术手段在 18F-FDG合成模块中的应用也引起了人们的广泛关注。作为以静脉注射方式给药的示踪剂, 18F-FDG的质量控制要求严格。先进的检测手段以及药品生产和质量管理规范的实施为 18F-FDG的质量控制提供了保证。对18FFDG的代谢动力学研究发现,该示踪剂静脉注射后的代谢过程符合三室模型,为临床用药提供了依据。该文从合成原理、工艺流程、质量控制、代谢分布与临床应用等几个方面对 18F-FDG的研究进展进行综述。Abstract: As one of the most important tracer for PET-CT, the preparation of 18F-FDG by nucleophilic substitutionis better than electrophilic substitution, therefore the substitution of the formerfor the latter is imperative.Automatic synthesis module technology has powerful function on the large-scale production of radioactive drugs and widely clinical been used.In recent years the application of new technology in 18F-FDG synthesis module is very fascinating.The requirement for quality control of 18F-FDG is tremendously strict, for which the administration way of 18F-FDG is intravenous injection.The advanced detective methods and the standardization of Good Manufacturing Practice are guarantee to 18F-FDG quality control.The researches on pharmacokinetics of 18F-FDG show that the metabolic process accords with three-compartment model after intravenous, which provides a basis for clinical medication.In this paper, we review the 18F-FDG in detail from the principleof synthesis, craft process, quality control, metabolic distributionandclinicalapplication andso on.
-
Key words:
- Fluorodeoxyglucose F18 /
- Quality control /
- Pharmacokinetics /
- Technology, pharmaceutical
-
[1] Ido T, Wan CN, Fowler JS, et al. Fluorination with F2. A convenient synthesis of 2-deoxy-2-fluoro-D-glucose. J Org Chem, 1977, 42(13): 2341-2342. [2] Coenen HH, Pike VW, Stöcklin G, et al. Recommendation for a practical production of [2-18F] fluoro-2-deoxy-D-glucose. Appl Radiat Isot, 1987, 38(8): 605-610. doi: 10.1016/0883-2889(87)90124-9 [3] Brodack JW, Dence CS, Kilbourn MR, et al. Robotic production of 2-deoxy-2 [18F]fluoro-D-glucose: a routine method of synthesis using tetrabutylammonium [18F]fluoride. Appl Radiat Isot, 1988, 39(7): 699-703. doi: 10.1016/0883-2889(88)90060-3 [4] Kilbourn MR, Hood JT, Welch MJ. A simple 18O water target for 18F production. Int J Appl Radiat Isot, 1984, 35(7): 599-602. doi: 10.1016/0020-708X(84)90102-9 [5] Kilbourn MR, Jerabek PA, Welch MJ. An improved [18O] water target for [18F] fluoride production. Int J Appl Radiat Isot, 1985, 36(4): 327-328. doi: 10.1016/0020-708X(85)90099-7 [6] Bogni A, Pascali C, Iwata R, et al. [18F]FDG synthesis by Anatech RB-86 robotic system: Improvements and general considerations. J Radioanal Nucl Chem, 1998, 230(1-2): 45-50. doi: 10.1007/BF02387445 [7] Toorongian SA, Mulholland GK, Jewett DM, et al. Routine production of 2-deoxy-2-[18F]fluoro-D-glucose by direct nucleophilic exchange on a quaternary 4-aminopyridinium resin. Nucl Med Biol, 1990, 17(3): 273-279. [8] Kim HW, Jeong JM, Lee YS, et al. Rapid synthesis of [18F]FDG without an evaporation step using an ionic liquid. Appl Radiat Isot, 2004, 61(6): 1241-1246. doi: 10.1016/j.apradiso.2004.02.027 [9] Hamacher K, Hirschfelder T, Coenen HH. Electrochemical cell for separation of [18F]fluoride from irradiated 18O-water and subsequent no carrier added nucleophilic fluorination. Appl Radiat Isot, 2002, 56(3): 519-523. doi: 10.1016/S0969-8043(01)00156-7 [10] Chaly T, Mattacchieri R, Velez JW, et al. A large scale manual production of [18F]FDG using a synthetic unit made of sterile disposable components and operated by a Master Slave Manipulator. Appl Radiat Isot, 1990, 41(1): 29-34. doi: 10.1016/0883-2889(90)90126-2 [11] Culbert PA, Adam MJ, Hurtado ET, et al. Automated synthesis of [18F]FDG using tetrabutylammonium bicarbonate. Appl Radiat Isot, 1995, 46(9): 887-891. doi: 10.1016/0969-8043(95)00177-F [12] Alexoff DL, Russell JAG, Shiue CY, et al. Modular automation in PET tracer manufacturing: application of an autosynthesizer to the production of 2-deoxy-2-[18F]fluoro-D-glucose. Appl Radiat Isot, 1986, 37(10): 1045-1061. doi: 10.1016/0883-2889(86)90045-6 [13] Mock BH, Vavrek MT, Mulholland GK. Back-to-back"One-Pot" [18F] FDG syntheses in a single Siemens-CTI chemistry process control unit. Nucl Med Biol, 1996, 23(4): 497-501. doi: 10.1016/0969-8051(96)00030-3 [14] 朱丽, 侯丽雅, 章维一. 基于微流体数字化技术的微化学反应器. 中国机械工程, 2007, 18(5): 597-599. doi: 10.3321/j.issn:1004-132X.2007.05.023
[15] 张锦明, 张书文, 田嘉禾, 等. 影响2- 18F-2-脱氧-β-D-葡萄糖合成效率因素初探. 同位素, 2003, 16(1): 30-33. doi: 10.3969/j.issn.1000-7512.2003.01.007
[16] Mulholland GK. Simple rapid hydrolysis of acetyl protecting groups in the FDG synthesis using cation exchange resins. Nucl Med Biol, 1995, 22(1): 19-23. doi: 10.1016/0969-8051(94)E0068-T [17] Füchtner F, Steinbach J, Mading P, et al. Basic hydrolysis of 2-[18F]fluoro-1, 3, 4, 6-tetra-O-acetyl-D-glucose in the preparation of 2-[18F]fluoro-2-deoxy-D-glucose. Appl Radiat Isot, 1996, 47(1): 61-66. doi: 10.1016/0969-8043(95)00258-8 [18] The United States Pharmacopoeia Convention. The United States Pharmacopeia. 26 th ed. 2003: 808-810. [19] 叶肇云, 齐秀珍. 18FDG放射液化学纯度的测定. 同位素, 2004, 17(2): 104-107. doi: 10.3969/j.issn.1000-7512.2004.02.009
[20] Mock BH, Winkle W, Vavrek MT, et al. A color spot test for the detectionofKryptofix2.2. 2 in[18F]FDGpreparations. NuclMedBiol, 1997, 24(2): 193-195. [21] Ma Y, Huang BX, Channing MA, et al. Quantification of Kryptofix 2.2. 2 in 2-[18F]FDG and other radiopharmaceuticals by LC/MS/MS. Nucl Med Biol, 2002, 29(1): 125-129. [22] 张锦明, 田嘉禾. 18F-FDG的质量控制及方法. 中华核医学杂志, 2005, 25(6): 383-384.
[23] Hunter GJ, Hamberg LM, Alpert NM. Simplified measurement of deoxyglucose utilization rate. J Nucl Med, 1996, 37(6): 950-955. [24] PhelpsME, HoffmanEJ, SelinC, etal. Investigation of [18F]2-fluoro-2-deoxyglucose for the measure of myocardial glucose metabolism. J Nucl Med, 1978, 19(12): 1311-1319. [25] Gallagher BM, Ansari A, Atkins H, et al. Radiopharmaceuticals XXVII. 18F-labeled 2-deoxy-2-fluoro-d-glucose as a radiopharmaceutical for measuring regional myocardial glucose metabolism in vivo: tissue distribution and imaging studies in animals. J Nucl Med, 1977, 18(10): 990-996. [26] 李彪, 朱承谟. 正电子放射性药物的临床应用与进展. 诊断学理论与实践, 2005, 4(2): 93-95.
[27] 陈泽龙, 王楷堂, 李天然, 等. 18F-FDG显像剂的制备及其在肿瘤诊断中的作用评价. 福建医药杂志, 2006, 28(1): 1-3.
-





 下载:
下载: