-
淋巴瘤是原发于淋巴结及结外淋巴组织或器官的恶性肿瘤, 多发于淋巴结、扁桃体、脾脏及骨髓。流行病学资料显示, 淋巴瘤的发病率在全球呈逐年上升趋势。我国每年新发淋巴瘤患者约5万例, 年病死数约2万; 男性发病率为1.39/10万, 女性为0.84/10万, 病死率约1.5/10万; 在男性恶性肿瘤中列第九位, 女性中列第十位; 多发于中青年, 以20~40岁多见, 城市高于农村[1]。淋巴瘤的发病原因多与病毒感染、免疫抑制及环境等因素有关, 当淋巴瘤细胞侵袭血液系统时可引发淋巴细胞性白血病。病理学将淋巴瘤分为霍奇金淋巴瘤和非霍奇金淋巴瘤(non-Hodgkin’s lymphoma, NHL)两大类。在我国, 霍奇金淋巴瘤患者仅占淋巴瘤的8%~11%, 其中90%起源于淋巴结; NHL占89%~92%, 其中60%起源于淋巴结, 且NHL所占比例有逐年上升的趋势。因此, 如何提高NHL的疗效是临床长期关注的焦点, 其中, 针对B淋巴细胞分化抗原CD20的生物治疗和分子显像已展现出良好的前景。
-
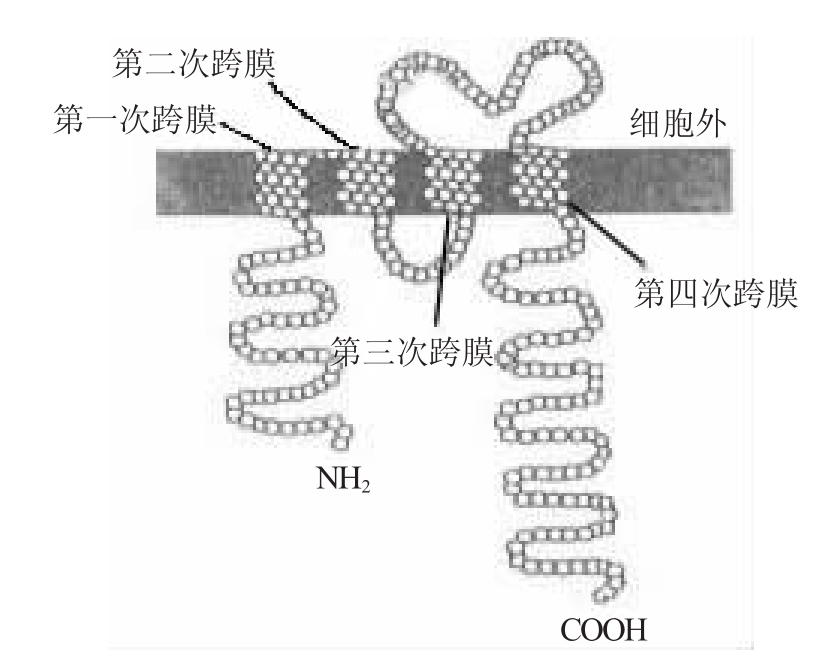
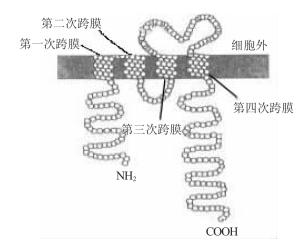
CD20是位于B淋巴细胞膜表面的磷酸化蛋白, 由279个氨基酸残基组成, 由于磷酸化程度不同, 其分子质量为(33~37)×103, 以四次跨膜的形式存在(图 1)[2], 其中, 氨基端和羧基端以及第二次跨膜与第三次跨膜之间的氨基酸序列均位于胞质内, 仅第三次跨膜与第四次跨膜之间的25个氨基酸Asn163~Gln187(NIYNCEPANPSEKNSPSTQYCYSIQ)构成胞外段, 是生物治疗的作用靶点[3]。胞外段的Ala170~Ser173是抗CD20单克隆抗体(如利妥昔单抗等)的主要识别结构域。CD20的生物学功能尚未完全阐明, 推测其参与了B细胞的增殖、分化、信号转导和钙离子的跨膜传递过程。编码人CD20的基因位于染色体11q12.13, 长度为16 kb, 含有8个外显子。
目前研究发现, CD20在人的前B细胞、未成熟B细胞、成熟的B细胞以及激活的B细胞中均有表达, 但在造血干细胞、原B细胞、浆细胞、淋巴祖细胞和其他正常组织中无表达, 人血清中亦无游离CD20的存在。研究证实, 绝大多数NHL起源于B细胞, 约95%的B细胞性淋巴瘤CD20呈阳性[4-5]。CD20在NHL细胞中的特异性表达, 使之成为NHL生物治疗和分子显像研究的理想靶点。
-
目前, 淋巴瘤的常规治疗方法为化疗和放疗, 复发率约为30%, NHL患者完全缓解率为45%~55%, 长期无病生存率为30%~35%[6]。由于化疗药物的选择性差, 对造血系统、肝肾功能的不良作用较大, 因此, 针对NHL细胞表面抗原的免疫治疗和放射免疫治疗研究日益受到临床的关注。
-
Rituximab是全球首个被批准用于临床治疗CD20阳性淋巴瘤的单克隆抗体, 目前在治疗NHL中应用广泛, 完全缓解率高达65%。Rituximab是一种人/鼠嵌合型免疫球蛋白G单抗, 含有1328个氨基酸残基, 分子质量约144×103, 由鼠抗CD20单抗的抗原结合片段(antigen-binding fragment, Fab)与人免疫球蛋白G抗体的结晶片段(fragment crystallizable, Fc)构成(图 2)[7]。Du等[2, 8]先后阐明了rituximab和C2H7抗体与CD20特异性结合的机制, 即rituximab的抗原结合部位由轻链(L)可变区和重链(H)可变区组成, 共有L1、L2、L3、H1、H2及H3等6个环状互补决定区, 其中L3、H1、H2和H3共同构成一个“袋状结构”, 能够特异性地与分化群20胞外段结合。
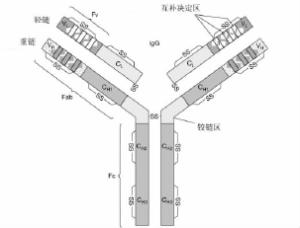
图 2 利妥昔单克隆抗体结构示意图图中,Fv:抗原结合部位;Fab:抗原结合片段;Fc:结晶片段;IgG:免疫球蛋白G;VL:轻链可变区;VH:重链可变区;CL:轻链恒定区;CH1:重链恒定区1;CH2:重链恒定区2;CH3:重链恒定区3;SS:二硫键。
Rituximab的治疗机理是通过抗体依赖的细胞毒作用、补体介导的细胞毒作用以及抗原-抗体结合后诱导的细胞凋亡, 抑制NHL细胞的生长[9]。
随着对CD20研究的深入, rituximab也有应用于慢性淋巴细胞性白血病、类风湿性关节炎及多种自身免疫性疾病治疗的报道[10], 其治疗机制多与rituximab结合CD20后引起B细胞数量下调有关。
-
Hayden-Ledbetter等[11]制备了靶向 CD20 的单链二聚体重组rxituximab片段 TRU-015, 由单链抗原结合部位、人免疫球蛋白 G 铰链区、重链恒定区2和重链恒定区3组成, 分子质量为 104×103。研究显示, 与全分子rituximab单抗相比, TRU-015 去除了重链恒定区1和轻链恒定区, 分子质量降低, 既增强了其在肿瘤组织中的穿透力, 也降低了免疫原性。裸鼠接种瘤细胞 7~8 d后, 构建 Ramos 细胞和 Daudi 细胞两种 NHL 移植瘤模型, 分别静脉注射相同剂量(100μg)的TRU-015、rituximab及人免疫球蛋白G, 结果显示, TRU-015治疗Ramos细胞和Daudi细胞移植瘤小鼠的平均存活时间分别为28 d和56 d, rituximab分别为13 d和29 d, 免疫球蛋白G分别为8 d和14 d, 表明TRU-015治疗NHL移植瘤的效果明显优于rituximab和人免疫球蛋白G。
Rossi等[12]采用Dock-and-Lock方法制备了Hex-hA20、Tri-hA20和Tetra-hA20等3种重组抗CD20单抗, 它们的组成分别为6个Fab结合1个Fc、3个Fab聚合及4个Fab聚合, 并构建了重症联合免疫缺陷小鼠淋巴瘤模型, 经竞争性酶联免疫吸附测定证实, Hex-hA20对CD20的亲和力是人源化抗CD20单抗veltuzumab的3倍; Hex-hA20对Raji、Ramos、Daudi等3种NHL细胞的半效应浓度分别为0.064 nmol/L、0.15 nmol/L、0.15 nmol/L, 而Veltuzumab均 > 10 nmol/L; 检测Raji细胞的24 h凋亡率, 3种重组单抗为12%~16%, veltuzumab为6%~9%, 而未经处理的对照组为3%。此外, 3种重组单抗还能介导同型分子的聚集及抑制细胞的钙动员, 从而有效抑制NHL细胞的生长。
-
放射免疫治疗(radioimmunotherapy, RIT)是指用能发射β或α粒子的放射性核素标记抗体, 然后引入体内, 通过抗原-抗体的特异性结合反应, 实现放射性核素对靶组织的高选择性内照射治疗。淋巴瘤细胞对射线有较高的敏感性, 这为应用RIT方法开展针对NHL细胞CD20的治疗奠定了理论基础。
-
目前, 用于RIT的放射性核素主要有131Ⅰ、90Y、177Lu、211At、213Bi、149Tb等。131Ⅰ主要发射β射线, 半衰期为8.04 d, 射线平均能量为183 keV, 最大能量为807MeV, 在组织内平均射程为0.4mm, 由于其射线能量较低, 故多用于体积较小或转移病灶; 但是, 131Ⅰ还发射364 keV的高能γ射线, 给辐射防护带来一定困难, 因此131Ⅰ并非理想的治疗用核素。90Y发射单纯β射线, 半衰期为2.7 d, 其射线平均能量为935 keV, 最大能量为2.280MeV, 组织内平均射程为2.5mm, 由于射线能量较高, 90Y多用于体积较大的病灶。177Lu的半衰期为6.7 d, 发射的β射线平均能量为133 keV, 最大能量为497 keV, 组织内最大射程 < 0.2mm, 适用于体积小或转移病灶; 177Lu还发射113~208 keV的γ射线, 适用于SPECT。
211At、213Bi和149Tb均为α衰变核素(表 1), α粒子的线性能量转移约为β粒子的400倍, 因此, α衰变核素是靶向内照射治疗效率最高的核素。由于α粒子的电离辐射作用极强, 因此, 如何提高α衰变核素在靶组织的特异性高浓聚结合, 同时有效避免对正常组织的损伤, 是α衰变核素内照射治疗研究亟待解决的问题。
核素 半衰期(h) 射线能量(MeV) 射程(|xm) LET (keV/fjLm) 21IAt 7.2 6.8 55.8 98.8 213Bi 1.0 7.8 87.0 110.0 149Tb 4.1 3.5 28.0 142.0 注:表中,LET为传能线密度。 表 1 α衰变核素211At、213Bi、149Tb的物理特性
-
Leahy等[13]评价了131Ⅰ-rituximab对91例NHL患者的疗效: 静脉注射131Ⅰ-rituximab 1.36~5.34GBq, 全身吸收剂量0.75Gy。90 d后采用Kaplan-Meier法评价疗效, 结果显示: 总缓解率约76%, 其中完全缓解和未经证实完全缓解约53%;总体中位无进展生存期约13个月, 完全缓解患者与部分缓解患者的中位无进展生存期分别约20个月和7个月; 平均随访23个月, 总体中位生存期约50个月, 4年生存率约59%, 其中完全缓解患者的生存时间明显长于药物无反应者; 不良反应以血小板和中性粒细胞减少常见。
Hainsworth等[14]评价了90Y-替伊莫单抗(90Y-ibritumomab tiuxetan)对41例NHL患者的疗效: 患者在0~4周静脉注射Rituximab, 剂量为375mg/m2, 5~13周行Rituximab联合化疗(CHOP方案: 环磷酰胺、阿霉素、长春新碱、泼尼松, 或COP方案: 环磷酰胺、长春新碱、泼尼松或), 第14周完全缓解率为30%;第15周静脉注射90Y-ibritumomab tiuxetan, 剂量为(1.11~1.48)×104Bq/kg, 第28周完全缓解率为72%。该组患者平均随访67个月, 5年无进展生存率和存活率分别为64%和96%, 不良反应仍以血小板和中性粒细胞减少为常见。
Forrer等[15]用177Lu标记1, 4, 7, 10-四氮杂环十二烷-N, N', N'', N'''-四乙酸(1, 4, 7, 10-tetraazacyclododecane-N, N', N'', N'''-tetraacetic Acid, DOTA)-rituximab, 制备得到177Lu-(DOTA)4-rituximab。在pH 5.0~6.0、37℃条件下, 标记率 > 99%, 室温放置7 d后, 用高效液相色谱法测定标记物放化纯 > 97%;将人CD20 cDNA转染至小鼠L-VB1细胞, 流式细胞仪测定177Lu-(DOTA)4-rituximab与CD20阳性的L-VB1细胞的免疫结合率 > 70%;对NHL患者静脉注射1110~1480MBq177Lu-(DOTA)4-rituximab前及注射后4 d分别行18F-FDGPET, 结果显示, 治疗后肿瘤部位18F-FDG浓聚减低。与131Ⅰ和90Y相比, 177Lu发射β射线的能量适中、射程较短、线性能量转移较高, 因此, 177Lu-(DOTA)4-rituximab治疗NHL具有效率高、对正常组织损伤小等优点。此外, 还可同时应用SPECT监测其在体内的分布。
Beyer等[16]在pH为5.5条件下制备149Tb-环己基-二亚乙基三胺五乙酸-rituximab, 薄层色谱法测定其标记率 > 99%;对重症联合免疫缺陷小鼠静脉注射5×106Daudi细胞构建淋巴瘤模型, 2 d后, 实验组静脉注射5.5MBq149Tb-rituximab(5μg), 对照组1和对照组2分别静脉注射5μg和300μg rituximab, 对照组3不给予治疗, 结果显示: ①89%的实验组小鼠存活时间 > 120 d, 处死后组织切片未发现病理改变, 其余11%小鼠于48 d内死亡, 解剖发现有腹部肿瘤生长; ②对照组1的小鼠最长存活时间为43 d, 17%小鼠肉眼发现肿瘤生长, 83%出现瘫痪或体质量明显减轻; ③对照组2的小鼠最长存活时间为116 d, 全部有肿瘤生长; ④未经治疗组小鼠37 d全部死亡, 50%肉眼发现肿瘤生长, 50%出现瘫痪或体质量明显减轻。结果表明, 149Tb-环己基-二亚乙基三胺五乙酸-rituximab对NHL的疗效优于rituximab。
针对NHL细胞膜表面CD20的免疫治疗及RIT均属生物分子治疗范畴, 应遵循个体化治疗原则。然而, 临床上仍有部分NHL患者肿瘤细胞表面不表达或低表达CD20, 因此, 在体显示和评价NHL患者瘤细胞CD20的表达有助于预测针对其进行的免疫治疗和RIT疗效, 为个体化治疗提供依据。
-
RII是指用放射性核素标记特定的单克隆抗体, 注入体内后能与相关抗原特异性结合而使其显影, 对病变进行定位和定性诊断, 并为免疫治疗和放射免疫治疗提供客观依据。
传统的67Ga肿瘤显像诊断NHL特异性差、敏感性低、显像时间长, 已逐步被18F-FDG PET所取代。18F-FDG PET检测淋巴瘤敏感性高, 可实现早期诊断、准确的临床分期、探测复发与转移灶、鉴别肿瘤复发与瘢痕、早期评价放化疗效果、指导骨髓穿刺活检等, 此外, 18F-FDG PET对小淋巴结及结外病变的检出率优于CT, 对指导临床治疗NHL具有重要意义[17-18]。然而, 18F-FDG是非特异性显像剂, 炎症、感染及活动性结核等良性病变也能摄取18F-FDG, 易造成假阳性; 一些低度恶性淋巴瘤代谢活性低(如小B细胞性淋巴瘤), 摄取18F-FDG不明显, 易造成假阴性[19-20]。应用放射性核素标记抗CD20单抗, 制备高选择性的NHL显像剂, 不仅有助于提高NHL诊断的特异性, 同时也为NHL的免疫治疗及放免治疗提供客观依据。目前, 用于NHL放免显像的核素主要有99Tcm和124Ⅰ等。99Tcm发射单纯γ射线, 能量为141 keV, 半衰期为6.02 h; 124Ⅰ是正电子核素, 半衰期为4.2 d。
Stopar等[21]将rituximab与亚甲基二膦酸盐、氟化亚锡、氨基苯甲酸的溶液混合, 用302 nm紫外线照射20min, 室温下加入高锝酸盐, 温育1 h, 得到99Tcm-rituximab, 其标记率 > 95%, 免疫活性 > 93.3%。对NHL患者静脉注射500~600 MBq99Tcmrituximab, 分别于注射后3 h、6 h、20 h显像, 结果显示: 血池、肝、肾、脾显影, 肿瘤部位显像剂浓聚随时间逐渐增多, 为评估NHL患者肿瘤细胞表面CD20的表达提供了一种无创性影像诊断方法[22]。但该显像剂存在肿瘤清晰显影的时间长、软组织本底高等不足, 这与rituximab分子质量大、肿瘤组织穿透能力弱等有关。
Olafsen等[23]设计、制备了单链抗原结合部位-重链恒定区3(single-chain Fv-CH3, scFv-CH3)二聚体(分子质量为80×103)和单链抗原结合部位-结晶片段(single-chain Fv-Fc, scFv-Fc)二聚体(分子质量为105×103)两种rituximab的重组片段, 通过Iodogen碘化法进行124Ⅰ标记, 标记率分别为84.9%和80.9%;小鼠淋巴瘤模型PET显示, 这两种标记的重组片段均能快速、特异性浓聚于CD20阳性肿瘤组织; 静脉注射124Ⅰ-scFv-CH321 h后, 肿瘤与肝、脾、肾、肺及血池的T/NT值为4.8~14.3, 明显优于124Ⅰ-scFv-Fc的3.3~4.7, 这是因为: ①scFv-CH3可与巨噬细胞、中性粒细胞及嗜酸性粒细胞的Fc受体相互作用, 血液中半清除期较长、肿瘤摄取较高, 而scFv-Fc的Fc区域有两个突变区, 不能与Fc受体相互作用, 血清半衰期短; ②scFv-CH3的分子质量小, 组织穿透能力强, 血液清除快。Olafsen等[24]合成了仅由轻链可变区、重链可变区、连接肽及C端的一个半胱氨酸组成的抗CD20 scFv二聚体(分子质量约50×103), 同样采用Iodogen法进行124Ⅰ标记, 标记率为78.9%~85.6%;对B细胞淋巴瘤小鼠静脉注射后8 h PET显示, 肿瘤可清晰显影, 肿瘤与各主要脏器的T/NT值为1.2~3.7。T/ NT值不高的原因可能与重组片段分子结构改变后引起亲和力的下降有关。
目前, 针对CD20的99Tcm标记的RII存在显像时间过长, 而124Ⅰ标记需分离纯化且难以推广应用等不足。因此, 针对CD20胞外段筛选特异结合的多肽作为核医学分子显像探针, 通过降低分子质量、加快血液清除速度、提高穿透力、缩短显像时间、提高T/NT值, 是未来NHL患者个体化诊疗的关键和发展方向。
非霍奇金淋巴瘤的CD20分子显像及靶向治疗研究进展
Progress of study on the molecular imaging and targeted therapy in CD20 of non-Hodgkin's lymphoma
-
摘要: 应用放射性核素标记B淋巴细胞分化抗原CD20单抗或其重组片段,在分子水平实现对非霍奇金淋巴瘤(NHL)显像和治疗,这将成为提高患者生存率的有效手段。该文介绍了CD20表面抗原的生物学特性及NHL抗CD20单抗的免疫治疗、放射免疫治疗以及放射免疫显像的研究进展。Abstract: The molecular imaging and targeted therapy with radiolabeled anti-CD20 monoclonal antibody or recombinant anti-CD20 monoclonal antibody fragments is the effective methods to improve the survival rate for non-Hodgkin's lymphoma(NHL).This article reviews the biological characteristics of CD20 and the immunotherapy, radioimmunotherapy, radioimmunoimaging with anti-CD20 monoclonal antibody for NHL.
-
Key words:
- Non-Hodgkin's lymphoma /
- Cluster of differentiation 20 /
- Rituximab /
- Immunotherapy /
- Radioimmunoimaging
-
表 1 α衰变核素211At、213Bi、149Tb的物理特性
核素 半衰期(h) 射线能量(MeV) 射程(|xm) LET (keV/fjLm) 21IAt 7.2 6.8 55.8 98.8 213Bi 1.0 7.8 87.0 110.0 149Tb 4.1 3.5 28.0 142.0 注:表中,LET为传能线密度。 -
[1] 任金马, 蓝绍颖. 恶性淋巴瘤的流行病学研究进展. 南通医学院学报, 2003, 23(4): 523-525. doi: 10.3969/j.issn.1674-7887.2003.04.122
[2] 刘银星, 杨纯正. CD20分子与靶向治疗. 生命的化学, 2003, 23(1): 60-61. doi: 10.3969/j.issn.1000-1336.2003.01.024
[3] Du J, Wang H, Zhong C, et al. Structural basis for recognition of CD20 by therapeutic antibody rituximab. J Biol Chem, 2007, 282(20): 15073-15080. doi: 10.1074/jbc.M701654200 [4] Jacobs SA, Foon KA. The expanding role of rituximab and radioimmunotherapy in the treatment of B-cell lymphomas. Expert Opin Biol Ther, 2007, 7(11): 1749-1762. doi: 10.1517/14712598.7.11.1749 [5] Arzoo K, SadeghiS, Liebman HA. Treatment of refractory antibody mediated autoimmune disorders with an anti-CD20 monoclonal antibody(rituximab). Ann Rheum Dis, 2002, 61(10): 922-924. doi: 10.1136/ard.61.10.922 [6] 李禹兵, 刘延香, 路喻清. 非霍奇金淋巴瘤的研究进展. 现代肿瘤医学, 2010, 18(3): 620-624. doi: 10.3969/j.issn.1672-4992.2010.03.077
[7] Boye J, Elter T, Engert A. An overview of the current clinical use of the anti-CD20 monoclonal antibody rituximab. Ann Oncol, 2003, 14(4): 520-535. doi: 10.1093/annonc/mdg175 [8] Du J, Wang H, Zhong C, et al. Crystal structure of chimeric antibody C2H7 Fab in complex with a CD20 peptide. Mol Immunol, 2008, 45(10): 2861-2868. doi: 10.1016/j.molimm.2008.01.034 [9] Glennie MJ, French RR, CraggMS, et al. Mechanisms of killing by anti-CD20 monoclonal antibodies. Mol Immunol, 2007, 44(16): 3823-3837. doi: 10.1016/j.molimm.2007.06.151 [10] Goldblatt F, Isenberg DA. Anti-CD20 monoclonal antibody in rheumatoid arthritis and systemic lupus erythematosus. Handb Exp Pharmacol, 2008, 181: 163-181. [11] Hayden-Ledbetter MS, Cerveny CG, Espling E, et al. CD20-directed small modular immunopharmaceutical, TRU-015, depletes normal and malignant B cells. Clin Cancer Res, 2009, 15(8): 2739-2746. doi: 10.1158/1078-0432.CCR-08-1694 [12] Rossi EA, Goldenberg DM, Cardillo TM, et al. Novel designs of multivalent anti-CD20 humanized antibodies as improved lymphoma therapeutics. Cancer Res, 2008, 68(20): 8384-8392. doi: 10.1158/0008-5472.CAN-08-2033 [13] Leahy MF, Seymour JF, Hicks RJ, et al. Multicenter phase Ⅱ clinical study of iodine-131-rituximab radioimmunotherapy in relapsed or refractory indolent non-Hodgkin's lymphoma. J Clin Oncol, 2006, 24(27): 4418-4425. doi: 10.1200/JCO.2005.05.3470 [14] Hainsworth JD, Spigel DR, Markus TM, et al. Rituximab plus short-duration chemotherapy followed by Yttrium-90 Ibritumomab tiuxetan as first-line treatment for patients with follicular non-Hodgkin lymphoma: a phase IItrial of the Sarah Cannon Oncology Research Consortium. Clin Lymphoma Myeloma, 2009, 9(3): 223-228. doi: 10.3816/CLM.2009.n.044 [15] Forrer F, Chen J, FaniM, et al. In vitro characterization of177Luradiolabelled chimeric anti-CD20 monoclonal antibody and a preliminary dosimetry study. Eur J Nucl Med and Mol Imaging, 2009, 36(9): 1443-1452. doi: 10.1007/s00259-009-1120-2 [16] Beyer GJ, Miederer M, Vranjes-Duri S, et al. Targeted alpha therapy in vivo: direct evidence for single cancer cell kill using 149Tb-rituximab. Eur J Nucl Med Mol Imaging, 2004, 31(4): 547-554. doi: 10.1007/s00259-003-1413-9 [17] Cronin CG, SwordsR, TruongMT, et al. Clinicalutility of PET/CT in lymphoma. AJR Am J Roentgenol, 2010, 194(1): W91-W103. [18] Hutchings M, Barrington SF. PET/CT for therapy response assessment in lymphoma. J Nucl Med, 2009, 50 (Suppl1): 21S-30S. [19] Juweid ME. Utility of positron emission tomography(PET)scanning in managing patients with Hodgkin lymphoma. Hematology Am Soc Hematol Educ Program, 2006, 501(1): 259-265. [20] Kazama T, Faria SC, Varavithya V, et al. FDG PET in the evaluation of treatment for lymphoma: clinical usefulness and pitfalls. Radiographics, 2005, 25(1): 191-207. doi: 10.1148/rg.251045045 [21] Stopar TG, Mlinaric-Rascan I, Fettich J, et al. 99mTc-rituximab radiolabelled by photo-activation: a new non-Hodgkin's lymphoma imaging agent. Eur J Nucl Med Mol Imaging, 2006, 33(1): 53-59. doi: 10.1007/s00259-005-1838-4 [22] Gmeiner Stopar T, Fettich J, Zver S, et al. 99mTc-labelled rituximab, a new non-Hodgkin's lymphoma imaging agent: first clinical experience. Nucl Med Commun, 2008, 29(12): 1059-1065. [23] Olafsen T, Betting D, Kenanova VE, et al. Recombinant anti-CD20 antibody fragments for small-animal PET imaging of B-cell lymphomas. J Nucl Med, 2009, 50(9): 1500-1508. [24] Olafsen T, Sirk SJ, Betting DJ, et al. ImmunoPET imaging of B-cell lymphoma using 124Ⅰ-anti-CD20 scFv dimers (diabodies). Protein Eng, Des Sel, 2010, 23(4): 243-249. doi: 10.1093/protein/gzp081 -





 下载:
下载: