-
目前, 肺癌已成为我国最常见、发病率增幅最大的恶性肿瘤之一, 其生存率与其临床分期密切相关。X线片、CT和MRI能精确定位肺癌及评估其范围及大小, 但定性价值有限; PET对肺癌诊断准确性较高, 但检查费用高、药物来源不便, 限制了其临床应用。因此, 寻求敏感性高、特异性好的无创性诊断手段, 对尽早明确治疗方案尤为重要。
生长抑素受体(somatostatin receptor, SSTR)作为肿瘤的基因型标志之一, 在神经内分泌源性肿瘤及一些非神经内分泌源性肿瘤细胞膜上都有高度表达, 生长抑素及其类似物(somatostatin analogue, SSTA)能与细胞膜上的SSTR特异性结合, 从而产生一系列抑制体内激素释放及细胞增殖等生物学效应[1]。因此, 放射性核素标记SSTA的受体显像对肿瘤的诊断具有很高的特异性和敏感性。近年来, 国内外有关99Tcm标记的新型SSTA99Tcm-depreotide的肿瘤受体显像研究已成为热点, 而目前国内尚无有关99Tcm-depreotide合成的报道。本实验采用直接标记法, 以SnCl2作为还原剂, 在不同条件下对自行合成的depreotide进行99Tcm标记, 通过对比标记率筛选出最佳标记条件, 并通过99Tcm-depreotide与人肺腺癌A549细胞的体外结合实验, 探讨99Tcmdepreotide与肺癌细胞受体的特异性结合机制。
-
Depreotide分子由两部分组成, 一部分是与SSTR结合的环肽cyclo-[(N-Me)Phe-Tyr-D-Trp-Lys-Val-Hcy], 另一部分则是与核素螯合的线性肽β-Dap-Lys-Cys-Lys。本实验采用芴甲氧羰酰基固相合成法先分别合成两个多肽片段, 再用液相法连接两个片段, 最后脱去侧链保护基芴甲氧羰酰基, 经反相高效液相色谱(Agillent 1100, Agillent公司)纯化, 质谱分析, 得到目标产物depreotide。
-
采用直接标记法用99Tcm标记depreotide。将20μg depreotide加入2 ml0.2 mol/L磷酸盐缓冲液(pH分别为5.0、6.0、7.0, 每pH点重复3组, 共9组)溶液中, 充分混匀后依次加入1 ml(1000~1200 MBq)99TcmO4-淋洗液(上海原普同位素科技有限公司)、25μl新鲜配制的SnCl2溶液, 反应条件见表 1, 其中, 反应温度分别为15℃、37℃、50℃, 并与不同pH组配对成9组, 反应时间均为30 min。
1 2 3 4 5 6 7 8 9 磷酸盐缓冲液
pH值5.0 5.0 5.0 6.0 6.0 6.0 7.0 7.0 7.0 温度(℃) 15 37 50 15 37 50 15 37 50 表 1 99Tcm标记depreotide的反应条件(9组)
-
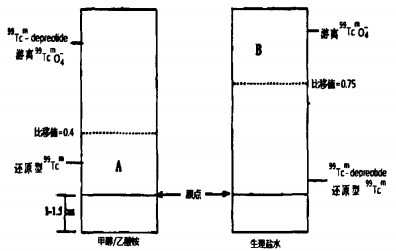
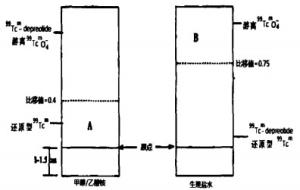
采取纸层析法测定标记率, 用游离99TcmO4-作为对照点样, 分别采用以下两种系统进行层析: (1) 生理盐水系统: 99Tcm-depreotide和还原型99Tcm位于原点附近(比移值=0~0.4), 游离99TcmO4-位于前沿(比移值=0.8~1.0);(2)甲醇/乙酸铵(methanol/ ammonium acetate, MAA)(购自上海吉尔生化有限公司)系统: 还原型99Tcm位于原点附近(比移值=0~0.3), 99Tcm-depreotide和游离99TcmO4-位于前沿(比移值=0.7~1.0)。
当样品达到层析纸另一边边缘时取出晾干, 将晾干的层析纸沿虚线剪开, 用γ免疫计数器(科大创新股份有限公司, 安徽合肥)测定放射性计数, 计算标记率。
-
室温下, 用自制的Sephadex G25柱纯化标记物。将磷酸盐缓冲液(pH=5.8, 0.2mol/L)和15%乙醇的混合液作为洗脱液, 以8滴/min的速度洗脱, 收集洗脱液(约0.5 ml/管)并测定各管的放射性计数, 用紫外分光光度计测定每管的A280值。
-
测定纯化后的99Tcm-depreotide放化纯, 具体步骤同标记率检测。标记物于室温下放置4 h后再测定其放化纯, 以判断其稳定性。
-
将人肺腺癌A549细胞株(上海细胞生物研究所提供)加入培养瓶中, 用适量的RPMI1640培养基(购自美国Hyclone公司)在37℃、5%CO2培养箱中培养, 每3 d换液一次, 用0.25%胰蛋白酶+ 0.02%乙二胺四乙酸消化传代, 待细胞总数满足实验要求后, 以2×105/孔的细胞浓度接种于48孔细胞培养板中, 当细胞生长至单层接触融合时, 吸弃培养基, 用磷酸缓冲液清洗2次后备用。
-
在每孔A549细胞中加入200μl新鲜RPMI-1640培养基及100μl99Tcm-depreotide(37 MBq/L, 无菌滤膜处理过), 分别在4℃、25℃、37℃条件下温育20、40、60、120 min后, 迅速移去培养基并用4℃磷酸缓冲液(pH=7.4)洗涤2次终止反应, 用0.25%胰蛋白酶消化细胞, 300×g离心5min, 沉淀计数。分别计算不同温度和不同温育时间下细胞对99Tcm-depreotide的摄取率: 肿瘤细胞摄取率(%)=(沉淀放射性计数/总放射性计数)×100%。
-
在每孔A549细胞中加入200μl新鲜RPMI-1640培养基及100μl99Tcm-depreotide(37MBq/L), 分别在4℃、25℃及37℃下培养2 h, 待其摄取达到最大值时, 迅速移去培养基并用4℃磷酸缓冲液(pH=7.4)洗涤2次终止反应。重新加入200μl新鲜培养基, 在4℃及37℃下培养, 分别于0、15、30、60、90 min时取样(步骤同摄取实验), 并测定放射性计数。
-
所有数据点用3个平衡样, 采用SPSS 12.0软件对结果进行统计学分析, 实验数据用均值±标准差(x±s)表示, P > 0.05被认为差异无统计学意义, P < 0.05被认为差异有显著统计学意义, P < 0.01被认为差异有非常显著统计学意义。
-
反相高效液相色谱法分析结果表明, 产物纯度为95.29%。经质谱鉴定, 该产物分子质量为1368u, 证实该产物为depreotide。
-
如图 1所示, 将晾干的层析纸沿虚线剪开, 分别计算以下两个数值。
A=(A段层析纸计数/MAA层析纸总计数)×100%
B=(B段层析纸计数/生理盐水层析纸总计数)×100%
99Tcm-depreotide标记率=100%-(A+B)
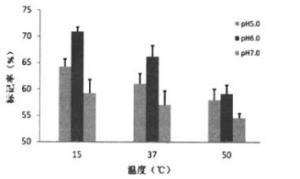
计算不同温度和不同pH值缓冲液实验组的标记率, 同一实验组包括3个样本, 用x ±s表示各组标记率(表 2), 并绘制柱状图(图 2)。观察图 2各组标记率变化可知, 不同温度和不同pH值缓冲液下的标记率有所差异。
15℃ 37℃ 50℃ pH5.0 64.28±1, 38 61.05±1.87 58.02±2.00 pH6.0 70:95±0.84 66.19±2.06 59.11±1.65 pH7.0 59.22±2.62 57.09±2.55 54.61±0.80 表 2 不同时间和pH值反应条件下的99Tcm-depreotide标记率[(x ±s)%]
-
由图 2可见, 相同温度下, 缓冲液pH=6.0实验组的标记率高于pH=5.0和pH=7.0两实验组, 随着温度逐渐升高, 各实验组标记率的差异有缩小的趋势。由表 2可见: 15℃时, pH6.0组的标记率显著高于pH5.0组、pH7.0组(t=7.15, t=7.38, P均 < 0.01);37℃时, pH6.0组标记率也高于pH5.0和pH7.0组(t=3.19, P < 0.05;t=4.80, P < 0.01);50℃温度下, pH6.0组的标记率与pH5.0组的差异无统计学意义(t=0.872, P > 0.05), 但仍高于pH7.0组(t= 4.256, P < 0.05)。
-
观察图 2可知, 随着反应温度由15℃逐渐升高到50℃, 相同pH实验组的标记率均呈下降趋势, 其中以pH=6.0实验组变化最为明显, 平均标记率下降了11.84%;pH=7.0实验组变化最小, 平均标记率下降了4.61%。由表 2可见: 在pH6.0环境下, 15℃组的标记率显著高于37℃组(t=4.78, P < 0.05), 后者更显著高于50℃组(t=6.01, P < 0.01); 在pH5.0环境下, 15℃和37℃实验组的标记率也均高于50℃组(t=5.76, P < 0.01; t=2.47, P < 0.05);在标记率随温度变化趋势最小的pH7.0环境下, 15℃组标记率也显著高于50℃组(t=3.76, P < 0.05)。
-
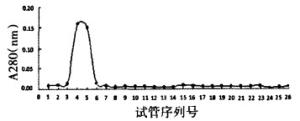
标记物经Sephadex G25层折柱分离后, 测量各管放射性计数, 结果显示, 洗脱曲线有两个峰, 第一峰为99Tcm-depreotide, 第二峰为游离的99TcmO4-(图 3)。用紫外分光光度计检测各时相管产品溶液, 仅有一个峰, 对应图 3中的第一峰(图 4), 为99Tcm-depreotide。
-
测定纯化后的99Tcm-depreotide的放化纯, 结果显示其放化纯达90.21%。室温(15℃)下放置4 h后测定其放化纯为87.31%。
-
不同温度和不同时间点测得的A549细胞对99Tcm-depreotide的摄取率见表 3所示。在4℃及25℃条件下, 随着时间的延长, A549细胞对99Tcmdepreotide的摄取率呈现逐渐增高的趋势; 而在37℃条件下, 摄取峰值发生在60 min, 之后随着时间的延长摄取率有所下降。在相同的时间点, 摄取率随温度的升高逐渐增加。
时间
(min)样本
数温度(℃) 4 25 37 20 5 7.247±0.216 14.811±0.183 15.493±0.170 40 5 11.393±0.550 15.403±0.238 16.030±0.091 60 5 13.393±0.335 16.383±0.115 20.750±0.481 120 5 14.650±0.457 18.463±0.352 18.917±0.093 表 3 不同时间和温度下肺腺癌A549细胞对99Tcmdepreotide的摄取率[(x ±s)%]
-
99Tcm-depreotide在A549细胞中的滞留率见表 4所示。99Tcm-depreotide在A549细胞中清除迅速, 15 min时, 细胞滞留率分别为62.7%(4℃)和63.58%(37℃), 两组数据之间差异无统计学意义(t=0.669, P > 0.05)。但在30 min、60 min、90 min时, 37℃实验组的滞留率差异有统计学意义(t=3.110, P < 0.05;t=2.648, P < 0.01;t=3.340, P < 0.01)。
时间
(min)样本
数温度(℃) 4 25 37 0 5 100 100 100 15 5 62.70±1.97 63.24±2.21 63.58±2J9 30 5 52.94±2.89 53.47±2.12 58.13±2.35 60 5 41.99±2.97 44.20±2.85 46.76±2.72 90 5 26.53±1.97 28.91±2.35 31.83±2.92 表 4 不同时间和温度下99Tcm-depreotide在肺腺癌A549细胞中的滞留率[(x ±s)%]
-
放射性核素标记的多肽受体显像是核医学中最年轻、最有活力的分支领域之一, 其中多肽受体显像剂depreotide是近年来合成的一种新的SSTA, 它由一段SSTR识别的环六肽和一段可与金属螯合的四肽链连接而成。与奥曲肽(octreotide)相比较, depreotide是一种不含二硫键的环状SSTA, 在标记过程中可避免二硫键发生还原性断裂的可能; 其结构中一段含半胱氨酸的三肽序列为Tc5+提供了配位电子, 因而容易被99Tcm标记[2-3]; 此外, depreotide被肿瘤摄取的浓度更高, 而且由于其主要经肾脏排泄, 肝脏吸收低, 显像质量优于奥曲肽[4]。99Tcmdepreotide与SSTR2、SSTR3、SSTR5的亲和力高于99Tcm-奥曲肽[5], 更适于肺癌尤其是非小细胞肺癌的肿瘤显像。
目前, 国内外对核素标记比较常用的方法大致有3种[6], 第一种是直接标记法, 是用还原剂打开分子内的二硫键, 形成两个疏基(-SH), 从而很容易与99Tcm结合。此法简单易行, 且不需要对相关基团进行保护或脱保护, 产率较高, 但是直接法只能对具有二硫键的环状肽进行标记, 此外由于二硫键桥内多数存在多肽的生物活性基团, 破坏二硫键桥会使多肽与受体的亲和力降低4个数量级[7]。第二种是间接法中的后标法, 即用99Tcm标记前先在多肽的末端氨基酸上连接一个双功能螯合剂, 此法对含和不含二硫键的环状肽都适用, 但此法制备过程长而复杂。第三种是针对环状肽的直接标记法, 该法简单可靠。由于活性基团大都位于环状肽结构内, 99Tcm只是结合到人工合成并附加在肽键非活性中心基团的氨基酸序列上, 以维持生物活性基团构型, 不会影响肽与受体的亲和力。由于depreotide不含二硫键结构, 且在同型半胱氨酸侧链上连接着具有单胺-二酰胺-硫螯合体结构的-β-Dap-Lys-Cys-序列, 可以向99Tcm提供配对电子, 因此采用直接标记法在理论上不会使多肽失去生物活性。
本研究采用直接标记法, 通过改变标记时的反应温度和缓冲液的pH值比较不同条件下99Tcmdepreotide的标记率变化, 进而筛选出最适合的标记温度和缓冲液pH值。我们选择纸层析法测定标记率, 展开剂包括生理盐水和MAA两种体系, 将实验数据对比分析后发现, 不同温度和pH值对标记率的影响比较明显, 在相同的温度下, 缓冲液pH=6.0实验组的标记率高于pH=5.0和pH=7.0两实验组; 但随着反应温度由15℃逐渐升高到50℃, 各pH实验组的标记率皆有所下降, 且标记率的差异有缩小的趋势, 这可能是由于随着温度的升高, depreotide的稳定性发生了变化, 导致不同pH实验组的标记率差异不明显。此外, 随着温度的升高, pH=6.0实验组标记率变化最为明显, 平均标记率下降了11.84%;而pH=7.0实验组变化最小, 平均标记率下降了4.61%。由此可见, 99Tcm标记depreotide的温度不宜太高, 反应缓冲液pH值宜偏酸, 这些条件有利于保持depreotide的稳定性, 进而保证较高的标记率。
细胞实验的数据显示, A549细胞与SSTR有较好的亲和力, 从而间接说明了肺癌的细胞表面有SSTR表达, 这与Virgolini等[5]学者的观点一致。细胞实验结果表明, 标记后的99Tcm-depreotide仍保持良好的生物活性, A549细胞对99Tcm-depreotide有较好的亲和力, 其摄取和内化具有一定的温度依赖性, 细胞实验反应体系的最适温度为37℃, 而这正接近人体的生理状态, 这一实验数据有利于今后有关99Tcm-depreotide临床试验的开展。在37℃下, A549细胞摄取99Tcm-depreotide的高峰在60 min, 相对于111In-奥曲肽显像时间为注射显像剂后24 h, 99Tcm-depreotide更易成像。同时, A549细胞对99Tcm-depreotide的清除迅速而且没有明显的温度依赖性, A549细胞摄取99Tcm-depreotide达最大值后的半清除时间为48 min, 表明99Tcm-depreotide具有较好的生物降解性, 不会积聚于细胞内而产生细胞毒性, 适用于受体显像。综上所述, 纯化后的99Tcm-depreotide的放化纯达到90.21%, 在室温15℃下放置4 h后, 放化纯仍保持为87.31%, 表明99Tcm-depreotide的稳定性较好。细胞实验显示, 99Tcm-depreotide与肺腺癌细胞在人体温度的反应条件下具有较好的受体结合特异性, 这为进一步临床应用研究提供了可靠的参数。
本研究的不足之处在于没有同时进行动物肿瘤显像实验, 我们将在下一步的研究中进行99Tcmdereotide的动物体内生物学分布实验及显像研究。
99Tcm标记depreotide及与肺腺癌A549细胞亲和性研究
Experimental studies of depreotide labeled with 99Tcm and the affinity with human lung adenocarcinoma cell line A549
-
摘要:
目的 筛选99Tcm标记depreotide的最佳条件,并通过99Tcm-depreotide与人肺腺癌A549细胞结合特性的研究,评价其作为肿瘤生长抑素受体显像剂的可靠性。 方法 ① 采用直接标记法,在不同pH值(5.0、6.0、7.0)的磷酸缓冲溶液和不同温度(15℃、37℃、50℃)条件下对depreotide进行99Tcm标记,以纸层析法测定标记率,并通过对比分析,筛选出最佳标记条件。②采用受体放射分析法,分别在不同温度下将99Tcm-depreotide与A549细胞孵化,分析不同温度在A549细胞对99Tcmdepreotide摄取率和滞留率中的作用。 结果 ① 相同温度下,缓冲液pH=6.0时,99Tcm与depreotide的标记率高于pH=5.0和pH=7.0两组;随着反应温度由15℃逐渐升高到50℃,各pH实验组的标记率呈不同程度下降。②A549细胞对99Tcm-depreotide的摄取率随温度的升高逐渐增加,在37℃时,摄取峰值时间在60 min;对99Tcm-depreotide的清除速度不依赖于温度,37℃时的半清除时间为48 min。 结论 在低温(< 15℃)和弱酸性环境下,99Tcm直接标记depreotide的标记率高,稳定性好。在37℃时,A549细胞特异性结合99Tcm-depreotide,具有适于受体显像的摄取峰值时间和半清除时间。 -
关键词:
- 受体, 生长抑素 /
- 同位素标记 /
- 肺肿瘤 /
- 99Tcm-地普奥肽
Abstract:Objective To establish a simple and reliable method of making 99Tcm-depreotide by direct labeling.Furthermore, to investigate 99Tcm-depreotide's specific receptor binding properties in vitro with human lung adenocarcinoma cell line A549, and to evaluate the potentiality of 99Tcm-depreotide as a somatostatin receptor imaging agent for lung cancer. Methods ① Depreotide was labeled with 99Tcm through a direct labeling using SnCl2as reductant.Compared the labeling efficiency in different pH and temperature, then searched the best labeling method.Assessed the radiochemical purity and stability in vitro.②Using radioreceptor assay, it was observed that 99Tcm-depreotide was incubated with A549 cell and uptake kinetics, then stagnation and half time were compared at different temperature and time points, and that 99Tcm-depreotide was incubated with A549 cell the internalization and surface-bound activity were compared at 37℃ and different time points. Results ① At the same temperature, labeling rate of pH6.0 group was higher than that of pH5.0 and pH7.0 groups.At the same pH, the labeling rate of all of the three different pH experiment groups reduced with increasing temperature from 15℃ to 50℃ in this study.②The uptake rate increased with temperature at the same time point, and the peak time of maximum uptake was 60min at 37℃.The cleaning curves were similar at different temperature, and the half cleaning time at 37℃was 48 min. Conclusions When depreotide was labeled with 99Tcm, the temperature could not be too high(< 15℃) and the pH would better be less than 6.0.99Tcm-depreotid was a potential somatostatin receptor imaging agent with its appropriate the peak time of maximum uptake and the half cleaning time at37℃. -
Key words:
- Receptors, somatostatin /
- Isotope labeling /
- Lung neoplasms /
- 99Tcm-depreotide
-
表 1 99Tcm标记depreotide的反应条件(9组)
1 2 3 4 5 6 7 8 9 磷酸盐缓冲液
pH值5.0 5.0 5.0 6.0 6.0 6.0 7.0 7.0 7.0 温度(℃) 15 37 50 15 37 50 15 37 50 表 2 不同时间和pH值反应条件下的99Tcm-depreotide标记率[(x ±s)%]
15℃ 37℃ 50℃ pH5.0 64.28±1, 38 61.05±1.87 58.02±2.00 pH6.0 70:95±0.84 66.19±2.06 59.11±1.65 pH7.0 59.22±2.62 57.09±2.55 54.61±0.80 表 3 不同时间和温度下肺腺癌A549细胞对99Tcmdepreotide的摄取率[(x ±s)%]
时间
(min)样本
数温度(℃) 4 25 37 20 5 7.247±0.216 14.811±0.183 15.493±0.170 40 5 11.393±0.550 15.403±0.238 16.030±0.091 60 5 13.393±0.335 16.383±0.115 20.750±0.481 120 5 14.650±0.457 18.463±0.352 18.917±0.093 表 4 不同时间和温度下99Tcm-depreotide在肺腺癌A549细胞中的滞留率[(x ±s)%]
时间
(min)样本
数温度(℃) 4 25 37 0 5 100 100 100 15 5 62.70±1.97 63.24±2.21 63.58±2J9 30 5 52.94±2.89 53.47±2.12 58.13±2.35 60 5 41.99±2.97 44.20±2.85 46.76±2.72 90 5 26.53±1.97 28.91±2.35 31.83±2.92 -
[1] Watt HL, Kharmate G, Kumar U. Biology of somatostatin in breast cancer. Mol Cell Endocrinol, 2008, 286(1-2): 251-261. doi: 10.1016/j.mce.2008.01.006 [2] Shorr AF, Helman DL, Lettieri CJ, et al. Depreotide scanning in sarcoidosis: a pilot study. Chest, 2004, 126(4): 1337-1343. doi: 10.1016/S0012-3692(15)31315-5 [3] 王秀娟, 李险峰. 生长抑素受体肿瘤显像的临床应用及研究进展. 国际放射医学核医学杂志, 2006, 30(4): 217-219. doi: 10.3760/cma.j.issn.1673-4114.2006.04.008
[4] Van Den Bossche B, D'haeninck E, Bacher K, et al. Biodistribution and dosimetry of 99mTc-depreotide (P829) in patients suffering from breastcarcinoma. Cancer Biother Radiopharm, 2004, 19(6): 776-783. [5] Virgolini I, Leimer M, Handmaker H, et al. Somatostatin receptor subtype specificity and in vivo binding of a novel tumor tracer, 99mTc-P829. Cancer Res, 1998, 58(9): 1850-1859. [6] Liu S. Bifunctional coupling agents for radiolabeling of biomolecules and target-specific delivery of metallic radionuclides. Adv Drug Deliv Rev, 2008, 60(12): 1347-1370. doi: 10.1016/j.addr.2008.04.006 [7] Uehara T, Arano Y, Ono M, etal. The integrity of the disulfide bond in a cyclic somatostatin analog during 99mTc complexation reactions. Nucl Med Boil, 1999, 26(8): 883-89. doi: 10.1016/S0969-8051(99)00066-9 -





 下载:
下载: