-
恶性肿瘤新陈代谢速度加快,就需要新生血管提供充足的氧和营养物质来满足肿瘤生存及进展的需要。目前,抗血管疗法已成为一种常用的临床治疗恶性肿瘤的方法[1]。本研究用新西兰大白兔制作的VX2肺肿瘤模型作为实验对象,对其进行11C-胆碱、18F-FDG PET-CT对比研究,并与病理及免疫组化结果对照,以检验11C-胆碱、18F-FDG PET-CT反映肿瘤血管生成的效能。
-
新西兰大白兔54只(中国药品生物制品检定所实验动物中心),月龄5~6月,体质量2.5~3.0 kg,健康状况良好,雌雄不限。VX2肿瘤细胞由活体种兔后肢肌肉注射传代获得。
-
氯胺酮(上海第一生化药业有限公司)20mg,咪唑安定(江苏恩华药业集团有限公司)5mg,采用肌肉注射麻醉。
-
无菌手术切下种兔后肢肿瘤,去除坏死组织后剪切成泥,放入200~400目细胞筛内,加少许生理盐水挤压过滤,收集细胞悬液,以离心半径为10 cm,1500转/min,离心3 min,去上清,将沉淀再次悬浮于生理盐水中。进行细胞计数,并用台盼蓝排除法计算活细胞百分率,制成107个/ml的活细胞悬液。
-
实验兔麻醉后取左侧卧位,在胸骨剑突上约2 cm水平、右侧腋中线处肋间隙穿刺进针,进针距离1~1.5 cm,并用止血钳固定。用2 ml注射器吸取0.5 ml细胞悬液(约含5×106个活细胞),缓慢注入。
-
实验兔接种VX2肿瘤7 d后用CT监测是否成瘤。以肺内单发结节为肿瘤种植成功的标志,如果发现单发结节则为成瘤,否则为未成瘤。
-
荷瘤兔在接种VX2肿瘤10~11 d后行PET,所用仪器为GE Discovery LS PET-CT扫描仪(美国GE公司)。先行11C-胆碱(由加速器自制) PET-CT,在静脉注射11C-胆碱37 MBq后5 min进行检查;注射11C-胆碱后60 min静脉注射18.5 MBq18F-FDG (由加速器自制),再等待60 min后行18F-FDG PET-CT。荷瘤兔俯卧位固定,先行低剂量螺旋CT,再行PET。用低剂量CT作衰减校正、迭代重建得到PET断层图像,层厚5 mm。在肿瘤最大层面测定其标准化摄取值(standardized uptake value, SUV),感兴趣区包括肿瘤截面积2/3以上的区域,并避开肿瘤边缘和坏死区,获得SUV最大值(SUVmax)。
-
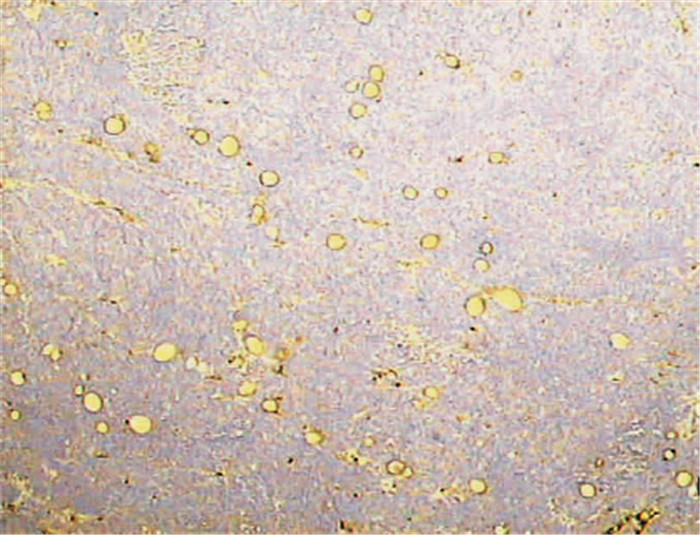
常规固定、包埋和切片后,用免疫组化单克隆抗CD34抗体(浓度1:50,Zymed公司,购于天津津脉试剂公司)标记血管。使用二步法免疫组化染色(免疫球蛋白-过氧化酶联合多聚法),CD34染色后微血管特异性标记为棕黄色。用高倍镜(200倍,0.739 mm2) 视野进行计数,计数3个“热点”区的微血管密度(microvessel density,MVD) 平均值。
-
统计学分析采用SPSS 11.5统计软件包,数据表示为x±s。11C-胆碱SUVmax、18F-FDG SUVmax与肿瘤大小和MVD的相关性分析采用Pearson直线相关分析,P < 0.05被认为差异具有统计学意义。
-
54只实验兔中,36只实验兔成功种植单发VX2肺肿瘤,成功率为66.7%,其中33只实验兔成功完成所有检查。
-
大体观察:肿瘤呈球形,切面呈白色鱼肉样,浸润性生长,边界不清;大部分肿瘤无明显坏死,少部分可见坏死、液化。测量肿瘤直径并计算肿瘤体积,平均为(1.68±1.61) cm3 (0.13~8.00 cm3)。镜下观察:肿瘤细胞排列密集,核大、深染,瘤巨细胞多见;间质较少,血管丰富(图 1),经高倍镜下计数,每个视野内的MVD平均为(35.8±13.6) 个(13~64个)。
-
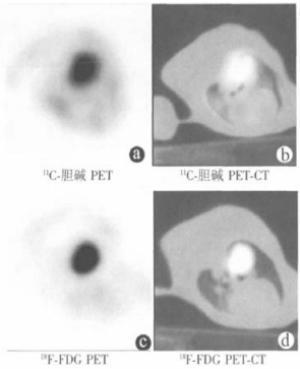
实验兔双肺可见轻度的11C-胆碱浓集,但不影响肿瘤显示。部分实验兔(5/33, 15.15%) 心肌可见18F-FDG浓集,而通过PET-CT融合图像可对肿瘤进行准确定位。兔VX2肺肿瘤模型右肺肿块的11C-胆碱和18F-FDG PET-CT结果见图 2。
-
33只兔VX2肺肿瘤11C-胆碱SUVmax平均为4.02±3.07 (1.4~12.2),18F-FDG SUVmax平均为5.70±3.45 (1.0~13.0)。经统计分析,11C-胆碱SUVmax与肿瘤大小(r=0.237,P=0.184)及MVD (r=0.238,P=0.181) 之间均不具有相关性。18F-FDG SUVmax与MVD (r=0.525, P=0.002) 之间存在正相关关系,与肿瘤大小(r=0.335, P=0.057)之间呈临界正相关关系。肿瘤大小与肿瘤MVD之间存在正相关关系(r=0.362, P=0.038)。结果显示,18F-FDG PET-CT可反映兔VX2肺肿瘤血管生成,而11C-胆碱PET-CT则不能反映肿瘤血管生成。
-
肺肿瘤MVD与肿瘤恶性程度及预后密切相关。然而,这通常需经组织病理学来进行评价,而光镜下对微血管进行计数比较困难,且由于肿瘤的不均一性易导致采样的误差,因此迫切需要一种新的手段对MVD进行评价。本课题应用新西兰大白兔VX2肺肿瘤模型对11C-胆碱和18F-FDG PET-CT进行了比较,并对其与肿瘤MVD进行了相关性研究。
-
VX2肿瘤是由家兔皮肤乳头状瘤经Shope病毒诱导形成的一种间变性鳞癌,该瘤株具有诱导时间短、种植成功率高、植入后组织学性质稳定等优点,而且有较高的可重复性[2]。因此,本研究选择新西兰大白兔为研究对象制作肺肿瘤模型。目前,大多数学者在制作兔肺肿瘤模型时,所采用的方法为在CT引导下经皮下穿刺入肺,缓慢注入含106~108个VX2细胞的悬液,10~14 d后,肿瘤即可长至直径10 mm,成瘤率为46%~77.8%。本研究即采用穿刺法,54只实验兔中的36只在7 d后形成单发肺肿瘤,成功率达66.7%。
肿瘤如果无血管生成,血供缺乏,将发生坏死或凋亡[3]。本研究结果显示,VX2肺肿瘤具有较高的MVD,并与肿瘤大小呈正相关,与Zagzag等[4]的结果一致,支持有关肿瘤血管生成的理论。
-
本研究中的33只兔VX2肺肿瘤均可见不同程度的11C-胆碱和18F-FDG摄取,平均SUVmax分别为4.02和5.70,与国外学者研究结果相似。
本研究中,实验兔双肺可见程度不一的11C-胆碱摄取,虽然国外学者的早期研究显示正常兔肺有11C-胆碱明显摄取,但其数量较少,而且本研究的实验兔右肺种植肿瘤也可能导致其生理代谢的改变。此外,兔心肌有时可摄取18F-FDG而影响肿瘤在PET上的观察,而通过PET-CT融合图像可对肿瘤进行准确定位,消除肺及心肌摄取示踪剂对肿瘤显像观察的影响。
-
研究表明,无论在生理还是病理状态下,葡萄糖代谢率与血供都是相关的。此外,恶性肿瘤由于局部血供相对或绝对缺乏而导致葡萄糖有氧代谢降低,无氧糖酵解增加,使得葡萄糖利用率降低而葡萄糖及其放射性类似物18F-FDG的摄取率增加,放射自显影动物实验研究即显示肿瘤坏死周边缺氧区18F-FDG摄取更高[5],因此肿瘤血供可能是决定肿瘤葡萄糖代谢率的重要因素。Mankoff等[6]认为,18F-FDG摄取与血流比率的增加提示葡萄糖摄取增加,也提示肿瘤可能缺氧。本研究发现,兔VX2肺肿瘤18F-FDG SUVmax与MVD之间具有正相关关系(r=0.525, P<0.01),18F-FDG PET-CT可反映肿瘤血管生成。国外学者的研究也显示,乳腺癌、肺癌、泌尿生殖系统肿瘤等的18F-FDG摄取与MVD存在明显正相关关系[7-12],支持18F-FDG PET-CT可反映恶性肿瘤血管生成。Guo等[13]进一步发现,肺腺肿瘤18F-FDG摄取可反映肿瘤血管生成状态,特别是可反映活动性血管的生成。
-
有关11C-胆碱摄取与MVD之间相关性的研究还很少,结果也不尽相同。Shinoura等[14]的研究发现,虽然脑瘤/正常脑组织摄取11C-胆碱的比值与15O-H2O测定的局部脑血流并不相关,但在血管丰富的肿瘤中,局部脑血流比率与11C-胆碱摄取均较高。此外,Spaeth等[15]的研究结果显示,在鼠F98脑胶质瘤模型中,肿瘤与对侧脑皮质11C-胆碱摄取比值和MVD之间存在正相关关系。但本研究结果显示,兔VX2肺瘤11C-胆碱SUVmax与MVD之间不具有相关性(r=0.238, P=0.181),即11C-胆碱PET-CT不能反映肿瘤血管生成。这可能与胆碱在细胞的代谢途径多、影响因素多有关,如胆碱进入细胞后还可作为第二信使调节细胞代谢;在肝、肾内转化为甲基供体用作生物合成的原料;在神经系统内可生成神经递质等。恶性肿瘤的生长、进展需要充足的氧和各种营养物质,肿瘤的血供多,可被肿瘤摄取的胆碱也多;肿瘤的血供少,可被肿瘤摄取的胆碱就少,二者变化趋势相同,但不一定具有线性相关关系。
总之,18F-FDG SUVmax与肿瘤MVD之间存在相关性,18F-FDG PET-CT可反映肿瘤血管生成;11C-胆碱SUVmax与肿瘤MVD之间不存在相关性,11C-胆碱PET-CT不能反映肿瘤血管生成。
兔VX2肺肿瘤PET-CT与血管生成的相关性研究
The correlation between PET-CT imaging and microvessed density in rabbit lung VX2 tumor model
-
摘要:
目的 探讨11C-胆碱和18F-FDG PET-CT反映兔VX2肺肿瘤血管生成的效能。 方法 新西兰大白兔54只,右肺接种VX2肿瘤10~11 d后,行11C-胆碱和18F-FDG PET-CT,测量肿瘤11C-胆碱和18F-FDG最大标准化摄取值(SUVmax)。同时,测量肿瘤标本大小,用免疫组化方法评价肿瘤微血管密度(MVD)。然后对肿瘤胆碱SUVmax、18F-FDG SUVmax与肿瘤大小、MVD进行相关性分析。 结果 33只实验兔成功完成所有检查,得到VX2肺肿瘤的11C-胆碱SUVmax平均值为4.02±3.07 (1.4~12.2),对18F-FDG的SUVmax平均值为5.70±3.45 (1.0~13.0),肿瘤大小平均值为(1.68±1.61)cm3 (0.13~8.00 cm3)。高倍镜(200倍, 0.739 mm2)视野下,肿瘤MVD平均值为(35.8±13.6)个(13~64个)。经统计学分析,11C-胆碱SUVmax与肿瘤大小及MVD之间均不具有相关性;18F-FDG SUVmax与MVD (r=0.525, P=0.002)之间存在正相关关系,与肿瘤大小(r=0.335, P=0.057)之间呈临界正相关关系。 结论 18F-FDG PET-CT可反映兔VX2肺肿瘤血管生成,11C-胆碱PET-CT不能反映肿瘤血管生成。 Abstract:Objective To evaluate and compare the suitability of 11C-choline and 18F-FDG PET-CT for reflecting tumors angiogenesis. Methods Fifty-four New Zealand white rabbits which weighted 2.5~3.0 kg were used in the experiment. Under general anesthesia, a needle was transthoracically inserted into the right lung, 0.5 ml viable VX2 tumor cell suspension was slowly injected through the needle to establish the model. 11C-choline and 18F-FDG PET-CT were performed after 10~11 d. The tumors SUVmax were calculated. The sections were stained with hematoxylin and eosin, and immunostained for CD34. Assessment of microvessel density (MVD) was performed by computer-assisted image analysis. The relationship 11C-choline SUVmax and 18F-FDG SUVmax with tumor size and MVD were statistically analyzed. Results Thirty-three rabbits successfully completed all imaging examinations. 11C-choline and 18F-FDG differently accumulated in all lung VX2 tumors. The mean of 11C-choline SUVmax was 4.02±3.07 (1.4~12.2), and the mean of 18F-FDG SUVmax was 5.70±3.45 (1.0~13.0). The mean size of tumor was(1.68±1.61)cm3 (0.13~8.00 cm3). Under high power microscope field of vision (200×, 0.739 mm2), the mean of MVD was 35.8±13.6(13~64). 11C-choline SUVmax did not correlate with tumor size and MVD. 18F-FDG SUVmax significantly and positively related to MVD (r=0.525, P=0.002). There was a critical positive correlation between 18F-FDG SUVmax and tumor size (r=0.335, P=0.057). Conclusions In the rabbit VX2 lung tumor model, 18F-FDG SUVmax correlated with MVD, so 18F-FDG PET-CT could reflect tumor angiogenesis. 11C-choline SUVmax did not statistically correlate with MVD, and 11C-choline PET-CT could not reflect tumor angiogenesis. -
Key words:
- Lung neoplasms /
- Positron-emission tomopraphy /
- Fluorodeoxyglucose F18 /
- 11C-choline /
- Model, animal /
- Rabbits /
- Microvessel density
-
[1] Charnley N, Donaldson S, Price P. Imaging angiogenesis. Methods Mol Biol, 2009, 467(1): 25-51. [2] Kuszyk BS, Corl FM, Franano FN, et al. Tumor transport physiology: Implications for imaging and imaging-guided therapy. AJR Am J Roentgenol, 2001, 177(4): 747-753. doi: 10.2214/ajr.177.4.1770747 [3] Holmgren L, O' Reilly MS, Folkman J. Dormancy of micrometas-tases: balanced proliferation and apoptosis in the presence of angio-genesis suppression. Nat Med, 1995, 1(2): 149-153. doi: 10.1038/nm0295-149 [4] Zagzag D, Brem S, Robert F. Neovascularization and tumor growth in the rabbit brain. A model for experimental studies of angiogenesis and the blood-brain barrier. Am J Pathol, 1988, 131(2) : 361-372. [5] Brown RS, Fisher SJ, Wahl RL. Autoradiographic evaluation of the intra-tumoral distribution of 2-deoxy-D-glucose and monoclonal antibodies in xenografts of human ovarian adenocarcinoma. J Nucl Med, 1993, 34(1) : 75-82. [6] Mankoff DA, Dunnwald LK, Gralow JR, et al. Blood flow and metabolism in locally advanced breast cancer: relationship to re-sponse to therapy. J Nucl Med, 2002, 43(4) : 500-509. [7] Bos R, van Der Hoeven JJ, van Der Wall E, et al. Biologic correlates of (18)fluorodeoxyglucose uptake in human breast cancer mea-sured by positron emission tomography. J Clin Oncol, 2002, 20(2) : 379-387. doi: 10.1200/JCO.2002.20.2.379 [8] Zee YK, O'Connor JP, Parker GJ, et al. Imaging angiogenesis of gen-itourinary tumors. Nat Rev Urol, 2010, 7(2) : 69-82. doi: 10.1038/nrurol.2009.262 [9] Bajpai J, Gamanagatti S, Sharma MC, et al. Noninvasive imaging surrogate of angiogenesis in osteosarcoma. Pediatr Blood Cancer, 2010, 54(4): 526-531. [10] Niu G, Chen X. PET Imaging of Angiogenesis. PET Clin, 2009, 4(1) : 17-38. doi: 10.1016/j.cpet.2009.04.011 [11] Kaira K, Oriuchi N, Shimizu K, et al. Correlation of angiogenesis with 18F-FMT and 18F-FDG uptake in non-small cell lung cancer. Cancer Sci, 2009, 100(4) : 753-758. doi: 10.1111/j.1349-7006.2008.01077.x [12] Tateishi U, Nishihara H, Tsukamoto E, et al. Lung tumors evaluated with FDG-PET and dynamic CT: the relationship between vascular density and glucose metabolism. J Comput Assist Tomogr, 2002, 26(2): 185-190. doi: 10.1097/00004728-200203000-00004 [13] Guo J, Higashi K, Ueda Y, et al. Microvessel density: correlation with 18F-FDG uptake and prognostic impact in lung adenocarcino-mas. J Nucl Med, 2006, 47(3): 419-425. [14] Shinoura N, Nishijima M, Hara T, et al. Brain tumors: detection with C-11 choline PET. Radiology, 1997, 202(2): 497-503. doi: 10.1148/radiology.202.2.9015080 [15] Spaeth N, Wyss MT, Pahnke J, et al. Uptake of 18F-fluorocholine, 18F-fluoro-ethyl-L-tyrosine and 18F-fluoro-2-deoxyglucose in F98 gliomas in the rat. Eur J Nucl Med Mol Imaging, 2006, 33(6) : 673-682. doi: 10.1007/s00259-005-0045-7 -






 下载:
下载: