-
噬菌体展示(phage display)技术是一项研究生物活性肽、肽类药物筛选和抗体制备等非常有用的手段[1]。近年发展起来的噬菌体随机肽库体内筛选方法(phage display in vivo),是寻找与组织、器官特异性结合多肽的有效手段[2-3]。此法可在受体分子尚不清楚的情况下,以受体天然存在的环境组织器官为配基,利用噬菌体短肽的抗原特异性寻找未知的靶分子,确定其结构域,具有特异结合活体组织器官、在体内稳定性好、特异性高、缩短了研究周期等优点,而且筛选与治疗在相同条件下进行,避免了体外筛选得到的配体在体内试验无效或活性低的缺点,最大程度保证了筛选到的短肽的靶向特异性[4]。目前,国际上已经通过噬菌体体内筛选技术成功得到了几组特异肿瘤组织结合的多肽[5-8],将多肽与阿霉素和肿瘤坏死因子α耦联后,在小鼠肿瘤模型中起到了良好的抗肿瘤作用[9-10];将放射性核素标记该类多肽也可应用于肿瘤的显像和放射治疗的研究中[11-13]。本研究通过噬菌体体内筛选技术筛选与肺癌组织特异结合的七肽,并用125I标记后进行肺癌显像,结果如下。
-
T7噬菌体展示文库购于New England Biolabs,2×1013 pfu/ml,复杂度为2.8×109个转化子。抑肽酶和亮抑肽酶为美国AMRESCO公司产品。四环素、异丙基-β-D-硫代吡喃半乳糖和5-溴-4-氯-3-吲哚-β-D-半乳糖苷为美国AMRESCO公司产品。Na125I (125I,比活度为643.8 GBq/mg,无载体) 购自Amer-sham公司。Sephedex G-75 (Particle Size:10~40 μm) 为Pharmacia公司产品。其他试剂均为国产试剂。
-
IRM-2小鼠由我所自主培育。Lewis肺癌瘤株购自中国医学科学院实验动物研究所。
-
小动物活体成像系统(KODAK IS in vivo FX,美国),生物安全柜(Thermo Electron B2,美国),动物天平(SHIMADZU UX4200H,日本),组织天平(Sartorius BS223S,德国),低温冰(Thermo,美国),全自动放射免疫γ计数器(上海核所日环光电仪器有限公司)。
-
参照文献[14],在无菌条件下通过后肢腋下包埋的方法将Lewis肺癌接种至6周龄的IRM-2小鼠,制备肿瘤模型。待肿瘤达0.5 cm后,用于后续噬菌体内筛选。
-
将10μl滴度为1011 pfu的噬菌体混合于200μl RPMI 1640培养基中,通过尾静脉注入Lewis肺癌小鼠体内。5 min后切开小鼠胸部并暴露心脏,由左心室用静脉穿刺入主动脉,缓慢推入20 ml磷酸缓冲液(pH=7.4),同时在小鼠右心耳处剪开一小口,使血液流出,直至流出的血液变成淡红色为止。取出肿瘤组织,加入1 ml存放于4℃的RPMI 1640培养基(含1 mmol苯甲基磺酰氟、20 μg /ml抑肽酶、1 μg /ml亮抑肽酶),匀浆后再加入1 ml冰浴后的RPMI 1640培养基(含1 mmol苯甲基磺酰氟、20 μg /ml抑肽酶、1 μg /ml亮抑肽酶和1%牛血清白蛋白) 进行洗涤,以离心半径为15 cm,5000转/min离心5 min,小心吸出上清,并重复以上操作洗涤5次。将离心后的沉淀与2 ml处于对数生长期的大肠杆菌ER2738混合,室温下静置30 min。加入10 ml预温的Luria-Bertani培养基,室温下孵育30 min,测定噬菌体滴度。将5 ml上述肿瘤组织与大肠杆菌的混悬液保存备用,剩余部分与2 ml处于对数生长期的大肠杆菌ER2738混合,倒入盛有200 ml Luria-Bertani培养基(含0.1%四环素)的锥形瓶中,37℃振荡孵育16 h。将该培养液在4℃下以离心半径为15 cm,8000转/ min离心15 min,并把上清移入锥形瓶中,加入1/6体积的聚乙二醇/氯化钠,在4℃下沉降过夜。再在4℃下以离心半径为15 cm,10 000转/min离心15 min,弃上清。用1 ml RPMI 1640培养基重悬沉淀物,再次加入160 μl聚乙二醇/氯化钠溶液,冰浴1 h,在4℃下以离心半径为15 cm,10 000转/min离心10 min,弃上清,以200 μl含0.02%叠氮化钠的RPMI 1640培养基重悬沉淀物,此即为第一轮扩增的噬菌体。重复以上操作,进行4轮筛选。
-
将第四轮筛选获得的噬菌体感染大肠杆菌后铺于含有异丙基-β-D-硫代吡喃半乳糖/5-溴-4-氯-3-吲哚-β-D-半乳糖苷的Luria-Bertani培养基上,随即挑取10个分隔良好的蓝色噬菌斑,扩增培养。收集扩增的噬菌体,按照试剂盒说明提取DNA,送上海生工生物工程技术服务有限公司进行测序。根据测得的序列,推导出插入外源七肽的氨基酸序列。
根据测得的七肽序列,另用化学合成法合成七肽,并对七肽进行高效液相层析法纯化和质谱鉴定,用以鉴定体内筛选得到的七肽。
-
用氯胺-T法对七肽进行125I标记。将1.0 mg七肽溶解到50μl pH=7.2的50 mmol/L磷酸缓冲液中,转移至1.5 ml离心管内,然后加入Na125I约18.5 MBq(0.5 mCi)和50μl氯胺-T (1 mg/ml) 液,室温震荡反应5 min,再加入50μl (0.2 mg/ml) 偏亚硫酸钠溶液终止反应。取0.1μl点样纸层析,进行标记率的测定,展开剂为乙醇∶水=9∶1,点样后上行展开一段距离,取出晾干,从原点下0.5 cm开始每隔1 cm剪条,用放射免疫γ计数器测每段的放射性活度。
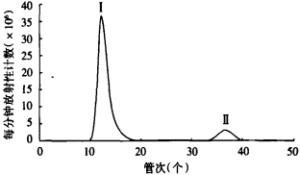
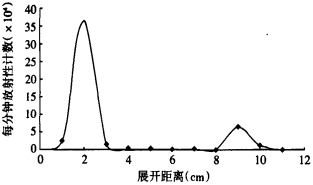
将反应液移入预处理的Sephedex G-75层析柱(1.0 cm×15 cm),用0.05 mol/L磷酸缓冲液(pH=7.4)洗脱,收集洗脱液,每管收集0.5μl,共收集50管。每管取1.0μl测量放射性强度。取0.2μl柱层析纯化产物点样纸层析测放化纯度,方法同标记率的测定方法。
将标记物室温放置72 h,采用上述纸层析法再次检测125I-七肽的放化纯度及其稳定性。
-
将125I-七肽通过尾静脉注射入Lewis肺癌小鼠模型中,给药后分别在0.5、2、6和20 h利用小动物活体成像系统进行体内放射性分布测定。
-
IRM-2小鼠是我所自主培育的肿瘤易感小鼠,已经成功接种了多种肿瘤。接种Lewis肺癌后10 d左右,肿瘤直径可达0. 5 cm,用于后续噬菌体体内七肽筛选。
-
对收集的噬菌体进行滴度测定,第一轮未扩增的噬菌体每10μl滴度为5×105 pfu,扩增后的噬菌体每10μl滴度为1.55×1011 pfu。此后每轮筛选的噬菌体未扩增,滴度逐渐增大。挑取20个单菌落,测序外源插入七肽序列,其中一管测序错误、两管信号弱而未测出,其余17个样品测定的序列推导出的多肽序列结果见表 1。结果显示,出现频率最高的七肽序列为谷氨酰胺-酪氨-甘氨酸-谷氨酰胺-苯丙氨酸-丙氨酸-酪氨酸,即:QYGQFAY。
多肽序列 出现频率 1 YSGKPGW 2/20 2 QYGQFAY 13/20 3 LMLRDVC 1/20 4 CREAGNY 1/20 注:表中多肽序列的代号为相应的氨基酸缩写。 表 1 T7噬菌体展示文库筛选的靶向结合Lewis肺癌的七肽序列
通过化学合成法合成QYGQFAY七肽,并进行高效液相层析法纯化和质谱鉴定,结果:合成的七肽纯度为98%,质谱结果与QYGQFAY分子质量相吻合。
-
纸层析测定标记率时,游离125I的比移值为0.8~0.9,125I-QYGQFAY的比移值为0.1~0.2,标记率约为85 %(图 1)。对标记的QYGQFAY七肽进行Sephedex G-75柱层析分离,对洗脱液进行放射性计数可知,QYGQFAY峰出现在第12~15管,游离125I峰出现在第36 ~ 38管(图 2)。纯化产物的纸层析结果显示,125I-QYGQFAY七肽的放化纯度 > 99%(图 3)。72 h后再次进行放化纯度的检测,放化纯度 > 95%,说明125I-QYGQFAY七肽在室温下放置3 d仍可稳定的存在。
-
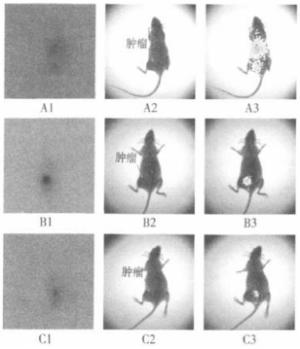
经Lewis肺癌小鼠尾静脉注射125I-QYGQFAY七肽后0.5、2、6 h用小动物活体成像系统测定荷瘤鼠体内放射性分布的结果见图 4。0.5 h时几乎全身分布,主要集中在肝脏等部位,肿瘤部位有部分分布,但是聚集的量较少(A3);2 h时放射性几乎都聚集于肿瘤部位,其他器官基本无分布(B3);6 h时放射性仍然主要集中在肿瘤部位,但体内总的放射性已经较低,已基本代谢完。
-
随着环境污染的加重,肺癌在城市肿瘤致死病因中由原来的第4位上升到第1位[15-16]。在工业发达的国家,死于肺癌的患者人数占各种癌症死亡人数总和的29%,肺癌5年存活率仅为14. 1%,而肺癌早期诊断率仅为15%,但早期确诊患者5年存活率可达60%~90%。因此,肺癌的早期诊断是非常重要的。
本实验通过噬菌体展示体内筛选的方法获得了与肺癌组织特异结合的七肽,通过序列测定,确定该七肽含有3个带苯环的芳香族氨基酸、2个含酰胺基的氨基酸和2个中性氨基酸,即:QYGQFAY七肽。由于它含有3个苯环结构,可以初步推测其主要是通过空间结构与肿瘤组织特异表达蛋白结合。
动物实验结果表明,125I-QYGQFAY七肽可以很好地与肿瘤组织特异的结合,静脉注射后2 h几乎全部在肿瘤部位富集,而且体内代谢较快,6 h时体内分布已经明显减少。以上说明该七肽具有很高的肿瘤特异性,显像时间为2 h左右,且体内清除较快,是较理想的肺癌显像诊断试剂。
多肽类肺癌显像剂的制备及其初步鉴定
The preparation and identification of peptide imaging agent of lung cancer
-
摘要:
目的 通过噬菌体随机七肽文库筛选出与体内肺癌组织特异结合的七肽,并制备肽类肺癌早期诊断试剂。 方法 通过噬菌体展示体内筛选技术获得与肺癌特异结合的噬菌体,进行序列测定,合成特异结合的多肽,125I标记后经静脉注射入小鼠体内,观察其在小鼠Lewis肺癌模型中的分布。 结果 通过4轮筛选获得了QYGQFAY七肽,该七肽经125I标记后可以很好地与肺癌组织特异结合,在体内2 h左右与肿瘤结合得最充分,而且体内代谢较快,6 h左右体内分布明显减少,基本代谢完毕。 结论 该七肽可以较好地对Lewis肺癌进行显像和诊断。 Abstract:Objective To screen in vivo lung cancer specific binding 7-peptide from T7 phage display random peptide library and prepare peptide imaging agent in early diagnosis of lung cancer. Methods Used phage display in vivo technology to get the 7-peptide phage that can bind the lung cancer specifically, then sequenced and synthesized 7-peptide. After being labeled by 125I, this 7-peptide was injected into mice via vein and the distribution in the mice tumor mold was observed. Results One 7-peptide was obtained after four rounds of screening, and the peptide could bind lung cancer tissue specifically. Metabolism of this peptide in mice was fast and imaging of lung cancer was best two hours later after injection. The distribution in vivo decreased and almost disappeared after six hours. Conclusion This 7-peptide could be used to image and diagnose of lung cancer effectively. -
Key words:
- Phage display /
- Peptides /
- Peptide library /
- Lung neoplasms
-
表 1 T7噬菌体展示文库筛选的靶向结合Lewis肺癌的七肽序列
多肽序列 出现频率 1 YSGKPGW 2/20 2 QYGQFAY 13/20 3 LMLRDVC 1/20 4 CREAGNY 1/20 注:表中多肽序列的代号为相应的氨基酸缩写。 -
[1] Scott JK, Smith GP. Searching for peptide ligands with an epitope library. Science, 1990, 249(4967): 386-390. doi: 10.1126/science.1696028 [2] Pasqualini R, Ruoslahti E. Organ targeting in vivo using phage display peptide libraries. Nature, 1996, 380(6572): 364-366. doi: 10.1038/380364a0 [3] Pasqualini R, Koivunen E, Ruoslahti E. Alpha v integrins as receptors for tumor targeting by circulating ligands. Nat Biotechnol, 1997, 15(6): 542-546. doi: 10.1038/nbt0697-542 [4] Lee TY, Lin CT, Kuo SY, et al. Peptide-mediated targeting to tumor blood vessels of lung cancer for drug delivery. Cancer Res, 2007, 67(22): 10958-10965. doi: 10.1158/0008-5472.CAN-07-2233 [5] Yang W, Luo D, Wang S, et al. TMTP1, a novel tumor-homing peptide specifically targeting metastasis. Clin Cancer Res, 2008, 14(17): 5494-5502. doi: 10.1158/1078-0432.CCR-08-0233 [6] Hui X, Han Y, Liang S, et al. Specific targeting of the vascul-ature of gastric cancer by a new tumor-homing peptide CGNSNPKSC. J Control Release, 2008, 131(2): 86-93. doi: 10.1016/j.jconrel.2008.07.024 [7] Du B, Han H, Wang Z, et al. Targeted drug delivery to hepatocarcinoma in vivo by phage-displayed specific binding Peptide. Mol Cancer Res, 2010, 8(2): 135-144. doi: 10.1158/1541-7786.MCR-09-0339 [8] Chen B, Cao S, Zhang Y, et al. A novel peptide (GX1) homing to gastric cancer vasculature inhibits angiogenesis and cooperates with TNF alpha in anti-tumor therapy. BMC Cell Biol, 2009, 10: 63. doi: 10.1186/1471-2121-10-63 [9] Zhang L, Hoffman JA, Ruoslahti E, et al. Molecular profiling of heart endothelial cells. Circulation, 2005, 112(11): 1601-1611. doi: 10.1161/CIRCULATIONAHA.104.529537 [10] Garces CA, Kurenova EV, Golubovskaya VM, et al. Vascular endothelial growth factor receptor-3 and focal adhesion kinase bind and suppress apoptosis in breast cancer cells. Cancer Res, 2006, 66(3): 1446-1454. doi: 10.1158/0008-5472.CAN-05-1661 [11] Howell RC, Revskaya E, Pazo V, et al. Phage display library derived peptides that bind to human tumor melanin as potential vehicles for targeted radionuclide therapy of metastatic melanoma. Bioconjug Chem, 2007, 18(6): 1739-1748. doi: 10.1021/bc060330u [12] Zitzmann S, Krämer S, Mier W, et al. Identification and evaluation of a new tumor cell-binding peptide, FROP-1. J Nucl Med, 2007, 48(6): 965-972. doi: 10.2967/jnumed.106.036699 [13] Zitzmann S, Mier W, Schad A, et al. A new prostate carcinoma binding peptide (DUP-1)for tumor imaging and therapy. Clin Cancer Res, 2005, 11(1): 139-146. [14] 王月英, 周继文, 穆传杰, 等. IRM-2近交系小鼠肿瘤模型的建立. 中国比较医学杂志, 2003, 13(4): 246-248. doi: 10.3969/j.issn.1671-7856.2003.04.016
[15] Ries L, Eisner MP, Kosary CL, et al. SEER cancer statistics review, 1973-1997. USA: National Cancer Institute, 2000: 1-7. [16] Strauss GM. Randomized population trials and screening for lung cancer: breaking the cure barrier. Cancer, 2000, 89(11 Suppl): 2399-2421. -






 下载:
下载: