-
胃泌素释放肽前体(progastrin-releasingpeptide(31-98), ProGRP(31-98))是一种灵敏、可靠的小细胞肺癌标志物, 在小细胞肺癌的早期诊断中优于其他指标, 有关ProGRP的研究近年来较活跃[1-5]。抗Pro-GRP(31-98)单链抗体(anti-ProGRP(31-98) single-chain anti-body fragment, anti-ProGR(31-98) scFv)是中国辐射防护研究院通过基因工程改造的一种单链抗体, 本研究对anti-ProGRP(31-98) scFv的131I标记方法及其稳定性和免疫活性进行了研究, 现报道如下。
-
anti-ProGRP(31-98) scFv由中国辐射防护研究院周小林教授惠赠。Na131I溶液为中国核动力研究院产品。氯胺-T与Na2S2O5来源于sigma公司, 葡聚糖凝胶Sephadex G25柱购自Pharmacia公司, 小牛血清、RPMI 1640培养基和胰蛋白酶均购自杭州四季青公司。磷酸缓冲液(phosphate buffer solution, PB)及磷酸盐缓冲液(phosphate buffer saline, PBS)由本实验室自行配制。人小细胞肺癌NCI-H446细胞株及人肺腺癌A549细胞株为本实验室保存。
BB16/BB5056型CO2培养箱为德国Heraeus公司产品, 放射性活度仪为美国Capintec公司产品, SN-695B型智能放免计数器由上海日环光电仪器有限公司生产。
-
采用氯胺-T法[6], 用Na131I标记anti-ProGRP(31-98) scFv。取37 MBq(1 mci, 4 μl)Na131I液加入50 μl(7.5 μg)anti-ProGRP(31-98) scFv液中, 再加入100 μl氯胺-T溶液, 振荡3min, 然后迅速加200μlNa2S2O5溶液, 振荡2 min。利用纸层析法测定标记率, 新华1号层析纸为支持物, 用生理盐水展开, 131I-anti-ProGRP(31-98) scFv的比移值为1/10, 游离131I的比移值是1。
-
采用凝胶柱层析法分离纯化131I-anti-ProGRP(31-98) scFv。待Sephadex G25柱上方的PB将流尽时, 加入2~3 ml的PBS进行饱和, 然后将Na131I标记液加于Sephadex G25柱的上端, 用0.05 mol/L、pH= 7.5的PB洗脱, 将洗脱液收集到离心管中, 每管0.5 ml, 利用放射性活度仪测量每管的放射性计数。达到第一个放射性高峰的样品即为131I-anti-Pro-GRP(31-98) scFv, 第二放射性高峰为游离131I。利用纸层析法计算样品的放化纯。
-
取50 μl纯化的131I-anti-ProGRP(31-98) scFv置于37℃水浴箱中, 分别于2、4、6、8、12、24、48 h测定其放化纯。另取10名健康人血清充分混合, 然后将131I-anti-ProGRP(31-98) scFv与该血清充分混匀, 放置于37℃水浴箱中, 分别在混合后的2、4、6、8、12、24、48 h测定其放化纯。
-
采用细胞结合分析法[7]测定131I-anti-ProGRP(31-98) scFv的免疫活性。收集处于对数生长期的密度为5×106个/ml的NCI-H446细胞悬液0.7 ml, 加入2 ml 4℃PBS, 离心半径为13cm, 1000 r/min离心5min, 共2次, 弃上清液; 加入0.5 ml 1%的Triton-X100预孵5min; 加入2ml PBS, 离心半径为13cm, 1000 r/ min离心5min, 共2次, 弃上清液; 加入1 ml PBS将细胞打匀, 吸取0.2 ml于离心管(4个复管)中, 每管中加入20 μl经PBS稀释的131I-anti-Pro-GRP(31-98) scFv(约7.4×103Bq), 混匀后, 4℃放置24h, 测量每管总放射性活度T, 加入2 mlPBS, 离心半径为13 cm, 1000 r/min离心5min, 共2次, 弃上清液, 测定沉淀细胞的放射性活度B, 免疫结合率=B/T×100%。131I-anti-ProGRP(31-98) scFv对A549细胞的免疫结合率测定方法同上。
-
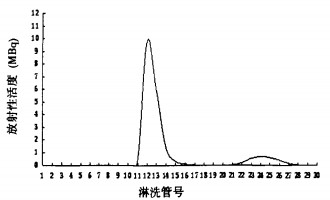
标记液经Sephadex G25柱分离纯化后的洗脱曲线见图 1。131I-anti-ProGRP(31-98) scFv的标记率为93.35%。
-
经测量计算, 纯化后即刻131I-anti-ProGRP(31-98) scFv的放化纯为98.49%。131I-anti-ProGRP(31-98) scFv在37℃水浴箱中放置24h后放化纯为94.59%, 48 h后仍达91.59%;与健康人血清充分混合后, 在37℃水浴箱中放置24 h后放化纯为85.16%, 48 h后的放化纯为82.49%。
-
anti-ProGRP(31-98) scFv经131I标记后, 仍然保持较好的免疫活性, 其与人小细胞肺癌NCI-H446细胞株及人肺腺癌A549细胞株的免疫结合率分别为85.36%和21.02%。
-
利用放射性核素标记的单克隆抗体(monoclonal antibody, McAb)进行的放射免疫显像对于恶性肿瘤早期诊断、分型、肿瘤转移灶和复发灶的定位等方面起着独特的作用[8]。相对而言, 鼠源性McAb应用于放射免疫显像时存在诸多缺陷, 临床应用受到一定限制, 例如, 鼠源性McAb免疫原性较强, 进入人体后易产生人抗鼠抗体反应; 其分子质量较大, 穿透力较弱, 不易到达病变部位, 不利于显像和治疗; 在血液中清除速度较慢, T/NT值较小, 难以获得清晰的图像等[9-10]。因此制备小型化抗体和人源化抗体是克服这些缺陷的根本所在。
我们前期对anti-ProGRP(31-98)单克隆抗体E-B5及D-D3的研究表明, 虽然131I-E-B5及131I-D-D3能够在高表达ProGRP的恶性肿瘤部位特异性高浓聚, 但是血液清除速度较慢, 最佳显像时间长达72~96 h, 难以满足临床早期、及时诊断的要求[1]。anti-ProGRP(31-98) scFv是在D-D3的基础上通过基因工程技术改造的一种单链抗体, 具备一般单链抗体的共性特点, 更易进入肿瘤细胞发挥作用。scFv是单克隆抗体的重链可变区和轻链可变区的融合产物, 分子质量约为完整免疫球蛋白G的1/6, 仅为30×103左右, 穿透力强, 能够进入机体的各种组织, 体内半衰期短, 能很快从机体中清除, 免疫原性较低, 由于不含Fc部分而没有Fc受体导致的非抗原特异性结合, 可以提高T/NT值[11-12]。
放射性碘标记抗体的常用方法有氯胺-T法、乳过氧化物酶法和四氯二苯基苷脲碘化法, 其中氯胺-T法标记的效率高、重复性好、试剂便宜并且易得, 是目前使用最多的碘标记抗体方法[13]。本研究进行了多次氯胺-T法标记发现, Na131I溶液与anti-ProGRP(31-98) scFv的最佳标记比例为37 MBq Na131I溶液标记7.5 μg anti-ProGRP(31-98) scFv, 依照这一比例标记的131I-anti-ProGRP(31-98) scFv标记效果最佳。这表明131I-anti-ProGRP(31-98) scFv在体外及模拟体内环境的情况下有较好的稳定性, 并保持了良好的免疫活性。这一结果为利用131I-anti-ProGRP(31-98) scFv开展相应的实验动物体内分布研究及荷瘤裸鼠的放免显像和放免治疗研究奠定了坚实的基础。
131I标记抗胃泌素释放前体单链抗体的制备及其稳定性和免疫活性研究
Preparation and evaluation of 131I-anti-ProGRP(31-98) single-chain antibody fragment
-
摘要:
目的 研究抗胃泌素释放前体(ProGRP(31-98))单链抗体(scFv)的131I标记方法,并对其标记后的稳定性和免疫活性进行分析。 方法 采用氯胺-T法碘化标记制备131I-anti-ProGRP(31-98) scFv,凝胶柱层析法分离纯化标记产物,利用纸层析法测定标记物的标记率、放化纯和稳定性,通过细胞结合试验测定131I-anti-ProGRP(31-98) scFv的免疫活性。 结果 131I-anti-ProGRP(31-98)标记率为93.35%。标记产物纯化后即刻放化纯为98.49%,在37℃水浴箱中放置24 h后放化纯为94.59%,48 h后测定仍大于90%,与正常人血清充分混合24 h后放化纯为85.16%,48 h测定大于80%。131I-anti-ProGRP(31-98) scFv对人小细胞肺癌NCI-H446和肺腺癌A549细胞株的免疫结合率分别为85.36%和21.02%。 结论 131I-anti-ProGRP(31-98) scFv的标记率高,且有良好的稳定性和免疫活性,有望成为高表达ProGRP的恶性肿瘤放射免疫显像及治疗药物,值得进一步深入研究。 Abstract:Objective Tostudythe 131I labeling methods, stability and immunological activity of antiprogastrin-releasing peptide(31-98) single-chain antibody(anti-ProGRP(31-98) scFv). Methods The anti-Pro-GRP(31-98) scFv was labeled by Chloramine-T method using 131I, and purified by gel column separation method. The labeling efficiency, radiochemical purity and stability were estimated by using paper chromatography. Immunological activity was detected with cell conjugation assay. Results The labeling efficiency and radiochemical purity of 131I-anti-ProGRP(31-98) scFv were 93.35%and 98.49%, respectively.The radiochemical purity was 94.59%after incubation in water bath at 37℃ for 24h, and still maintained above 90%for 48 h. After incubation with healthy human serum for 48 h, the radiochemical purity was still above 80%.The immunobinding ratios of 131I-anti-ProGRP(31-98) scFv for NCI-H446 cells and A549 cells were 85.36%and 21.02%, respectively. Conclusions 131I-anti-ProGRP(31-98) scFv not only has high labeling efficiency and radiochemical purity, but also has good stability and keeps good immunological activity.Therefore, it could be a promising agent for radioimmunoimaging and radioimmunotherapy for the malignant tumors which highly express ProGRP. -
[1] 徐巧玲, 周小林, 石怡珍, 等. 抗ProGRP(31-98)单克隆抗体E-B5的131I标记及体内生物学分布研究. 中华核医学杂志, 2009, 29(4): 274-278.
[2] 高晓天, 周小林, 梁克, 等. 抗前胃泌素释放肽单克隆抗体在小细胞肺癌诊断应用. 中国热带医学, 2009, 9(1): 51-53.
[3] Nordlund MS, Fermer C, Nilsson O, et al. Production and characterization of monoclonal antibodies for immunoassay of the lung cancer marker proGRP. Tumour Biol, 2007, 28(2): 100-110. doi: 10.1159/000099335 [4] Yamaguchi H, Soda H, Kitazaki T, et al. Serum progastrin-releasing peptide levels followed by whole-body positron emission tomography detects early recurrence of small-cell lung cancer. Respirology, 2007, 12(1): 137-139. doi: 10.1111/j.1440-1843.2006.00966.x [5] Satoh H, Kagohashi K, Kurishima K, et al. Comparison of neuronespecific enolase and pro-gastrin releasing peptide in the prognostic evaluation of small cell lung cancer patients. Clin Oncol, 2006, 18(9): 720. doi: 10.1016/j.clon.2006.07.009 [6] 尹晓玲, 彭志平, 文明, 等. 131I标记抗肺癌单克隆抗体1E2在荷瘤小鼠体内分布及对小鼠移植瘤作用. 中国肿瘤临床, 2008, 35(23): 1364-1368. doi: 10.3969/j.issn.1000-8179.2008.23.012
[7] 苗积生, 沈毅. 放射性核素标记单克隆抗体(McAb)免疫反应活性分数的测定. 同位素, 1996, 9(2): 85-88.
[8] 魏莉, 罗荣城. 放射性核素标记抗CD20单克隆抗体治疗B细胞淋巴瘤的研究进展. 国际放射医学核医学杂志, 2006, 30(3): 153-157. doi: 10.3760/cma.j.issn.1673-4114.2006.03.009
[9] Davda JP, Jain M, Batra SK, et al. A physiologically based pharmacokinetic(PBPK)model to characterize and predict the disposition of monoclonal antibody CC49 and its single chain Fv constructs. Int Immunopharmacol, 2008, 8(3): 401-413. doi: 10.1016/j.intimp.2007.10.023 [10] 王世真. 分子核医学. 2版. 北京: 中国协和医科大学出版社, 2004: 253-256.
[11] Ferl GZ, Kenanova V, Wu AM, et al. A two-tiered physiologically based model for dually labeled single-chain Fv-Fc antibody fragments. Mol Cancer Ther, 2006, 5(6): 1550-1558. doi: 10.1158/1535-7163.MCT-06-0072 [12] 包贺菊, 李亚明, 于彤, 等. 99Tcm标记的ND1重组单链抗体在荷人结肠癌裸鼠体内分布及放射免疫显像研究. 中国临床医学影像杂志, 2006, 17(Suppl): 41-43.
[13] 刘长征, 张汝森. 氯胺-T法和Iodogen法碘标记抗体的比较. 中山医科大学学报, 1995, 16(3): 43-46.
-





 下载:
下载: