-
目前的影像模式可以分为两大类: 一是提供结构信息的, 如MRI、CT及超声检查等; 二是提供功能及分子信息的, 如PET、SPECT、磁共振波谱成像及光学成像等。由于目前还没有单纯一种影像模式能够同时提供全部的解剖及功能信息, 因此, 人们希望通过融合不同影像模式的方式来同时获取解剖及功能图像。PET-CT和SPECT-CT已经成功应用于临床, 最近又出现了PET-MRI系统[1-2], 其他一些设备也在研制中。在许多情况下, 这些影像模式需要使用显像剂或对比剂来产生或放大影像对比, 例如, 放射性核素用于PET或SPECT、顺磁性物质用于MRI增强、高密度分子用于CT增强、微泡用于超声增强或荧光素用于光学成像等。这些显像剂或对比剂的运用大大提高了影像诊断的能力。近年来, 人们在多模式影像探针的研究领域已经取得了巨大进展。与使用两种不同生物学分布的探针进行显像然后再进行复杂数据融合不同, 双功能探针在一个分子中融合了能同时用于两种不同影像模式的结构。本文讨论了双模式分子影像探针的研究进展及其应用。
-
放射性核素显像(如PET)具有很高的探测灵敏度, 但是空间分辨率差, 因而难以分辨细致的解剖结构; MRI拥有很高的空间分辨率及良好的形态学分辨率, 但是探测灵敏度又有限, 而结合MRI的高空间分辨率、良好的形态学分辨率及PET的高灵敏度, 可以大大提高早期诊断疾病的能力。目前, 有数种PET-MRI系统已成功用于小动物及人体成像[1-2]。与此同时, PET-MRI双模式探针的研制也取得了很大进展。124I-血清白蛋白-锰铁氧化物(124I-serum albumin-Mn magnetism engineered iron oxide, 124I-SA-MnMEIO)双模式PET-MRI探针用于前哨淋巴结检查就是一个很好的例子[3]。淋巴系统是人体重要的防御系统, 也是重要的癌症转移途径, 淋巴结的准确成像对癌症的诊断、分期及决策治疗都是至关重要的。Choi等[3]将SA包被在磁性纳米粒MnMEIO周围, 然后再将放射性碘离子结合到SA的酪氨酸残基上, 形成124I-SA-MnMEIO。MnMEIO是一种锰铁氧化物纳米粒, 其MRI对比效应较超顺磁性氧化铁纳米粒高2~3倍[4]。124I-SAMnMEIO保持了磁性纳米粒和放射性碘各自的成像效应, 它们之间不会产生相互影响。当把124I-SAMnMEIO注入小鼠前爪后, 位于深部的臂淋巴结被清晰显示。另一个相似的例子就是64Cu标记的超顺磁性氧化铁的脂质体, 这种脂质体已被用于动脉粥样硬化患者的血小板显像[5]。
上述简单组合而成的双模式探针显示了核素显像与MRI的互补性, 进而能为疾病诊断提供更为详细的信息。近来, Lee等[6]报道了一种新的PETMRI双功能纳米探针, 这种探针能被用于整合素受体ανβ3表达阳性的肿瘤。整合素受体ανβ3在肿瘤的发生、新生血管的生成及转移过程中起着重要的作用, 是肿瘤血管内皮细胞膜特异性标志物, 在肿瘤新生血管内皮细胞表面呈上调状态, 正常组织血管内皮细胞的含量极少, 而保留有精氨酸-甘氨酸-天冬氨酸(arginine-glycine-aspartate, RGD)的序列能与之特异性结合[7], 所以整合素受体ανβ3已经被公认为一种有效的显像靶分子。由于RGD肽能特异性结合整合素受体ανβ3, 因此, 大多数成像探针实际上是定位于整合素受体ανβ3的RGD序列。Lee等[6]报道的以RGD序列为基础的PET-MRI影像探针同时具有氧化铁的多聚天冬氨酸(ployaspartic acid coated iron oxide, PASP-IO)纳米粒、由1, 4, 7, 10-四氮杂环十二烷-N, N', N', N''-四乙酸(1, 4, 7, 10-tetraazacyclododecane-N, N', N', N''-tetraacetic acid, DOTA)螯合的64Cu及由化学共价键结合的能识别整合素受体ανβ3的RGD序列, 研究发现64Cu-DOTA-IO-RGD能够用于整合素受体ανβ3阳性的人脑星形胶质母细胞瘤U87MG细胞的显像, 当给接种了U87MG肿瘤的小鼠静脉注射64Cu-DOTAIO-RGD后, 在小动物PET及MRI均显示了64Cu-DOTA-IO-RGD的聚集。
尽管PET-MRI双模式探针的应用为双模式影像提供了补充, 但目前仍存在一些问题。比如, PET具有高度的灵敏度, 仅需要很小剂量的探针就可以显像; 而MRI缺乏灵敏度, 需要注射很大剂量的探针, 因此需要考虑这种由于不同显像模式的不同探测灵敏度所带来的问题。
一体化的PET-MRI系统仍然处在发展的早期阶段[8-9]。随着新的高敏感性的MRI被开发以及PETMRI的进一步融合, PET-MRI双模式探针将会有更大的应用前景。
-
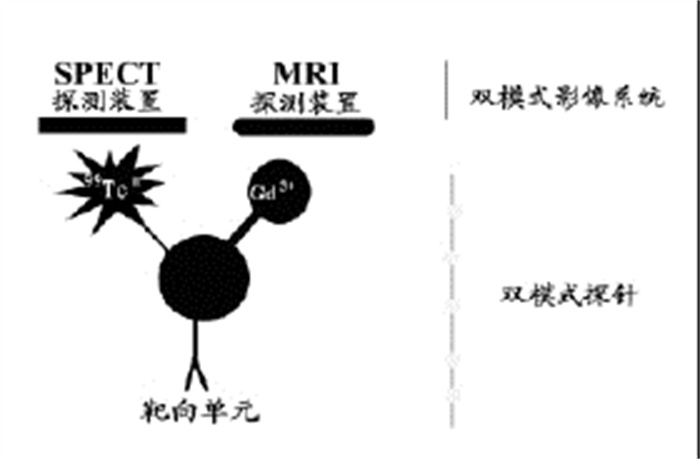
SPECT-MRI双模式影像探测示意见图 1。最近丁志凌等[10]和Chen等[11]通过99Tcm标记二亚乙基三胺五乙酸钆(gadolinium-diethylenetriamine pentaace tic acid, Gd-DTPA)的方法制备了一种同时具有放射性核素及顺磁性物质的螯合物, 初步研究了这种螯合物的生物学分布, 并在SPECT及MRI下分别进行了显像研究, 结果显示这种螯合物可成为一种潜在的双模式影像探针[12]。
-
PET或SPECT与光学成像相结合的多功能分子影像研究正在进行中[13]。与其他影像探针相比, 核医学-光学成像双模式影像探针能充分利用核医学与光学成像一致的高探测敏感性, 使得从同一系统以相似的机制获得完整的数据成为可能。光学成像能提供微观水平的空间分辨率, 并且能与核医学影像形成交叉验证。尽管核医学-光学成像系统还处于起步阶段, 但一些以多肽、小分子、抗体为基础的供核医学-光学成像系统使用的双模式探针已陆续被报道。
Li等[14]报道了一种以多肽为基础的用于核医学-光学成像系统双模式影像探针111In-DTPAIRDye800-RGD环肽(IR Dye800为一种近红外荧光素), 它由111In和DTPA螯合用于核医学显像, 并用近红外荧光素IRDye800用于光学成像。该探针在整合素受体ανβ3阳性的M21黑色素瘤比整合素受体ανβ3阴性的M21黑色素瘤有更高的分布率, 所以这种探针的光学及核医学成像有可能用于检测整合素受体ανβ3阳性的肿瘤。相似的思路被用于白细胞介素11受体α链(interleukin-11 receptor α, IL-11Rα)[15]。IL-11是一个多功能细胞因子, 它属于一个多效细胞因子家族, 其受体IL-11Rα与乳腺癌的发生发展有关, 并且在乳腺癌骨转移中扮演重要角色, 能提示乳腺癌的预后, 进而IL-11Rα有可能被用于肿瘤的体内靶向诊断。Wang等[15]报道了一种以IL-11Rα为靶向的探针111In-DTPA-Bz-NHSA-K(IR-783-S-Ph-CO)-c(CGRRAGGSC)NH2(111In-DLIA-IL11Rα), 其由环形多肽Cys-Gly-Arg-Arg-Ala-Gly-Gly-Ser-Cys组成, 目前已知可以靶向结合于IL-11Rα, 其连接上111In-DTPA作为放射性示踪剂、IR-783作为近红外荧光素用于光学成像。
现代无机高分子化学及影像医学的发展已经使设计纳米影像探针成为可能。Cai等[16]报道了一种以量子点(quantum dot, QD)为基础的双模式探针用于PET-光学成像系统。QD是一种无机荧光体, 比常规有机荧光素具有更优良的光学成像特性[17]。QD表面被RGD肽修饰, 从而具有更强的整合素受体ανβ3靶向性, 并且以64Cu标记DOTA-QDRGD后能用于PET。这种双功能探针能很好显示裸鼠整合素受体ανβ3阳性的U87MG肿瘤, 其肿瘤∶肌肉之比达4.0, 在PET体内探测和体外荧光和组织匀浆荧光相关性对比实验中显示了很好的线性关系。
双标记抗体已经被用于活体乳腺癌的成像。人表皮生长因子受体2(human epithelial growth factor receptor-2, HER2)属于表皮生长因子受体家族成员, 本身具有酪氨酸蛋白激酶活性, 通过调节复杂的细胞内信号传导网络以控制正常或病变细胞生长分化, HER2的过度表达是乳腺侵袭性肿瘤和预后不良的信号。Trastuzumab是一种作用于HER2信号传导的人抗-HER2抗体, 已经被美国食品和药物管理局批准用于HER2过度表达的乳腺癌治疗。HER2存在于细胞的质膜, 作为潜在的肿瘤诊断靶点, 通过标记Trastuzumab或其片段可实现多种方法显示HER2过度表达肿瘤。Sampath等[18]研制了一种双标记抗体——(111In-DTPA)n-Trastuzumab-(IRDye800)m, 并证明它对HER2过度表达的肿瘤具有良好的特异性, 在接种了SKBr3细胞的肿瘤小鼠体内, (111In-DTPA)n-trastuzumab-(IRDye800)m成功地通过光学成像和SPECT显示了肿瘤。
尽管放射性核素显像和光学成像显示两者的敏感性具有可比性, 结合核医学在深部组织的高度敏感性及光学成像的高分辨率可以获得探针分布的可视化影像并且为基础研究及可能的临床应用提供快速高效的影像模式, 但目前由于光学成像的探测深度有限, 双模式核医学-光学成像研究主要用于小动物。
-
MRI已成为一种成熟的影像工具, 能提供亚毫米水平的空间高分辨率。MRI对比剂主要通过其顺磁性缩短T1或T2弛豫时间起作用, 增加T1信号强度, 降低T2信号强度。近来有多种新型磁共振对比剂被报道, 例如顺磁性含钆脂质体——超顺磁性氧化铁(superparamagnetic iron oxide, SPIO)纳米粒[19]。MRI-光学成像也是提供活体分子靶向显像的一个有效方法, 其结合了MRI的高空间-时间分辨率及深部组织穿透力和光学成像的高灵敏度。在为数众多的多模式影像探针中, 用于MRI-光学成像的纳米粒探针可能是又一主要的研究方向, 这类探针同时具有含RGD序列的脂质体、能被MRI探测的氧化铁纳米粒及Cy5.5近红外荧光素, 有可能被很好的应用于临床。然而, 目前它们中的大部分没有实现MRI与光学成像的同时显像, 这可能是因为MRI的灵敏度较低或者近红外线的组织穿透力有限。Yu等[20]最近报道了一种热交叉偶联SPIO(thermally cross-linked superparamagneticiron oxide, TCL-SPIO)纳米粒, 并且用这种探针进行了活体肿瘤显像, 将Cy5.5-TCL-SPIO纳米粒由静脉注入接种了Lewis肺肿瘤的小鼠体内, 肿瘤能在4 h内被T2加权MRI清晰显示, 并在光学成像下显影。
Biodot等[21]也报道了一种新的氧化钆(gadolin iumoxide, Gd2O3), 其可用于MRI-光学成像系统。已有报道, 结晶氧化钆纳米粒比钆螯合物具有更高的弛豫率[22]。这些纳米粒具有顺磁性氧化钆核心以及聚硅氧烷外壳, 能够携带荧光染料用于光学成像, 氧化钆核心比广泛使用的含钆对比剂(如Gd-DTPA)具有更好的成像特性。但是, 目前MRI-光学成像的结合还需要进一步优化, MRI需要一个与剂量相关的大的对比剂数量, 还要与光学成像的高灵敏度相统一。
-
碘有很大的X射线吸收系数, 临床上被广泛作为CT对比剂使用, 但目前的CT对比剂如碘化合物由于增强时间较短、经肾脏快速排泄、肾脏毒性和血管渗透等原因, 使其应用受到一定局限。近来, 高密度纳米粒作为CT对比剂的研究已取得突破, 例如, 含金纳米粒在体内CT对比中就有很好的应用, 并且有望成为潜在的双模式探针应用于CT, 因为它能被较容易地控制大小、形状以及表面修饰。Alric等[23]报道了一种螯合了钆的金纳米粒(aurum dithiolated diethylenetriaminepentaacetic gadolinium, Au@DTDTPA-Gd), 该纳米粒用多层DTPA外壳包裹了金纳米粒, 而DTPA外壳又通过二硫键螯合了钆, 能表现出与剂量相关的X射线吸收性质。通过CT及MRI观察, 该纳米粒能在血池中自由循环, 没有观察到肺、肝脏及脾脏的蓄积。由于通过表面修饰金纳米粒可以与目的基团共价连接, 因此针对Au@DTDTPA-Gd的双模式影像探针可望被开发。
超声由于其安全性、费用低廉、使用方便以及广泛的适应证而被广泛应用于临床, 超声对比剂是一种具有声学活性的微泡, 其直径从数百纳米到数毫米, 由于这些微泡具有很大的尺寸, 静脉注射后它们大部分停留于血管内, 因此分子靶主要在脉管系统, 靶向性由微泡外壳的化学结构修饰或共价结合靶向配体到其表面来实现。超声具有相对高的空间分辨率, 但是在组织穿透力及敏感性上则较局限, 因此靶向性微泡的生物学分布及药代动力学不能被准确监测。Willmann等[24]报道了能用于超声-PET系统的、由18F标记的定位于肿瘤血管内皮生长因子受体2的靶向微泡, 并评估了这种微泡在肿瘤小鼠体内的生物学分布, PET显示其在数分钟内快速从血液内清除, 然后被肝脏的枯否细胞和脾脏的巨噬细胞吞噬, 并且这种靶向性微泡在肿瘤组织中有较高的摄取率。
-
双模式影像的临床应用前景是巨大的, 这些先进的影像方法为从分子水平研究疾病的发生、发展过程提供了前所未有的机会, 在诊断疾病、判断预后、制定治疗计划、监测治疗效果中扮演重要角色。为了实现这个目的, 不光需要设计多模式的成像设备, 同时还要发展多模式成像探针。分子影像技术的出现、多学科间的交叉以及纳米技术的进步, 使双模式影像探针的研究快速发展, 然而, 双模式探针的使用仍然处在起步阶段, 还有很多工作需要去做, 包括不同技术的准确性及可重复性、标准化及图像处理的改进等。
在本文中, 我们介绍了多个双模式影像探针的研究进展。这些探针在双模式分子影像中会发挥越来越巨大的作用, 从而将进一步推动未来的多模式分子影像的发展。
双模式分子影像探针研究进展
The research progress of dual-modality probes for molecular imaging
-
摘要: 许多影像模式能应用于体内组织的解剖或功能成像。然而,每种影像模式都有自己的优缺点,目前还没有一种单纯模式能同时提供全部的解剖、功能以及分子信息。联合使用两种不同的影像模式,将大大提高影像诊断及治疗的能力。随着越来越多的双模式影像系统出现,人们对双模式探针的研究已经取得了很大的进展,这些双模式探针能充分发挥每种影像模式的优势,已经成为未来多模式影像的新工具,为临床诊断提供全面的信息。该文讨论了双模式影像探针的研究进展及其面临的挑战。
-
关键词:
- 分子探针 /
- 体层摄影术 /
- 图像处理, 计算机辅助
Abstract: Various imaging modalities have been exploited to investigate the anatomic or functional dissemination of tissues in the body.However, no single imaging modality allows overall structural, functional, and molecular information as each imaging modality has its own unique strengths and weaknesses.The combination of two imaging modalities that investigates the strengths of different methods might offer the prospect of improved diagnostic abilities.As more and more dual-modality imaging system have become clinically adopted, significant progress has been made toward the creation of dual-modality imaging probes, which can be used as novel tools for future multimodality systems.These all-in-one probes take full advantage of two different imaging modalities and could provide comprehensive information for clinical diagnostics.This review discusses the advantages and challenges in developing dual-modality imaging probes.-
Key words:
- Molecular probes /
- Tomography /
- Image processing, computer-assisted
-
[1] Slates RB, F arahani K, Shao Y, et al. A study of artefacts in simultaneous PET and MR imaging using a prototype MR compatible PET scanner. Phys Med Biol, 1999, 44(8): 2015-2027. doi: 10.1088/0031-9155/44/8/312 [2] Cho ZH, Son YD, Kim HK, et al. A fusion PET-MRI system with a high-resolution research tomograph-PET and ultra-high field 7.0 TMRI for the molecular-genetic imaging of the brain. Proteomics, 2008, 8(6): 1302-1323. [3] Choi JS, Park JC, Nah H, et al. A hybrid nanoparticle probe for dual-modality positron emission tomography and magnetic resonance imaging. Angew Chem Int Ed Engl, 2008, 47(33): 6259-6262. doi: 10.1002/anie.200801369 [4] Lee JH, Huh YM, Jun YW, et al. Artificially engineered magnetic nanoparticles for ultra-sensitive molecular imaging. Nat Med, 2007, 13(1): 95-99. doi: 10.1038/nm1467 [5] Jarrett BR, Gustafsson B, Kukis DL, et al. Synthesis of 64Cu-labeled magnetic nanoparticles for multimodal imaging. Bioconjug Chem, 2008, 19(7): 1496-1504. doi: 10.1021/bc800108v [6] Lee HY, Li Z, Chen K, et al. PET/MRI dual-modality tumor imaging using arginine-glycine-aspartic(RGD)-conjugated radiolabeled iron oxide nanoparticles. J Nucl Med, 2008, 49(8): 1371-1379. doi: 10.2967/jnumed.108.051243 [7] 王浩, 施培基, 周晓靓, 等. RGD肽及其衍生物在肿瘤显像及治疗中的研究进展. 国际放射医学核医学杂志, 2007, 31(5): 274-277. doi: 10.3760/cma.j.issn.1673-4114.2007.05.006
[8] Judenhofer MS, Wehrl HF, Newport DF, et al. Simultaneous PETMRI: a new approach for functional and morphological imaging. Nat Med, 2008, 14(4): 459-465. doi: 10.1038/nm1700 [9] Catana C, Procissi D, Wu Y, et al. Simultaneous in vivo positron emission tomography and magnetic resonance imaging. Proc Natl Acad Sci USA, 2008, 105(10): 3705-3710. doi: 10.1073/pnas.0711622105 [10] 丁志凌, 陈跃, 孙媛媛, 等. Gd-DTPA-Dimeglumine的99Tcm标记及其生物学特性. 同位素, 2009, 22(3): 149-155.
[11] Chen Y, Ding ZL, Huang ZW, et al. Preparation and in vivo eraluation of9Tcm-DTPA-Gd for possjble multimodal imaging use. Eur J Nud Mol Imaging, 2009, 36(suppl2): S242. [12] Chen Y, Ding ZL, Huang ZW, et al. Preparation and biodistribution of a novel 99mTc-DTPA-Gd as a potential agent for multimodality imaging. Eur J Nucl Med Mol Imaging, 2009, 36(suppl2): S376. [13] Culver J, Akers W, Achilefu S. Multimodality molecular imaging with combined optical and SPECT/PET modalities. J Nucl Med, 2008, 49(2): 169-172. doi: 10.2967/jnumed.107.043331 [14] Li C, Wang W, Wu Q, et al. Dual optical and nuclear imaging in human melanoma xenografts using a single targeted imaging probe. Nucl Med Biol, 2006, 33(3): 349-358. doi: 10.1016/j.nucmedbio.2006.01.001 [15] Wang W, Ke S, Kwon S, et al. A new optical and nuclear duallabeled imaging agent targeting interleukin 11 receptor alphachain. Bioconjug Chem, 2007, 18(2): 397-402. doi: 10.1021/bc0602679 [16] Cai W, Chen K, Li ZB, et al. Dual-function probe for PET and nearinfrared fluorescence imaging of tumor vasculature. J Nucl Med, 2007, 48(11): 1862-1870. doi: 10.2967/jnumed.107.043216 [17] Alivisatos P. The use of nanocrystals in biological detection. Nat Biotechnol, 2004, 22(1): 47-52. doi: 10.1038/nbt927 [18] Sampath L, Kwon S, Ke S, et al. Dual-labeled trastuzumab-based imaging agent for the detection of human epidermal growth factor receptor 2 overexpression in breast cancer. J Nucl Med, 2007, 48(9): 1501-1510. doi: 10.2967/jnumed.107.042234 [19] Thorek DL, Chen AK, Czupryna J, et al. Superparamagnetic iron oxide nanoparticle probes for molecular imaging. Ann Biomed Eng, 2006, 34(1): 23-38. doi: 10.1007/s10439-005-9002-7 [20] Yu M K, Jeongyy, Park J, et al. Drug-loaded superparamagnetic iron oxide nanoparticles for combined cancer imaging and therapy in vivo. Angew Chem Int Ed, 2008, 47(29): 5362-5365. doi: 10.1002/anie.200800857 [21] Bridot JL, Faure AC, Laurent S, et al. Hybrid gadolinium oxide nanoparticles: multimodal contrast agents for in vivo imaging. J Am Chem Soc, 2007, 129(16): 5076-5084. doi: 10.1021/ja068356j [22] Louis C, Bazzi R, Christophe A, et al. Nanosized hybrid particles with double luminescence for biological labeling. Chem Mater, 2005, l7(7): 1673-1682. [23] Alric C, Serduc R, Mandon C, et al. Gold nanoparticles designed for combining dual modality imaging and radiotherapy. Gold Bulletin, 2008, 41(2): 90-97. doi: 10.1007/BF03216586 [24] Willmann JK, Cheng Z, Davis C, et al. Targeted microbubbles for imaging tumor angiogenesis: assessment of whole-body biodistribution with dynamic micro-PET in mice. Radiology, 2008, 249(1): 2l2-219. -






 下载:
下载: