-
检测存活心肌是否存在以及存活心肌的数量对于缺血性心脏病患者的临床治疗决策的制定具有重要的指导价值[1-2]。虽然多种无创性影像技术可用于评价心肌活力,但不同影像技术的原理导致了其对于心肌活力检测结果的差异[3]。其中核素心肌灌注/代谢显像(以下简称18F-FDG PET)与心脏磁共振成像(cardiac magnetic resonance,CMR)都是评价心肌活力重要的无创性影像技术。与心肌灌注显像相结合的18F-FDG PET心肌代谢显像通过对心肌葡萄糖代谢状况的检测来评价心肌活力;而CMR则利用延迟成像中钆对比剂在纤维瘢痕组织中的异常聚集,使瘢痕组织(梗死心肌)与正常心肌在T1加权像上呈现不同的信号,从而区分梗死心肌与存活心肌,2种影像技术各具优势。目前,PET/MRI已开始用于临床上对存活心肌的一体化检测,研究结果显示,18F-FDG PET与CMR相结合更有利于心肌活力的评价,可以充分发挥18F-FDG PET与CMR各自的优势[4-7]。然而,二者结合的前提是对二者差异的深入认识,以及产生差异的原因的合理解释。虽然以往已有18F-FDG PET与CMR评价心肌活力的价值的对比研究,但样本量相对较少,且对二者的差异分析仍不够全面[4]。本研究旨在进行更加深入且全面的研究,为18F-FDG PET与CMR在评价心肌活力方面更有效地结合提供依据。
-
回顾性分析2016年3月至2019年12月于中国医学科学院阜外医院同期(一个月内)接受18F-FDG PET与CMR评价心肌活力的缺血性心脏病合并心功能不全的患者285例,其中男性260例、女性25例,年龄(57.8±10.0)岁。纳入标准:经冠状动脉造影或CT冠状动脉成像明确为冠心病;超声心动图测定的左室射血分数(LVEF)<50%;18F-FDG PET与CMR检查间隔时间不超过1个月。排除标准:合并非缺血性心肌病、瓣膜性心脏病、先天性心脏病、1个月以内的急性心肌梗死;18F-FDG PET 与CMR检查间期病情发生明显变化或行血运重建术。本研究免除签署知情同意书。本研究经中国医学科学院阜外医院伦理委员会批准(批准号:2023-2062)。
-
患者于静息状态下静脉注射99Tcm-MIBI(原子高科股份有限公司)740 MBq,约60 min后进行显像。采用德国西门子公司 Symbia T16型双探头SPECT/CT仪,配备低能高分辨准直器,矩阵128×128,能峰140 keV,窗宽20%,放大倍数1.25,2个探头呈90°排列,自右前斜45°至左后斜45°,共旋转180°,采集64个投影,每个投影采集20 s。图像重建采用有序子集最大期望值法,4次迭代,8个子集,获得心脏短轴、水平长轴和垂直长轴图像。
-
SPECT心肌灌注显像次日,患者继续行PET心肌代谢显像。显像前所有患者禁食至少8 h,根据血糖水平,口服5~50 g葡萄糖,根据患者血糖变化,可静脉推注适量的胰岛素,调整血糖至适当水平,于静息状态下静脉注射18F-FDG(原子高科股份有限公司)185 MBq,60 min后进行PET/CT显像[8]。采用德国西门子公司Truepoint Biograph 64型PET/CT仪。先进行CT扫描,用于图像定位和衰减校正,随后采用门控方式进行PET图像采集。PET图像采集时间为10 min。图像重建采用有序子集最大期望值法,4次迭代,8个子集,矩阵128×128,放大倍数2.0,短轴图像层厚3 mm。
-
采用荷兰飞利浦公司Ingenia 3.0 T全数字MRI系统行CMR。采用平衡稳态自由进动序列行功能电影成像,包括左心室长轴两腔心、四腔心及8~10层连续短轴图像。采用心功能专用分析软件在左心室短轴电影上测量和计算舒张末期容积、收缩末期容积和射血分数。经肘静脉注入钆喷酸葡胺(德国拜尔医疗制药公司)0.2 mmol/kg,注射速度为4 ml/s,10~15 min后采用相位敏感反转恢复序列行延迟增强成像,扫描层面与电影扫描层面一致。
-
采用5分法[9]分别对99Tcm-MIBI SPECT心肌灌注图像和18F-FDG PET心肌代谢图像进行17节段的半定量视觉评分:放射性摄取完全正常为0分;放射性摄取为正常摄取的76%~99%为1分;放射性摄取为正常摄取的51%~75%为2分;放射性摄取为正常摄取的26%~50%为3分,放射性摄取为正常摄取的0%~25%为4分。血流灌注与代谢均完全正常(均为0分)的心肌节段根据室壁运动是否存在异常分为正常心肌或顿抑心肌;血流灌注减低(1~4分)但代谢正常(0分)的心肌节段为冬眠心肌;血流灌注与代谢均减低(>0分)的心肌节段为梗死心肌。依据血流灌注评分是否低于代谢评分的不同情况又分为非透壁梗死伴正常心肌(血流灌注和代谢评分均为1~3分,二者得分相同)、非透壁梗死伴冬眠心肌(血流灌注评分为2~4分,代谢评分为1~3分,且代谢评分低于血流灌注评分)和透壁梗死心肌(血流灌注和代谢评分均为4分)。采用QGS软件(美国Cedars-Sinai医学中心)对各心肌节段进行室壁运动评分:正常(0分)、轻度减低(1~2分)、重度减低(3分)和无运动(4分)。每个节段的冬眠心肌评分=血流灌注评分−代谢评分,冬眠心肌总含量以百分数的形式表示,计算公式:冬眠心肌总含量=17个节段的冬眠心肌评分总和/(17×4)。梗死心肌总含量同样以百分数的形式表示,计算公式:梗死心肌总含量=17个节段的代谢评分总和/(17×4)[9]。
根据CMR延迟强化图像上每个心肌节段延迟强化程度,采用5分法[10]进行视觉评分:0分为无强化;1分为1%~25%延迟强化厚度;2分为26%~50%延迟强化厚度;3分为51%~75%延迟强化厚度;4分为延迟强化厚度>76%。0分为无梗死;1~2分为非透壁梗死;3~4分为透壁梗死。梗死心肌总含量以百分数的形式表示,计算公式:梗死心肌总含量=17个节段的延迟强化评分总和/(17×4)[10]。
所有患者的18F-FDG PET和CMR图像分别由2名有10年以上工作经验的放射科和核医学科医师独立进行分析,结果不一致时由第3位有10年以上工作经验的主任医师来判断。
-
应用SPSS 25.0软件进行统计学分析。符合正态分布的计量资料以
$\bar x \pm s $ 表示,非正态分布的计量资料以M(Q1,Q3)表示,计数资料以频数及百分比表示。2组计数资料的比较采用Wilcoxon秩和检验,采用Spearman相关系数分析非正态分布计量资料之间的相关性,采用Kendall′s tau-b相关系数分析计数资料之间的相关性。以CMR结果作为诊断梗死心肌的“金标准”,并计算18F-FDG PET检测梗死心肌的灵敏度和特异度,采用Bland-Altman法分析比较CMR与18F-FDG PET检测梗死心肌的一致性。P<0.05为差异有统计学意义。 -
本研究共纳入285例缺血性心脏病合并心功能不全的患者,其中107例患者LVEF≤35%,178例患者LVEF>35%且<50%。209例患者病变血管数目为3支,50例患者为2支,26例患者为单支。285例缺血性心脏病合并心功能不全患者的基线资料见表1。
基本特征 数值 性别[例(%)] 男性 260(91.2) 女性 25(8.8) 年龄(岁, $\bar x \pm s $ 

57.8±10.0 BMI(kg/m2, $\bar x \pm s $ 

25.1±4.3 高血压[例(%)] 153(53.7) 高脂血症[例(%)] 217(76.1) 糖尿病[例(%)] 120(42.1) 吸烟[例(%)] 207(72.6) 脑梗死[例(%)] 43(15.1) COPD[例(%)] 8(2.8) 外周动脉粥样硬化[例(%)] 48(16.8) 既往心肌梗死[例(%)] 233(81.8) LVEF(%) 26.0±12.0 LVEDV(ml, $\bar x \pm s $ 

241.7±96.2 LVESV(ml, $ \bar x \pm s $ 

177.6±86.6 注:BMI为身体质量指数;COPD为慢性阻塞性肺疾病;LVEF为左室射血分数;LVEDV为左室舒张末期容积;LVESV为左室收缩末期容积 表 1 285例缺血性心脏病合并心功能不全患者的基线资料
Table 1. The baseline information of 285 patients with ischemic heart failure combined with cardiac dysfunction
-
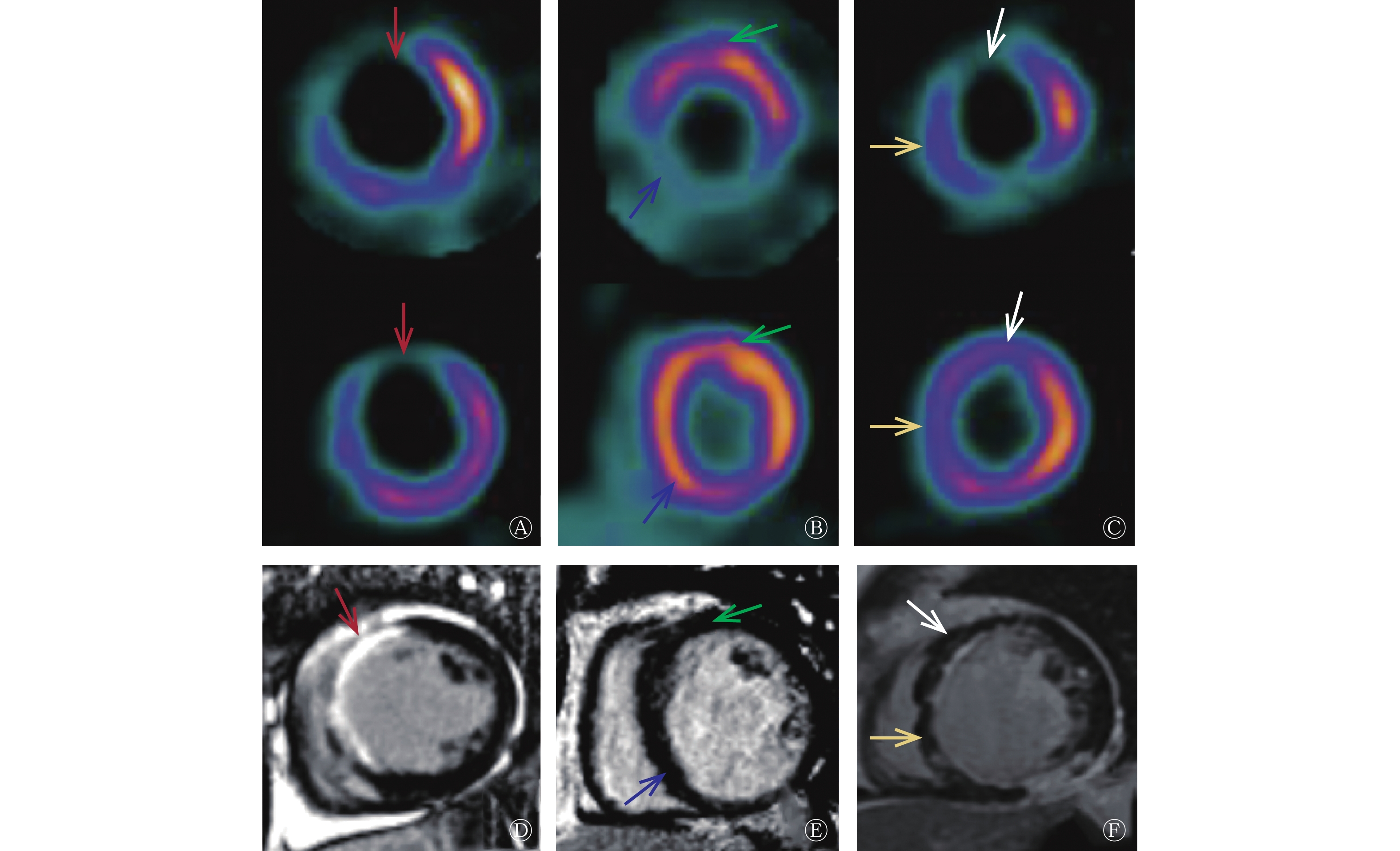
285例患者总共4845个心肌节段,共有3376个(69.7%,3376/4845)18F-FDG PET显示室壁运动异常的心肌节段被纳入分析。CMR显示其中1308个节段为无梗死、1371个节段为非透壁梗死、697个节段为透壁梗死。而18F-FDG PET则显示其中1263个节段灌注/代谢均正常(顿抑心肌)、606个节段为冬眠心肌、344个节段为非透壁梗死伴正常心肌、901个节段为非透壁梗死伴冬眠心肌、262个节段为透壁梗死心肌(图1、表2)。
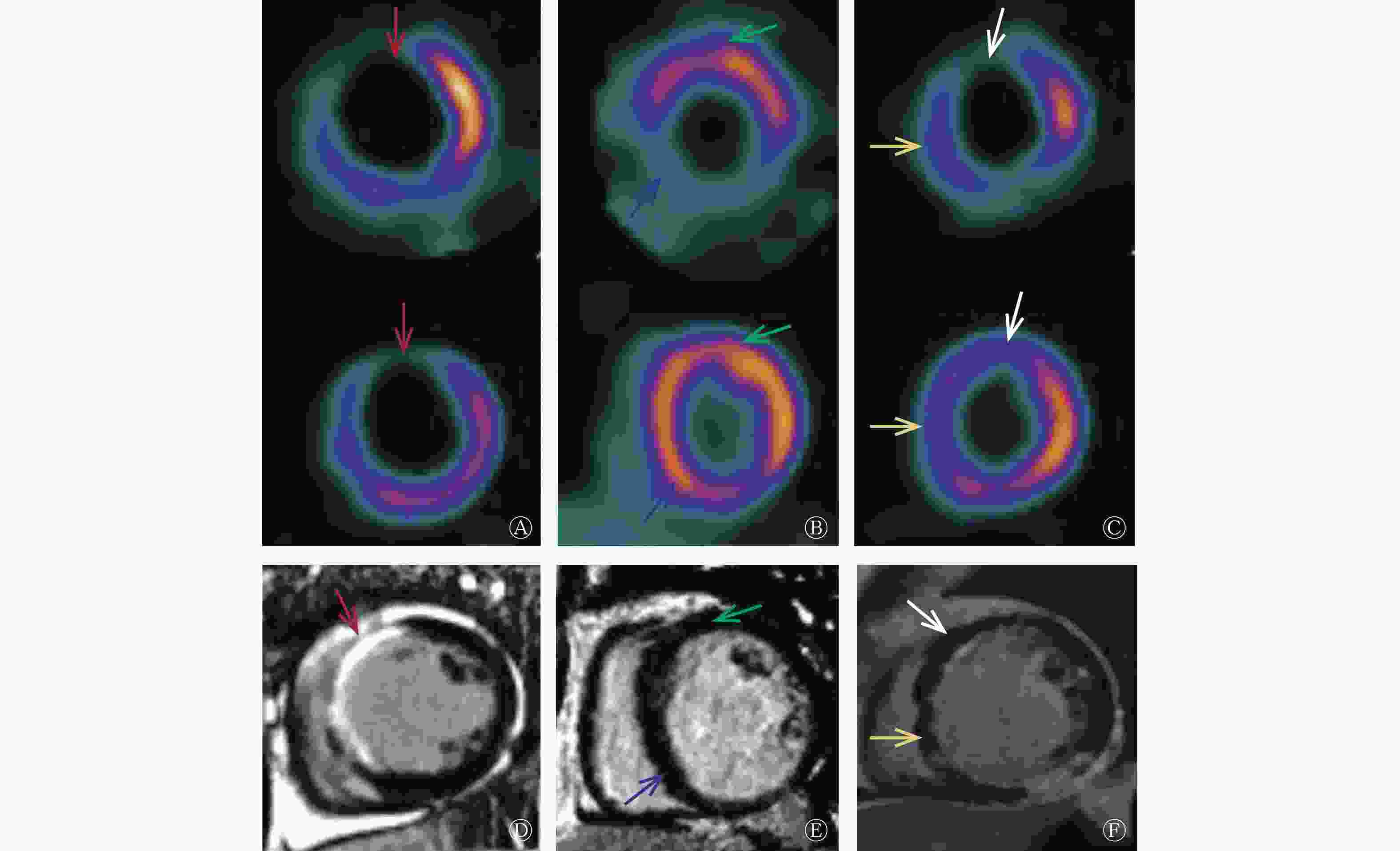
图 1 缺血性心脏病患者的CMR与18F-FDG PET所示不同心肌活力的显像图
Figure 1. Myocardial viability on cardiac magnetic resonance (CMR) and 18F-fluorodeoxyglucose (FDG) PET in patients with ischemic heart failure
CMR 结果 18F-FDG PET 结果 合计 正常心肌 冬眠心肌 非透壁梗死伴正常心肌 非透壁梗死伴冬眠心肌 透壁梗死心肌 无梗死 879 237 46 146 0 1308 非透壁梗死 358 328 147 510 28 1371 透壁梗死 26 41 151 245 234 697 合计 1263 606 344 901 262 3376 注:FDG为氟脱氧葡萄糖;PET为正电子发射断层显像术;CMR为心脏磁共振成像 表 2 18F-FDG PET与CMR评价3376个室壁运动异常的心肌节段心肌活力的结果比较(个)
Table 2. Comparison of 18F-fluorodeoxyglucose (FDG) PET and cardiac magnetic resonance (CMR) in assessment of myocardial viability in 3376 segments with wall motion abnormality (n)
在个体水平,18F-FDG PET和CMR检测的梗死心肌总含量分别为17.6%±13.0%和19.2%±13.4%,二者之间存在显著的相关性(r=0.67,P<0.001,图2A)。Bland-Altman法分析结果显示:与CMR相比,18F-FDG PET对于梗死心肌总含量的检测存在一定程度的低估,CMR与18F-FDG PET评价梗死心肌总含量差值的95%CI为−12.7%~27.8%,平均差值为7.5%(图2B)。
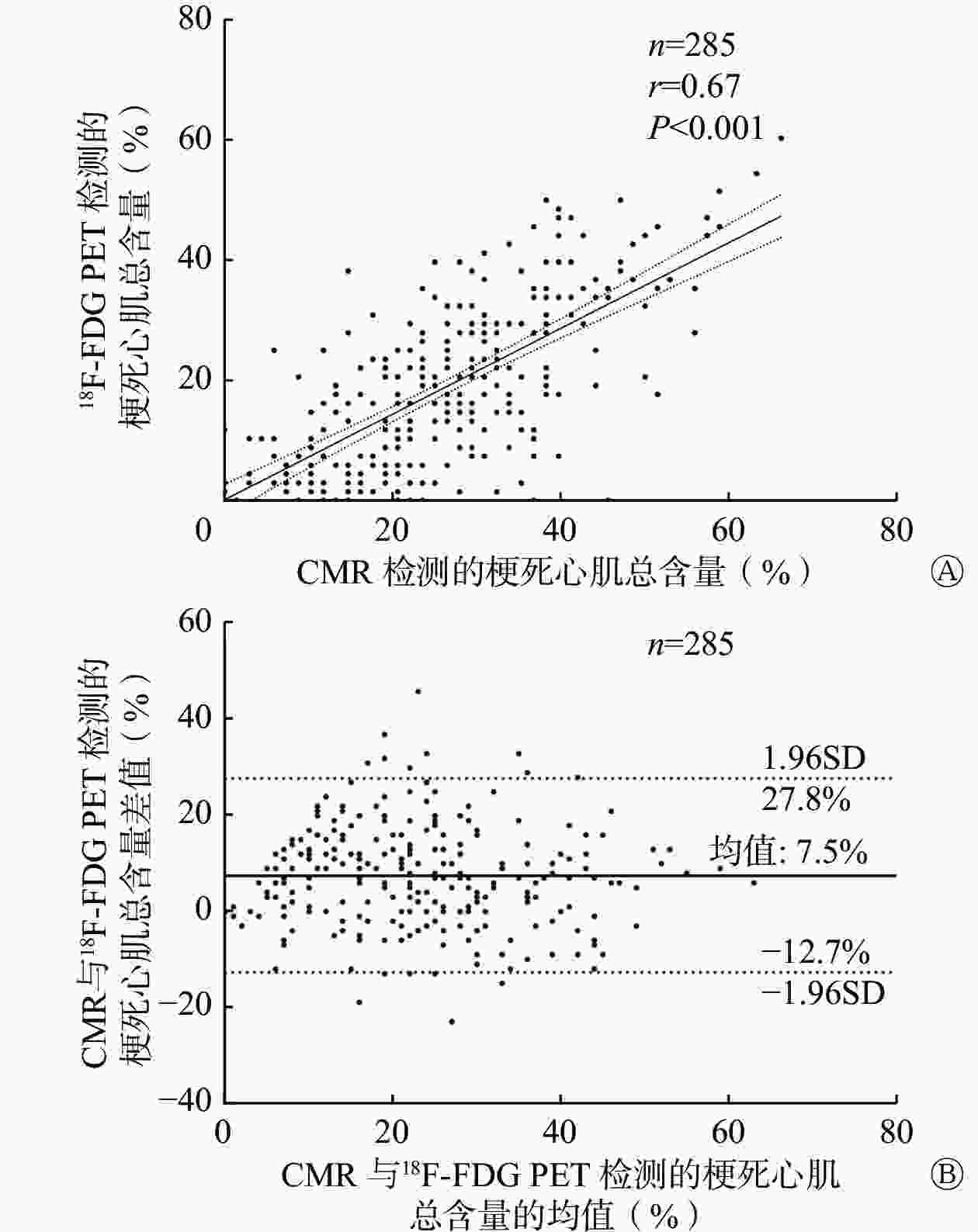
图 2 285例缺血性心脏病患者CMR检测的梗死心肌总含量与18F-FDG PET检测的梗死心肌总含量的相关性(A)和一致性分析(B)
Figure 2. The correlation (A) and agreement (B) of the total content of infarcted myocardium measured through cardiac magnetic resonance (CMR) and 18F-fluorodeoxyglucose (FDG) PET in 285 patients with ischemic heart failure
在CMR显示为透壁梗死的697个运动异常节段中,18F-FDG PET显示绝大多数(90.4%,630/697)节段可见透壁或非透壁梗死,二者显示出较高的一致性。而在CMR显示为非透壁梗死的1371个运动异常节段中,却有多达686个(50.0%,686/1371)节段18F-FDG PET未显示梗死改变,其中358个节段为正常心肌,328个节段为冬眠心肌。
以CMR发现延迟强化作为评价心肌梗死(包括透壁和非透壁心肌梗死)的标准,在节段水平,18F-FDG PET检测梗死心肌的灵敏度为63.6%(1315/2068)、特异度为85.3%(1116/1308)。随着室壁运动障碍严重程度的加剧,18F-FDG PET检测梗死心肌的灵敏度逐步提高,其对室壁运动轻度减低、重度减低和无运动的心肌节段的检测灵敏度分别为46.3%(223/482)、60.7%(568/936)和80.6%(524/650),而特异度则逐步轻度降低,分别为89.8%(467/520)、84.2%(484/575)和77.5%(165/213)。
-
在个体水平, CMR检测的每例患者梗死心肌总含量与18F-FDG PET检测的冬眠心肌总含量之间无显著的相关性(r=−0.09,P=0.12)。在节段水平,在CMR检测为非透壁梗死的1371个节段中,18F-FDG PET检测838个(61.1%)节段有冬眠心肌,其中328个(23.9%)节段完全为冬眠心肌,510个(37.2%)节段有部分为冬眠心肌。而在CMR检测为透壁梗死的697个节段中,18F-FDG PET检测286个(41.0%)节段有冬眠心肌,其中有41个(5.9%)节段完全为冬眠心肌,245个(35.2%)节段有部分为冬眠心肌。CMR检测为非透壁梗死的节段比透壁梗死的节段含有更多的冬眠心肌(61.1%对41.0%,χ2=66.207,P<0.001)。
而另一方面,在室壁运动异常而CMR检测为无梗死或非透壁梗死的2679个节段中,有1237个(46.2%)节段18F-FDG PET检测为灌注/代谢正常(顿抑心肌),1221个(45.6%)节段18F-FDG PET检测有冬眠心肌。
-
本研究比较了18F-FDG PET与CMR在缺血性心脏病伴心功能不全患者心肌活力评价中的价值,结果显示:(1)18F-FDG PET与CMR在透壁梗死的检测中具有较好的一致性,但CMR能够发现更多的非透壁梗死(心内膜下梗死);(2)18F-FDG PET能够在CMR显示的梗死心肌中发现较多的存活心肌。
梗死心肌代表不可逆的心肌损伤,既往研究结果表明,随着心肌节段瘢痕范围的扩大,血运重建后室壁功能恢复的可能性降低[11]。因此,准确判断心肌梗死的范围具有重要的临床意义。本研究结果显示,尽管18F-FDG PET与CMR对于透壁梗死的检测具有较好的一致性,但CMR发现的内膜下心肌梗死的节段中约有50.0%被18F-FDG PET所遗漏,这与Klein等[12]的研究结果相近。在该研究中,虽然在个体水平上18F-FDG PET与CMR显示的梗死心肌总含量之间存在较高的相关性(81%),但是在节段水平上,CMR发现的内膜下心肌梗死的节段中约有66.33%在18F-FDG PET上未显示任何梗死改变。这可能是由于18F-FDG PET的分辨率低于CMR,会遗漏内膜下轻微的梗死心肌。此外,受部分容积效应的影响,正常或存活心肌18F-FDG摄取的高信号可能会导致同一节段中的内膜下心肌梗死被掩盖。因此,梗死心肌的范围越大,18F-FDG PET对梗死心肌的检测越灵敏。
本研究结果还显示,有小部分心肌节段在18F-FDG PET上显示的梗死心肌范围较CMR更大,其原因可能是这些节段中心肌变薄,导致18F-FDG摄取被低估,从而高估了梗死心肌的范围。对于室壁变薄的节段的检测,CMR因具有较高的空间分辨率,故更有优势[13]。目前,CMR由于空间分辨率较高,被认为是诊断梗死心肌的 “金标准”,对于预测室壁功能是否能够恢复而言,CMR的阴性预测值较高[14]。因此,在18F-FDG PET鉴别存活心肌的同时,利用CMR准确检测梗死心肌同样也是十分重要的。
心肌缺血损伤后可能会形成顿抑心肌、冬眠心肌和梗死心肌,三者都会出现室壁运动的异常,但只有存活心肌在血运重建术后其室壁功能才有可能得到恢复[4-5,13,15-16]。许多研究结果表明,存在血流灌注减低但存活的冬眠心肌是预后不良的危险因素[17-18],而顿抑心肌在静息状态下的血流灌注是正常的,因此,理论上认为冬眠心肌最需要积极的血运重建加以挽救。CMR的不足之处在于不能区分冬眠心肌和顿抑心肌,而是将室壁运动功能异常但是未发生延迟强化的心肌节段统一视为存活心肌[3],并推测是否需要进行血运重建。而18F-FDG PET将心肌血流灌注和心肌代谢显像的功能联合起来,是目前唯一可以区分冬眠心肌与顿抑心肌的影像方法[19]。以往的许多研究者将CMR延迟强化厚度占心肌节段的50%作为CMR判断梗死心肌与存活心肌的最佳临界值[4],认为延迟强化厚度<50%则说明存在较多的存活心肌,可以进行积极的血运重建。但本研究结果显示,在CMR显示为无梗死或非透壁梗死(延迟强化厚度<50%)的2679个节段中,有46.2%的心肌节段在18F-FDG PET上显示为心肌血流灌注/代谢正常,即为顿抑心肌。因此,18F-FDG PET在鉴别冬眠心肌与顿抑心肌方面具有独特的优势,对于治疗决策的制定具有重要意义。
Wang等[9]曾探讨CMR诊断梗死心肌与冬眠心肌的关系,结果表明:虽然在节段水平上,非透壁梗死的心肌节段比透壁梗死的心肌节段有更多的冬眠心肌,但在个体水平上,梗死心肌的总含量与冬眠心肌的总含量却没有明确的相关性。Beitzke 等[7]的研究结果也表明,无论是用50%还是75% 延迟强化厚度作为CMR判断梗死心肌与存活心肌的最佳临界值,透壁梗死与冬眠心肌之间均无明确的相关性。在本研究中,尽管非透壁梗死的心肌节段有较多的冬眠心肌,但梗死心肌的总含量与冬眠心肌的总含量无明显的相关性,这表明检测梗死心肌对于冬眠心肌的间接评估没有提示作用,18F-FDG PET在鉴别冬眠心肌方面的作用是不可替代的。
此外,在本研究中我们还发现,即使在CMR诊断为透壁梗死的心肌节段中,也有超过41.0%的节段18F-FDG PET可以检测到冬眠心肌。既往研究结果也显示,CMR显示为透壁梗死的节段中梗死心肌与非梗死心肌是掺杂存在的[9]。虽然CMR对于梗死心肌的检测具有较高的灵敏度和准确率,但仅仅依靠CMR也可能会高估梗死心肌的范围和遗漏冬眠心肌,而冬眠心肌常常是发生恶性心律失常的病理基础[20],不容忽视。即使是CMR提示为透壁梗死的节段,如果存在冬眠心肌,也有必要进行血运重建。
本研究存在以下的局限性:(1)本研究为18F-FDG PET与CMR 2种影像技术比较的横断面研究,缺少对治疗后室壁运动恢复情况的验证研究;(2)由于回顾性研究受到资料完整性的限制,本研究中对室壁运动的评分均采用QGS软件进行,而没有结合CMR;(3)18F-FDG PET与CMR是分别进行的,未进行图像融合,在节段位置的匹配上可能存在误差。
综上所述,18F-FDG PET与CMR作为2种常用的无创性影像技术,在评价心肌活力方面各具优势。CMR在检测心肌梗死方面具有更高的检出率,而18F-FDG PET能够检出更多的存活心肌并鉴别冬眠心肌,18F-FDG PET与CMR二者相结合可以提供更全面的心肌活力信息。
利益冲突 所有作者声明无利益冲突
作者贡献声明 宋书扬负责研究的设计与实施、数据的采集与分析、论文的撰写;韩旭负责数据的采集与分析;汪蕾、闫朝武、方纬负责论文的审阅、指导与修订
核素心肌灌注/代谢显像与心脏磁共振成像评价缺血性心脏病心肌活力的对比研究
Comparison of radionuclide myocardial perfusion/metabolic imaging with cardiac magnetic resonance for assessing myocardial viability in ischemic heart failure
-
摘要:
目的 对比核素心肌灌注/代谢显像[以下简称18F-氟脱氧葡萄糖(FDG) PET]与心脏磁共振成像(CMR)在缺血性心脏病患者心肌活力评价中的价值。 方法 回顾性分析2016年3月至2019年12月于中国医学科学院阜外医院同期(一个月内)接受18F-FDG PET与CMR评价心肌活力的缺血性心脏病合并心功能不全的患者285例,其中男性260例、女性25例,年龄(57.8±10.0)岁。按照17节段法分析18F-FDG PET与CMR 2种方法鉴别各心肌节段存活心肌与梗死心肌结果的一致性和差异。采用Spearman相关系数和Kendall′s tau-b相关系数分析2种方法之间鉴别心肌活力类型的相关性。采用Bland-Altman法分析比较2种方法检测梗死心肌的一致性。 结果 285例患者总共4845个心肌节段,共有3376个(69.7%)18F-FDG PET显示室壁运动异常的心肌节段被纳入分析。18F-FDG PET与CMR检测的梗死心肌总含量分别为17.6%±13.0%和19.2%±13.4%,二者之间存在显著的相关性(r=0.67,P<0.001)。与CMR相比,18F-FDG PET对于梗死心肌总含量的检测存在一定程度的低估(梗死心肌总含量差值的95%CI为−12.7%~27.8%,平均差值为7.5%)。在CMR检测为透壁梗死的697个运动异常节段中,18F-FDG PET检测绝大多数(90.4%,630/697)节段可见透壁或非透壁梗死,二者显示出较高的一致性。而在CMR检测为非透壁梗死的1371个节段中,却有多达686个(50.0%)节段18F-FDG PET未检测到梗死改变。在个体水平,CMR检测的每例患者的梗死心肌总含量与18F-FDG PET检测的冬眠心肌总含量之间无显著的相关性(r=−0.09,P=0.12)。在节段水平,在CMR检测为非透壁梗死的1371个节段中,18F-FDG PET检测838个(61.1%)节段有冬眠心肌;而在CMR检测为透壁梗死的697个节段中,18F-FDG PET检测286个(41.0%)节段有冬眠心肌。CMR检测为非透壁梗死的节段比透壁梗死的节段含有更多的冬眠心肌(61.1% 对41.0%, χ2=66.207,P<0.001)。 结论 18F-FDG PET与CMR在评价缺血性心脏病患者心肌活力中各具优势。CMR在检测心肌梗死方面具有更高的检出率,而18F-FDG PET能够检出更多的存活心肌并鉴别冬眠心肌,18F-FDG PET与CMR 二者相结合可以提供更全面的心肌活力信息。 Abstract:Objective To compare the capability of radionuclide myocardial perfusion/metabolic imaging (hereinafter referred to as 18F-FDG PET) and cardiac magnetic resonance (CMR) in the assessment of myocardial viability among patients with ischemic heart failure. Methods A total of 285 consecutive patients with ischemic heart failure combined with cardiac dysfunction who underwent 18F-FDG PET and CMR imaging simultaneously (within a month) at Fuwai Hospital, Chinese Academy of Medical Sciences from March 2016 to December 2019 were included in the retrospective analysis. The patients comprised 260 males and 25 females, aged (57.8±10.0) years. The 17-segment method was used to compare the agreement and differences of 18F-FDG PET and CMR in the identification of viable myocardium and infarcted myocardium in each myocardial segment. Spearman correlation coefficient and Kendall′s tau-b correlation coefficient were used to analyze the correlation between the two methods in the identification of different myocardial viabilities. The Bland-Altman method was used to evaluate the diagnostic agreement between the two methods in assessing infarcted myocardium. Results Of the 285 patients with a total of 4845 myocardial segments, 3376 (69.7%) myocardial segments with wall motion abnormality on 18F-FDG PET were included in the analysis. The total content of infarcted myocardium measured through 18F-FDG PET and CMR was 17.6%±13.0% and 19.2%±13.4%, respectively, and a significant correlation existed between them (r=0.67, P<0.001). By contrast, 18F-FDG PET may underestimate the content of infarcted myocardium compared with CMR (The 95%CI of the total difference in infarcted myocardium content was −12.7%–27.8%, and the mean difference was 7.5%). Among the 697 segments with motion abnormality detected through CMR as transmural infarctions, most (90.4%, 630/697) showed transmural or non-transmural infarctions detected through 18F-FDG PET, showing a high agreement between the two methods. Among the 1371 segments detected as non-transmural infarctions through CMR, as many as 686 (50.0%) did not show infarct changes on 18F-FDG PET. At the individual level, no significant correlation (r=−0.09, P=0.12) exists between the total infarcted myocardium content detected through CMR and the total hibernating myocardium content detected through 18F-FDG PET in each patient. Among the 1371 segments detected as non-transmural infarctions through CMR, 838 (61.1%) had hibernating myocardium detected through 18F-FDG PET. Moreover, among the 697 segments detected as transmural infarctions through CMR, 286 (41.0%) had hibernating myocardium detected through 18F-FDG PET. Segments with non-transmural infarctions detected through CMR contained more hibernating myocardium than those with transmural infarctions (61.1% vs. 41.0%, χ2=66.207, P<0.001). Conclusions 18F-FDG PET and CMR have their strengths in assessing myocardial viability in patients with ischemic heart failure. CMR is superior to 18F-FDG PET in terms of identifying infarcted myocardium, whereas 18F-FDG PET is more sensitive in detecting viable myocardium with the ability to distinguish hibernating myocardium. Combining 18F-FDG PET and CMR will provide more comprehensive information on myocardial viability. -
表 1 285例缺血性心脏病合并心功能不全患者的基线资料
Table 1. The baseline information of 285 patients with ischemic heart failure combined with cardiac dysfunction
基本特征 数值 性别[例(%)] 男性 260(91.2) 女性 25(8.8) 年龄(岁, $\bar x \pm s $ 

57.8±10.0 BMI(kg/m2, $\bar x \pm s $ 

25.1±4.3 高血压[例(%)] 153(53.7) 高脂血症[例(%)] 217(76.1) 糖尿病[例(%)] 120(42.1) 吸烟[例(%)] 207(72.6) 脑梗死[例(%)] 43(15.1) COPD[例(%)] 8(2.8) 外周动脉粥样硬化[例(%)] 48(16.8) 既往心肌梗死[例(%)] 233(81.8) LVEF(%) 26.0±12.0 LVEDV(ml, $\bar x \pm s $ 

241.7±96.2 LVESV(ml, $ \bar x \pm s $ 

177.6±86.6 注:BMI为身体质量指数;COPD为慢性阻塞性肺疾病;LVEF为左室射血分数;LVEDV为左室舒张末期容积;LVESV为左室收缩末期容积 表 2 18F-FDG PET与CMR评价3376个室壁运动异常的心肌节段心肌活力的结果比较(个)
Table 2. Comparison of 18F-fluorodeoxyglucose (FDG) PET and cardiac magnetic resonance (CMR) in assessment of myocardial viability in 3376 segments with wall motion abnormality (n)
CMR 结果 18F-FDG PET 结果 合计 正常心肌 冬眠心肌 非透壁梗死伴正常心肌 非透壁梗死伴冬眠心肌 透壁梗死心肌 无梗死 879 237 46 146 0 1308 非透壁梗死 358 328 147 510 28 1371 透壁梗死 26 41 151 245 234 697 合计 1263 606 344 901 262 3376 注:FDG为氟脱氧葡萄糖;PET为正电子发射断层显像术;CMR为心脏磁共振成像 -
[1] Neumann FJ, Sousa-Uva M, Ahlsson A, et al. 2018 ESC/EACTS Guidelines on myocardial revascularization[J]. Eur Heart J, 2019, 40(2): 87−165. DOI: 10.1093/eurheartj/ehy394. [2] Knuuti J, Wijns W, Saraste A, et al. 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes: the task force for the diagnosis and management of chronic coronary syndromes of the European Society of Cardiology (ESC)[J]. Eur Heart J, 2020, 41(3): 407−477. DOI: 10.1093/eurheartj/ehz425. [3] Garcia MJ, Kwong RY, Scherrer-Crosbie M, et al. State of the art: imaging for myocardial viability: a scientific statement from the American heart association[J]. Circ Cardiovasc Imaging, 2020, 13(7): e000053. DOI: 10.1161/hci.0000000000000053. [4] Rischpler C, Langwieser N, Souvatzoglou M, et al. PET/MRI early after myocardial infarction: evaluation of viability with late gadolinium enhancement transmurality vs. 18F-FDG uptake[J]. Eur Heart J Cardiovasc Imaging, 2015, 16(6): 661−669. DOI: 10.1093/ehjci/jeu317. [5] Vitadello T, Kunze KP, Nekolla SG, et al. Hybrid PET/MR imaging for the prediction of left ventricular recovery after percutaneous revascularisation of coronary chronic total occlusions[J]. Eur J Nucl Med Mol Imaging, 2020, 47(13): 3074−3083. DOI: 10.1007/s00259-020-04877-w. [6] Priamo J, Adamopoulos D, Rager O, et al. Downstream indication to revascularization following hybrid cardiac PET/MRI: preliminary results[J]. Nucl Med Commun, 2017, 38(6): 515−522. DOI: 10.1097/mnm.0000000000000680. [7] Beitzke D, Rasul S, Lassen ML, et al. Assessment of myocardial viability in ischemic heart disease by PET/MRI: comparison of left ventricular perfusion, hibernation, and scar burden[J]. Acad Radiol, 2020, 27(2): 188−197. DOI: 10.1016/j.acra.2019.03.021. [8] Sun XX, Li SH, Wang YW, et al. Rescue protocol to improve the image quality of 18F-FDG PET/CT myocardial metabolic imaging[J]. Clin Nucl Med, 2021, 46(5): 369−374. DOI: 10.1097/rlu.0000000000003572. [9] Wang L, Lu MJ, Feng L, et al. Relationship of myocardial hibernation, scar, and angiographic collateral flow in ischemic cardiomyopathy with coronary chronic total occlusion[J]. J Nucl Cardiol, 2019, 26(5): 1720−1730. DOI: 10.1007/s12350-018-1241-8. [10] Roes SD, Kaandorp TA, Marsan NA, et al. Agreement and disagreement between contrast-enhanced magnetic resonance imaging and nuclear imaging for assessment of myocardial viability[J]. Eur J Nucl Med Mol Imaging, 2009, 36(4): 594−601. DOI: 10.1007/s00259-008-1001-0. [11] Khalaf S, Chamsi-Pasha M, Al-Mallah MH. Assessment of myocardial viability by PET[J]. Curr Opin Cardiol, 2019, 34(5): 466−472. DOI: 10.1097/hco.0000000000000652. [12] Klein C, Nekolla SG, Bengel FM, et al. Assessment of myocardial viability with contrast-enhanced magnetic resonance imaging: comparison with positron emission tomography[J]. Circulation, 2002, 105(2): 162−167. DOI: 10.1161/hc0202.102123. [13] Kühl HP, Lipke CSA, Krombach GA, et al. Assessment of reversible myocardial dysfunction in chronic ischaemic heart disease: comparison of contrast-enhanced cardiovascular magnetic resonance and a combined positron emission tomography-single photon emission computed tomography imaging protocol[J]. Eur Heart J, 2006, 27(7): 846−853. DOI: 10.1093/eurheartj/ehi747. [14] Santos BS, Ferreira MJ. Positron emission tomography in ischemic heart disease[J/OL]. Rev Port Cardiol (Engl Ed), 2019, 38(8): 599−608 [2023-08-13]. https://pubmed.ncbi.nlm.nih.gov/31694787. DOI: 10.1016/j.repc.2019.02.011. [15] Knuesel PR, Nanz D, Wyss C, et al. Characterization of dysfunctional myocardium by positron emission tomography and magnetic resonance: relation to functional outcome after revascularization[J]. Circulation, 2003, 108(9): 1095−1100. DOI: 10.1161/01.Cir.0000085993.93936.Ba. [16] Kiko T, Yokokawa T, Misaka T, et al. Myocardial viability with chronic total occlusion assessed by hybrid positron emission tomography/magnetic resonance imaging[J]. J Nucl Cardiol, 2021, 28(5): 2335−2342. DOI: 10.1007/s12350-020-02041-3. [17] Kwon DH, Obuchowski NA, Marwick TH, et al. Jeopardized myocardium defined by late gadolinium enhancement magnetic resonance imaging predicts survival in patients with ischemic cardiomyopathy: impact of revascularization[J/OL]. J Am Heart Assoc, 2018, 7(22): e009394[2023-08-13]. https://www.ahajournals.org/doi/10.1161/JAHA.118.009394?url_ver=Z39.88-2003&rfr_id=ori:rid:crossref.org&rfr_dat=cr_pub%20%200pubmed. DOI: 10.1161/jaha.118.009394. [18] Gerber BL, Rousseau MF, Ahn SA, et al. Prognostic value of myocardial viability by delayed-enhanced magnetic resonance in patients with coronary artery disease and low ejection fraction: impact of revascularization therapy[J]. J Am Coll Cardiol, 2012, 59(9): 825−835. DOI: 10.1016/j.jacc.2011.09.073. [19] Bucciarelli-Ducci C, Auger D, Di Mario C, et al. CMR guidance for recanalization of coronary chronic total occlusion[J]. JACC Cardiovasc Imaging, 2016, 9(5): 547−556. DOI: 10.1016/j.jcmg.2015.10.025. [20] Panza JA, Ellis AM, Al-Khalidi HR, et al. Myocardial viability and long-term outcomes in ischemic cardiomyopathy[J]. N Engl J Med, 2019, 381(8): 739−748. DOI: 10.1056/NEJMoa1807365. -





 下载:
下载: