-
甲状腺癌的发病率及晚期病死率逐年升高[1-2]。DTC作为一种最常见的甲状腺癌,发病率在所有甲状腺癌中高达95%以上,其主要包括甲状腺乳头状癌(papillary carcinoma of thyroid,PTC)和甲状腺滤泡状癌[3]。大多数DTC患者经手术、131I内照射治疗或TSH抑制治疗后预后较好,但仍有23%的患者会发生远处转移[4],其中约1/3发生失分化,最终发展为放射性碘难治性分化型甲状腺癌(radioactive iodine-refractory differentiated thyroid cancer,RAIR-DTC)[5]。RAIR-DTC患者的预后较差,平均生存期仅为3~5年,10年生存率仅为10%[3]。目前靶向前列腺特异性膜抗原(prostate specific membrane antigen,PSMA)的药物已用于前列腺癌患者的诊断及治疗,且不良反应少[6]。而PSMA并非只在前列腺中特异性表达,Verburg等[7]和Verma等[8]进行的68Ga-PSMA PET/CT显像研究结果显示,DTC患者的PSMA表达水平同样较高;Ciappuccini等[9]开展的免疫组织化学研究结果也证实了DTC患者血管内皮细胞中有PSMA表达,且RAIR-DTC患者中PSMA表达水平更高。这表明18F-PSMA PET有望成为RAIR-DTC患者新的诊断方法,但目前对RAIR-DTC患者进行18F-PSMA PET/CT显像的研究较少。本文中我们对1例索拉非尼靶向治疗耐药的RAIR-DTC患者行18F-PSMA PET/CT显像,评估其在适合进行放射性核素标记PSMA靶向治疗的患者筛选中的价值,旨在为RAIR-DTC患者提供新的诊断和治疗方法。
-
患者男性,69岁,2014年4月10日因“右下肺孤立性结节伴右颈部淋巴结肿大”至江苏省苏北人民医院就诊。2014年4月14日行CT引导下肺穿刺活检术,术后组织病理学检查结果示右肺转移性PTC。2014年4月25日行甲状腺癌根治术,术后组织病理学检查结果示甲状腺右叶及峡部PTC,肿块大小1.2 cm× 0.8 cm× 0.8 cm,颈部淋巴结(Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅵ、Ⅶ区)均见癌转移。131I治疗前血清TSH为89.83 mIU/L(正常参考值为0.27~4.20 mIU/L)、甲状腺球蛋白(thyroglobulin,Tg)为160.1 ng/ml(正常参考值为1.4~78.0 ng/ml)、甲状腺球蛋白抗体为11.58 IU/ml(正常参考值为0~115.00 IU/ml)。2014年6月4日给予患者7.4 GBq 131I内照射治疗,5 d后行131I全身显像(whole body scan,WBS),结果显示:颈部多发放射性浓聚灶,考虑为残留甲状腺组织及甲状腺癌转移;右肺局灶性放射性浓聚灶,考虑为甲状腺癌转移。
131I内照射治疗后给予患者TSH抑制治疗。2014年7月21日,131I内照射治疗后1个月复查结果:血清TSH为0.03 mIU/L、Tg为28.8 ng/ml、甲状腺球蛋白抗体为11.12 IU/ml;2014年11月28日,131I内照射治疗后6个月复查结果:血清Tg下降至14.6 ng/ml、TSH为1.57 mIU/L、甲状腺球蛋白抗体为73.88 IU/ml。2014年12月11日行右肺转移瘤切除术,术后组织病理学检查结果为右下肺转移性PTC,但患者后续未规律随诊。
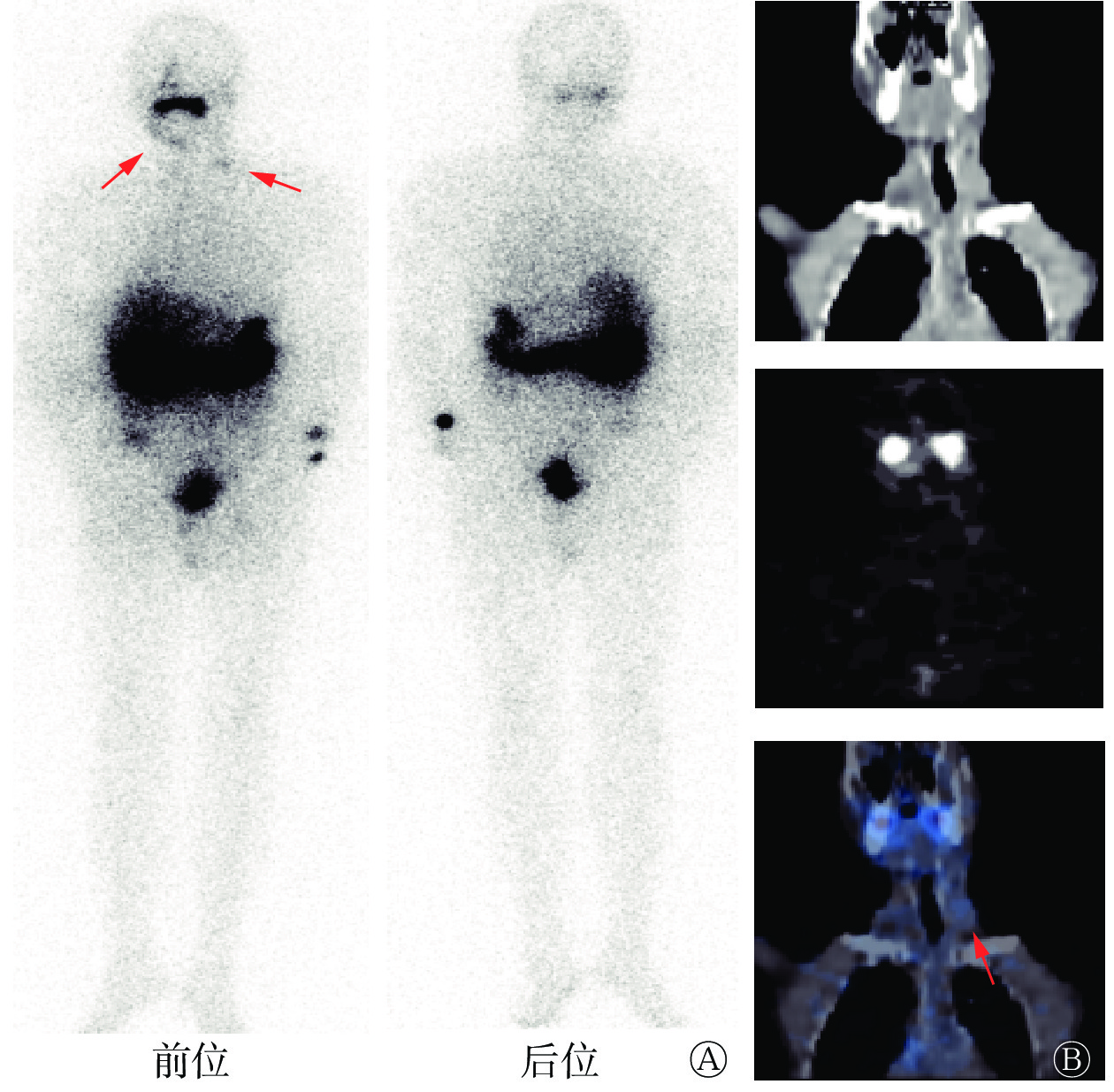
2017年4月11日至2020年4月6日,患者血清Tg水平呈进行性升高,同时颌下偏右位置可自行摸到进行性增大肿块。2020年4月8日再次于我科就诊,颈部超声示:原甲状腺右侧叶部位不均匀质地低回声包块,双侧颈部多发低回声及混合性回声肿块伴微小钙化点,颌下混合性回声包块伴钙化;胸部CT示:双肺多发结节,右侧气管食管旁沟、两侧锁骨上窝多发淋巴结肿大,考虑肿瘤复发转移。2020年4月10日再次行7.4 GBq 131I内照射治疗,5 d后行131I WBS,结果示:双侧颈部放射性稍增高影,考虑为甲状腺癌颈部淋巴结转移(图1)。2021年1月5日,患者因再次131I内照射治疗后血清Tg水平下降缓慢,右颈部病灶未见明显缩小,给予索拉非尼靶向治疗(400 mg/d)。索拉非尼治疗后血清学检查及影像检查结果示:Tg水平和转移淋巴结均较前无明显好转。于是患者至上级医院就诊,行右颌下病灶活检,结果为甲状腺癌转移。综合患者血清学检查、影像检查结果以及治疗史,临床考虑为RAIR-DTC。
图 1 放射性碘难治性分化型甲状腺癌患者(男性,69岁)再次131I内照射治疗后的131I全身显像图和颈部冠状面SPECT/CT图
Figure 1. 131I whole body scan images and cervical coronal SPECT/CT images of a patient (male, 69 years old) with radioactive iodine-refractory differentiated thyroid cancer after the second 131I internal irradiation
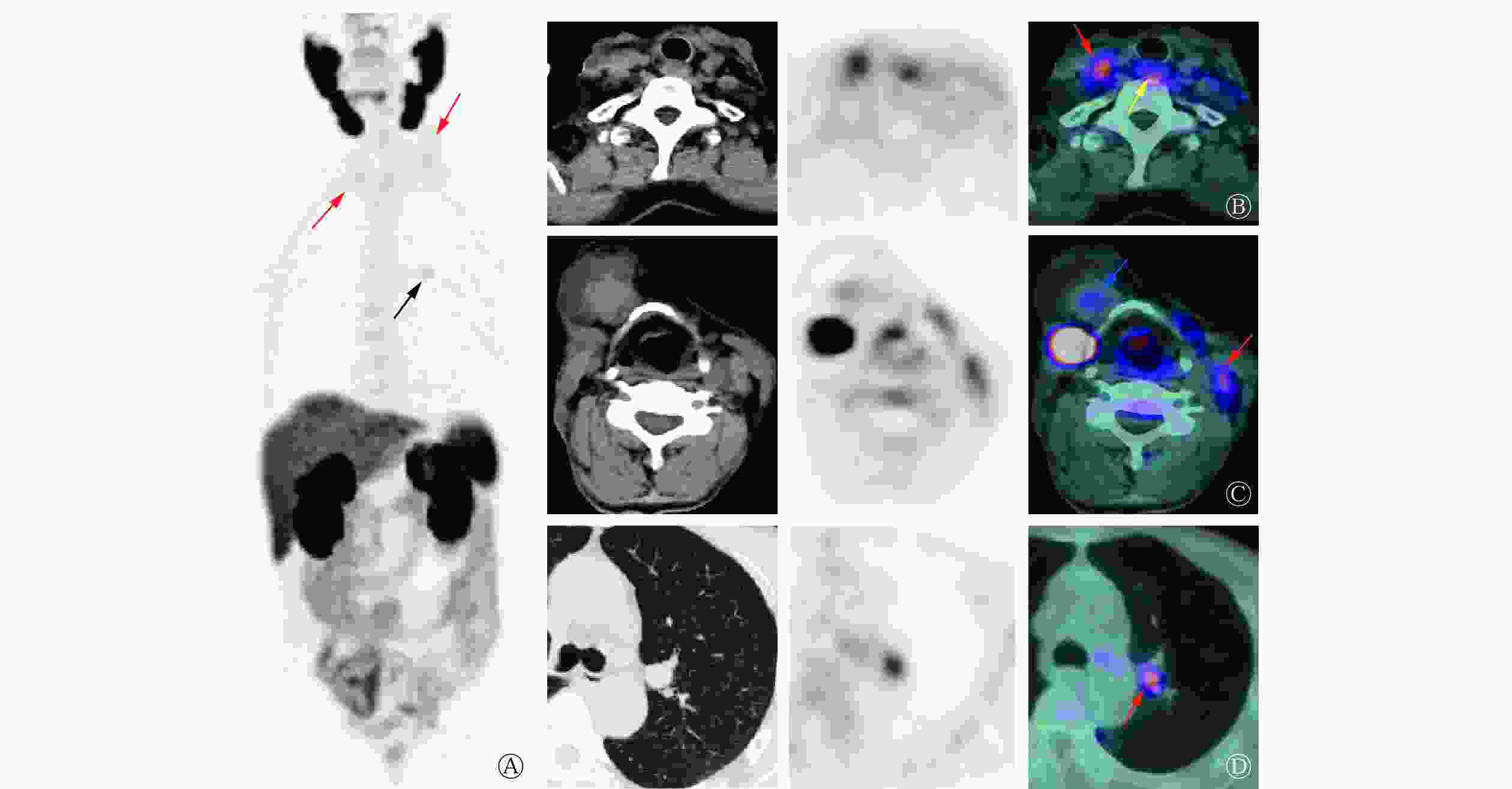
2022年6月,患者为评估病情再次至我科就诊,体格检查:气管居中,颈部可见“L”型 23 cm左右的手术瘢痕,右颌下、双侧颈部及锁骨区触及多个肿大淋巴结(较大者约鸡蛋大小),质地硬、不活动、边界清晰、无痛,颈部未触及甲状腺。行18F-PSMA PET/CT显像(显像剂18F-PSMA 1007购自常熟华益医药有限公司),结果显示:气管右后方(原甲状腺右侧叶部位)混杂密度结节伴放射性摄取升高,大小约2.8 cm×1.5 cm×1.1 cm,SUVmax为3.79(图2B);甲状软骨右前方囊实性肿块影伴实性成分放射性摄取升高,大小约4.5 cm×4.6 cm×4.6 cm,SUVmax为2.15(图2C);双侧颈部及双侧锁骨区多发混杂密度结节、肿块伴放射性摄取升高,较大结节大小约2.2 cm×1.5 cm×2.7 cm,SUVmax为3.65(图2B、2C);双肺多发结节,部分伴PSMA表达水平升高,较大结节位于左肺上叶前段,肺窗示结节大小约1.5 cm×1.3 cm×1.2 cm,SUVmax为3.16(图2D)。结合病史,考虑肿瘤复发转移。
-
RAIR-DTC一般定义为在无外源性碘负荷干扰且处于TSH刺激状态(>30 mIU/L)时,出现以下4种情况的DTC患者:(1)转移灶在首次131I 内照射治疗后的WBS中表现为不摄碘;(2)原本摄碘的功能性转移灶逐渐丧失摄碘能力;(3)部分转移灶摄碘、部分转移灶不摄碘,且可通过18F-FDG PET/CT、CT或MRI等其他影像检查显示;(4)摄碘转移灶在多次131I内照射治疗后虽然保持摄碘能力但仍在1年内出现病情进展,包括病灶逐渐增大、出现新发病灶、Tg水平持续升高等[2]。本例患者首次131I内照射治疗后WBS示颈部及右肺部见放射性浓聚灶,6个月后Tg水平较前下降,这提示131I内照射治疗有效。但131I内照射治疗后血清Tg水平下降缓慢,且3年后血清Tg水平进行性升高,右颈部出现进行性增大的肿块。因颈部术后粘连、二次手术难度大,患者再次行131I内照射治疗,此时患者胸部CT已显示双肺多发转移瘤、双侧颈部及锁骨区多发肿大淋巴结,而131I WBS仅显示部分病灶摄碘,这提示病灶出现失分化可能,后续进行的索拉非尼靶向治疗亦不能控制病情。综上,本例患者被确诊为RAIR-DTC,由于此类患者预后较差,因此迫切需要寻找新的检查及治疗方法。
PSMA又称为谷氨酸羧肽酶Ⅱ,是一种跨膜糖蛋白,最先在前列腺癌细胞中被发现[10],但其表达并不局限于在前列腺中,多种肿瘤的新生血管内皮细胞亦有表达,包括胶质母细胞瘤、肾癌、肺癌、乳腺癌和甲状腺癌等[11]。Verma等[8]的免疫组织化学研究结果显示,PSMA在各亚型甲状腺癌中均有表达,在PTC和甲状腺滤泡状癌中的表达率分别为61%(134/220)和56%(43/77),而在RAIR-DTC中的表达率更高,为63%(15/24),这提示靶向PSMA显像及治疗在RAIR-DTC患者中可能更有前景。目前国内尚无甲状腺癌靶向PSMA显像的相关研究,而国外研究中的显像药物均为68Ga-PSMA,与68Ga-PSMA相比,18F-PSMA-1007能大规模生产,且半衰期适宜、空间分辨率较好[12],更适用于临床研究,因此本研究中选择的显像剂是18F-PSMA-1007。
Verburg等[7]对1例伴颈部淋巴结及肺转移的131I WBS阴性的DTC患者行68Ga-PSMA PET/CT显像,结果显示所有转移灶均有PSMA表达,这与Taywade等[13]的研究结果一致。Verma等[8]进行的68Ga-PSMA PET/CT研究共纳入10例转移性DTC患者,结果显示所有摄碘转移灶均有PSMA表达,且68Ga-PSMA PET/CT对转移灶的检出率高于18F-FDG PET/CT(93.75%对81.85%)。这与一些小样本及个案报道等的研究结果类似,68Ga-PSMA PET/CT不仅能检出摄碘转移灶,亦可检出失分化病灶,且较18F-FDG PET/CT具有明显优势,尤其是在颅内病灶及骨转移病灶的检出方面[14-15]。遗憾的是本例患者拒绝行18F-FDG PET/CT检查,因此无法比较18F-PSMA PET/CT与18F-FDG PET/CT对病灶的检出能力,但可以肯定的是,结合超声及CT检查结果,本例患者的大多数转移灶均有PSMA表达,因此18F-PSMA PET/CT在RAIR-DTC患者诊疗中的作用不容忽视,但尚需大样本研究结果证实其灵敏度和特异度。Uijen等[11]的系统性综述得出,DTC患者原发灶、复发灶和转移灶中PSMA的表达并不相同,原发灶、复发灶的SUVmax为1.4~13.7,而转移灶的SUVmax为0.9~101.8,这提示转移性DTC患者可能有足够的放射性摄取,从而适合接受PSMA放射性配体治疗(radioligand therapy,RLT)。本例患者复发灶的SUVmax为3.79,转移灶的SUVmax为2.05~3.65,与上述研究结果基本一致。
靶向PSMA的RLT是前列腺癌治疗的研究热点,该疗法不良反应少[16]。但在甲状腺癌中靶向PSMA的RLT目前尚处于探索阶段[17-18]。鉴于目前对前列腺癌靶向PSMA RLT的患者的纳入标准缺乏共识,甲状腺癌的靶向PSMA的RLT患者的纳入标准就更不确定了,因此有必要进行大规模RAIR-DTC患者的群体药代动力学和剂量学研究,以制定RAIR-DTC患者的靶向PSMA RLT的纳入标准。
利益冲突 所有作者声明无利益冲突
作者贡献声明 姜玲负责研究命题的设计、文献的检索、病例资料的调阅、论文的撰写;段钰、徐迟峰、汪凌负责图像的采集与分析、论文写作的指导;周海中负责研究的指导、论文的审阅
放射性碘难治性分化型甲状腺癌18F-PSMA PET/CT显像1例
18F-PSMA PET/CT imaging of radioactive iodine-refractory differentiated thyroid cancer: a case report
-
摘要: 笔者报道了1例放射性碘难治性分化型甲状腺癌(RAIR-DTC)患者,分别从临床病史、18F-前列腺特异性膜抗原(PSMA) PET/CT显像方面分析了RAIR-DTC 的特点。RAIR-DTC预后较差,诊断及治疗方法有限。目前18F-PSMA PET/CT显像用于RAIR-DTC患者诊断的研究较少。笔者对1例RAIR-DTC患者行18F-PSMA PET/CT显像,以期为RAIR-DTC患者提供新的诊断及治疗方法。Abstract: The authors reported a case of radioactive iodine-refractory differentiated thyroid cancer (RAIR-DTC). The characteristics of RAIR-DTC were analyzed from the aspects of clinical history and 18F-prostate specific membrane antigen (PSMA) PET/CT imaging. RAIR-DTC has a poor prognosis, and the diagnostic and therapeutic methods are limited. At present, there are few studies on 18F-PSMA PET/CT imaging in the diagnosis of RAIR-DTC patients. The authors performed 18F-PSMA PET/CT imaging on a patient with RAIR-DTC, in order to provide new diagnostic and therapeutic methods for patients with RAIR-DTC.
-
Key words:
-
-
[1] Miranda-Filho A, Lortet-Tieulent J, Bray F, et al. Thyroid cancer incidence trends by histology in 25 countries: a population-based study[J]. Lancet Diabetes Endocrinol, 2021, 9(4): 225−234. DOI: 10.1016/s2213-8587(21)00027-9. [2] Megwalu UC, Moon PK. Thyroid cancer incidence and mortality trends in the United States: 2000-2018[J]. Thyroid, 2022, 32(5): 560−570. DOI: 10.1089/thy.2021.0662. [3] 中华医学会核医学分会. 131I治疗分化型甲状腺癌指南(2021版)[J]. 中华核医学与分子影像杂志, 2021, 41(4): 218−241. DOI: 10.3760/cma.j.cn321828-20201113-00412.
Chinese Society of Nuclear Medicine. Guidelines for radioiodine therapy of differentiated thyroid cancer (2021 edition)[J]. Chin J Nucl Med Mol Imaging, 2021, 41(4): 218−241. DOI: 10.3760/cma.j.cn321828-20201113-00412.[4] Berdelou A, Lamartina L, Klain M, et al. Treatment of refractory thyroid cancer[J]. Endocr Relat Cancer, 2018, 25(4): R209−R223. DOI: 10.1530/erc-17-0542. [5] Schlumberger M, Brose M, Elisei R, et al. Definition and management of radioactive iodine-refractory differentiated thyroid cancer[J]. Lancet Diabetes Endocrinol, 2014, 2(5): 356−358. DOI: 10.1016/s2213-8587(13)70215-8. [6] Wang FJ, Li ZF, Feng XQ, et al. Advances in PSMA-targeted therapy for prostate cancer[J]. Prostate Cancer Prostatic Dis, 2022, 25(1): 11−26. DOI: 10.1038/s41391-021-00394-5. [7] Verburg FA, Krohn T, Heinzel A, et al. First evidence of PSMA expression in differentiated thyroid cancer using [68Ga]PSMA-HBED-CC PET/CT[J]. Eur J Nucl Med Mol Imaging, 2015, 42(10): 1622−1623. DOI: 10.1007/s00259-015-3065-y. [8] Verma P, Malhotra G, Agrawal R, et al. Evidence of prostate-specific membrane antigen expression in metastatic differentiated thyroid cancer using 68Ga-PSMA-HBED-CC PET/CT[J]. Clin Nucl Med, 2018, 43(8): e265−e268. DOI: 10.1097/RLU.0000000000002161. [9] Ciappuccini R, Saguet-Rysanek V, Giffard F, et al. PSMA expression in differentiated thyroid cancer: association with radioiodine, 18FDG uptake, and patient outcome[J]. J Clin Endocrinol Metab, 2021, 106(12): 3536−3545. DOI: 10.1210/clinem/dgab563. [10] Evans JC, Malhotra M, Cryan JF, et al. The therapeutic and diagnostic potential of the prostate specific membrane antigen/glutamate carboxypeptidase Ⅱ (PSMA/GCPⅡ) in cancer and neurological disease[J]. Br J Pharmacol, 2016, 173(21): 3041−3079. DOI: 10.1111/bph.13576. [11] Uijen MJM, Derks YHW, Merkx RIJ, et al. PSMA radioligand therapy for solid tumors other than prostate cancer: background, opportunities, challenges, and first clinical reports[J]. Eur J Nucl Med Mol Imaging, 2021, 48(13): 4350−4368. DOI: 10.1007/s00259-021-05433-w. [12] Kuten J, Fahoum I, Savin Z, et al. Head-to-head comparison of 68Ga-PSMA-11 with 18F-PSMA-1007 PET/CT in staging prostate cancer using histopathology and immunohistochemical analysis as a reference standard[J]. J Nucl Med, 2020, 61(4): 527−532. DOI: 10.2967/jnumed.119.234187. [13] Taywade SK, Damle NA, Bal C. PSMA expression in papillary thyroid carcinoma: opening a new horizon in management of thyroid cancer?[J]. Clin Nucl Med, 2016, 41(5): e263−e265. DOI: 10.1097/rlu.0000000000001148. [14] Lengana T, Lawal IO, Mokoala K, et al. 68Ga-PSMA: a one-stop shop in radioactive iodine refractory thyroid cancer?[J]. Nucl Med Mol Imaging, 2019, 53(6): 442−445. DOI: 10.1007/s13139-019-00621-x. [15] Sasikumar A, Joy A, Pillai MRA, et al. Rare case of intratracheal metastasis detected on 68Ga-prostate-specific membrane antigen PET/CT scan in a case of thyroglobulin elevated negative iodine scan syndrome[J]. Clin Nucl Med, 2018, 43(4): 282−283. DOI: 10.1097/rlu.0000000000001992. [16] Hofman MS, Violet J, Hicks RJ, et al. [177Lu]-PSMA-617 radionuclide treatment in patients with metastatic castration-resistant prostate cancer (LuPSMA trial): a single-centre, single-arm, phase 2 study[J]. Lancet Oncol, 2018, 19(6): 825−833. DOI: 10.1016/s1470-2045(18)30198-0. [17] de Vries LH, Lodewijk L, Braat AJAT, et al. 68Ga-PSMA PET/CT in radioactive iodine-refractory differentiated thyroid cancer and first treatment results with 177Lu-PSMA-617[J/OL]. EJNMMI Res, 2020, 10(1): 18[2023-06-24]. https://ejnmmires.springeropen.com/articles/10.1186/s13550-020-0610-x. DOI: 10.1186/s13550-020-0610-x. [18] Assadi M, Ahmadzadehfar H. 177Lu-DOTATATE and 177Lu-prostate-specific membrane antigen therapy in a patient with advanced metastatic radioiodine-refractory differentiated thyroid cancer after failure of tyrosine kinase inhibitors treatment[J]. World J Nucl Med, 2019, 18(4): 406−408. DOI: 10.4103/wjnm.WJNM_112_18. -





 下载:
下载: