-
在DTC的治疗管理中,甲状腺全切除术(total thyroidectomy, TT)或甲状腺近全切除术(near total thyroidectomy, NTT)是清除肿瘤组织的主要方法。术后131I治疗虽然提高了高危患者的无病生存率和总生存率,但对中低危患者的生存率提高似乎没有明显作用[1-2]。对于术后行131I治疗的DTC患者来说,选择最佳剂量的131I以达到成功治疗的目的仍存在挑战。2项大型Ⅲ期临床试验的长期随访结果证明,低剂量(1.1 GBq)和高剂量(3.7 GBq)131I对低危或中低危DTC患者的短期疗效及长期预后差异均无统计学意义[3-4]。但是在另一项大型随机对照试验(randomized controlled trial, RCT)中,相较于低剂量(1.1 GBq)131I治疗,高剂量(3.7 GBq)131I治疗更易实现短期治疗成功的目标[5]。本研究旨在对已发表的相关文献进行Meta分析,以期对不同剂量131I治疗中低危DTC患者后的短期疗效及长期预后进行评价。
-
检索 PubMed、EMBASE、Cochrane Library、中国知网、万方数据库等数据库,检索时间均为自建库至2022年9月。英文检索词包括“radioiodine”,“radioiodide”,“ Iodine-131”,“ Iodine 131”,“ I-131”,“131I”,“ablat*”,“ differentiated thyroid neoplasm”,“ differentiated thyroid cancer”, “ differentiated thyroid carcinoma”,“papillary thyroid neoplasm”,“papillary thyroid cancer”,“papillary thyroid carcinoma”,“follicular thyroid neoplasm”,“ follicular thyroid cancer”,“ follicular thyroid carcinoma”,“ long-term”,“recurrence”;中文检索关键词包括“分化型甲状腺癌”、“恶性肿瘤”、“ 131I”、“ 碘-131”、“放射性碘”、“放射性核素”、“放射性同位素”。
-
纳入标准:(1)研究为RCT;(2)评估DTC患者(年龄≥16岁)临床结果的研究;(3)患者接受TT或NTT,伴或不伴颈部淋巴结清扫术;(4)术后组织病理学检查证实为DTC,具体类型可以为甲状腺乳头状癌、甲状腺滤泡状癌或混合型,且复发风险分层符合低、中危分层;(5)术后首次131I治疗,低剂量(1.1~2.2 GBq)和高剂量(3.7 GBq)治疗组分别作为试验组和对照组;(6)131I治疗后6~12个月进行疗效评估;(7)进行长期随访(随访时间不低于1年),评估患者长期预后。
排除标准:(1)研究对象存在侵袭性病理亚型;(2)研究对象为妊娠或哺乳期患者;(3)综述、评论性文章、致编辑的信、试验计划、摘要和会议论文;(4)样本量<5的文献;(5)重复报道。
-
包括短期疗效及长期预后指标(疗效评估及复发或病死率)(随访时间≥ 12个月)。
-
2名研究人员独立评估了所有选定的文献,以确定是否符合要求。他们通过讨论解决评估中产生的分歧,如果没有达成一致意见,就联系其他研究人员,并通过投票做出决定。在阅读摘要之前,对所有文题进行相关性审查,然后仔细阅读并评估研究全文。当多家出版物报道了来自同一患者队列的研究结果时,选择最新或最全面的研究。文献提取内容包括:(1)纳入文献的基本信息,包括文献文题、作者姓名、发表期刊、发表时间及所属国家等;(2)研究对象特征,包括患者例数、性别和年龄、手术方式、淋巴结转移情况、131I治疗剂量及后续治疗信息等;(3)疾病特征,包括组织病理学类型和危险度分层;(4)结局指标:包括短期疗效及长期预后。
所有数据均由2名研究人员独立记录,并在评价过程完成后进行比较、核对,以降低偏倚风险。如有意见分歧,则选择讨论或与第3名研究人员协商后达成一致。采用Cochrane风险偏倚工具评估每个纳入RCT的偏倚风险和质量,包含以下7个方面:随机分配方案、分配隐藏方法、实施者与参与者设盲、结果评价设盲、结局数据完整性、选择性报告结果和其他来源偏倚。2名研究人员独立评估每个合格的试验,然后绘制偏倚风险图。
纳入的试验质量采用Jadad量表[6]评分标准(总分为5分)进行评估,得分为3分以上代表研究质量高。
-
应用RevMan5.4软件进行统计学分析。采用相对危险度(risk ratio,RR)及其95%CI对二分类数据进行效应统计量的描述。通过直接观察森林图、χ2值和I2值的不一致程度评估研究间的统计学异质性。当P<0.10,I2>50%时,表示存在统计学异质性,应选择随机效应模型;当P>0.10,I2≤50%时应选择固定效应模型。当发现存在统计学异质性时,采用敏感性分析重新进行Meta分析,其结果与未排除研究时的Meta分析结果进行比较,探讨排除的研究对合并效应量和结果的影响程度,通过亚组分析进一步探究可能影响结果的潜在因素。P<0.05为差异有统计学意义。
-
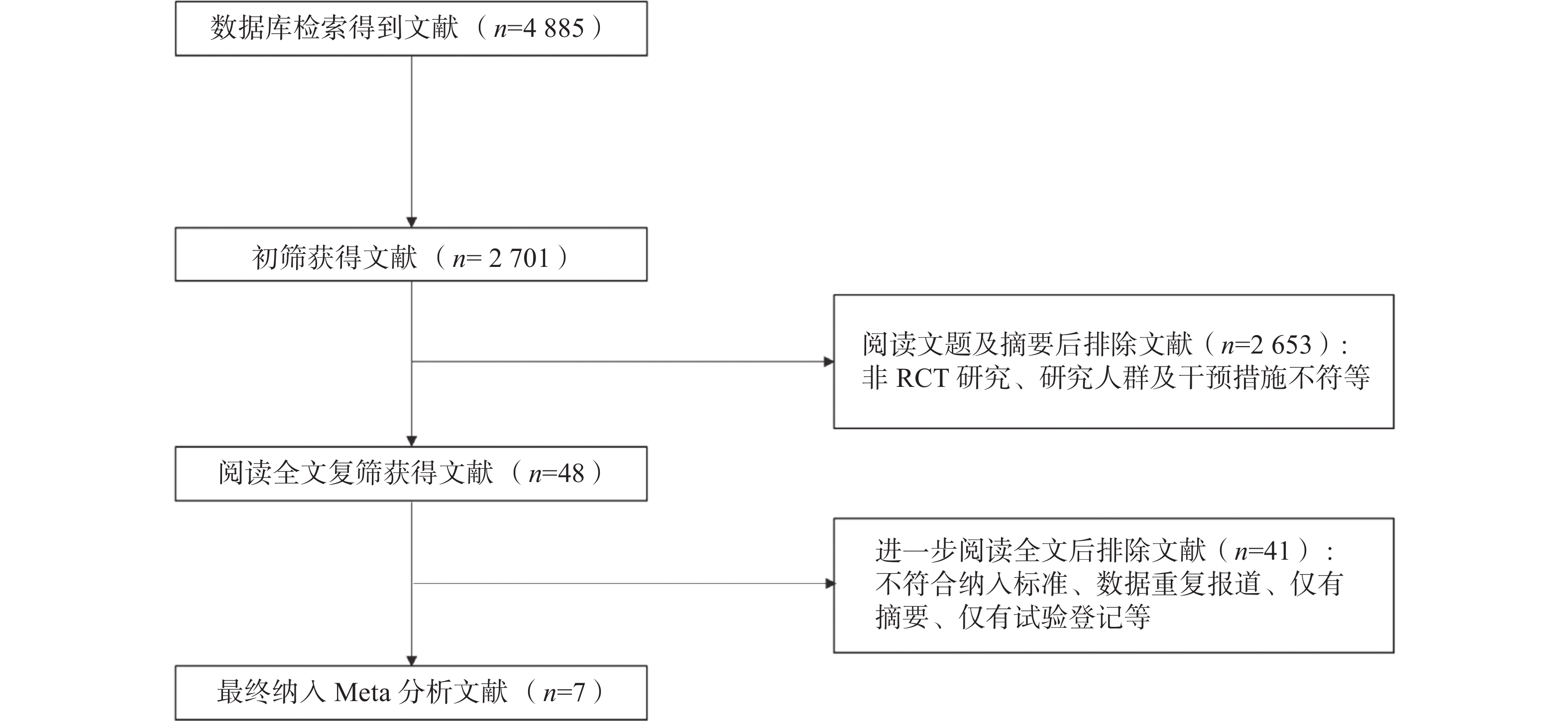
从各数据库中检索到了4885篇文献,筛除重复文献后获得2701篇,其中2653篇因摘要或文题与研究主题不相关被排除。经全文审查后,又有41篇文献被剔除。最后筛选出7篇RCT文献,共2754例患者。文献筛选流程图见图1。纳入的RCT文献特征见表1。
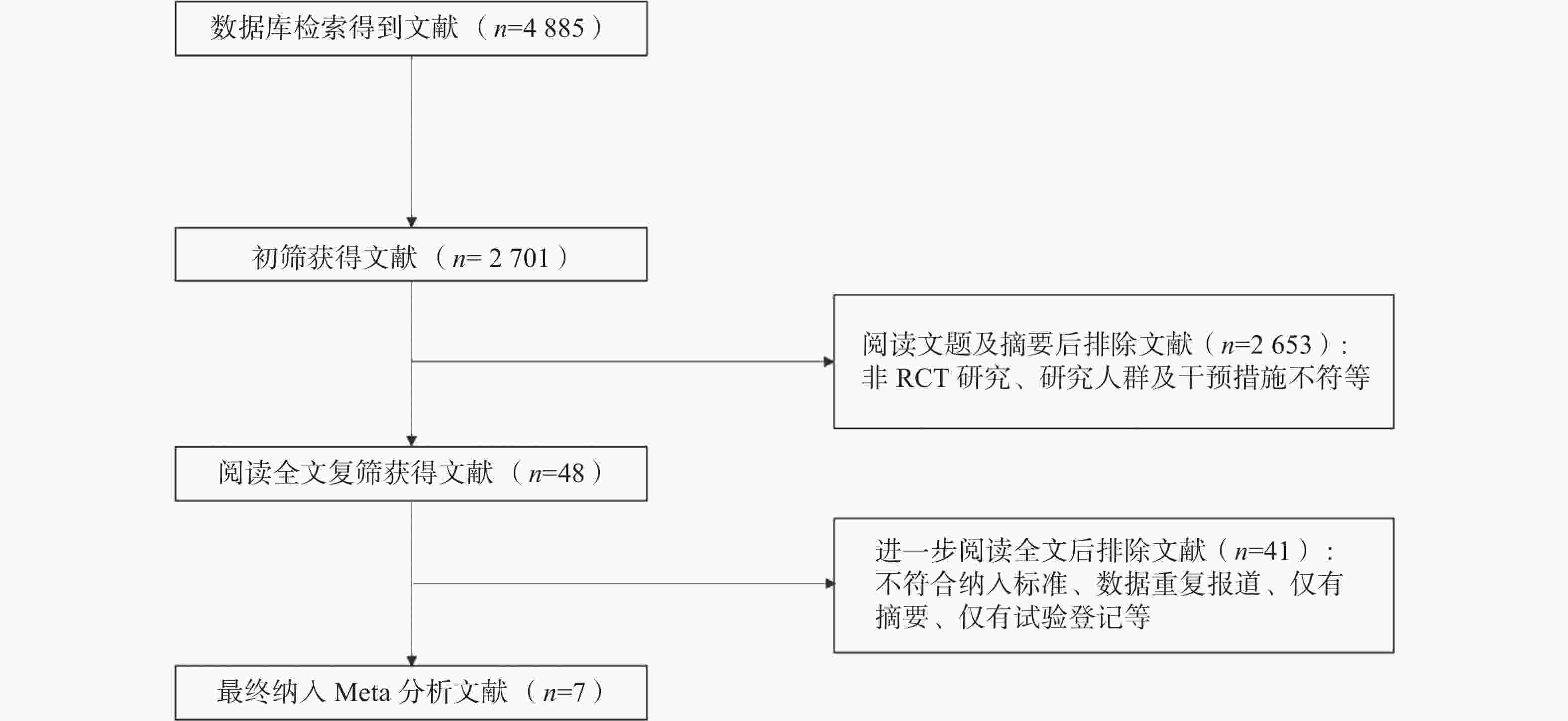
图 1 不同剂量131I治疗中低危分化型甲状腺癌后短期疗效及长期预后Meta分析的文献纳入流程图
Figure 1. Flow chart for literature inclusion process for Meta-analysis of short-term efficacy and long-term prognosis of different doses of 131I in the treatment of low- and intermediate-risk differentiated thyroid cancer
纳入文献 发表
年份国家 例数
(女/男)病理类型(PTC/FTC) TNM分期 手术术式 治疗前TSH
刺激方式治疗剂量分组 平均随访
时间(月)治疗后短期成功标准 复发标准 Dehbi等[3] 2019 英国 326/108 − T1~3,
N1~3,
M0TT或NTT(伴或不伴淋巴结清扫术) THW或外源性补充rhTSH 低剂量组(1.1 GBq):217例;
高剂量组(3.7 GBq):217例78 治疗后6~9个月:WBS(−); sTg<2 ng/ml 影像检查(WBS、超声、PET/CT等)提示复发;组织病理学检查结果证实为复发;sTg≥2 ng/ml Schlumberger
等[4]2018 法国 590/162 693/58 T1~3,
N0,
M0TT THW或外源性补充rhTSH 低剂量组(1.1 GBq):363例;
高剂量组(3.7 GBq):363例6~110 治疗后6~10个月:超声(−)且sTg<1 ng/ml;TgAb(+),WBS(−) 组织病理学检查结果证实为复发;影像检查提示复发;sTg>1 ng/ml Fallahi等[5] 2012 伊朗 286/55 326/15 T1~3,
N1~3,
M0TT(大多数伴淋巴结清扫术) THW 低剂量组(1.1 GBq):171例;
高剂量组(3.7 GBq):170例12 治疗后6~12个月:WBS(−);sTg<2 ng/ml WBS(+);sTg>2 ng/ml Kukulska等[7] 2010 波兰 285/24 265/44 T1~3,
N1~3,
M0TT或NTT(大多数伴淋巴结清扫术) THW 低剂量组(1.1 GBq或2.2 GBq):214例;高剂量组(3.7 GBq):95例 24~120 治疗后12个月:WBS(−);sTg<10 ng/ml sTg>1 ng/ml;超声或其他影像检查提示复发 Ma等[8] 2017 中国 199/79 268/7a T1~3,
N1~3,
M0TT 或NTT(伴或不伴淋巴结清扫术) THW 低剂量组(1.85 GBq):155例;高剂量组(3.7 GBq):123例 24~36 治疗后6~9个月:WBS(−);sTg<2 ng/ml 影像检查(WBS、超声等)提示复发;sTg>2 ng/ml Ahtiainen等[9] 2020 芬兰 129/31 146/11b T1~3,
N1~3,
M0TT或NTT THW 低剂量组(1.1 GBq):81例、
高剂量组(3.7 GBq):79例156 治疗后4~8个月:WBS(−);sTg<1 ng/ml 组织病理学检查结果证实为复发;影像检查(WBS、CT、MRI等)提示复发;sTg>1 ng/ml Dong等[10] 2021 中国 363/143 − T1~2,
N0~1,
M0TT或NTT(伴或不伴淋巴结清扫术) THW 低剂量组(1.1 GBq):251例;
高剂量组(3.7 GBq):255 例54 治疗后6~9个月:超声(−)且sTg<1 ng/ml或抑制性Tg<0.2 ng/ml;TgAb(+);WBS(−) 组织病理学检查结果证实为复发;影像检查(超声、CT等)提示复发;sTg>1 ng/ml 注:a表示另有3例为滤泡型甲状腺乳头状癌;b表示另有3例为PTC和FTC均有;−表示无此项数据;PTC为甲状腺乳头状癌;FTC为甲状腺滤泡状癌;TNM为肿瘤、淋巴结、转移;TSH为促甲状腺激素;TT为全切除术;NTT为近全切除术;THW为甲状腺激素戒断;rhTSH为重组人促甲状腺激素;WBS为全身扫描;sTg为刺激性甲状腺球蛋白;PET为正电子发射断层显像术;CT为计算机体层摄影术;TgAb为甲状腺球蛋白抗体;MRI为磁共振成像 表 1 纳入的7篇不同剂量131I治疗中低危分化型甲状腺癌后短期疗效及长期预后的研究文献的基本特征
Table 1. Basic characteristics of 7 included studies on short-term efficacy and long-term prognosis of different doses of 131I in the treatment of low- and intermediate-risk differentiated thyroid cancer
-
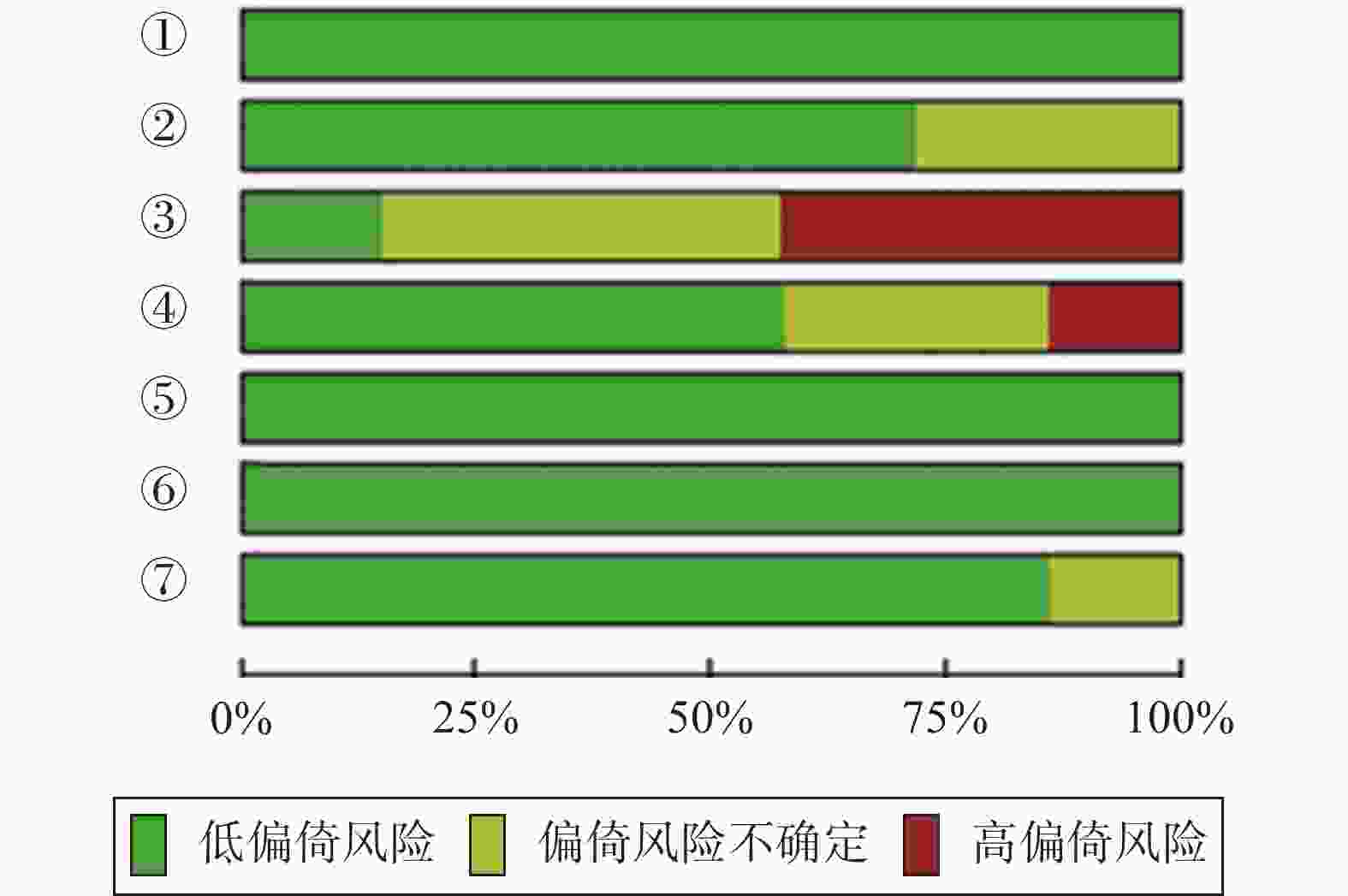
参考Jadad量表,纳入的7篇文献中,1篇(文献[7])得分为2分,5篇(文献[3、4、8、9、10])得分为3分,1篇(文献[5])得分为5分。所有文献(100%,7/7)均描述了随机分配方案,大部分文献(71.4%,5/7)描述了分配隐藏方法,但对实施者与参与者(14.3%,1/7)、结果评价(57.1%,4/7)采用盲法试验的文献占比相对较低。总体而言,纳入文献的方法学质量比较好,偏倚风险相对较低。纳入文献的偏倚风险见图2。
-
对7项研究的异质性分析结果显示,差异有统计学意义(P=0.002,I2=72%),故采用随机效应模型。低剂量组和高剂量组131I治疗后短期疗效的差异无统计学意义(RR=0.93,95%CI:0.86~1.01,P=0.07)(图3)。敏感性分析结果显示,当剔除文献[5]时,其余6项研究的异质性的差异无统计学意义(P=0.87,I2=0%),采用固定效应模型分析得出低剂量组和高剂量组131I治疗后短期疗效的差异仍无统计学意义(RR=0.97,95%CI:0.93~1.02,P=0.19)(图4)。仅从短期疗效来看,倾向于高剂量131I的清甲成功率高于低剂量131I (72.1%对68.6%;剔除文献[5]后为73.4%对72.7%),但Meta分析结果显示,不同131I治疗剂量组间的短期疗效的差异无统计学意义(图4)。
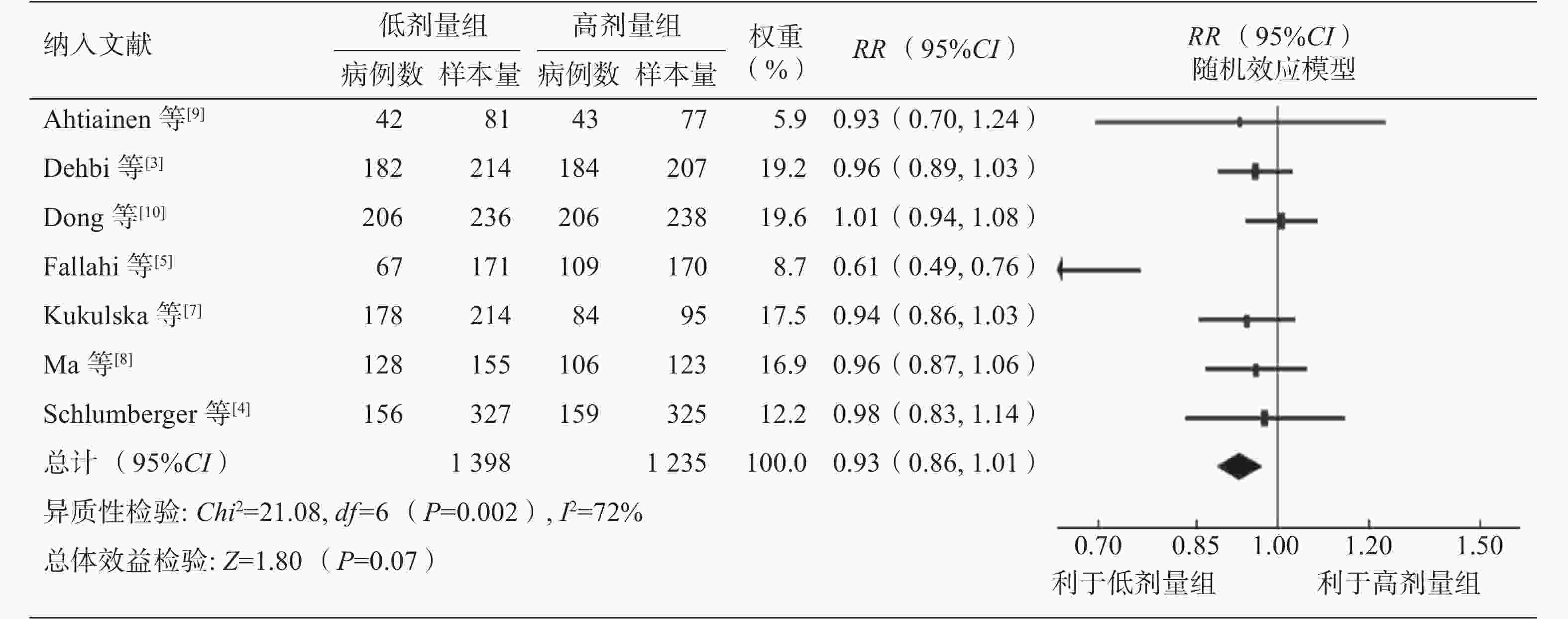
图 3 不同剂量131I治疗中低危分化型甲状腺癌后短期疗效的森林图
Figure 3. Forest plot of short-term efficacy after different doses of 131I in the treatment of low- and intermediate-risk differentiated thyroid cancer
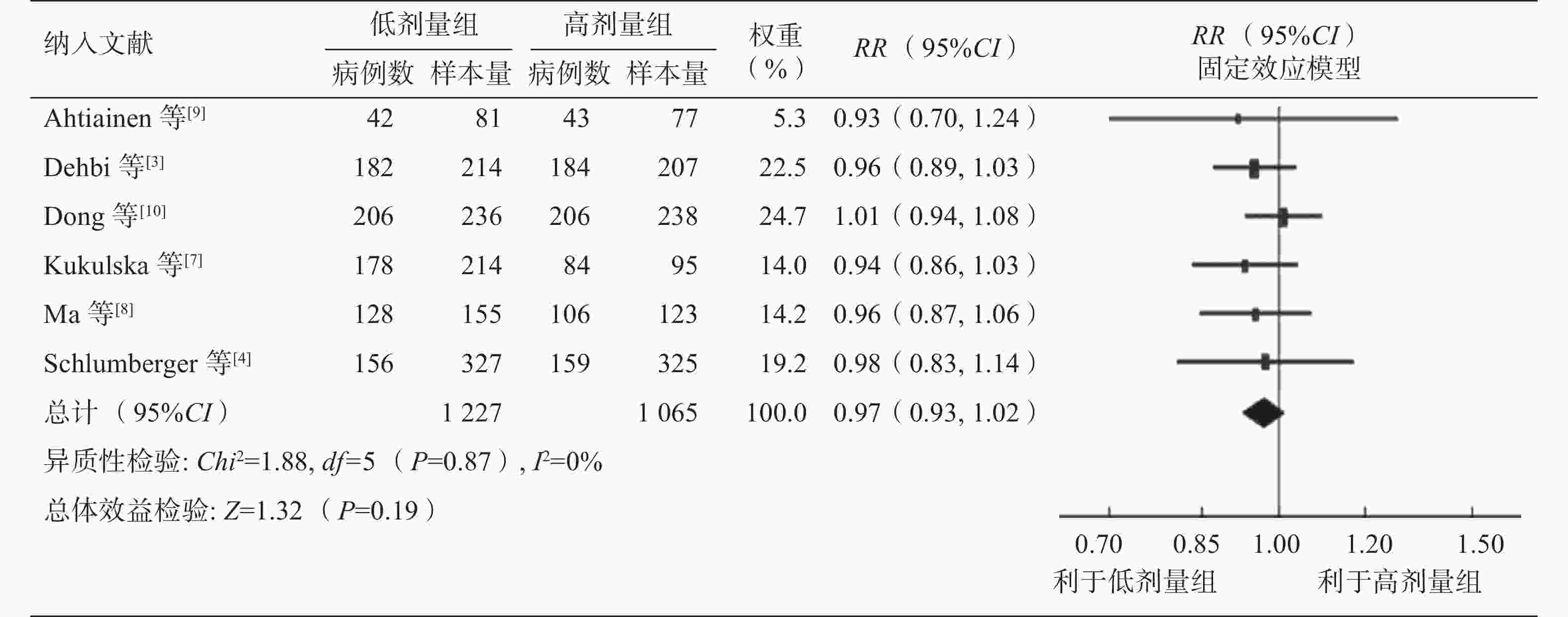
图 4 不同剂量131I治疗中低危分化型甲状腺癌后短期疗效的森林图(敏感性分析)
Figure 4. Forest plot of short-term efficacy after different doses of 131I in the treatment of low- and intermediate-risk differentiated thyroid cancer (sensitivity analysis)
本研究对地区、术式、危险度分层、治疗前TSH刺激方式及清甲成功定义标准甲状腺球蛋白(thyroglobulin,Tg)水平等方面进行了亚组分析。根据纳入研究中131I治疗前TSH刺激方式的不同,将纳入研究分为甲状腺激素戒断(thyroid hormone withdrawal,THW)和外源性补充重组人促甲状腺激素(recombinant human thyroid stimulating hormone,rhTSH)2个亚组。1项研究中将Tg标准分为刺激性Tg(stimulated Tg,sTg)<1 ng/ml或抑制性Tg<0.2 ng/ml,故将其剔除后分析。其余6项研究的Meta分析结果显示,地区、术式、危险度分层、治疗前TSH刺激方式及Tg水平各亚组间的差异均无统计学意义(表2)。各亚组异质性分析结果显示,亚洲组、TT组、中低危组、THW组以及Tg<2 ng/ml组间存在异质性,采用随机效应模型;将文献[5]剔除后采用固定效应模型进行分析,结果同前。
亚组组别 文献序号 RR(95%CI) P值 异质性检验 P值 I2(%) 地区 欧洲 3–4,7,9 0.95(0.90,1.01) 0.08 0.98 0 亚洲 5,8,10 0.86(0.68,1.08) 0.20 <0.0001 92 术式 TT 4–5 0.78(0.49,1.23) 0.28 0.0007 91 NTT 3,7–10 0.97(0.93,1.01) 0.15 0.76 0 危险度分层 中低危 3,5,7–10 0.92(0.83,1.01) 0.08 0.0004 78 低危 4 0.98(0.83,1.14) 0.76 − − TSH刺激方式 THW 5,7–10 0.90(0.79,1.02) 0.11 0.0001 83 THW/外源性补充rhTSH 3–4 0.96(0.90,1.03) 0.23 0.79 0 短期疗效评估标准 Tg<10 ng/ml 7 0.94(0.86,1.03) 0.20 − − Tg<2 ng/ml 3,5,8 0.85(0.68,1.05) 0.13 0.0001 90 Tg<1 ng/ml 4,9 0.96(0.84,1.11) 0.61 0.77 0 注:文献[10]因将短期疗效评估标准Tg分为刺激性Tg<1 ng/ml或抑制性Tg<0.2 ng/ml,故将其剔除。TT为全切除术;NTT为近全切除术;TSH为促甲状腺激素;THW为甲状腺激素戒断;rhTSH为重组人促甲状腺激素;Tg为甲状腺球蛋白;RR为相对危险度;CI为置信区间;−表示无此项数据 表 2 不同剂量131I治疗中低危分化型甲状腺癌后短期疗效的亚组分析
Table 2. Subgroup analysis of short-term efficacy of different doses of 131I in the treatment of low- and intermediate-risk differentiated thyroid cancer
-
纳入的7项研究均描述了复发数据。对7项研究行Meta分析未显示异质性(P=0.78,I2=0%),采用固定效应模型。Meta分析结果显示,低剂量组和高剂量组131I治疗对中低危DTC患者的长期预后的差异无统计学意义(RR=0.93,95%CI:0.58~1.49,P=0.77)(图5)。7项研究中有5项研究描述了后续治疗的数据,其中有4项研究提供了后续进一步131I治疗的数据,另有1项研究对后续131I治疗的数据报道模糊,故采用该研究的前期数据进行Meta分析,结果表明,低剂量组和高剂量组后续131I治疗的差异有统计学意义,接受低剂量131I治疗的患者更有可能因残留甲状腺或持续性/复发性疾病接受2次甚至多次治疗 (RR=1.61,95%CI:1.33~1.95,P<0.001)(图6)。
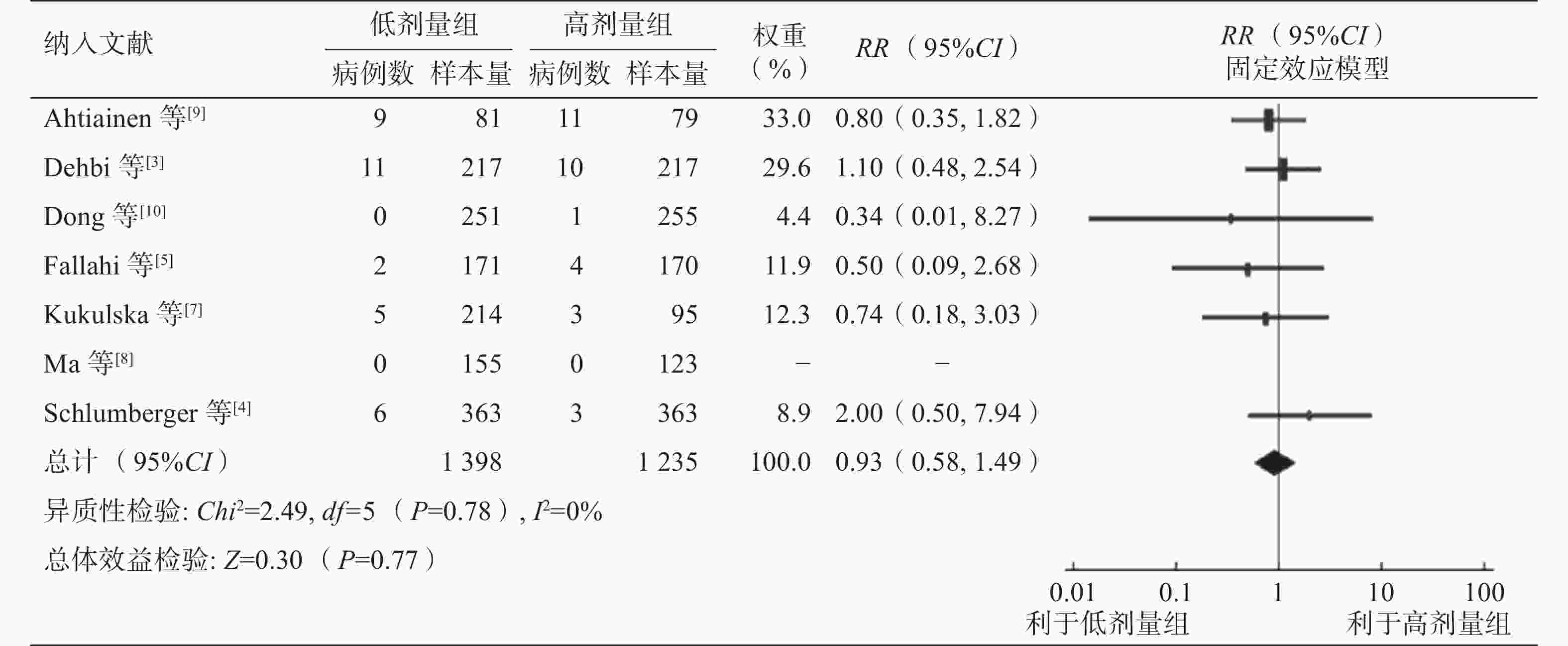
图 5 不同剂量131I治疗中低危分化型甲状腺癌后长期预后的森林图
Figure 5. Forest plot of long-term prognosis after different doses of 131I in the treatment of low- and intermediate-risk differentiated thyroid cancer
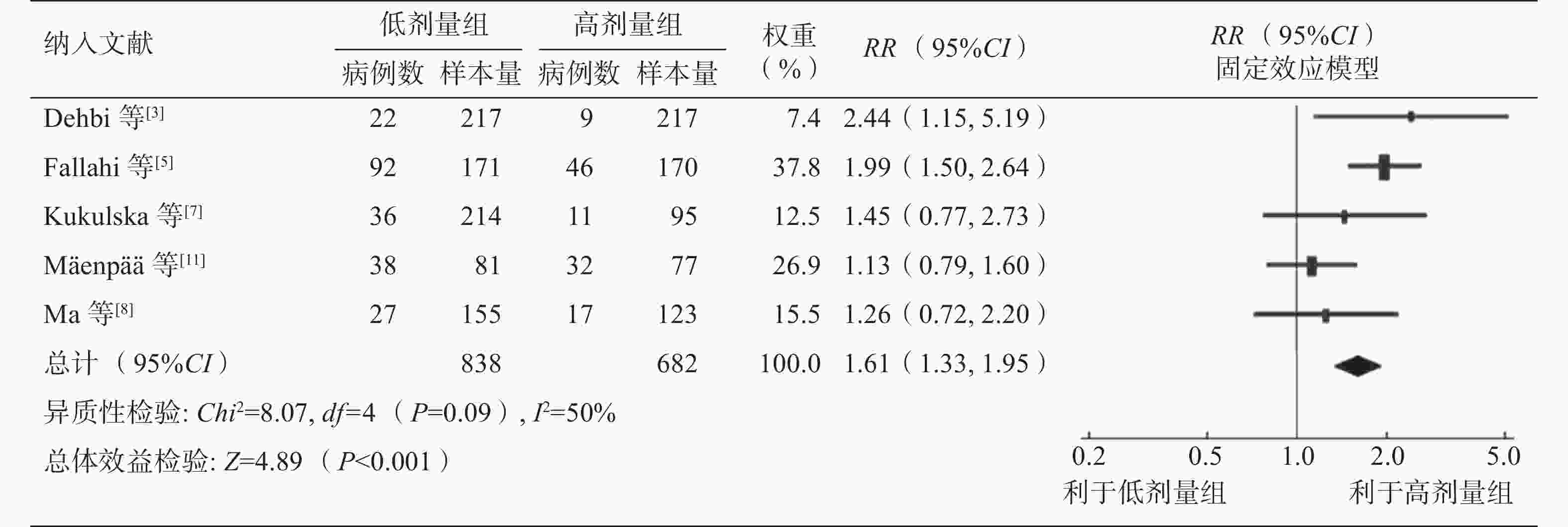
图 6 不同剂量131I治疗中低危分化型甲状腺癌后后续131I治疗的森林图
Figure 6. Forest plot of subsequent 131I treatment after different doses of 131I treatment for low- and intermediate-risk differentiated thyroid cancer
我们对术式、危险度分层及随访时间等进行了亚组分析,结果显示,随访时间为5年及5年以上的患者的复发率与随访时间低于5年的患者的复发率的差异无统计学意义。我们将随访时间延长至10年再次行亚组分析,结果无明显变化。Meta分析结果显示,不同剂量131I治疗中低危DTC后各亚组间的长期预后的差异均无统计学意义(表3)。
亚组组别 文献序号 RR(95%CI) P值 异质性检验 P值 I2(%) 术式 TT 4–5 1.09(0.28,4.21) 0.80 0.21 36 NTT 3,7–10 0.88(0.52,1.50) 0.63 0.87 0 危险度分层 中低危 3,5,7–10 2.00(0.50,7.94) 0.32 − − 低危 4 0.83(0.50,1.37) 0.46 0.89 0 随访时间1 <5 年 5,8,10 0.45(0.10,2.02) 0.30 0.84 0 ≥5年 3–4,7,9 1.03(0.60,1.75) 0.93 0.69 0 随访时间2 <10 年 3–5,7–8,10 1.00(0.56,1.76) 0.99 0.68 0 ≥10年 9 0.80(0.35,1.82) 0.54 − − 注:TT为全切除术;NTT为近全切除术;RR为相对危险度;CI为置信区间;−表示无此项数据 表 3 不同剂量131I治疗中低危分化型甲状腺癌后长期预后的亚组分析
Table 3. Subgroup analysis of long-term prognosis after different doses of 131I in the treatment of low- and intermediate-risk differentiated thyroid cancer
-
相关文献报道,131I治疗能明显改善高危DTC患者预后,但中低危DTC患者的生存获益似乎不太明显[1]。近年来关于不同剂量131I治疗DTC的成功率的Meta分析结果也存在争议。James等[12]对6项RCT和4项观察性研究,共计3821例中低危DTC患者进行了分析,结果显示不同剂量(低剂量组:1.1~2.2 GBq;高剂量组:3.7 GBq)131I治疗之间的短期疗效差异无统计学意义(RR=0.95,95%CI:0.87~1.03,P=0.20,I2=79%);接受低剂量131I治疗的患者通常伴有更短的住院时间(length of stay,LOS)和更少的治疗费用,同时相关的不良反应的发生率出现了最大限度地降低。另有一项研究推荐高剂量131I治疗,研究者纳入了17项RCT,共计3737例中低危DTC患者,分析后发现高剂量(3.7 GBq)比低剂量(1.1 GBq)131I治疗的成功率高出11%,且二者的差异有统计学意义(RR=0.89,95%CI:0.81~0.97,P=0.008)[13]。
本研究结果表明,低剂量(1.1~2.2 GBq)131I治疗的成功率并不低于高剂量(3.7 GBq)131I治疗。131I治疗成功标准的不一致性可能是导致最终结果不同的一个重要原因,这也进一步增加了对DTC患者管理的复杂性。美国甲状腺协会(ATA)指南[2]对131I治疗成功的标准定义为无临床、生化(sTg<1 ng/ml)和结构性疾病证据。本研究纳入的7项研究对短期疗效评估标准Tg的定义不一致,3项研究定义为sTg<2 ng/ml[3, 5, 8],2项研究定义为sTg<1 ng/ml[4, 9],1项研究定义为sTg<10 ng/ml[7],还有1项研究将Tg分为2类,即sTg<1 ng/ml或抑制性Tg<0.2 ng/ml[10]。在本研究中,剔除Dong等[10]的研究后,对Tg标准的不一致对成功率的影响行亚组分析,结果显示各亚组间差异无统计学意义,与以往的研究结果一致[14]。这表明指南中的标准不是十分精确的,应对评估标准进行更加清晰地定义。
术后131I治疗DTC的可行性是讨论的热点,尤其是对于病死率极低的低危和部分中危DTC[11]。本研究纳入的7项研究中,仅1项研究报道了病死率[9]。Ahtiainen等[9]的研究结果显示,对160例低危DTC患者随访0.3~17.1年(中位随访时间13年)后患者的总病死率为7.5%(12/160),其中有3例(131I治疗剂量为3.7 GBq)在随访期间死于甲状腺癌,随访时间分别为0.3年、3.4年和4.6年;其余9例死于甲状腺癌外的其他因素。与病死率相比,对DTC复发率的分析和讨论意义更大。本研究还对患者后续行131I治疗的情况进行了分析,其中有5项研究[3, 5, 7-8, 11]报道了后续131I治疗的情况,结果显示低剂量131I治疗的患者行再次或者多次131I治疗的百分比高于高剂量131I治疗患者,且二者的差异有统计学意义。纳入研究中再次行131I治疗的患者部分是因为存在残留甲状腺或者未达到治疗成功标准,相关研究数据表明低剂量组行再次131I治疗的患者中部分是因为存在残留甲状腺(颈部甲状腺床摄取或者微弱摄取),且占比明显高于高剂量组[12]。这或许说明采用低剂量131I治疗的患者更有可能因为残留甲状腺或持续性/复发性疾病而进行≥2次的131I治疗。
本研究因缺乏数据和存在异质性未对纳入研究中的LOS和不良反应进行分析。在纳入的7项研究中有3项[3, 5, 11]提到了LOS,其中2项[3, 11]的研究结果显示,与接受高剂量131I治疗的患者相比,接受低剂量131I治疗的患者的LOS更短(均P<0.001)。但在另一项研究中,低剂量组中需再次行131I治疗的患者的百分比高于高剂量组(58.5%对30.0%),累计LOS更长,且2组间差异有统计学意义(P<0.001)[5]。2项大型前瞻性RCT的研究结果显示,在131I治疗期间,外源性补充rhTSH组的不良反应发生率低于THW组,且与外源性补充rhTSH相比,THW与患者生活质量恶化相关;但131I清甲治疗3个月后,2组间的不良反应发生率的差异无统计学意义,这表明外源性补充rhTSH虽然可以维持或提高患者治疗期间的生活质量,但不良反应的发生率会随着时间的推移而降低,且与TSH刺激方式的相关性不大[15-16]。本研究纳入的研究中患者涉及的不良反应程度较轻,主要包括颈部疼痛、恶心、唾液腺疼痛、骨髓抑制、肝肾功能损伤等。Mallick等[16]报道了6例接受不同剂量131I治疗的DTC患者的严重不良反应,其中1例为脊柱骨折(131I治疗剂量为1.1 GBq),5例存在吐血、胸痛、盆腔疼痛或急性肾功能衰竭(131I治疗剂量为3.7 GBq),但严重不良反应与131I治疗剂量之间的相关性并不明确。
本研究通过对7篇文献的分析,证明了低剂量和高剂量131I治疗中低危DTC后的短期疗效及长期预后的差异均无统计学意义;低剂量131I治疗的患者更有可能因为残留甲状腺或持续性/复发性疾病而进行≥ 2次的131I治疗。本研究存在一定的局限性。(1)纳入的研究数量较少;(2)不同研究间的131I治疗后的疗效评估标准不一致,随访时长有差异,可能会影响最终的结论,故文中进行了相应的亚组分析以尽量降低这些影响。
利益冲突 所有作者声明无利益冲突
作者贡献声明 张静负责文献的检索、数据的提取、统计学分析、论文的撰写与修订;陆奕行负责文献的检索、数据的提取;邓胜明负责协助文献质量的评价;章斌负责研究命题的设计、论文的审阅
不同剂量131I治疗中低危分化型甲状腺癌的短期疗效及长期预后的Meta分析
Efficacy and prognosis after different doses of 131I treatment for differentiated thyroid cancer in low- and intermediate-risk patients: a Meta-analysis
-
摘要:
目的 评价中低危分化型甲状腺癌(DTC)患者不同剂量131I治疗后的短期疗效及长期预后的差异。 方法 检索 PubMed、EMBASE、Cochrane Library、中国知网、万方数据库等数据库中关于DTC患者131I治疗后短期疗效及长期预后评估的文献,检索时间均为自建库至2022年9月。根据纳入和排除标准筛选文献。应用RevMan 5.4软件进行Meta分析。采用相对危险度( RR)及其 95%置信区间(CI)对二分类数据进行效应统计量描述。采用χ2检验和I2值对文献进行异质性评价。 结果 最终纳入7篇文献,共2754例患者,其中低剂量组(1.1~2.2 GBq)1452例、高剂量组(3.7 GBq)1302例。(1)低剂量组和高剂量组131I治疗后短期疗效的差异无统计学意义(RR=0.93,95%CI:0.86~1.01,P=0.07)。对地区[欧洲(RR=0.95,95%CI:0.90~1.01,P=0.08);亚洲(RR=0.86,95%CI:0.68~1.08,P=0.20)]、术式[甲状腺全切除术(TT)(RR=0.78,95%CI:0.49~1.23,P=0.28);甲状腺近全切除术(NTT) (RR=0.97,95%CI:0.93~1.01,P=0.15)]、危险度分层[中低危(RR=0.92,95%CI:0.83~1.01,P=0.08);低危(RR=0.98,95%CI:0.83~1.14,P=0.76)]、治疗前TSH刺激方式[甲状腺激素戒断(THW)(RR=0.90,95%CI:0.79~1.02,P=0.11);THW/外源性补充重组人促甲状腺激素(RR=0.96,95%CI:0.90~1.03,P=0.23)]及清甲成功定义标准甲状腺球蛋白(Tg)水平[Tg<10 ng/ml(RR=0.94,95%CI:0.86~1.03,P=0.20);Tg<2 ng/ml(RR=0.85,95%CI:0.68~1.05,P=0.13); Tg<1 ng/ml(RR=0.96,95%CI:0.84~1.11,P=0.61)]等做进一步分析,结果显示,各亚组间的差异均无统计学意义。(2)低剂量组和高剂量组131I治疗后长期预后的差异无统计学意义(RR=0.93,95%CI:0.58~1.49,P=0.77)。对术式[TT(RR=1.09,95%CI:0.28~4.21,P=0.80);NTT(RR=0.88,95%CI:0.52~1.50,P=0.63)]、危险度分层[中低危(RR=2.00,95%CI:0.50~7.94,P=0.32);低危(RR=0.83,95%CI:0.50~1.37,P=0.46)]及随访时间{[<5年(RR=0.45,95%CI:0.10~2.02,P=0.30);≥5年(RR=1.03,95%CI:0.60~1.75,P=0.93)] 、[<10年(RR=1.00,95%CI:0.56~1.76,P=0.99);≥10年(RR=0.80,95%CI:0.35~1.82,P=0.54)]}的进一步分析结果显示,各亚组间的差异均无统计学意义。(3)低剂量组和高剂量组后续131I治疗的差异有统计学意义(RR=1.61,95%CI:1.33~1.95,P<0.001)。 结论 低剂量和高剂量131I治疗中低危DTC后的短期疗效及长期预后的差异均无统计学意义;低剂量131I治疗的患者更有可能因为残留甲状腺或持续性/复发性疾病而进行≥ 2次的131I治疗。 Abstract:Objective To evaluate the short-term efficacy and long-term prognosis of patients with low- and intermediate-risk differentiated thyroid cancer (DTC) treated with different 131I doses. Methods Studies on the short-term efficacy and long-term prognosis evaluation of patients with DTC after 131I treatment were searched from databases such as PubMed, EMBASE, Cochrane Library, CNKI, and Wanfang from inception to September 2022. Screening of literature was based on specific inclusion and exclusion criteria. Meta-analysis was performed with RevMan 5.4 software. Dichotomous data were compared using relative risk (RR), and 95% confidence intervals (95%CI) were calculated for each estimate. Heterogeneity was evaluated by χ2 test and I2 value. Results Seven studies with 2754 patients were included. The low-dose group (1.1–2.2 GBq) comprised 1452 cases, and the high-dose group (3.7 GBq) consisted of 1302 cases. (1) No significant difference in short-term efficacy (RR=0.93, 95%CI: 0.86–1.01, P=0.07) was found between the low- and high-dose groups. Further analysis showed no statistically significant difference between the subgroups of regions (Europe (RR=0.95, 95%CI: 0.90–1.01, P=0.08) and Asia (RR=0.86, 95%CI: 0.68–1.08, P=0.20)); operation modes(total thyroidectomy (RR=0.78, 95%CI: 0.49–1.23, P=0.28); and near total thyroidectomy (RR=0.97, 95%CI: 0.93–1.01, P=0.15)); risk stratification (low and intermediate risk (RR=0.92, 95%CI: 0.83–1.01, P=0.08); and low risk (RR=0.98, 95%CI: 0.83–1.14, P=0.76)); thyroid-stimulating hormone (TSH) stimulation modes (thyroid hormone withdrawal (RR=0.90, 95%CI: 0.79–1.02, P=0.11); and thyroid hormone withdrawal/recombinant human TSH (RR=0.96, 95%CI: 0.90–1.03, P=0.23)); and criteria for successful ablation (Tg<10 ng/ml (RR=0.94, 95%CI: 0.86–1.03, P=0.20), Tg<2 ng/ml (RR=0.85, 95%CI: 0.68–1.05, P=0.13), and Tg<1 ng/ml (RR=0.96, 95%CI: 0.84–1.11, P=0.61)). (2)No significant difference in long-term prognosis was observed between the low- and high-dose groups (RR=0.93, 95%CI: 0.58–1.49, P=0.77). Further analysis showed no statistically significant difference between the subgroups of operation modes (total thyroidectomy (RR=1.09, 95%CI: 0.28–4.21, P=0.80); and near total thyroidectomy (RR=0.88, 95%CI: 0.52–1.50, P=0.63)); risk stratification (low and intermediate risk (RR=2.00, 95%CI: 0.50–7.94, P=0.32); and low risk (RR=0.83, 95%CI: 0.50–1.37, P=0.46)); and follow-up time (<5 years (RR=0.45, 95%CI: 0.10–2.02, P=0.30), ≥5 years (RR=1.03, 95%CI: 0.60–1.75, P=0.93), <10 years (RR=1.00, 95%CI: 0.56–1.76, P=0.99), and ≥10 years (RR=0.80, 95%CI: 0.35–1.82, P=0.54)). (3) Significant difference in subsequent 131I treatment was found between the low- and high-dose groups (RR=1.61, 95%CI: 1.33–1.95, P<0.001). Conclusions No statistically significant difference in short-term efficacy and long-term prognosis was observed between low- and high-dose 131I treatments for low- and intermediate-risk DTC. Patients treated with low-dose 131I are likely to undergo ≥ 2 times of 131I treatment due to residual thyroid or persistent/recurrent diseases. -
表 1 纳入的7篇不同剂量131I治疗中低危分化型甲状腺癌后短期疗效及长期预后的研究文献的基本特征
Table 1. Basic characteristics of 7 included studies on short-term efficacy and long-term prognosis of different doses of 131I in the treatment of low- and intermediate-risk differentiated thyroid cancer
纳入文献 发表
年份国家 例数
(女/男)病理类型(PTC/FTC) TNM分期 手术术式 治疗前TSH
刺激方式治疗剂量分组 平均随访
时间(月)治疗后短期成功标准 复发标准 Dehbi等[3] 2019 英国 326/108 − T1~3,
N1~3,
M0TT或NTT(伴或不伴淋巴结清扫术) THW或外源性补充rhTSH 低剂量组(1.1 GBq):217例;
高剂量组(3.7 GBq):217例78 治疗后6~9个月:WBS(−); sTg<2 ng/ml 影像检查(WBS、超声、PET/CT等)提示复发;组织病理学检查结果证实为复发;sTg≥2 ng/ml Schlumberger
等[4]2018 法国 590/162 693/58 T1~3,
N0,
M0TT THW或外源性补充rhTSH 低剂量组(1.1 GBq):363例;
高剂量组(3.7 GBq):363例6~110 治疗后6~10个月:超声(−)且sTg<1 ng/ml;TgAb(+),WBS(−) 组织病理学检查结果证实为复发;影像检查提示复发;sTg>1 ng/ml Fallahi等[5] 2012 伊朗 286/55 326/15 T1~3,
N1~3,
M0TT(大多数伴淋巴结清扫术) THW 低剂量组(1.1 GBq):171例;
高剂量组(3.7 GBq):170例12 治疗后6~12个月:WBS(−);sTg<2 ng/ml WBS(+);sTg>2 ng/ml Kukulska等[7] 2010 波兰 285/24 265/44 T1~3,
N1~3,
M0TT或NTT(大多数伴淋巴结清扫术) THW 低剂量组(1.1 GBq或2.2 GBq):214例;高剂量组(3.7 GBq):95例 24~120 治疗后12个月:WBS(−);sTg<10 ng/ml sTg>1 ng/ml;超声或其他影像检查提示复发 Ma等[8] 2017 中国 199/79 268/7a T1~3,
N1~3,
M0TT 或NTT(伴或不伴淋巴结清扫术) THW 低剂量组(1.85 GBq):155例;高剂量组(3.7 GBq):123例 24~36 治疗后6~9个月:WBS(−);sTg<2 ng/ml 影像检查(WBS、超声等)提示复发;sTg>2 ng/ml Ahtiainen等[9] 2020 芬兰 129/31 146/11b T1~3,
N1~3,
M0TT或NTT THW 低剂量组(1.1 GBq):81例、
高剂量组(3.7 GBq):79例156 治疗后4~8个月:WBS(−);sTg<1 ng/ml 组织病理学检查结果证实为复发;影像检查(WBS、CT、MRI等)提示复发;sTg>1 ng/ml Dong等[10] 2021 中国 363/143 − T1~2,
N0~1,
M0TT或NTT(伴或不伴淋巴结清扫术) THW 低剂量组(1.1 GBq):251例;
高剂量组(3.7 GBq):255 例54 治疗后6~9个月:超声(−)且sTg<1 ng/ml或抑制性Tg<0.2 ng/ml;TgAb(+);WBS(−) 组织病理学检查结果证实为复发;影像检查(超声、CT等)提示复发;sTg>1 ng/ml 注:a表示另有3例为滤泡型甲状腺乳头状癌;b表示另有3例为PTC和FTC均有;−表示无此项数据;PTC为甲状腺乳头状癌;FTC为甲状腺滤泡状癌;TNM为肿瘤、淋巴结、转移;TSH为促甲状腺激素;TT为全切除术;NTT为近全切除术;THW为甲状腺激素戒断;rhTSH为重组人促甲状腺激素;WBS为全身扫描;sTg为刺激性甲状腺球蛋白;PET为正电子发射断层显像术;CT为计算机体层摄影术;TgAb为甲状腺球蛋白抗体;MRI为磁共振成像 表 2 不同剂量131I治疗中低危分化型甲状腺癌后短期疗效的亚组分析
Table 2. Subgroup analysis of short-term efficacy of different doses of 131I in the treatment of low- and intermediate-risk differentiated thyroid cancer
亚组组别 文献序号 RR(95%CI) P值 异质性检验 P值 I2(%) 地区 欧洲 3–4,7,9 0.95(0.90,1.01) 0.08 0.98 0 亚洲 5,8,10 0.86(0.68,1.08) 0.20 <0.0001 92 术式 TT 4–5 0.78(0.49,1.23) 0.28 0.0007 91 NTT 3,7–10 0.97(0.93,1.01) 0.15 0.76 0 危险度分层 中低危 3,5,7–10 0.92(0.83,1.01) 0.08 0.0004 78 低危 4 0.98(0.83,1.14) 0.76 − − TSH刺激方式 THW 5,7–10 0.90(0.79,1.02) 0.11 0.0001 83 THW/外源性补充rhTSH 3–4 0.96(0.90,1.03) 0.23 0.79 0 短期疗效评估标准 Tg<10 ng/ml 7 0.94(0.86,1.03) 0.20 − − Tg<2 ng/ml 3,5,8 0.85(0.68,1.05) 0.13 0.0001 90 Tg<1 ng/ml 4,9 0.96(0.84,1.11) 0.61 0.77 0 注:文献[10]因将短期疗效评估标准Tg分为刺激性Tg<1 ng/ml或抑制性Tg<0.2 ng/ml,故将其剔除。TT为全切除术;NTT为近全切除术;TSH为促甲状腺激素;THW为甲状腺激素戒断;rhTSH为重组人促甲状腺激素;Tg为甲状腺球蛋白;RR为相对危险度;CI为置信区间;−表示无此项数据 表 3 不同剂量131I治疗中低危分化型甲状腺癌后长期预后的亚组分析
Table 3. Subgroup analysis of long-term prognosis after different doses of 131I in the treatment of low- and intermediate-risk differentiated thyroid cancer
亚组组别 文献序号 RR(95%CI) P值 异质性检验 P值 I2(%) 术式 TT 4–5 1.09(0.28,4.21) 0.80 0.21 36 NTT 3,7–10 0.88(0.52,1.50) 0.63 0.87 0 危险度分层 中低危 3,5,7–10 2.00(0.50,7.94) 0.32 − − 低危 4 0.83(0.50,1.37) 0.46 0.89 0 随访时间1 <5 年 5,8,10 0.45(0.10,2.02) 0.30 0.84 0 ≥5年 3–4,7,9 1.03(0.60,1.75) 0.93 0.69 0 随访时间2 <10 年 3–5,7–8,10 1.00(0.56,1.76) 0.99 0.68 0 ≥10年 9 0.80(0.35,1.82) 0.54 − − 注:TT为全切除术;NTT为近全切除术;RR为相对危险度;CI为置信区间;−表示无此项数据 -
[1] 中华医学会核医学分会. 131I治疗分化型甲状腺癌指南(2021版)[J]. 中华核医学与分子影像杂志, 2021, 41(4): 218−241. DOI: 10.3760/cma.j.cn321828-20201113-00412.
Chinese Society of Nuclear Medicine. Guidelines for radioiodine therapy of differentiated thyroid cancer (2021 edition)[J]. Chin J Nucl Med Mol Imaging, 2021, 41(4): 218−241. DOI: 10.3760/cma.j.cn321828-20201113-00412.[2] Haugen BR, Alexander EK, Bible KC, et al. 2015 American Thyroid Association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer: the American Thyroid Association guidelines task force on thyroid nodules and differentiated thyroid cancer[J]. Thyroid, 2016, 26(1): 1−133. DOI: 10.1089/thy.2015.0020. [3] Dehbi HM, Mallick U, Wadsley J, et al. Recurrence after low-dose radioiodine ablation and recombinant human thyroid-stimulating hormone for differentiated thyroid cancer (HiLo): long-term results of an open-label, non-inferiority randomised controlled trial[J]. Lancet Diabetes Endocrinol, 2019, 7(1): 44−51. DOI: 10.1016/S2213-8587(18)30306-1. [4] Schlumberger M, Leboulleux S, Catargi B, et al. Outcome after ablation in patients with low-risk thyroid cancer (ESTIMABL1): 5-year follow-up results of a randomised, phase 3, equivalence trial[J]. Lancet Diabetes Endocrinol, 2018, 6(8): 618−626. DOI: 10.1016/S2213-8587(18)30113-X. [5] Fallahi B, Beiki D, Takavar A, et al. Low versus high radioiodine dose in postoperative ablation of residual thyroid tissue in patients with differentiated thyroid carcinoma: a large randomized clinical trial[J]. Nucl Med Commun, 2012, 33(3): 275−282. DOI: 10.1097/MNM.0b013e32834e306a. [6] Jadad AR, Moore RA, Carroll D, et al. Assessing the quality of reports of randomized clinical trials: is blinding necessary?[J/OL]. Control Clin Trials, 1996, 17(1): 1–12[2023-03-22]. https://www.sciencedirect.com/science/article/abs/pii/0197245695001344?via%3Dihub. DOI: 10.1016/0197-2456(95)00134-4. [7] Kukulska A, Krajewska J, Gawkowska-Suwińska M, et al. Radioiodine thyroid remnant ablation in patients with differentiated thyroid carcinoma (DTC): prospective comparison of long-term outcomes of treatment with 30, 60 and 100 mCi[J/OL]. Thyroid Res, 2010, 3(1): 9[2023-03-22]. https://thyroidresearchjournal.biomedcentral.com/articles/10.1186/1756-6614-3-9. DOI: 10.1186/1756-6614-3-9. [8] Ma C, Feng F, Wang SY, et al. Chinese data of efficacy of low- and high-dose iodine-131 for the ablation of thyroid remnant[J]. Thyroid, 2017, 27(6): 832−837. DOI: 10.1089/thy.2015.0658. [9] Ahtiainen V, Vaalavirta L, Tenhunen M, et al. Randomised comparison of 1.1 GBq and 3.7 GBq radioiodine to ablate the thyroid in the treatment of low-risk thyroid cancer: a 13-year follow-up[J]. Acta Oncol, 2020, 59(9): 1064−1071. DOI: 10.1080/0284186X.2020.1785003. [10] Dong P, Qu Y, Yang L, et al. Outcomes after radioiodine ablation in patients with thyroid cancer: long-term follow-up of a Chinese randomized clinicaltrial[J]. Clin Endocrinol (Oxf), 2021, 95(5): 782−789. DOI: 10.1111/cen.14563. [11] Mäenpää HO, Heikkonen J, Vaalavirta L, et al. Low vs. high radioiodine activity to ablate the thyroid after thyroidectomy for cancer: a randomized study[J/OL]. PLoS One, 2008, 3(4): e1885[2023-03-22]. https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0001885. DOI: 10.1371/journal.pone.0001885. [12] James DL, Ryan ÉJ, Davey MG, et al. Radioiodine remnant ablation for differentiated thyroid cancer: a systematic review and meta-analysis[J]. JAMA Otolaryngol Head Neck Surg, 2021, 147(6): 544−552. DOI: 10.1001/jamaoto.2021.0288. [13] Song XH, Meng ZW, Jia Q, et al. Different radioiodine dose for remnant thyroid ablation in patients with differentiated thyroid cancer: a meta-analysis[J]. Clin Nucl Med, 2015, 40(10): 774−779. DOI: 10.1097/RLU.0000000000000914. [14] Vardarli I, Weidemann F, Aboukoura M, et al. Longer-term recurrence rate after low versus high dose radioiodine ablation for differentiated thyroid Cancer in low and intermediate risk patients: a meta-analysis[J/OL]. BMC Cancer, 2020, 20(1): 550[2023-03-22]. https://bmccancer.biomedcentral.com/articles/10.1186/s12885-020-07029-3. DOI: 10.1186/s12885-020-07029-3. [15] Schlumberger M, Catargi B, Borget I, et al. Strategies of radioiodine ablation in patients with low-risk thyroid cancer[J]. N Engl J Med, 2012, 366(18): 1663−1673. DOI: 10.1056/NEJMoa1108586. [16] Mallick U, Harmer C, Yap B, et al. Ablation with low-dose radioiodine and thyrotropin alfa in thyroid cancer[J]. N Engl J Med, 2012, 366(18): 1674−1685. DOI: 10.1056/NEJMoa1109589. -





 下载:
下载: