-
胃癌是最常见的恶性肿瘤之一。2020年全球癌症统计数据显示,在185个国家或地区的36种癌症中,胃癌的发病率居第5位,病死率居第4位[1]。我国胃癌患者总体5年生存率不足50%[2],转移和术后复发是其预后差的主要原因,其中淋巴结转移是主要危险因素之一[3]。评估淋巴结转移的重要指标之一是淋巴结大小,但胃癌患者中超过60%的转移淋巴结小于8 mm[4],导致CT检出率较低。通过18F-FDG PET/CT显像中葡萄糖代谢情况和淋巴结短径综合评估淋巴结转移,从而提高术前淋巴结分期的准确性[5]。然而,在临床上综合评估为N0期的胃癌患者中,仍可发现11%~56%的患者术后存在淋巴结转移[6-7],即隐匿性淋巴结转移(occult lymph node metastasis,OLM)。存在OLM的患者更易出现肿瘤复发,预后较差[8]。因此, OLM的早期确诊对临床医师精准制定治疗方案及预后评估具有重要意义。18F-FDG PET/CT有多个异质性指数(heterogeneity index, HI),如变异系数[9]、线性回归斜率[10]等,有研究者发现HI对于多种恶性肿瘤的OLM具有预测价值[11-12]。目前采用HI预测胃癌患者的OLM尚无有效依据。胃腺癌是胃癌最常见的类型,本研究旨在探讨胃腺癌患者术前18F-FDG PET/CT显像中原发灶的肿瘤内代谢HI对胃癌OLM的预测价值。
-
回顾性分析2016年1月至2022年12月于郑州大学第一附属医院术前行18F-FDG PET/CT检查的79例胃腺癌患者的临床资料,其中男性62例、女性17例,年龄(63.8±9.0)岁。所有患者均于显像后1个月内行胃腺癌根治术,根据术后组织病理学检查结果分为OLM阳性组(n=39)和OLM阴性组(n=40)。比较2组患者的年龄、性别、肿瘤原发灶部位、分化程度、Lauren分型、病理T分期、糖类抗原199(carbohydrate antigen199,CA199)、癌胚抗原(carcinoembryonic antigen,CEA)等。纳入标准:(1)组织病理学检查结果为胃腺癌;(2)18F-FDG PET/CT检查后1个月内行胃腺癌根治术 。排除标准:(1)术前影像检查发现任何区域疑似转移的淋巴结(CT或MRI图像上淋巴结短径≥10 mm或18F-FDG PET/CT图像上SUVmax≥2.5);(2)伴有远处转移;(3)行任何抗肿瘤治疗;(4)伴有其他活动性恶性肿瘤;(5)因胃充盈差导致病灶观察不清;(6)无组织病理学检查结果或临床资料不完整。因本研究为回顾性研究,豁免签署患者知情同意书。本研究符合《赫尔辛基宣言》的原则。
-
使用德国Siemens公司的Biograph Truepoint 64型PET/CT仪进行扫描。18F-FDG由日本住友集团的HM-20医用回旋加速器生产自动化合成模块合成,放射化学纯度≥98%。所有患者行PET/CT检查前禁食6 h以上,空腹血糖水平≤11.1 mmol/L。按患者体质量静脉注射18F-FDG 3.70~5.55 MBq/kg,嘱患者于安静状态下休息60 min后行PET/CT扫描,扫描范围自颅顶至大腿中上段。头部CT扫描参数:管电压120 kV、管电流380 mA、层厚3 mm;体部CT扫描参数:管电压120 kV、管电流由设备根据患者的身高、体质量及扫描部位自动调整,0.8 s/周。随后于相同扫描范围行PET三维扫描,扫描参数:头部3 min/床位,体部2.5 min/床位,共采集4~6个床位。采用德国Siemens公司的Syngo True D软件对PET/CT图像进行融合重建,最终得到横断面PET/CT融合图像。
-
由2名5年以上工作经验的核医学科主治医师独立阅片并对图像进行参数评估,意见不一致时与高年资主任医师讨论后决定。以原发灶SUVmax=2.5为阈值手动勾画ROI体积(volume of interest,VOI)。SUV主要包括SUVmax、SUVmean和标准化摄取值峰值(peak of standard uptake value,SUVpeak)。肿瘤/肝脏比值(TLR)为原发灶SUVmax与肝脏SUVmean的比值。体积参数包括肿瘤代谢体积(metabolic tumor volume,MTV )和糖酵解总量(total lesion glycolysis,TLG)。计算2个HI:(1)HI-1即CV,为SUV的标准差(standard deviation,SD)与SUVmean的比值,即SD/SUVmean如文献[9, 13]所述;(2)HI-2即根据不同的SUV临界值(40%SUVmax、60%SUVmax和80%SUVmax)对MTV进行线性回归的斜率的绝对值,通过对既往文献提出的方法[10, 14]修改后得出。
-
应用IBM SPSS 27.0软件对数据进行统计学分析。符合正态分布的计量资料以
$ \bar{x} $ ±s表示, 组间比较采用两独立样本t检验(方差齐);不符合正态分布的计量资料以M(Q1,Q3)表示,组间比较采用Mann-Whitney U检验。计数资料采用频数(%)表示,组间比较采用$\chi^2 $ 检验。对于缺失数据采用直接删除法。采用Logistic回归模型对OLM的危险因素进行单因素和多因素分析,将单因素分析中P<0.05的因素纳入后续多因素分析。绘制ROC曲线评估对单因素分析存在意义的HI的诊断效能。P<0.05为差异有统计学意义。 -
由表1可知,OLM阳性组与OLM阴性组间性别、分化程度及病理T分期差异均有统计学意义(均P<0.05),年龄、肿瘤原发灶部位、分化程度、Lauren分型、CA199水平升高和CEA水平升高组间差异均无统计学意义(均P>0.05)。
组别 年龄
(岁,$ \stackrel{-}{x} $ 

性别(例,%) 肿瘤原发灶部位(例,%) 分化程度(例,%) 男 女 GEJ及
胃底部胃体及
大小弯胃窦及
幽门区中分化 中-低分化 低分化 OLM阳性组(n=39) 62.82±10.48 27(69.2) 12(30.8) 16(41.0) 11(28.2) 12(30.8) 8(20.5) 12(30.8) 19(48.7) OLM阴性组(n=40) 64.80±7.22 35(87.5) 5(12.5) 21(52.5) 9(22.5) 10(25.0) 17(42.5) 13(32.5) 10(25.0) 检验值 z=−0.196 x2=3.903 x2=1.045 x2=6.061 P值 0.844 0.048 0.593 0.048 组别 Lauren分型(例,%) 病理T分期(例,%) CA199水平升高(例,%) CEA水平升高(例,%) 肠型 弥漫型 混合型 T1~T2 T3~T4 OLM阳性组(n=39) 16(41.0) 11(28.2) 12(30.8) 5(12.8) 34(87.2) 5(13.5) 4(10.8) OLM阴性组(n=40) 24(60.0) 9(22.5) 7(17.5) 15(37.5) 25(62.5) 7(18.9) 4(10.8) 检验值 x2=3.104 x2=6.361 x2=0.398 0 P值 0.212 0.012 0.528 1.00 表 1 胃腺癌隐匿性淋巴结转移阳性组与阴性组患者的临床特征比较
Table 1. Comparison of clinical characteristics between the positive and negative groups in patients with occult lymph node metastasis of gastric adenocarcinoma
-
由表2可知, OLM阳性组原发灶HI-2明显高于OLM阴性组,且差异有统计学意义(P<0.05);而OLM阴性组原发灶SUVmax、SUVmean 、HI-1均明显高于OLM阳性组,且差异均有统计学意义(均P<0.05)。
组别 SUVmax SUVpeak SUVmean TLR MTV(cm3) TLG(g) HI-1 HI-2 OLM阳性组(n=39) 5.59
(4.46,7.51)4.37
(3.23,5.38)3.33
(3.06,3.85)2.75
(2.20,3.70)11.94
(3.23,30.90)39.87
(9.48,113.88)0.23±0.12 4.98
(2.68,8.44)OLM阴性组(n=40) 6.91
(5.11,10.64)5.09
(3.90,7.21)3.65
(3.25,4.64)3.30
(2.42,5.36)12.32
(3.37,20.86)43.07
(11.69,90.10)0.29±0.14 2.61
(1.84,4.23)检验值 z=−2.000 z=−1.736 z=−2.001 z=−1.314 z=−0.074 z=−0.255 t=2.096 z=−3.178 P值 0.045 0.083 0.045 0.189 0.941 0.799 0.039 0.001 表 2 胃腺癌隐匿性淋巴结转移阳性组与阴性组患者18F-FDG PET/CT代谢参数的比较[M(Q1,Q3)或
$ \bar{x} $ Table 2. Comparison of metabolic parameters of 18F-FDG PET/CT between positive and negative groups of patients with occult lymph node metastasis in patients with occult lymph node metastasis of gastric adenocarcinoma [M(Q1, Q3) or
$ \bar{x} $ -
由表3单因素Logistic回归模型分析结果可知,分化程度、病理T分期、HI-1和HI-2是OLM的危险因素;由表3多因素Logistic回归模型分析结果可知,病理T分期和HI-2是胃腺癌患者OLM的独立危险因素。
临床特征和代谢参数 单因素分析
OR(95%CI)P值 多因素分析
OR(95%CI)P值 分化程度 0.054 0.174 中分化 1.000 1.000 中-低分化 1.962(0.621~6.193) 0.251 1.667(0.432~6.435) 0.459 低分化 4.037(1.295~12.585) 0.016 3.467(0.918~13.096) 0.067 病理T分期 T1-T2 1.000 1.000 T3-T4 4.080(1.310~12.709) 0.015 4.780(1.238~18.458) 0.023 SUVmax 0.891(0.792~1.003) 0.055 SUVpeak 0.877(0.758~1.014) 0.076 SUVmean 0.602(0.361~1.005) 0.052 TLR 0.808(0.631~1.034) 0.090 MTV(cm3) 0.999(0.977~1.021) 0.901 TLG(g) 0.998(0.994~1.003) 0.430 HI-1 0.025(0.001~0.992) 0.045 0.537(0.007~39.527) 0.777 HI-2 >4.962 7.368(2.385~22.764) <0.001 6.893(1.922~24.718) 0.003 ≤4.962 1.000 1.000 注:FDG为氟脱氧葡萄糖;PET为正电子发射断层显像术;CT为计算机体层摄影术;SUVmax为最大标准化摄取值;SUVpeak为标准化摄取值峰值;SUVmean为平均标准化摄取值;TLR为原发灶SUVmax/肝脏SUVmean的比值;MTV为肿瘤代谢体积;TLG为糖酵解总量;HI为异质性指数;CI为置信区间 表 3 胃腺癌隐匿性淋巴结转移患者临床特征和18F-FDG PET/CT代谢参数的单因素及多因素Logistic回归模型分析
Table 3. Logistic univariate and multivariate regression analysis of clinical characteristics and 18F-FDG PET/CT metabolic parameters in patients with occult lymph node metastasis of gastric adenocarcinoma
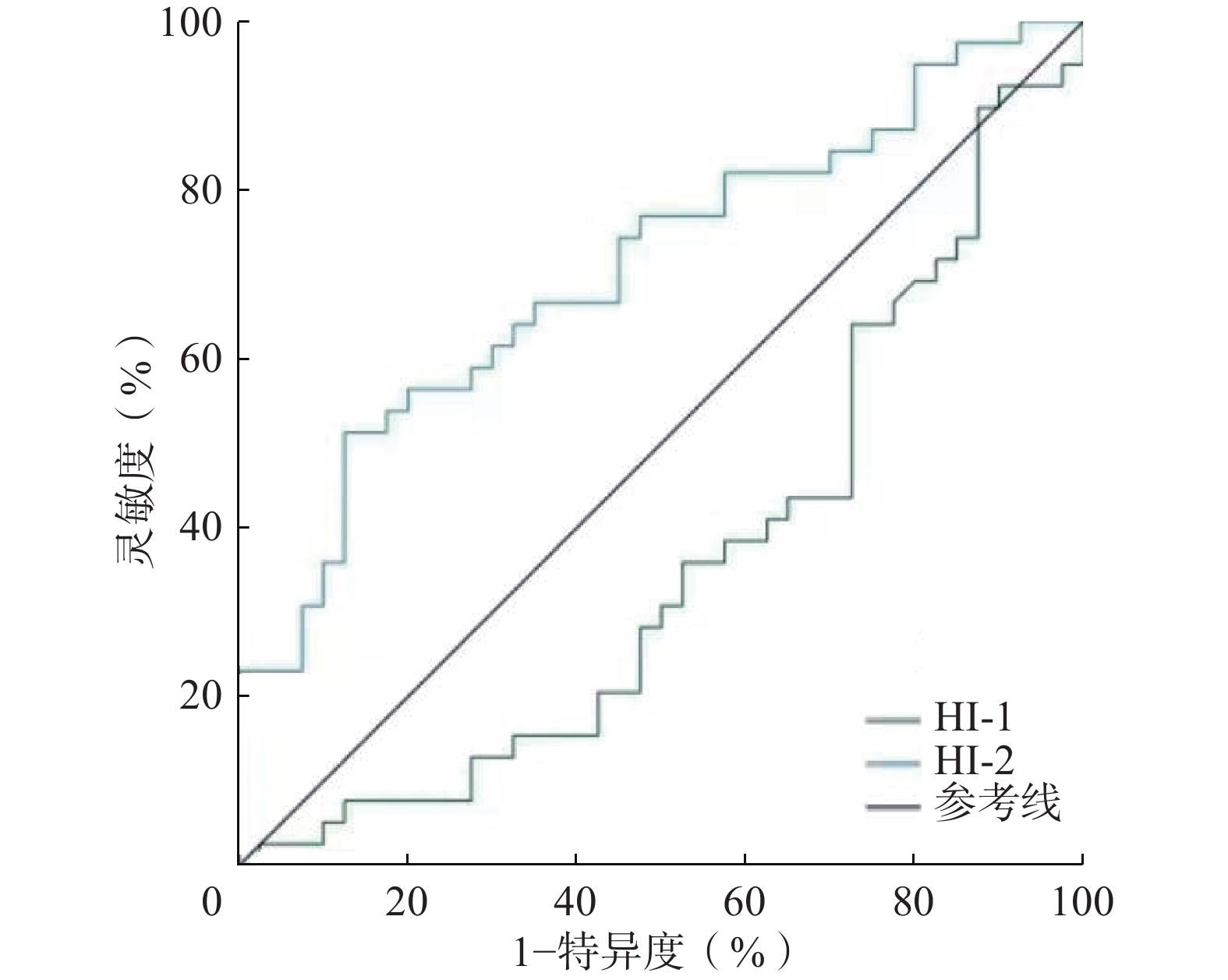
ROC曲线分析结果显示,HI-1预测OLM的AUC为0.360(95%CI:0.237~0.483,P=0.001),因此HI-1不具有诊断价值。HI-2预测OLM的AUC为0.708(95%CI:0.593~0.822,P<0.05)(图1),因此HI-2对OLM的诊断具有较好的准确率。当以最佳临界值4.962进行预测时,其诊断OLM的灵敏度和特异度分别为51.3%(20/39)和87.5%(35/40),典型患者图像见图2。
-
手术切除是治疗胃癌的主要方法。然而,大部分胃癌患者在手术切除后仍会复发。OLM是胃癌患者术后复发的主要危险因素。近年来,18F-FDG PET/CT的肿瘤内代谢HI在肿瘤的临床分期和预后预测方面具有重要价值[9,15-16]。Liu等[9]发现肿瘤原发灶的HI在评估胃癌患者预后中具有重要价值。Kim等[11]将HI用于食管癌区域淋巴结转移的预测,显示了其较好的预测价值。在本研究中,单因素及多因素Logistic回归模型分析的结果表明HI-2是胃癌OLM的独立预测因子。HI-2由不同SUV临界值下的系列MTV的线性回归斜率计算得出,在工作站上易获取,且重复性较高。18F-FDG PET/CT诊断胃癌淋巴结转移的特异性虽高达73%~92%,但灵敏度仅为40%~54.7%[17–19],在本研究中HI-2诊断OLM的灵敏度和特异度分别为51.3%和87.5%,因此肿瘤代谢HI对胃癌患者术前发现OLM具有重要的预测价值。
本研究发现肿瘤原发灶的SUVmax、SUVpeak、SUVmean及TLR在预测胃癌OLM方面无明显价值,这与Na等[20]的研究结果一致。但Yamada等[21]分析113例晚期胃癌患者的临床资料发现,肿瘤原发灶SUVmax是淋巴结转移的有效预测指标。张在炬等[22]发现SUVmax≥4.29作为胃癌淋巴结转移诊断标准时,其灵敏度和特异度分别为98.1%和45.7%。Oh[23]等发现SUVpeak可能是胃癌患者淋巴结转移的独立危险因素。造成以上研究结果差异的原因可能与肿瘤异质性、部分容积效应和样本差异有关[24]。本研究发现OLM阴性组SUVmax及SUVmean高于OLM阳性组,可能原因是阴性组中分化腺癌数目较多,这与既往研究结果[25-26]相符。
MTV和TLG是反映肿瘤负荷的代谢参数,但目前关于MTV和TLG在预测胃癌淋巴结转移的价值方面具有一定的争议。周锦等[27]发现MTV和TLG与肿瘤的N分期呈中度正相关。Xue等[28]发现MTV和TLG是胃癌淋巴结转移的独立预测因子。而王健林等[29]发现MTV和TLG与胃癌的N分期无明显相关性。本研究也未发现MTV和TLG在预测胃癌OLM方面的价值。上述研究结果存在差异的原因可能为:(1)MTV的获取方法尚未标准化,不同的SUV截断值结果不同;(2)本研究只分析了cN0期胃癌患者,与上述研究样本的范围不同;(3)胃部炎症及幽门螺杆菌感染等[30]均可导致对18F-FDG的高摄取,从而使代谢参数结果不可信。
我们的研究存在一定的局限性:(1)本研究是一项单中心、回顾性研究,纳入的患者数量相对较少;(2)MTV和HI的测量尚无标准化方法;(3)正常胃壁的生理性摄取可能会产生部分容积效应从而对肿瘤18F-FDG PET/CT的参数测量结果产生一定的影响,延迟显像或许可以降低胃壁生理性摄取的干扰,但需进一步的研究结果证实。
综上所述,肿瘤原发灶HI对胃癌OLM具有一定的预测价值,较高的HI-2是胃癌患者发生OLM的高危因素,这些发现有助于临床精准制定个体化治疗方案。
利益冲突 所有作者声明无利益冲突
作者贡献声明 王冉负责命题的提出与设计、数据的收集与分析、论文的撰写与修改;张涵玥负责文献的检索与整理;韩星敏负责论文最终版本的修订
18F-FDG PET/CT肿瘤内代谢异质性指数预测胃腺癌隐匿性淋巴结转移的价值
Value of 18F-FDG PET/CT intra-tumor metabolic heterogeneity index for predicting occult lymph node metastasis in gastric adenocarcinoma
-
摘要:
目的 评估术前18F-氟脱氧葡萄糖(FDG) PET/CT原发灶肿瘤内代谢异质性指数(HI)对胃腺癌隐匿性淋巴结转移(OLM)的预测价值。 方法 回顾性分析2016年1月至2022年12月于郑州大学第一附属医院术前行18F-FDG PET/CT检查的79例胃腺癌患者的临床资料,其中男性62例、女性17例,年龄(63.8±9.0)岁。所有患者均于18F-FDG PET/CT显像后1个月内行胃腺癌根治术,根据术后组织病理学检查结果分为OLM阳性组(n=39)和OLM阴性组(n=40)。采用卡方检验、两独立样本t检验(方差齐)和Mann-Whitney U检验对胃腺癌患者的临床特征、18F-FDG PET/CT代谢参数进行组间比较。采用单因素及多因素logistic回归模型分析预测OLM的独立危险因素。采用受试者工作特征(ROC)曲线分析HI对OLM的诊断效能。 结果 OLM阳性组与OLM阴性组间性别、分化程度及病理T分期差异均有统计学意义(x2=3.903~6.361,均P<0.05)。OLM阳性组原发灶HI-2明显高于OLM阴性组[4.98(2.68,8.44)对2.61(1.84,4.23)],且差异有统计学意义(z=−3.178,P<0.05);而OLM阴性组原发灶SUVmax、SUVmean、HI-1 [5.59(4.46,7.51)对6.91(5.11,10.64)=、3.33(3.06,3.85)对3.65(3.25,4.64)=、(0.23±0.12) 对(0.29±0.14)]均明显高于OLM阳性组,且差异均有统计学意义(z=−2.000、-2.001,t=2.096;均P<0.05)。单因素Logistic回归模型分析结果显示,分化程度(OR=4.037,95%CI:1.295~12.585,P<0.05)、病理T分期(OR=4.080,95%CI:1.310~12.709,P<0.05)、HI-1(OR=0.025,95%CI:0.001~0.992,P<0.05)和HI-2(OR=7.368,95%CI:2.385~22.764,P<0.001)是OLM的危险因素;多因素logistic回归模型分析结果显示,病理T分期(OR=4.780,95%CI:1.238~18.458,P<0.05)和HI-2(OR=6.893,95%CI:1.922~24.718,P<0.05)是胃腺癌患者OLM的独立危险因素。ROC曲线分析结果显示,HI-2预测OLM的ROC曲线下面积(AUC)为0.708(95%CI :0.237~0.483,P=0.001),当以其最佳临界值4.962进行预测时,其诊断OLM的灵敏度和特异度分别为51.3%(20/39)和87.5%(35/40)。 结论 胃腺癌术前18F-FDG PET/CT原发灶肿瘤内代谢HI对胃腺癌OLM具有预测价值,且HI-2是OLM的独立危险因素。 -
关键词:
- 胃肿瘤 /
- 淋巴结 /
- 肿瘤转移 /
- 正电子发射断层显像术 /
- 体层摄影术,X线计算机 /
- 脱氧葡萄糖
Abstract:Objective To investigate the predictive value of 18F-fluorodeoxyglucose(FDG) PET/CT primary lesions metabolic heterogeneity index for occult lymph node metastasis(OLM) in gastric cancer. Methods A retrospective analysis was performed on 79 patients [62 males, 17 females, age (63.8±9.0) years] with gastric cancer who underwent 18F-FDG PET/CT imaging and were diagnosed as clinical (c)N0 stage before surgery from January 2016 to December 2022 in the First Affiliated Hospital of Zhengzhou University. All patients underwent radical gastrectomy in our hospital within 1 month after imaging, and were divided into OLM-positive group and OLM-negative group according to postoperative pathology to determine whether there was lymph node metastasis. The following PET/CT parameters were measured: The maximum, mean and peak normalized uptake values (SUVmax, SUVmean, SUVpeak) , tumor metabolic volume (MTV) and total focal glycolysis (TLG)of the primary lesions.And TLR (tumor - liver ratio), heterogeneity index -1 (HI-1) and heterogeneity index -2 (HI-2) were calculated. The t test and Mann-Whitney U test of two independent samples were used to compare the parameters between groups. The independent risk factors of OLM were analyzed by logistic regression. The diagnostic efficacy of heterogeneity index on OLM was analyzed by receiver operating characteristic (ROC) curve. Results A total of 39 (49.4%, 39/79) of the 79 patients were pathologically confirmed to have OLM. HI-2 in OLM positive group was higher than that in OLM negative group [4.98 (2.68, 8.44) vs 2.61 (1.84, 4.23), z=−3.178, P < 0.05], while SUVmax in OLM negative group was higher than that in OLM negative group [5.59 (4.46, 7.51) vs 6.91 (5.11, 10.64). z=−2.000, P < 0.05], SUVmean[3.33 (3.06, 3.85) vs 3.65 (3.25, 4.64), z=−2.001, P < 0.05], HI-1[0.23±0.12 vs 0.29±0.14, t=2.096, P < 0.05] were significantly higher than those in OLM positive group. Multivariate logistic regression analysis showed that HI-2 was an independent risk factor for OLM [odds ratio (OR) =6.893, 95%CI: 1.922-24.718, P < 0.05]. The area under ROC curve (AUC) of HI-2 for OLM prediction was 0.708 (95%CI: 0.237-0.483, P=0.001), and the sensitivity and specificity for OLM diagnosis were 51.3% (20/39) and 87.5% (35/40), respectively, when the threshold was 4.962. Conclusion 18F-FDG PET/CT tumor metabolic heterogeneity index has predictive value for OLM in gastric cancer, and heterogeneity index -2 is an independent risk factor for OLM. -
表 1 胃腺癌隐匿性淋巴结转移阳性组与阴性组患者的临床特征比较
Table 1. Comparison of clinical characteristics between the positive and negative groups in patients with occult lymph node metastasis of gastric adenocarcinoma
组别 年龄
(岁,$ \stackrel{-}{x} $ 

性别(例,%) 肿瘤原发灶部位(例,%) 分化程度(例,%) 男 女 GEJ及
胃底部胃体及
大小弯胃窦及
幽门区中分化 中-低分化 低分化 OLM阳性组(n=39) 62.82±10.48 27(69.2) 12(30.8) 16(41.0) 11(28.2) 12(30.8) 8(20.5) 12(30.8) 19(48.7) OLM阴性组(n=40) 64.80±7.22 35(87.5) 5(12.5) 21(52.5) 9(22.5) 10(25.0) 17(42.5) 13(32.5) 10(25.0) 检验值 z=−0.196 x2=3.903 x2=1.045 x2=6.061 P值 0.844 0.048 0.593 0.048 组别 Lauren分型(例,%) 病理T分期(例,%) CA199水平升高(例,%) CEA水平升高(例,%) 肠型 弥漫型 混合型 T1~T2 T3~T4 OLM阳性组(n=39) 16(41.0) 11(28.2) 12(30.8) 5(12.8) 34(87.2) 5(13.5) 4(10.8) OLM阴性组(n=40) 24(60.0) 9(22.5) 7(17.5) 15(37.5) 25(62.5) 7(18.9) 4(10.8) 检验值 x2=3.104 x2=6.361 x2=0.398 0 P值 0.212 0.012 0.528 1.00 表 2 胃腺癌隐匿性淋巴结转移阳性组与阴性组患者18F-FDG PET/CT代谢参数的比较[M(Q1,Q3)或
$ \bar{x} $ Table 2. Comparison of metabolic parameters of 18F-FDG PET/CT between positive and negative groups of patients with occult lymph node metastasis in patients with occult lymph node metastasis of gastric adenocarcinoma [M(Q1, Q3) or
$ \bar{x} $ 组别 SUVmax SUVpeak SUVmean TLR MTV(cm3) TLG(g) HI-1 HI-2 OLM阳性组(n=39) 5.59
(4.46,7.51)4.37
(3.23,5.38)3.33
(3.06,3.85)2.75
(2.20,3.70)11.94
(3.23,30.90)39.87
(9.48,113.88)0.23±0.12 4.98
(2.68,8.44)OLM阴性组(n=40) 6.91
(5.11,10.64)5.09
(3.90,7.21)3.65
(3.25,4.64)3.30
(2.42,5.36)12.32
(3.37,20.86)43.07
(11.69,90.10)0.29±0.14 2.61
(1.84,4.23)检验值 z=−2.000 z=−1.736 z=−2.001 z=−1.314 z=−0.074 z=−0.255 t=2.096 z=−3.178 P值 0.045 0.083 0.045 0.189 0.941 0.799 0.039 0.001 表 3 胃腺癌隐匿性淋巴结转移患者临床特征和18F-FDG PET/CT代谢参数的单因素及多因素Logistic回归模型分析
Table 3. Logistic univariate and multivariate regression analysis of clinical characteristics and 18F-FDG PET/CT metabolic parameters in patients with occult lymph node metastasis of gastric adenocarcinoma
临床特征和代谢参数 单因素分析
OR(95%CI)P值 多因素分析
OR(95%CI)P值 分化程度 0.054 0.174 中分化 1.000 1.000 中-低分化 1.962(0.621~6.193) 0.251 1.667(0.432~6.435) 0.459 低分化 4.037(1.295~12.585) 0.016 3.467(0.918~13.096) 0.067 病理T分期 T1-T2 1.000 1.000 T3-T4 4.080(1.310~12.709) 0.015 4.780(1.238~18.458) 0.023 SUVmax 0.891(0.792~1.003) 0.055 SUVpeak 0.877(0.758~1.014) 0.076 SUVmean 0.602(0.361~1.005) 0.052 TLR 0.808(0.631~1.034) 0.090 MTV(cm3) 0.999(0.977~1.021) 0.901 TLG(g) 0.998(0.994~1.003) 0.430 HI-1 0.025(0.001~0.992) 0.045 0.537(0.007~39.527) 0.777 HI-2 >4.962 7.368(2.385~22.764) <0.001 6.893(1.922~24.718) 0.003 ≤4.962 1.000 1.000 注:FDG为氟脱氧葡萄糖;PET为正电子发射断层显像术;CT为计算机体层摄影术;SUVmax为最大标准化摄取值;SUVpeak为标准化摄取值峰值;SUVmean为平均标准化摄取值;TLR为原发灶SUVmax/肝脏SUVmean的比值;MTV为肿瘤代谢体积;TLG为糖酵解总量;HI为异质性指数;CI为置信区间 -
[1] Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209−249. DOI: 10.3322/caac.21660. [2] Cao W, Chen HD, Yu YW, et al. Changing profiles of cancer burden worldwide and in China: a secondary analysis of the global cancer statistics 2020[J]. Chin Med J (Engl), 2021, 134(7): 783−791. DOI: 10.1097/CM9.0000000000001474. [3] Spolverato G, Ejaz A, Kim Y, et al. Prognostic performance of different lymph node staging systems after curative intent resection for gastric adenocarcinoma[J]. Ann Surg, 2015, 262(6): 991−998. DOI: 10.1097/SLA.0000000000001040. [4] Sun ZP, Jiang YM, Chen CL, et al. Radiomics signature based on computed tomography images for the preoperative prediction of lymph node metastasis at individual stations in gastric cancer: a multicenter study[J]. Radiother Oncol, 2021, 165: 179−190. DOI: 10.1016/j.radonc.2021.11.003. [5] Smyth E, Schöder H, Strong VE, et al. A prospective evaluation of the utility of 2-deoxy-2-[18F]fluoro-D-glucose positron emission tomography and computed tomography in staging locally advanced gastric cancer[J]. Cancer, 2012, 118(22): 5481−5488. DOI: 10.1002/cncr.27550. [6] Lee CM, Cho JM, Jang YJ, et al. Should lymph node micrometastasis be considered in node staging for gastric cancer?: The significance of lymph node micrometastasis in gastric cancer[J]. Ann Surg Oncol, 2015, 22(3): 765−771. DOI: 10.1245/s10434-014-4073-z. [7] Mpallas KD, Lagopoulos VI, Kamparoudis AG. Prognostic significance of solitary lymphnode metastasis and micrometastasis in gastric cancer[J/OL]. Front Surg, 2018, 5: 63[2023-03-02]. https://www.frontiersin.org/articles/10.3389/fsurg.2018.00063/full. DOI: 10.3389/fsurg.2018.00063. [8] Ma DY, Zhang Y, Shao XL, et al. PET/CT for predicting occult lymph node metastasis in gastric cancer[J]. Curr Oncol, 2022, 29(9): 6523−6539. DOI: 10.3390/curroncol29090513. [9] Liu GB, Yin HY, Cheng X, et al. Intra-tumor metabolic heterogeneity of gastric cancer on 18F-FDG PETCT indicates patient survival outcomes[J]. Clin Exp Med, 2021, 21(1): 129−138. DOI: 10.1007/s10238-020-00659-8. [10] Kim YI, Kim YJ, Paeng JC, et al. Heterogeneity index evaluated by slope of linear regression on 18F-FDG PET/CT as a prognostic marker for predicting tumor recurrence in pancreatic ductal adenocarcinoma[J]. Eur J Nucl Med Mol Imaging, 2017, 44(12): 1995−2003. DOI: 10.1007/s00259-017-3755-8. [11] Kim SJ, Pak K, Chang S. Determination of regional lymph node status using 18F-FDG PET/CT parameters in oesophageal cancer patients: comparison of SUV, volumetric parameters and intratumoral heterogeneity[J]. Br J Radiol, 2016, 89(1058): 20150673. DOI: 10.1259/bjr.20150673. [12] Ouyang ML, Xia HW, Xu MM, et al. Prediction of occult lymph node metastasis using SUV, volumetric parameters and intratumoral heterogeneity of the primary tumor in T1-2N0M0 lung cancer patients staged by PET/CT[J]. Ann Nucl Med, 2019, 33(9): 671−680. DOI: 10.1007/s12149-019-01375-4. [13] Chung HH, Kang SY, Ha S, et al. Prognostic value of preoperative intratumoral FDG uptake heterogeneity in early stage uterine cervical cancer[J]. J Gynecol Oncol, 2016, 27(2): e15. DOI: 10.3802/jgo.2016.27.e15. [14] Kim TH, Yoon JK, Kang DK, et al. Correlation between F-18 fluorodeoxyglucose positron emission tomography metabolic parameters and dynamic contrast-enhanced MRI-derived perfusion data in patients with invasive ductal breast carcinoma[J]. Ann Surg Oncol, 2015, 22(12): 3866−3872. DOI: 10.1245/s10434-015-4526-z. [15] Pinho DF, King B, Xi Y, et al. Value of intratumoral metabolic heterogeneity and quantitative 18F-FDG PET/CT parameters in predicting prognosis for patients with cervical cancer[J]. AJR Am J Roentgenol, 2020, 214(4): 908−916. DOI: 10.2214/AJR.19.21604. [16] Tixier F, Hatt M, Valla C, et al. Visual versus quantitative assessment of intratumor 18F-FDG PET uptake heterogeneity: prognostic value in non-small cell lung cancer[J]. J Nucl Med, 2014, 55(8): 1235−1241. DOI: 10.2967/jnumed.113.133389. [17] Bosch KD, Chicklore S, Cook GJ, et al. Staging FDG PET-CT changes management in patients with gastric adenocarcinoma who are eligible for radical treatment[J]. Eur J Nucl Med Mol Imaging, 2020, 47(4): 759−767. DOI: 10.1007/s00259-019-04429-x. [18] Kawanaka Y, Kitajima K, Fukushima K, et al. Added value of pretreatment 18F-FDG PET/CT for staging of advanced gastric cancer: comparison with contrast-enhanced MDCT[J]. Eur J Radiol, 2016, 85(5): 989−995. DOI: 10.1016/j.ejrad.2016.03.003. [19] Choi JY, Shim KN, Kim SE, et al. The clinical value of 18F-fluorodeoxyglucose uptake on positron emission tomography/computed tomography for predicting regional lymph node metastasis and non-curative surgery in primary gastric carcinoma[J]. Korean J Gastroenterol, 2014, 64(6): 340−347. DOI: 10.4166/kjg.2014.64.6.340. [20] Na SJ, O JH, Park JM, et al. Prognostic value of metabolic parameters on preoperative 18F-fluorodeoxyglucose positron emission tomography/ computed tomography in patients with stage Ⅲ gastric cancer[J/OL]. Oncotarget, 2016, 7(39): 63968−63980[2023-03-02]. https://www.oncotarget.com/article/11574/text/. DOI: 10.18632/oncotarget.11574. [21] Yamada K, Urakawa N, Kanaji S, et al. Preoperative prediction of the pathological stage of advanced gastric cancer by 18F-fluoro-2-deoxyglucose positron emission tomography[J/OL]. Sci Rep, 2022, 12(1): 11370[2023-03-02]. https://www.nature.com/articles/s41598-022-14965-6. DOI: 10.1038/s41598-022-14965-6. [22] 张在炬, 陈亚明, 丁正强, 等. 18F-FDG PET/CT代谢参数与胃癌临床病理特征的相关性分析[J]. 临床和实验医学杂志, 2021, 20(13): 1450−1454. DOI: 10.3969/j.issn.1671-4695.2021.13.030.
Zhang ZJ, Chen YM, Ding ZQ, et al. Correlation between 18F-FDG PET/CT metabolic parameters and clinicopathological features of gastric cancer[J]. J Clin Exp Med, 2021, 20(13): 1450−1454. DOI: 10.3969/j.issn.1671-4695.2021.13.030.[23] Oh HH, Lee SE, Choi IS, et al. The peak-standardized uptake value (P-SUV) by preoperative positron emission tomography-computed tomography (PET-CT) is a useful indicator of lymph node metastasis in gastric cancer[J]. J Surg Oncol, 2011, 104(5): 530−533. DOI: 10.1002/jso.21985. [24] Boellaard R, Delgado-Bolton R, Oyen WJG, et al. FDG PET/CT: EANM procedure guidelines for tumour imaging: version 2.0[J]. Eur J Nucl Med Mol Imaging, 2015, 42(2): 328−354. DOI: 10.1007/s00259-014-2961-x. [25] 朱娅华, 邓玮玮, 范敏, 等. 18F-FDG PET/CT显像在胃癌分期及治疗方案制定中的应用价值[J]. 国际放射医学核医学杂志, 2018, 42(1): 15−20. DOI: 10.3760/cma.j.issn.1673-4114.2018.01.003.
Zhu YH, Deng WW, Fan M, et al. Value of 18F-FDG PET/CT imaging on the staging of gastric carcinoma and its influence on therapeutic schedule formulation[J]. Int J Rad Med Nucl Med, 2018, 42(1): 15−20. DOI: 10.3760/cma.j.issn.1673-4114.2018.01.003.[26] Perlaza P, Ortín J, Pagès M, et al. Should 18F-FDG PET/CT Be routinely performed in the clinical staging of locally advanced gastric adenocarcinoma?[J]. Clin Nucl Med, 2018, 43(6): 402−410. DOI: 10.1097/RLU.0000000000002028. [27] 周锦, 张漫雪, 胡秀芝, 等. 原发胃癌18F-FDG PET/CT代谢参数与临床病理特征的相关性[J]. 中国医学影像技术, 2019, 35(1): 95−99. DOI: 10.13929/j.1003-3289.201806068.
Zhou J, Zhang MX, Hu XZ, et al. Correlation of 18F-FDG PET/CT metabolic parameters and clinicopathological factors of primary gastric cancer[J]. Chin J Med Imaging Technol, 2019, 35(1): 95−99. DOI: 10.13929/j.1003-3289.201806068.[28] Xue XQ, Yu WJ, Shao XL, et al. Incremental value of PET primary lesion-based radiomics signature to conventional metabolic parameters and traditional risk factors for preoperative prediction of lymph node metastases in gastric cancer[J/OL]. Abdom Radiol (NY), 2023, 48(2): 510−518[2023-03-02]. https://link.springer.com/article/10.1007/s00261-022-03738-4. DOI: 10.1007/s00261-022-03738-4. [29] 王建林, 丁晓芳, 马晚俊, 等. 18F-FDG PET/CT代谢参数及代谢异质性与胃癌临床病理特征的相关性[J]. 中国临床医学影像杂志, 2022, 33(6): 414−418,429. DOI: 10.12117/jccmi.2022.06.008.
Wang JL, Ding XF, Ma WJ, et, al. Correlation of 18F-FDG PET/CT metabolic parameters and metabolic heterogeneity with clinicopathological features of gastric cancer[J]. J China Clin Med Imaging, 2022, 33(6): 414−418,429. DOI: 10.12117/jccmi.2022.06.008.[30] Kobayashi S, Ogura M, Suzawa N, et al. 18F-FDG uptake in the stomach on screening PET/CT: value for predicting Helicobacter pylori infection and chronic atrophic gastritis[J/OL]. BMC Med Imaging, 2016, 16(1): 58[2023-03-02]. https://bmcmedimaging.biomedcentral.com/articles/10.1186/s12880-016-0161-9. DOI: 10.1186/s12880-016-0161-9. -






 下载:
下载: