-
整合素αvβ3在新生血管内皮细胞和恶性肿瘤细胞表面高表达,而在正常组织中不表达或低表达。精氨酸-甘氨酸-天冬氨酸(arginine-glycine-aspatic acid,RGD)三肽序列是一种小分子肽,其与整合素αvβ3受体存在配体受体关系,且有较高的选择性和亲和力[1]。Parihar等[2]的研究结果显示,68Ga标记的RGD PET/CT显像对放射性碘难治性分化型甲状腺癌(radioiodine refractory DTC,RAIR-DTC)病灶的检出率为82.3%。在国内,99Tcm简单易得,性价比高,且SPECT/CT较PET/CT更普及,因此99Tcm标记的RGD SPECT/CT显像有望在国内推广。Zhao等[3]初步报道了整合素受体99Tcm-甲苯磺酸钠烟酰胺腙聚乙二醇双环RGD肽(简称99Tcm-3PRGD2)SPECT/CT显像用于RAIR-DTC病灶的定位和生长评估的可行性。但目前国内关于99Tcm-3PRGD2 SPECT/CT显像在RAIR-DTC中应用的文献较少。本研究旨在评价99Tcm-3PRGD2 SPECT/CT显像对RAIR-DTC病灶的诊断效能,为抗血管生成酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKI)在RAIR-DTC中的应用提供分子影像可视化依据。
-
前瞻性选择2019年10月至2022年5月在福建省立医院行99Tcm-3PRGD2 SPECT/CT检查的59例RAIR-DTC患者,其中男性17例、女性42例,中位年龄为51(28,80)岁。纳入标准(同时满足以下所有条件)[4-5]:(1)年龄>18岁;(2)甲状腺癌全切术后经组织病理学检查结果证实为DTC;(3)经131I治疗后影像检查未发现明确病灶,但血清疗效不佳[在无甲状腺球蛋白抗体(TgAb)干扰的情况下,刺激性甲状腺球蛋白(stimulated thyroglobulin,sTg)水平>10 ng/ml,且在随访中sTg的水平持续上升]或结构疗效不佳(CT、MRI、超声提示病灶进展);(4)131I全身显像阴性。排除标准(满足以下任意条件):(1)怀孕或哺乳期;(2)有第2原发肿瘤;(3)无法定期复查及随访;(4)研究者认为存在妨碍本研究的任何条件。本研究经福建省立医院伦理委员会批准[伦审科研第(K2019-09-037)号],所有患者均于检查前签署了知情同意书。
59例患者中,22例在行99Tcm-3PRGD2 SPECT/CT显像后接受了TKI治疗(安罗替尼14例、阿帕替尼5例、索拉非尼3例),37例接受了TSH抑制治疗(13例在2周内接受了18F-FDG PET/CT显像)。取每例患者最大病灶的SUVmax进行分析。
Parihar等[2] 的研究结果显示,68Ga-RGD PET/CT显像诊断RAIR-DTC的灵敏度和特异度均为82.3%。基于此,本研究假设99Tcm-3PRGD2 SPECT/CT显像对RAIR-DTC转移灶检出的灵敏度和特异度均>50%。采用PASS 11样本量计算软件计算所需样本量,假设α=0.05(单侧),β=0.1,计算结果表明,本研究至少需要纳入264个病灶。
-
3PRGD2冻干试剂由北京大学医学同位素研究中心提供。取一瓶3PRGD2冻干试剂静置5 min,加入1 ml 0.9% NaCl溶液溶解后,再加入约2 ml 99TcmO4 −溶液(1110~1850 MBq),混合均匀,置于100℃水浴中加热20 min[6]。18F-FDG由福建省立医院核医学科采用美国GE公司的MiniTrace加速器和Microlab全自动合成系统自行制备。99Tcm-3PRGD2和18F-FDG的放射化学纯度均>95%。
-
采用美国GE公司的Discovery NM/CT 670Pro SPECT/CT仪进行显像。静脉注射99Tcm-3PRGD2(11.1 MBq/kg)后,嘱患者多饮水,2 h后行全身平面及断层SPECT/CT显像,显像前排空小便。使用低能高分辨率准直器进行图像采集,采集参数:(1)全身前后位平面显像的能峰为140 keV、窗宽15%、床速为10 cm/min、矩阵为256×1024;(2)断层SPECT/CT显像的矩阵为128×128、放大倍数为1.0、探头旋转360°(30 s/帧,共60帧);同机CT扫描的电压为130 kV、电流为60 mA。
-
采用美国GE公司的 Discovery NM/CT 710 PET/CT仪进行显像。所有患者在接受PET/CT显像前均需禁食6 h以上,空腹血糖≤11.1 mmol/L。静脉注射18F-FDG的剂量为3.70~5.55 MBq/kg,患者于安静环境中休息50~60 min。排空小便后上机进行扫描。扫描范围从颅底至股骨上段,患者取仰卧位,双上肢抱头。先行CT扫描,扫描参数:电压140 kV、电流150 mA、矩阵512×512、螺距≥1.0、层厚7.5 mm、球管单圈旋转时间为0.5 s。采用标准重建法对CT图像进行重建,重建层厚5 mm;采用三维模式采集PET图像,采集床位依据CT定位扫描而定,每床位采集2.5 min。应用三维逻辑回归(LOR)重建算法对PET图像进行重建,重建层厚5 mm,间隔5 mm。并应用CT数据对PET图像进行衰减校正。将校正后的PET图像与CT图像进行融合,得到冠状面、矢状面和横断面的融合图像。
-
应用美国GE公司的核医学显像工作站Xeleris 3.0处理图像。由2位工作满5年的核医学科主治及以上职称的医师采用双盲阅片法进行视觉评估,意见不一致时由第3位上级医师判断,并通过文献已报道的方法诊断RAIR-DTC病灶[2]:排除生理性和炎症摄取后,当99Tcm-3PRGD2显像剂摄取高于正常区域,视为SPECT/CT显像阳性,病灶视为阳性病灶;同机CT表现形态异常,但相应部位未见显像剂异常摄取者,视为SPECT/CT显像阴性,病灶视为阴性病灶。定量分析[7]:应用美国GE公司的定量分析软件Q.Metrix 1.0程序进行图像重建,将采集的信息(SPECT的灵敏度、给药时间、满针和空针活度)输入系统,对99Tcm-3PRGD2浓聚区域进行定量分析,勾画感兴趣区体积(volume of interest,VOI),阈值为0.4;计算的SUV体素体积为3.2×10−3 ml,自动生成VOI相关定量参数,取SUVmax以评价病灶摄取情况。
-
RAIR-DTC病灶的判断标准[2,8-9]:(1)组织病理学检查结果证实为DTC,在后续随访过程中sTg水平持续上升或影像检查结果提示病情进展;(2)经靶向药物治疗、射频消融、125I粒子植入治疗等干预治疗后,病灶体积缩小且sTg水平降低;(3)在仅进行TSH抑制治疗的情况下,病灶体积增大且sTg水平升高。非RAIR-DTC病灶的判断标准[2,8-9]:随访过程中,在未干预的情况下,sTg水平自发地降低并维持在较低水平(sTg<10 ng/ml)。验证标准采用已报道的类似研究方法进行随访[10]:所有患者进行至少6个月(或直至病死)的临床随访,每2个月复查一次sTg。随访过程中患者根据临床需要进行相关影像检查(CT、MRI、超声、PET/CT、PET/MRI等)。18F-FDG PET/CT显像诊断RAIR-DTC病灶的验证标准同99Tcm-3PRGD2 SPECT/CT显像一致。
-
应用SPSS 19.0软件对数据进行统计学分析。符合正态分布的计量资料以
$\bar x \pm s $ 表示;连续非正态分布的计量资料以M(Q1,Q3)表示。采用ROC曲线评估99Tcm-3PRGD2 SPECT/CT显像、18F-FDG显像的诊断效能,并计算99Tcm-3PRGD2 SPECT/CT显像检出RAIR-DTC病灶的SUVmax临界值。采用Pearson相关分析法分析TL、sTg水平与SUVmax的相关性。采用配对t检验比较分析RAIR-DTC患者TKI治疗前后sTg水平、SUVmax、TL间的关系。采用Spearman分析法分析99Tcm-3PRGD2 SPECT/CT显像与18F-FDG PET/CT显像在检出阳性病灶的SUVmax之间的关系。P<0.05为差异或相关性有统计学意义。 -
在59例患者中共检测出295个病灶,其中能通过本研究验证标准定性且可进行SUVmax定量的病灶共276个。这276个病灶中有活体组织病理学检查结果的病灶共36个,无活体组织病理学检查结果的病灶共240个,所有病灶均结合相应的临床随访结果加以验证。
-
99Tcm-3PRGD2 SPECT/CT显像对276个RAIR-DTC病灶诊断的灵敏度、特异度、准确率、阳性预测值、阴性预测值分别为94.9%(203/214,95%CI:90.7%~97.3%)、88.7%(55/62,95%CI:77.5%~95.0%)、93.5%(258/276,95%CI:88.5%~95.3%)、96.7% (203/210,95%CI:93.0%~98.5%)、83.3% (55/66,95%CI:71.7%~91.0%)。ROC曲线分析结果显示,界定是否为RAIR-DTC病灶的SUVmax的最佳临界值为2.70,AUC为0.874,灵敏度为88.6%,特异度为81.8%,约登指数为0.704。
-
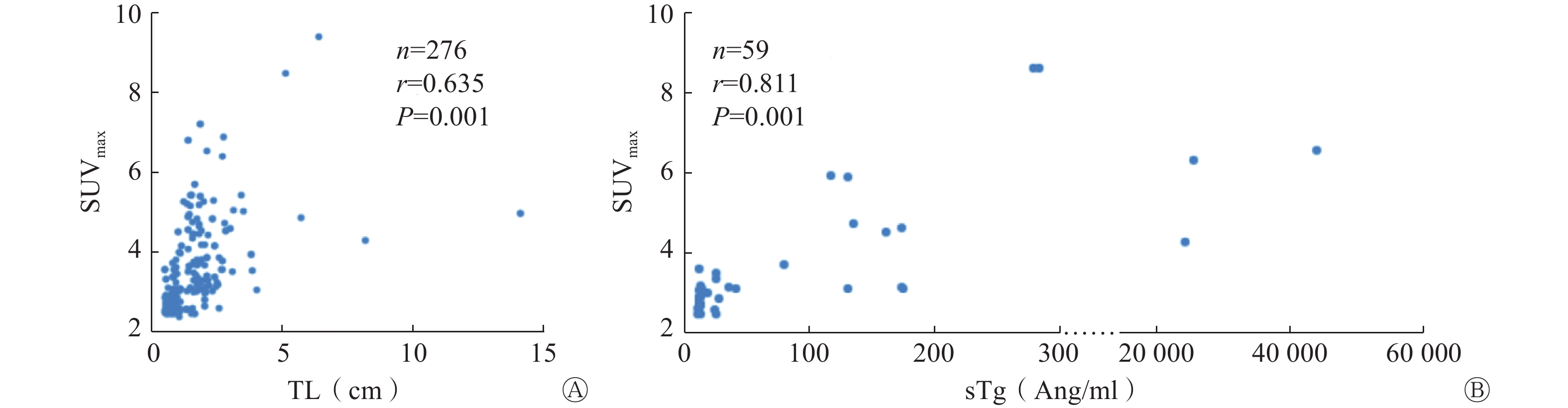
Pearson相关分析结果显示,TL与病灶SUVmax呈正相关(r=0.635,P=0.001);sTg水平与SUVmax呈正相关(r=0.811,P=0.001)(图1A、1B)。
-
对接受TKI治疗的22例患者的59个病灶进行研究的结果显示,SUVmax、TL及sTg水平在TKI治疗前后的差异均有统计学意义(t=11.027、6.205、3.928,均P=0.001,表1)。TKI治疗前后99Tcm-3PRGD2 SPECT/CT显像变化的典型病例见图2。
时间 SUVmax TL(cm) sTg水平(ng/ml) 治疗前 5.56±2.00 1.97±1.22 3369.45±3443.24 治疗后 3.68±1.43 1.12±0.57 899.62±671.15 t值 11.027 6.205 3.928 P值 0.001 0.001 0.001 注:RAIR-DTC为放射性碘难治性分化型甲状腺癌;3PRGD2为甲苯磺酸钠烟酰胺腙聚乙二醇双环精氨酸-甘氨酸-天冬氨酸肽;SPECT为单光子发射计算机体层摄影术;CT为计算机体层摄影术;SUVmax为最大标准化摄取值;TL为病灶长径;sTg为刺激性甲状腺球蛋白 表 1 RAIR-DTC患者酪氨酸激酶抑制剂治疗前后99Tcm- 3PRGD2 SPECT/CT显像病灶相关参数的变化(
$\bar x\pm s $ Table 1. Changes of parameters related to 99Tcm-SPECT/CT imaging in patients with radioiodine refractory differentiated thyroid cancer before and after tyrosine kinase inhibitors treatment (
$\bar x\pm s $ -
18F-FDG PET/CT显像和99Tcm-3PRGD2 SPECT/CT显像检测RAIR-DTC阳性病灶的灵敏度分别为96.7%(59/61)和93.4%(57/61),特异度分别为84.6%(11/13)和92.3%(12/13)。ROC曲线分析结果显示,18F-FDG PET/CT显像的AUC为86.8%(95%CI:76.1%~97.6%),99Tcm-3PRGD2 SPECT/CT显像的AUC为89.0%(95%CI:80.4%~97.5%),2种方法的AUC差异无统计学意义(Z=0.312,P=0.753,图3)。Spearman相关分析结果显示,99Tcm-3PRGD2 SPECT/CT显像与18F-FDG PET/CT显像检出阳性病灶的SUVmax呈正相关,且差异有统计学意义(r=0.560,P=0.001,图4)。
-
由于RAIR-DTC患者的预后差,特别是不摄碘进展性RAIR-DTC患者,其10年生存率不足10%[11-12],故其后续的诊治成为临床工作中关注的焦点。RAIR-DTC细胞生长缓慢,导致病灶葡萄糖代谢相对较低,因此,18F-FDG PET/CT显像诊断RAIR-DTC病灶有一定的局限性[13]。RAIR-DTC的发生机制涉及多种基因突变和信号通路的异常激活,导致RAIR-DTC病灶肿瘤新生血管增殖活跃[3]。整合素αvβ3是肿瘤血管生成的关键因子,其在调节癌细胞转移潜能、通过与纤维连接蛋白相互作用影响细胞活力、增加肿瘤细胞对分离的抵抗性等方面也具有重要作用[14]。
99Tcm-3PRGD2是一种靶向整合素αvβ3受体的新型放射性示踪剂,能反映肿瘤新生血管的生成情况。并有临床报道表明99Tcm-3PRGD2 SPECT/CT显像结果对调整进展性RAIR-DTC的治疗决策具有积极意义[15]。与PET/CT显像示踪剂18F-RGD和68Ga-RGD相比,99Tcm-3PRGD2是一种物理性能好、经济、使用范围广、便于多次随访复查的SPECT/CT显像示踪剂。
本研究结果显示,99Tcm-3PRGD2 SPECT/CT显像对RAIR-DTC病灶诊断的灵敏度和特异度分别为94.9%和88.7%,这与之前报道的68Ga-DOTA-RGD2 PET/CT显像对RAIR-DTC病灶的检查效果相似,均具有较高的灵敏度和特异度[2]。RAIR-DTC病灶丧失了钠/碘转运体的表达,但能继续产生sTg[16-17]。故sTg是一种灵敏的血清生物标志物,能较好地描述RAIR-DTC的特征。在本研究中,RAIR-DTC靶病灶的SUVmax与sTg水平及TL呈正相关。这表明RAIR-DTC肿瘤负荷大小和靶向血管生成的放射性示踪剂99Tcm-3PRGD2的摄取呈正相关。本研究同时预测了99Tcm-3PRGD2 SPECT/CT显像诊断RAIR-DTC病灶的最佳SUVmax的临界值为2.70。综上,靶病灶的SUVmax能够反映RAIR-DTC肿瘤负荷,且随着SUVmax的增加,预示着肿瘤细胞具有更快的生长速度与转移潜能。当SUVmax>2.70时,99Tcm-3PRGD2 SPECT/CT显像对RAIR-DTC病灶具有较高的诊断效能。
目前在TKI疗效监测方面,针对不同靶点的抗血管生成靶向药物相继问世,并被证实可以延长RAIR-DTC患者的无进展生存期 [11-12, 18]。根据实体瘤疗效评价标准,临床中常用超声和CT依据肿瘤大小的变化来评价治疗疗效[19]。然而,代谢功能的改变往往先于形态的改变。解剖变化往往不能及时评估治疗的反应,特别是TKI治疗[20]。因此,本研究尝试探索能可视化评估肿瘤新生血管活性的分子影像指标。本研究结果显示,经靶向药物治疗后,RAIR-DTC病灶的SUVmax明显低于治疗前,说明治疗后RAIR-DTC病灶内整合素αvβ3受体含量减少,即肿瘤新生血管减少,提示靶向药物可有效抑制肿瘤新生血管的形成。靶向药物治疗前后SUVmax与血清学指标(sTg)、形态学指标(肿瘤大小)变化方向一致(均减少)。故RAIR-DTC病灶TKI治疗前后的SUVmax的变化可作为灵敏的分子影像指标,协助早期预测TKI治疗效果,监测药物治疗后的早期反应,以便尽早确定疗效,及时终止不必要的TKI治疗。
与18F-FDG PET/CT显像相比,99Tcm-3PRGD2 SPECT/CT显像检测RAIR-DTC阳性病灶的灵敏度略低。这可能是因为18F-FDG PET/CT是一种固有分辨率更高、信噪比优于SPECT/CT的显像模式,具有可预见的优势。然而,99Tcm-3PRGD2 SPECT/CT显像的特异度更高,原因可能是当肿瘤细胞处于新血管生成阶段时,糖代谢率相对较低[21],此时,18F-FDG PET/CT显像的诊断效能没有明显优于99Tcm-3PRGD2 SPECT/CT。尽管2种显像剂的摄取模式不同,但我们发现99Tcm-3PRGD2 SPECT/CT显像与18F-FDG PET/CT显像在检出阳性病灶的SUVmax间存在显著相关性,这提示在RAIR-DTC肿瘤细胞增殖的过程中,细胞的糖代谢与新生血管的形成可能相互重叠。
不可否认,本研究具有一定的局限性。(1)出于伦理原因,并不是所有的RAIR-DTC病灶都能通过组织病理学检查结果证实。因此,缺乏对组织病理学相关性的研究。(2)纳入研究的RAIR-DTC患者样本量较少,本研究没有就靶向药物治疗前后RAIR-DTC病灶在18F-FDG PET/CT显像和99Tcm-3PRGD2 SPECT/CT显像中的表现进行对比研究。因此在下一阶段,我们计划进行更大样本量、前瞻性的纵向研究来对比18F-FDG PET/CT显像和99Tcm-3PRGD2 SPECT/CT显像对RAIR-DTC病灶靶向药治疗前后疗效的反应。(3)本研究的受试者范围较窄,仅限于不摄碘的进展性RAIR-DTC患者。但作为99Tcm-3PRGD2 SPECT/CT显像在RAIR-DTC方面的探索性研究,仍具有价值。下一步我们将探讨99Tcm-3PRGD2 SPECT/CT显像对所有类型RAIR-DTC患者的诊断价值。
综上所述,99Tcm-3PRGD2 SPECT/CT显像对不摄碘进展性RAIR-DTC转移病灶具有较高的灵敏度和特异度,与18F-FDG PET/CT显像相似。SUVmax能反映RAIR-DTC患者的肿瘤负荷,当SUVmax>2.70时,99Tcm-3PRGD2 SPECT/CT显像对RAIR-DTC病灶的诊断效能较高。在治疗方面,SUVmax可作为一项灵敏的分子影像指标,能协助早期预测TKI的治疗效果。总之,99Tcm-3PRGD2 SPECT/CT显像作为一种性价比高的显像模式,在RAIR-DTC患者诊疗管理中具有广阔的应用前景。
利益冲突 所有作者声明无利益冲突
作者贡献声明 李宇轩负责命题的提出、研究设计、现场实验的开展;张禹负责论文的撰写;林志毅负责研究的指导;苏耀东负责数据的统计与分析;石远颖负责数据的收集、整理与分析;陈文新负责论文的修改、经费的支持
99Tcm-3PRGD2 SPECT/CT显像在不摄碘进展性放射性碘难治性分化型甲状腺癌中的诊断价值
99Tcm-3PRGD2 SPECT/CT imaging in the diagnosis of progressive radioiodine refractory differentiated thyroid cancer without iodine uptake
-
摘要:
目的 评价99Tcm-甲苯磺酸钠烟酰胺腙聚乙二醇双环精氨酸-甘氨酸-天冬氨酸肽(简称99Tcm-3PRGD2) SPECT/CT显像对不摄碘进展性放射性碘难治性分化型甲状腺癌(RAIR-DTC)的诊断效能。 方法 前瞻性选择2019年10月至2022年5月在福建省立医院行99Tcm-3PRGD2 SPECT/CT检查的59例RAIR-DTC患者,其中男性17例、女性42例,中位年龄为51(28,80)岁。所有患者均行99Tcm-3PRGD2 SPECT/CT显像,其中22例接受酪氨酸激酶抑制剂(TKI)治疗,37例接受促甲状腺激素(TSH)抑制治疗(13例在2周内接受了18F-FDG PET/CT显像)。取每例患者最大病灶的最大标准化摄取值(SUVmax)进行分析。采用ROC曲线评估99Tcm-3PRGD2 SPECT/CT显像的诊断效能并计算99Tcm-3PRGD2 SPECT/CT显像检出RAIR-DTC病灶的SUVmax临界值;采用Pearson相关分析法分析病灶长径(TL)、刺激性甲状腺球蛋白(sTg)水平与SUVmax的相关性;采用配对t检验比较分析RAIR-DTC患者TKI治疗前后sTg水平、SUVmax、TL间的关系;采用Spearman分析法分析99Tcm-3PRGD2 SPECT/CT显像与18F-FDG PET/CT显像在检出阳性病灶的SUVmax之间的关系。 结果 59例RAIR-DTC患者的276个病灶被纳入分析,其中TKI治疗前后对比病灶59个。99Tcm-3PRGD2 SPECT/CT显像对RAIR-DTC病灶诊断的灵敏度和特异度分别为94.9% (95%CI:90.7%~97.3%)和88.7%(95%CI:77.5%~95.0%)。ROC曲线结果显示,99Tcm-3PRGD2 SPECT/CT显像检出RAIR-DTC病灶的SUVmax临界值为2.70。Pearson相关分析结果显示,靶病灶的SUVmax与sTg水平、TL均呈正相关(r=0.811、0.635,均P=0.001)。22例患者经TKI治疗后,RAIR-DTC病灶的SUVmax显著降低(t=11.027,P=0.001)。Spearman相关分析结果显示,99Tcm-3PRGD2 SPECT/CT显像与18F-FDG PET/CT显像在检出阳性病灶的SUVmax间呈正相关(r=0.560,P=0.001),且ROC曲线分析结果显示,99Tcm-3PRGD2 SPECT/CT显像对RAIR-DTC病灶的诊断效能与18F-FDG PET/CT显像的差异无统计学意义(Z=0.312,P=0.753)。 结论 99Tcm-3PRGD2 SPECT/CT显像对不摄碘进展性RAIR-DTC的诊断具有较高的灵敏度和特异度,与18F-FDG PET/CT显像相似。 -
关键词:
- 甲状腺肿瘤 /
- 碘放射性同位素 /
- 整合素αvβ3受体 /
- 单光子发射计算机体层摄影术 /
- 正电子发射断层显像术 /
- 体层摄影术,X线计算机
Abstract:Objective To evaluate the diagnostic efficiency of 99Tcm-sodium toluene sulfonate nicotinamide hydrazone PEGylated bicyclic arginine-glycine-aspatic acid peptide (abbreviation 99Tcm-3PRGD2) SPECT/CT imaging to progressive radioiodine refractory differentiated thyroid cancer (RAIR-DTC) without iodine uptake. Methods A total of 59 patients with RAIR-DTC who underwent 99Tcm-3PRGD2 SPECT/CT examination in Fujian Provincial Hospital from October 2019 to May 2022 were prospectively selected, including 17 males and 42 females, with a median age of 51 (28, 80) years. All patients underwent 99Tcm-3PRGD2 SPECT/CT, among them, 22 patients were treated with a tyrosine kinase inhibitor (TKI), and 37 patients had thyroid-stimulating hormone (TSH) inhibition [13 patients underwent 18F-fluorodeoxyglucose (FDG) PET/CT within two weeks]. Maximum standardized uptake value (SUVmax) of the lesion with the largest-length diameter in each patient was analyzed. The diagnostic efficiency of 99Tcm-3PRGD2 SPECT/CT imaging was evaluated by receiver operating characteristic (ROC) curves analysis and was also used to calculate the SUVmax cut-off value of 99Tcm-3PRGD2 SPECT/CT to assist in the detection of RAIR-DTC lesions. Using Pearson correlation analysis method to analyze the correlations between the target lesion (TL), stimulated thyroglobulin (sTg) levels and SUVmax. The relationships between the sTg levels, SUVmax and TL in RAIR-DTC patients before and after TKI treatment were analyzed by paired t test. Results A total of 276 lesions from 59 RAIR-DTC patients were included in the analysis. These 59 lesions were compared before and after TKI treatment. The sensitivity and specificity of 99Tcm-3PRGD2 SPECT/CT imaging for the diagnosis of RAIR-DTC lesions were 94.9% (95%CI: 90.7%–97.3%) and 88.7% (95%CI: 77.5%–95.0%), respectively. The ROC curves results showed that the cut-off value of SUVmax for RAIR-DTC lesions detected by 99Tcm-3PRGD2 SPECT/CT imaging was 2.70. The results of the Pearson correlation analysis showed that the SUVmax of the target lesions was positively correlated with the sTg levels and TL (r=0.811, 0.635, both P=0.001). The paired t test results showed that SUVmax in RAIR-DTC lesions was significantly decreased before and after TKI treatment (t=11.027, P=0.001). Spearman correlation analysis showed that there was a positive correlation between 99Tcm-3PRGD2 SPECT/CT imaging and 18F-FDG PET/CT imaging in detecting SUVmax of positive lesions (r=0.560, P=0.001). However, the results of ROC curves analysis did not show statistical significance in the diagnostic efficiency of 99Tcm-3PRGD2 SPECT/CT imaging for RAIR-DTC lesions versus 18F-FDG PET/CT imaging (Z=0.312, P=0.753). Conclusion 99Tcm-3PRGD2 SPECT/CT imaging had high sensitivity and specificity in the diagnosis of progressive RAIR-DTC without iodine uptake, similar to 18F-FDG PET/CT. -
表 1 RAIR-DTC患者酪氨酸激酶抑制剂治疗前后99Tcm- 3PRGD2 SPECT/CT显像病灶相关参数的变化(
$\bar x\pm s $ Table 1. Changes of parameters related to 99Tcm-SPECT/CT imaging in patients with radioiodine refractory differentiated thyroid cancer before and after tyrosine kinase inhibitors treatment (
$\bar x\pm s $ 时间 SUVmax TL(cm) sTg水平(ng/ml) 治疗前 5.56±2.00 1.97±1.22 3369.45±3443.24 治疗后 3.68±1.43 1.12±0.57 899.62±671.15 t值 11.027 6.205 3.928 P值 0.001 0.001 0.001 注:RAIR-DTC为放射性碘难治性分化型甲状腺癌;3PRGD2为甲苯磺酸钠烟酰胺腙聚乙二醇双环精氨酸-甘氨酸-天冬氨酸肽;SPECT为单光子发射计算机体层摄影术;CT为计算机体层摄影术;SUVmax为最大标准化摄取值;TL为病灶长径;sTg为刺激性甲状腺球蛋白 -
[1] Wang LJ, Shi JY, Kim YS, et al. Improving tumor-targeting capability and pharmacokinetics of 99mTc-labeled cyclic RGD dimers with PEG4 linkers[J]. Mol Pharm, 2009, 6(1): 231−245. DOI: 10.1021/mp800150r. [2] Parihar AS, Mittal BR, Kumar R, et al. 68Ga-DOTA-RGD2 positron emission tomography/computed tomography in radioiodine refractory thyroid cancer: prospective comparison of diagnostic accuracy with 18F-FDG positron emission tomography/computed tomography and evaluation toward potential theranostics[J]. Thyroid, 2020, 30(4): 557−567. DOI: 10.1089/thy.2019.0450. [3] Zhao D, Jin XN, Li F, et al. Integrin αvβ3 imaging of radioactive iodine-refractory thyroid cancer using 99mTc-3PRGD2[J]. J Nucl Med, 2012, 53(12): 1872−1877. DOI: 10.2967/jnumed.112.107821. [4] 中华医学会核医学分会. 131I治疗分化型甲状腺癌指南(2021版)[J]. 中华核医学与分子影像杂志, 2021, 41(4): 218−241. DOI: 10.3760/cma.j.cn321828-20201113-00412.
Chinese Medical Association. Guidelines for radioiodine therapy of differentiated thyroid cancer (2021 edition)[J]. Chin J Nucl Med Mol Imaging, 2021, 41(4): 218−241. DOI: 10.3760/cma.j.cn321828-20201113-00412.[5] 中国临床肿瘤学会指南工作委员会. 中国临床肿瘤学会(CSCO)分化型甲状腺癌诊疗指南2021[J]. 肿瘤预防与治疗, 2021, 34(12): 1164−1201. DOI: 10.3969/j.issn.1674-0904.2021.12.013.
Guidelines Working Committee of Chinese Society of Clinical Oncology. Guidelines of Chinese Society of Clinical Oncology (CSCO) differentiated thyroid cancer[J]. J Cancer Control Treat, 2021, 34(12): 1164−1201. DOI: 10.3969/j.issn.1674-0904.2021.12.013.[6] Jia B, Liu ZF, Zhu ZH, et al. Blood clearance kinetics, biodistribution, and radiation dosimetry of a kit-formulated integrin αvβ3-selective radiotracer 99mTc-3PRGD2 in non-human primates[J]. Mol Imaging Biol, 2011, 13(4): 730−736. DOI: 10.1007/s11307-010-0385-y. [7] Dong F, Li L, Bian YZ, et al. Standardized uptake value using thyroid quantitative SPECT/CT for the diagnosis and evaluation of graves' disease: a prospective multicenter study[J/OL]. Biomed Res Int, 2019, 2019: 7589853[2023-01-03]. https://www.hindawi.com/journals/bmri/2019/7589853/. DOI: 10.1155/2019/7589853. [8] Fu H, Wu J, Huang JX, et al. 68Ga fibroblast activation protein inhibitor PET/CT in the detection of metastatic thyroid cancer: comparison with 18F-FDG PET/CT[J]. Radiology, 2022, 304(2): 397−405. DOI: 10.1148/radiol.212430. [9] Xu QF, Liu RC, Wang J, et al. Role of [99mTc]Tc-galacto-RGD2 SPECT/CT in identifying metastatic differentiated thyroid carcinoma after thyroidectomy and radioactive iodine therapy[J]. Nucl Med Biol, 2020, 88-89: 34−43. DOI: 10.1016/j.nucmedbio.2020.06.006. [10] Zhang Y, Lin ZY, Li T, et al. Head-to-head comparison of 99mTc-PSMA and 99mTc-MDP SPECT/CT in diagnosing prostate cancer bone metastasis: a prospective, comparative imaging trial[J/OL]. Sci Rep, 2022, 12(1): 15993[2023-01-03]. https://www.nature.com/articles/s41598-022-20280-x. DOI: 10.1038/s41598-022-20280-x. [11] Durante C, Haddy N, Baudin E, et al. Long-term outcome of 444 patients with distant metastases from papillary and follicular thyroid carcinoma: benefits and limits of radioiodine therapy[J]. J Clin Endocrinol Metab, 2006, 91(8): 2892−2899. DOI: 10.1210/jc.2005-2838. [12] Schlumberger M, Tahara M, Wirth LJ, et al. Lenvatinib versus placebo in radioiodine-refractory thyroid cancer[J]. N Engl J Med, 2015, 372(7): 621−630. DOI: 10.1056/NEJMoa1406470. [13] Fu H, Fu J, Huang JX, et al. 68Ga-FAPI PET/CT versus 18F-FDG PET/CT for detecting metastatic lesions in a case of radioiodine-refractory differentiated thyroid cancer[J]. Clin Nucl Med, 2021, 46(11): 940−942. DOI: 10.1097/RLU.0000000000003730. [14] Liu J, Yuan SH, Wang LL, et al. Diagnostic and predictive value of using RGD PET/CT in patients with cancer: a systematic review and meta-analysis[J/OL]. Biomed Res Int, 2019, 2019: 8534761[2023-01-03]. https://www.hindawi.com/journals/bmri/2019/8534761/. DOI: 10.1155/2019/8534761. [15] Zhang Y, Li YX, Lin ZY, et al. Can 99Tcm-3PRGD2(ανβ3) and 18F-FDG dual-tracer molecular imaging change the therapeutic strategy for progressive refractory differentiated thyroid cancer: case report[J]. Medicine (Baltimore), 2023, 102(5): e32751. DOI: 10.1097/MD.0000000000032751. [16] Schlumberger M, Brose M, Elisei R, et al. Definition and management of radioactive iodine-refractory differentiated thyroid cancer[J]. Lancet Diabetes Endocrinol, 2014, 2(5): 356−358. DOI: 10.1016/S2213-8587(13)70215-8. [17] Kang SY, Bang JI, Kang KW, et al. FDG PET/CT for the early prediction of RAI therapy response in patients with metastatic differentiated thyroid carcinoma[J/OL]. PLoS One, 2019, 14(6): e0218416[2023-01-03]. https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0218416. DOI: 10.1371/journal.pone.0218416. [18] Brose MS, Nutting CM, Jarzab B, et al. Sorafenib in radioactive iodine-refractory, locally advanced or metastatic differentiated thyroid cancer: a randomised, double-blind, phase 3 trial[J]. Lancet, 2014, 384(9940): 319−328. DOI: 10.1016/S0140-6736(14)60421-9. [19] Lee EK, Kim SM, Kim BH, et al. Lesion-based evaluation predicts treatment response to lenvatinib for radioactive iodine-refractory differentiated thyroid cancer: a Korean multicenter retrospective study[J]. Thyroid, 2019, 29(12): 1811−1819. DOI: 10.1089/thy.2019.0022. [20] Lin YS, Qin SK, Li ZY, et al. Apatinib vs placebo in patients with locally advanced or metastatic, radioactive iodine-refractory differentiated thyroid cancer: the REALITY randomized clinical trial[J]. JAMA Oncol, 2022, 8(2): 242−250. DOI: 10.1001/jamaoncol.2021.6268. [21] Folkman J. Angiogenesis in cancer, vascular, rheumatoid and other disease[J]. Nat Med, 1995, 1(1): 27−30. DOI: 10.1038/nm0195-27. -






 下载:
下载: