-
肺癌是目前全世界范围内发病率和病死率位居前列的肿瘤[1],非小细胞肺癌(non-small cell lung cancer,NSCLC)是其最常见的类型[2]。Kim等[3]的研究结果显示,部分肺癌患者可发生表皮生长因子受体(epidermal growth factor receptor,EGFR)基因突变,对于EGFR基因突变的NSCLC患者,EGFR酪氨酸激酶抑制剂能够提高患者疗效、降低复发率、延长总生存期[3]。近年来,肺癌突变基因与影像特征之间的关系成为研究的热点[4],国内外针对肺癌EGFR基因突变与影像特征相关性研究的对象大多为Ⅲ ~Ⅳ期患者,检测标本来源于穿刺或手术,结论尚未统一。本研究探讨Ⅰ ~ⅢB期可切除周围型NSCLC患者EGFR基因突变与临床及高分辨率CT(high resolution CT,HRCT)影像特征的相关性,旨在为肺癌的精准治疗提供影像学依据。
-
回顾性分析2019年1月至2021年4月于惠州市中心人民医院接受手术切除、术后行EGFR基因检测且临床分期为Ⅰ ~ⅢB期的周围型NSCLC患者的临床及HRCT影像特征资料。纳入标准:(1)在手术完成后,术后切除标本均进行了EGFR基因检测;(2)按照第8版国际抗癌联盟(UICC)肺癌TNM分期标准[5]进行分期,术后组织病理学检查确诊为Ⅰ~ⅢB期单发周围型NSCLC;(3)具有完整的病历资料、术前HRCT影像资料。排除标准:(1)术前进行了抗肿瘤治疗;(2)影像检查和基因检测结果间隔超过1个月;(3)伴有其他恶性肿瘤病史。本研究共纳入164例患者,其中男性86例、女性78例,年龄(60.3±9.3)岁。
本研究获得了惠州市中心人民医院伦理委员会的批准(批准号:KYLL2020114)。因本研究为回顾性临床研究,豁免签署患者知情同意书。
-
使用美国GE公司Light speed 64排螺旋CT扫描仪进行胸部平扫及增强扫描。扫描前患者进行呼吸训练,取仰卧位进行检查。扫描条件:管电压120 keV、管电流100~120 mA、层厚5.0 mm、层间距5.0 mm。增强扫描采用高压注射器团注非离子型对比剂碘海醇(300 mg I/ml,江苏恒瑞医药股份有限公司),注射剂量为1.5 ml/kg,注射速率为3.0 ml/s,延迟30 s扫描。扫描范围从胸廓入口水平至肋膈角水平。最后将原始图像重建为1.0 mm层厚的薄层图像。由2名具有10年以上胸部影像诊断经验的放射科副主任医师采用单盲法独立阅片,分析图片存档和传输系统(PACS)(广州麦德医影科技有限公司)工作站中的HRCT图像,观察肿瘤的影像特征,将各影像特征结果进行统计学分析,意见不一致时经讨论协商确定。
-
观察的影像特征包括肿瘤大小、部位、密度类型,肿瘤内有无坏死、空泡征、空洞征、支气管充气征,以及边缘有无分叶征、毛刺征、血管集束征、胸膜牵拉征等。其中,肿瘤大小指在轴位肺窗图像(窗宽1600 HU;窗位−600 HU)上测量的肿瘤最大径。按肿瘤的密度特征将其分为磨玻璃影(ground-glass opacity,GGO)或混合磨玻度影(mixed ground-glass opacity,mGGO)和实性密度影。空洞征是指肿瘤内具有完整壁的含气区域。空泡征是指肿瘤内气体密度或低密度点状影,最大径<5 mm。支气管充气征指肺窗肿瘤内见透亮的支气管走行。分叶征指肿瘤表面多个凸起,形成类似分叶状形态。毛刺征指肺窗肿瘤边缘具有向各个方向延伸的放射状或毛刺状无分支的线条状影,短而直、不与胸膜相连。坏死指肿瘤实性成分中出现低密度且无强化区。血管集束征指有单支或多支血管聚集在肿瘤周围。胸膜牵拉征指肺窗肿瘤对邻近胸膜有牵拉改变,呈线状或三角形影。
-
所有患者经手术切除后的标本均送至汕头市信诺信息有限公司检验科进行EGFR基因检测,采用统一的试剂盒(厦门艾德生物医药科技股份有限公司)及操作方法,病理组织均在10%中性福尔马林溶液中固定后进行包埋,提取石蜡包埋后的肺癌组织标本DNA,采用下一代测序(next generation sequencing)的检测方法对标本进行EGFR基因检测,最后依据检测试剂盒操作说明书对EGFR基因进行检测。根据检测结果将患者分为EGFR基因突变型组和野生型组。
-
采用SPSS 22.0软件进行统计学分析。符合正态分布的计量资料以
$\bar x $ ±s表示,组间比较采用独立样本t检验(方差齐)。计数资料采用频数和百分比表示,组间比较采用卡方检验或Fisher确切概率检验。将单因素分析中差异有统计学意义的变量进一步纳入二元Logistic回归分析(进入法),采用ROC曲线AUC对构建的回归模型的诊断效能进行评估。P<0.05为差异有统计学意义。 -
在164例Ⅰ~ⅢB期周围型NSCLC患者中,EGFR基因突变型组114例(69.51%)、野生型组50例(30.49%)。与EGFR野生型组相比,EGFR基因突变型组多见于女性、年龄<60岁、无吸烟史及病理类型为肺腺癌的患者,且2组间差异均有统计学意义(均P<0.05)。2组患者的其他临床特征见表1。
临床特征 基因突变型组
(n=114)基因野生型组
(n=50)χ2值 P值 性别 21.91 <0.001 男性 46(40.4) 40(80.0) 女性 68(59.6) 10(20.0) 年龄 −4.71 <0.001 ≥60岁 52(45.6) 36(72.0) <60岁 62(54.4) 14(28.0) 吸烟史 34.64 <0.001 有 20(17.5) 32(64.0) 无 94(82.5) 18(36.0) 癌胚抗原水平 1.49 0.223 升高 28(24.6) 8(16.0) 正常 86(75.4) 42(84.0) 术后临床分期 0.96 0.617 Ⅰ期 78(68.4) 38(76.0) Ⅱ期 6(5.3) 2(4.0) ⅢA~ⅢB期 30(26.3) 10(20.0) 病理类型 − <0.001 鳞癌和(或)腺鳞癌 4(3.5) 18(36.0) 腺癌 110(96.5) 32(64.0) 注:−表示Fisher确切概率检验,无检验值;EGFR为表皮生长因子受体 表 1 164例周围型非小细胞肺癌患者的临床特征与EGFR 基因突变的关系[例(%)]
Table 1. Relationship between clinical features and epidermal growth factor receptor gene mutation in 164 patients with peripheral non-small cell lung cancer (cases (%))
-
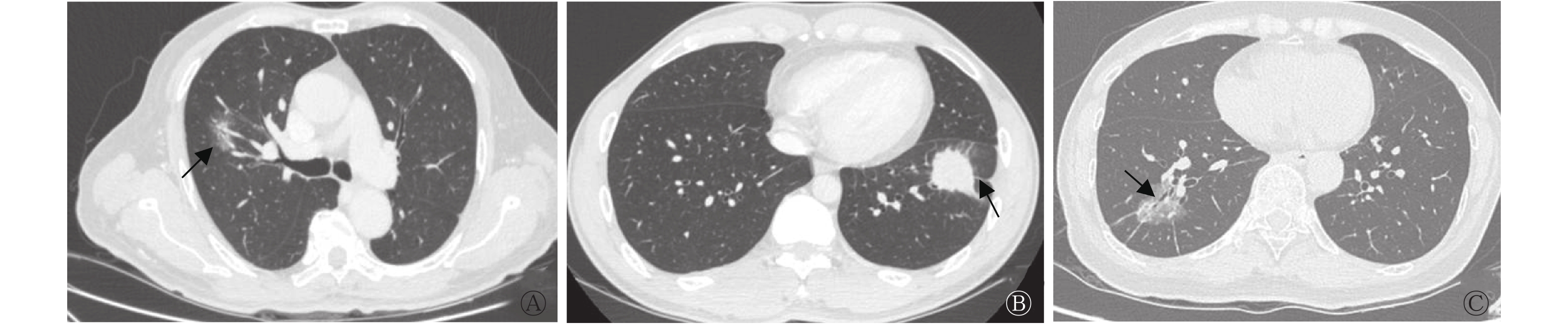
由表2可知,与EGFR野生型组相比,EGFR基因突变型组患者的肿瘤最大径小于野生型组患者[(2.52±1.51)cm对(4.12±6.07)cm],且肿瘤多位于右肺,密度类型多为GGO和(或)mGGO,多伴有分叶征、支气管充气征和胸膜牵拉征,2组的差异均有统计学意义(t=2.14,χ2=10.13~19.05,均P<0.05)。而2组在肿瘤毛刺征、空泡征、空洞征、坏死、血管集束征和胸腔淋巴结肿大等征象中的差异均无统计学意义(均P>0.05)。EGFR基因突变型组与野生型组患者的典型CT图见图1。
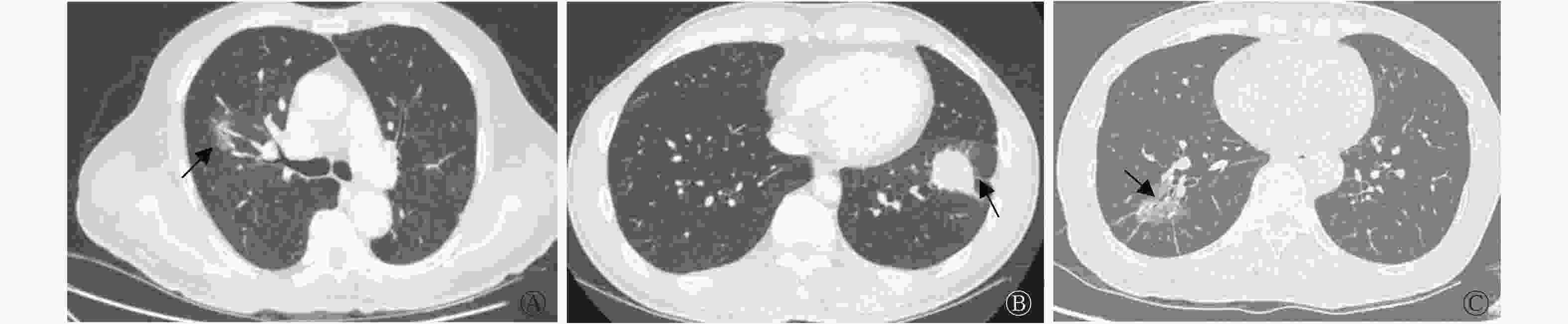
图 1 3例周围型非小细胞肺癌EGFR基因突变型与野生型患者的典型CT图
Figure 1. CT images of patients with epidermal growth factor receptor gene mutation and wild-type gene in 3 cases of peripheral non-small cell lung cancer
影像特征 基因突变型
组(n=114)基因野生型
组(n=50)检验值 P值 肿瘤大小(cm, $\bar x\pm s $ 

2.52±1.51 4.12±6.07 t=2.14 0.036 肿瘤部位[例(%)] χ2=10.13 0.001 左肺 34(29.8) 28(56.0) 右肺 80(70.2) 22(44.0) 密度类型[例(%)] χ2=19.05 <0.001 实性 40(35.1) 36(72.0) GGO和(或)mGGO 74(64.9) 14(28.0) 分叶征[例(%)] χ2=15.00 <0.001 有 96(84.2) 28(56.0) 无 18(15.8) 22(44.0) 毛刺征[例(%)] χ2=0.83 0.362 有 68(59.6) 26(52.0) 无 46(40.4) 24(48.0) 空泡征[例(%)] χ2=0.41 0.524 有 28(24.6) 10(20.0) 无 86(75.4) 40(80.0) 空洞征[例(%)] − 1.000 有 4(3.5) 2(3.6) 无 110(96.5) 48(96.4) 血管集束征[例(%)] χ2=0.40 0.527 有 18(15.8) 6(10.7) 无 96(84.2) 44(89.3) 支气管充气征[例(%)] χ2=16.69 <0.001 有 62(54.4) 10(20.0) 无 52(45.6) 40(80.0) 坏死[例(%)] χ2=2.33 0.127 有 6(5.3) 6(12.0) 无 108(94.7) 44(88.0) 胸膜牵拉征[例(%)] χ2=10.80 0.001 有 92(80.7) 28(56.0) 无 22(19.3) 22(44.0) 胸腔淋巴结肿大[例(%)] χ2=0.98 0.322 有 26(22.8) 8(25.0) 无 88(77.2) 42(75.0) 注:−表示Fisher确切概率检验,无检验值;CT为计算机体层摄影术;EGFR为表皮生长因子受体;GGO为磨玻璃影;mGGO为混合磨玻璃影 表 2 164例周围型非小细胞肺癌患者的高分辨率CT影像 特征与EGFR基因突变的关系
Table 2. Relationship between high resolution CT imaging features and epidermal growth factor receptor gene mutation in 164 patients with peripheral non-small cell lung cancer
-
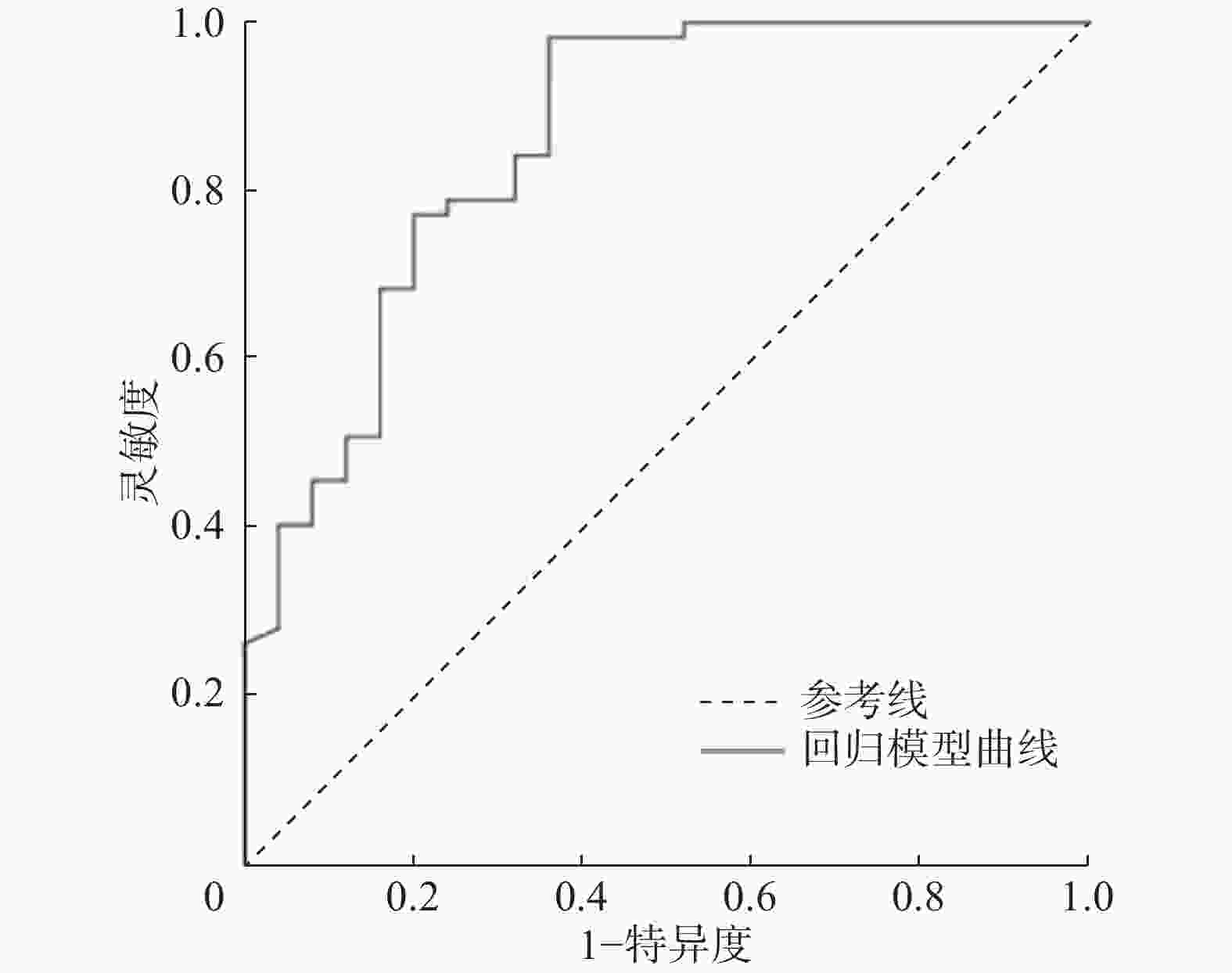
将单因素分析中差异有统计学意义的变量进一步纳入二元Logistic回归模型,结果显示,患者无吸烟史和肿瘤伴有分叶征是周围型NSCLC患者EGFR基因突变的独立预测因子(表3)。ROC曲线分析结果显示,回归模型的AUC为0.858(图2)。
影响因素 B值 SE值 Wald值 OR值 95%置信区间 P值 性别 −0.486 0.644 0.569 0.615 0.174~2.175 0.451 年龄 −0.469 0.516 0.826 0.625 0.227~1.720 0.363 吸烟 −1.492 0.624 5.719 0.225 0.066~0.764 <0.05 病理类型 1.185 0.784 2.285 2.548 0.704~15.213 0.131 肿瘤部位 0.935 0.482 3.768 2.548 0.991~6.549 0.052 肿瘤大小 −0.135 0.078 2.979 0.874 0.750~1.018 0.052 密度类型 −0.074 0.632 0.014 0.928 0.269~3.207 0.906 分叶征 1.207 0.577 4.377 3.344 1.079~10.360 <0.05 支气管充气征 0.865 0.611 2.005 2.375 0.717~7.864 0.157 胸膜牵拉征 0.116 0.547 0.045 1.123 0.385~3.278 0.832 注:EGFR为表皮生长因子受体;SE为标准误差;OR为比值比 表 3 164例周围型非小细胞肺癌患者EGFR基因突变相关 变量的Logistic回归分析结果
Table 3. Logistic regression analysis results of factors related to epidermal growth factor receptor gene mutation in 164 patients with peripheral non-small cell lung cancer
-
近年来分子肿瘤学研究不断深入,靶向药物治疗肺癌越来越受到关注和青睐。Sequist等[6]的研究结果表明,EGFR酪氨酸激酶抑制剂能够明显提高EGFR基因突变型NSCLC患者的临床治疗效果。Ⅰ~ⅢB期NSCLC完全切除术后辅助治疗指南(2021版)[7]指出,对于Ⅰ~ⅢB期NSCLC患者应根据EGFR基因突变情况以及肿瘤分期制定辅助治疗策略。由此可见,EGFR基因突变是指导临床靶向治疗的重要基础和前提条件。
既往研究结果证实,EGFR基因突变与患者性别、种族、吸烟史及病理类型相关,EGFR基因突变在亚裔、无吸烟史、女性、肺腺癌患者中更常见[8-9]。本研究164例Ⅰ ~ⅢB期周围型NSCLC患者中,EGFR基因突变率为69.51%,稍高于娄和南等[10]的研究结果(62.2%),高于Shi等[11]在亚裔人群Ⅳ期肺腺癌中的研究结果(51.4%)。本研究结果显示,EGFR基因突变型组最常见的病理类型为肺腺癌,同时女性多于男性,无吸烟史人群多于吸烟人群,与何小群等[12]的结果一致,推断EGFR基因突变率与女性的激素分泌可能有一定的关系。本研究中我们还发现,Ⅰ~ⅢB期周围型NSCLC患者癌胚抗原水平、术后临床分期在EGFR基因突变型组与野生型组间的差异均无统计学意义,与金晶[13]、Gao等[14]的研究结果有一定差异,可能与不同研究的病例纳入标准不同有关。国内外研究结果表明,肺癌EGFR基因突变与CT影像特征存在相关性,不同学者得出的结论存在一定差异[10, 15]。Yang等[15]认为,肿瘤体积越大,EGFR基因突变率就越高;而娄和南等[10]则提出肿瘤最大径为2.01 cm是判断EGFR基因突变状态的最佳诊断阈值。本研究中EGFR基因突变型组肿瘤最大径小于野生型组,与既往大部分研究认为的EGFR基因突变多见于小肿瘤的结论一致[10, 16]。陈志红等[17]和Han等[18]报道,GGO及mGGO是预测EGFR基因突变的征象,本研究支持该结论,即含GGO成分肿瘤的EGFR基因突变率明显高于含实性成分肿瘤。梁明玉[19]对179例肺腺癌患者的研究结果表明,无吸烟史、癌胚抗原水平升高、具有淋巴结转移、中央型肺癌、最大径≥3 cm的患者在EGFR基因突变型中更常见,而支气管异常、毛刺征与EGFR基因表达无明显相关。而阮磊等[20]研究结果显示,EGFR基因突变易出现在有空泡征或空洞征、分叶征、毛刺征、胸膜凹陷征的肿瘤中。陈研等[21]对106例肺腺癌EGFR基因表达进行了影像学研究,发现年龄、肿瘤大小、血管集束征、分叶征、毛刺征、空泡征与EGFR基因突变的差异均无统计学意义,但Ⅰ ~Ⅱ期、女性、无吸烟史、具有GGO、胸膜凹陷征、支气管充气征更常见于EGFR基因突变型肺腺癌患者中。本研究结果表明,EGFR基因突变更常见于有支气管充气征的肿瘤中,可能与EGFR基因突变患者的癌细胞不易破坏肺泡壁的支架结构,肿瘤侵袭力减弱有关,从而使肿瘤内可保留完整通畅的细支气管;有分叶征和胸膜牵拉征的肿瘤发生EGFR基因突变的概率显著升高,其他CT特征包括毛刺征、空泡征、空洞征、坏死、血管集束征、胸腔淋巴结肿大在2组间的差异无统计学意义。本研究构建的Logistic回归模型显示,患者无吸烟史和肿瘤伴有分叶征是周围型NSCLC患者EGFR基因突变的独立预测因子,且ROC曲线分析显示回归模型具有较高的诊断效能,对预测EGFR基因突变具有一定的临床价值。本研究中我们还发现EGFR基因突变肿瘤多位于右肺,但既往未见相同报道,需要进一步的多中心、大样本研究支持。本研究部分结果与既往国内外研究报道尚不能完全相符,除了这些特征本身是否有特征性差异之外,也可能与研究人群的种类、样本量、临床分期、病理类型及CT特征评价方法不同等因素有关。
本研究存在的局限性:(1)回顾性研究可能引入偏倚,未纳入Ⅳ期不可手术患者作为对照;(2)研究样本量偏小,未细分基因突变亚型;(3)未采用影像组学、深度学习等方法进行进一步分析。
综上所述,在Ⅰ ~ⅢB期可切除周围型NSCLC患者的临床及HRCT影像特征中,当患者具备年龄<60岁、女性、无吸烟史、病理类型为肺腺癌、肿瘤位于右肺、含有GGO和(或)mGGO、分叶征、支气管充气征、胸膜牵拉征时应高度怀疑EGFR基因发生突变,其中无吸烟史和肿瘤具有分叶征是预测周围型NSCLC患者EGFR基因突变的独立预测因子。
利益冲突 所有作者声明无利益冲突
作者贡献声明 尹凯文负责数据的收集、论文的撰写;魏巍负责研究命题的提出与设计;熊海林负责研究过程的实施与调查;黄锦贤负责图像的采集、数据的收集与分析;代海洋负责数据的统计分析、论文写作的指导与审阅
Ⅰ ~ⅢB期可切除周围型非小细胞肺癌患者临床及高分辨率CT影像特征与EGFR基因突变的相关性研究
Correlation between clinical and HRCT imaging features with epidermal growth factor receptor gene mutation in patients with stage Ⅰ −ⅢB resectable peripheral non-small cell lung cancer
-
摘要:
目的 探讨Ⅰ ~ⅢB期可切除周围型非小细胞肺癌(NSCLC)患者的临床及高分辨率CT(HRCT)影像特征与表皮生长因子受体(EGFR)基因突变的相关性。 方法 回顾性分析2019年1月至2021年4月于惠州市中心人民医院行手术切除、术后行EGFR基因检测且临床分期为Ⅰ ~ⅢB期的周围型NSCLC患者164例,其中男性86例、女性78例,年龄(60.3±9.3)岁。根据EGFR基因检测结果将患者分为EGFR基因突变型组和野生型组,分析患者的临床及HRCT影像特征并进行统计学分析。计量资料的比较采用两独立样本t检验,计数资料的比较采用χ2检验或Fisher确切概率检验。筛选差异有统计学意义的指标纳入二元Logistic 回归分析。采用受试者工作特征(ROC)曲线的曲线下面积对构建的回归模型的诊断效能进行评估。 结果 164例NSCLC患者中,EGFR基因突变型组114例(69.51%)、野生型组50例(30.49%)。与EGFR野生型组比较,EGFR基因突变型组多见于女性、年龄<60岁、无吸烟史、病理类型为肺腺癌的患者,且2组间的差异均有统计学意义(χ2=21.91、−4.71、34.64,Fisher确切概率法,均P<0.05)。HRCT影像特征中,EGFR基因突变型组肿瘤最大径小于野生型组[(2.52±1.51) cm对(4.12±6.07) cm],且肿瘤多位于右肺,密度类型多为磨玻璃影和(或)混合磨玻璃影,多伴有分叶征、支气管充气征和胸膜牵拉征,与EGFR野生型组相比,差异均有统计学意义(t=2.14,χ2=10.13~19.05,均P<0.05)。2组患者在术后临床分期、癌胚抗原水平、肿瘤伴有毛刺征、坏死、血管集束征、空泡征、空洞征、胸腔淋巴结肿大中的差异均无统计学意义(χ2=0.40~2.33,Fisher确切概率法,均P>0.05)。Logistic回归分析结果显示,患者无吸烟史(OR=0.225,95%CI:0.066~0.764)和肿瘤伴有分叶征(OR=3.344,95%CI:1.079~10.360)是EGFR基因突变的独立预测因子(均P<0.05),回归模型的ROC曲线的曲线下面积为0.858。 结论 Ⅰ ~ⅢB期可切除周围型NSCLC的临床及HRCT影像特征与EGFR基因突变具有一定的相关性,对指导临床评估患者情况有重要意义。 -
关键词:
- 癌,非小细胞肺 /
- 体层摄影术,X线计算机 /
- 表皮生长因子受体 /
- 基因突变
Abstract:Objective To investigate the correlation between epidermal growth factor receptor (EGFR) gene mutation with clinical and high-resolution CT (HRCT) imaging features in patients with stages Ⅰ −ⅢB resectable peripheral non-small cell lung cancer (NSCLC). Methods A total of 164 patients with peripheral NSCLC who underwent lung cancer resection, EGFR genetic testing, and clinical staging of Ⅰ −ⅢB in Huizhou Central People's Hospital from January 2019 to April 2021 were retrospectively analyzed. The cohort included 86 males and 78 females, aged 60.3±9.3 years. According to the results of EGFR genetic testing, the patients were divided into EGFR mutation and wild-type groups. The clinical and HRCT imaging features of the patients were analyzed and statistically analyzed. The measurement data were compared by two-independent-sample t-test, and the counting data were compared by chi-square and Fisher's exact probability tests. Indicators with statistical differences were selected for binary Logistic regression analysis. The area under curve of the receiver operating characteristic (ROC) curve was used in evaluating the diagnostic efficiency of the regression model. Results Among the 164 patients with NSCLC, 114 (69.51%) were confirmed to have EGFR mutations, and 50 (30.49%) had wild-type EGFR. Compared with the wild-type EGFR, EGFR mutations were more frequent in non smoking, female patients aged <60 years with a pathological type of adenocarcinoma. Differences between the groups were statistically significant (χ2=21.91, −4.71, 34.64; Fisher's exact probability method, all P<0.05). As observed in HRCT imaging features, the maximum diameter of EGFR mutation group was smaller than that of the wild-type group ((2.52±1.51) cm vs. (4.12±6.07) cm), and the tumors were mostly located in the right lung, with ground-glass opacity or mixed ground-glass opacity, lobulation sign, bronchial inflation sign, and pleural traction sign, compared with the wild-type group, and the differences were statistically significant (t=2.14, χ2=10.13–19.05, all P<0.05). No significant differences in postoperative clinical stage, carcinoembryonic antigen level, lesions with burr signs, necrosis, vascular convergence sign, vacuole sign, cavity sign and thoracic lymphadenopathy were found between the groups (χ2=0.40–2.33, Fisher's exact probability method, all P>0.05). The results of Logistic regression analysis showed that patients with no smoking history (OR=0.225, 95%CI: 0.066–0.764) and tumor accompanied by lobulation sign (OR=3.344, 95%CI: 1.079–10.360) are the independent predictors of EGFR gene mutation (all P<0.05), and the area under the curve of the regression model was 0.858. Conclusion The clinical and imaging features of resectable peripheral NSCLC in stages Ⅰ −ⅢB are correlated with EGFR gene mutation, which are of great significance to assess the patient's condition. -
表 1 164例周围型非小细胞肺癌患者的临床特征与EGFR 基因突变的关系[例(%)]
Table 1. Relationship between clinical features and epidermal growth factor receptor gene mutation in 164 patients with peripheral non-small cell lung cancer (cases (%))
临床特征 基因突变型组
(n=114)基因野生型组
(n=50)χ2值 P值 性别 21.91 <0.001 男性 46(40.4) 40(80.0) 女性 68(59.6) 10(20.0) 年龄 −4.71 <0.001 ≥60岁 52(45.6) 36(72.0) <60岁 62(54.4) 14(28.0) 吸烟史 34.64 <0.001 有 20(17.5) 32(64.0) 无 94(82.5) 18(36.0) 癌胚抗原水平 1.49 0.223 升高 28(24.6) 8(16.0) 正常 86(75.4) 42(84.0) 术后临床分期 0.96 0.617 Ⅰ期 78(68.4) 38(76.0) Ⅱ期 6(5.3) 2(4.0) ⅢA~ⅢB期 30(26.3) 10(20.0) 病理类型 − <0.001 鳞癌和(或)腺鳞癌 4(3.5) 18(36.0) 腺癌 110(96.5) 32(64.0) 注:−表示Fisher确切概率检验,无检验值;EGFR为表皮生长因子受体 表 2 164例周围型非小细胞肺癌患者的高分辨率CT影像 特征与EGFR基因突变的关系
Table 2. Relationship between high resolution CT imaging features and epidermal growth factor receptor gene mutation in 164 patients with peripheral non-small cell lung cancer
影像特征 基因突变型
组(n=114)基因野生型
组(n=50)检验值 P值 肿瘤大小(cm, $\bar x\pm s $ 

2.52±1.51 4.12±6.07 t=2.14 0.036 肿瘤部位[例(%)] χ2=10.13 0.001 左肺 34(29.8) 28(56.0) 右肺 80(70.2) 22(44.0) 密度类型[例(%)] χ2=19.05 <0.001 实性 40(35.1) 36(72.0) GGO和(或)mGGO 74(64.9) 14(28.0) 分叶征[例(%)] χ2=15.00 <0.001 有 96(84.2) 28(56.0) 无 18(15.8) 22(44.0) 毛刺征[例(%)] χ2=0.83 0.362 有 68(59.6) 26(52.0) 无 46(40.4) 24(48.0) 空泡征[例(%)] χ2=0.41 0.524 有 28(24.6) 10(20.0) 无 86(75.4) 40(80.0) 空洞征[例(%)] − 1.000 有 4(3.5) 2(3.6) 无 110(96.5) 48(96.4) 血管集束征[例(%)] χ2=0.40 0.527 有 18(15.8) 6(10.7) 无 96(84.2) 44(89.3) 支气管充气征[例(%)] χ2=16.69 <0.001 有 62(54.4) 10(20.0) 无 52(45.6) 40(80.0) 坏死[例(%)] χ2=2.33 0.127 有 6(5.3) 6(12.0) 无 108(94.7) 44(88.0) 胸膜牵拉征[例(%)] χ2=10.80 0.001 有 92(80.7) 28(56.0) 无 22(19.3) 22(44.0) 胸腔淋巴结肿大[例(%)] χ2=0.98 0.322 有 26(22.8) 8(25.0) 无 88(77.2) 42(75.0) 注:−表示Fisher确切概率检验,无检验值;CT为计算机体层摄影术;EGFR为表皮生长因子受体;GGO为磨玻璃影;mGGO为混合磨玻璃影 表 3 164例周围型非小细胞肺癌患者EGFR基因突变相关 变量的Logistic回归分析结果
Table 3. Logistic regression analysis results of factors related to epidermal growth factor receptor gene mutation in 164 patients with peripheral non-small cell lung cancer
影响因素 B值 SE值 Wald值 OR值 95%置信区间 P值 性别 −0.486 0.644 0.569 0.615 0.174~2.175 0.451 年龄 −0.469 0.516 0.826 0.625 0.227~1.720 0.363 吸烟 −1.492 0.624 5.719 0.225 0.066~0.764 <0.05 病理类型 1.185 0.784 2.285 2.548 0.704~15.213 0.131 肿瘤部位 0.935 0.482 3.768 2.548 0.991~6.549 0.052 肿瘤大小 −0.135 0.078 2.979 0.874 0.750~1.018 0.052 密度类型 −0.074 0.632 0.014 0.928 0.269~3.207 0.906 分叶征 1.207 0.577 4.377 3.344 1.079~10.360 <0.05 支气管充气征 0.865 0.611 2.005 2.375 0.717~7.864 0.157 胸膜牵拉征 0.116 0.547 0.045 1.123 0.385~3.278 0.832 注:EGFR为表皮生长因子受体;SE为标准误差;OR为比值比 -
[1] Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209−249. DOI: 10.3322/caac.21660. [2] Herbst RS, Morgensztern D, Boshoff C. The biology and management of non-small cell lung cancer[J]. Nature, 2018, 553(7689): 446−454. DOI: 10.1038/nature25183. [3] Kim ES, Kish JK, Cseh A, et al. Second-line Afatinib or chemotherapy following immunochemotherapy for the treatment of metastatic, squamous cell carcinoma of the lung: real-world effectiveness and safety from a multisite retrospective chart review in the USA[J]. Clin Lung Cancer, 2021, 22(4): 292−300.e1. DOI: 10.1016/j.cllc.2021.02.006. [4] Chen YQ, Yang Y, Ma LB, et al. Prediction of EGFR mutations by conventional CT-features in advanced pulmonary adenocarcinoma[J]. Eur J Radiol, 2019, 112: 44−51. DOI: 10.1016/j.ejrad.2019.01.005. [5] Rami-Porta R, Asamura H, Travis WD, et al. Lung cancer-major changes in the American Joint Committee on Cancer eighth edition cancer staging manual[J]. CA Cancer J Clin, 2017, 67(2): 138−155. DOI: 10.3322/caac.21390. [6] Sequist LV, Han JY, Ahn MJ, et al. Osimertinib plus savolitinib in patients with EGFR mutation-positive, MET-amplified, non-small-cell lung cancer after progression on EGFR tyrosine kinase inhibitors: interim results from a multicentre, open-label, phase 1b study[J]. Lancet Oncol, 2020, 21(3): 373−386. DOI: 10.1016/S1470-2045(19)30785-5. [7] 中国抗癌协会肺癌专业委员会, 中华医学会肿瘤学分会肺癌学组, 中国胸部肿瘤研究协作组. Ⅰ~ⅢB期非小细胞肺癌完全切除术后辅助治疗指南(2021版)[J]. 中华医学杂志, 2021, 101(16): 1132−1142. DOI: 10.3760/cma.j.cn112137-20210210-00406.
Lung Cancer Professional Committee of Chinese Anti-Cancer Association, Lung Cancer Group of Chinese Medical Association Oncology Branch, China Thoracic Cancer Research Collaboration Group. Guidelines for adjuvant therapy after complete resection of stage Ⅰ -ⅢB non-small cell lung cancer (2021)[J]. J China Med, 2021, 101(16): 1132−1142. DOI: 10.3760/cma.j.cn112137-20210210-00406.[8] Mei DD, Luo Y, Wang Y, Gong JS. CT texture analysis of lung adenocarcinoma: can Radiomic features be surrogate biomarkers for EGFR mutation statuses[J]. Cancer Imaging, 2018, 18(1): 52. DOI: 10.1186/s40644-018-0184-2. [9] Tu WT, Sun GY, Fan L, et al. Radiomics signature: a potential and incremental predictor for EGFR mutation status in NSCLC patients, comparison with CT morphology[J]. Lung Cancer, 2019, 132: 28−35. DOI: 10.1016/j.lungcan.2019.03.025. [10] 娄和南, 赵晓丹, 张亮, 等. 周围型浸润性肺腺癌EGFR基因突变与CT征象及病理的相关性[J]. 实用放射学杂志, 2016, 32(12): 1856−1860. DOI: 10.3969/j.issn.1002-1671.2016.12.009.
Lou HN, Zhao XD, Zhang L, et al. Correlation of CT features and pathological characteristics with EGFR gene mutations in invasive peripheral pulmonary adenocarcinoma[J]. J Pract Radiol, 2016, 32(12): 1856−1860. DOI: 10.3969/j.issn.1002-1671.2016.12.009.[11] Shi YK, Au JSK, Thongprasert S, et al. A prospective, molecular epidemiology study of EGFR mutations in Asian patients with advanced non-small-cell lung cancer of adenocarcinoma histology (PIONEER)[J]. J Thorac Oncol, 2014, 9(2): 154−162. DOI: 10.1097/JTO.0000000000000033. [12] 何小群, 李琦, 罗天友, 等. 临床、病理特征联合能谱CT评估非小细胞肺癌表皮生长因子受体基因突变[J]. 中国医学影像技术, 2021, 37(2): 230−234. DOI: 10.13929/j.issn.1003-3289.2021.02.015.
He XQ, Li Q, Luo TY, et al. Clinical, pathological and spectral CT characteristics in evaluation on epidermal growth factor receptor gene mutation of non-small cell lung cancer[J]. Chin J Med Imaging Technol, 2021, 37(2): 230−234. DOI: 10.13929/j.issn.1003-3289.2021.02.015.[13] 金晶. 肺腺癌18F-FDG PET/CT影像表现与EGFR基因突变的相关性分析及其在预后评估中的价值[D]. 青岛: 青岛大学, 2018.
Jin J. Correlation between 18F-FDG PET/CT imaging and EGFR gene mutation and the prognostic value of the metabolic parameters in patients with lung adenocarcinoma[D]. Qingdao: Qingdao University, 2018.[14] Gao XC, Wei CH, Zhang RG, et al. 18F-FDG PET/CT SUVmax and serum CEA levels as predictors for EGFR mutation state in Chinese patients with non-small cell lung cancer[J]. Oncol Lett, 2020, 20(4): 61. DOI: 10.3892/ol.2020.11922. [15] Yang Y, Yang Y, Zhou X, et al. EGFR L858R mutation is associated with lung adenocarcinoma patients with dominant ground-glass opacity[J]. Lung Cancer, 2015, 87(3): 272−277. DOI: 10.1016/j.lungcan.2014.12.016. [16] Liu Y, Kim J, Qu FY, et al. CT features associated with epidermal growth factor receptor mutation status in patients with lung adenocarcinoma[J]. Radiology, 2016, 280(1): 271−280. DOI: 10.1148/radiol.2016151455. [17] 陈志红, 赵雪梅, 叶元滋, 等. 肺腺癌EGFR突变与病理组织学亚型及CT影像学特征的关系[J]. 临床与实验病理学杂志, 2021, 37(4): 469−472. DOI: 10.13315/j.cnki.cjcep.2021.04.022.
Chen ZH, Zhao XM, Ye YZ, et al. The relationship between EGFR mutations and histopathological subtypes and CT imaging features in lung adenocarcinoma[J]. Chin J Clin Exp Pathol, 2021, 37(4): 469−472. DOI: 10.13315/j.cnki.cjcep.2021.04.022.[18] Han XY, Fan J, Gu J, et al. CT features associated with EGFR mutations and ALK positivity in patients with multiple primary lung adenocarcinomas[J]. Cancer Imaging, 2020, 20(1): 51. DOI: 10.1186/s40644-020-00330-1. [19] 梁明玉. 非小细胞肺癌临床和影像特征与表皮生长因子受体的相关性[J]. 实用放射学杂志, 2021, 37(3): 503−506. DOI: 10.3969/j.issn.1002-1671.2021.03.041.
Liang MY. Correlation between epidermal growth factor receptor and clinical and imaging features of non-small cell lung cancer[J]. J Pract Radiol, 2021, 37(3): 503−506. DOI: 10.3969/j.issn.1002-1671.2021.03.041.[20] 阮磊, 夏聪, 李俊, 等. 非小细胞肺癌CT征象肿瘤标记物与EGFR基因突变的相关性研究[J]. 浙江临床医学, 2020, 22(1): 17−19.
Ruan L, Xia C, Li J, et al. The correlation of CT signs, tumor markers and EGFR gene mutation in non-small cell lung cancer[J]. Zhejiang Clin Med J, 2020, 22(1): 17−19.[21] 陈妍, 余莹莹, 文智, 等. 肺腺癌高分辨率CT特征及组织病理学与EGFR基因状态的相关性分析[J]. 实用放射学杂志, 2021, 37(9): 1433−1436, 1475. DOI: 10.3969/j.issn.1002-1671.2021.09.008.
Chen Y, Yu YY, Wen Z, et al. Correlation of high resolution CT features and histopathology with EGFR gene status in lung adenocarcinoma[J]. J Pract Radiol, 2021, 37(9): 1433−1436, 1475. DOI: 10.3969/j.issn.1002-1671.2021.09.008. -





 下载:
下载: