-
弥漫大B细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)在我国是最常见的一种淋巴瘤类型,其中40%为结外弥漫大B细胞淋巴瘤(extranodal diffuse large B-cell lymphoma,EN-DLBCL)[1]。18F-FDG PET/CT在DLBCL化疗中期时的分期和疗效评估方面的应用价值已被广泛认可,并写入2021年美国国家综合癌症网非霍奇金淋巴瘤治疗指南[2]、中华医学会核医学分会淋巴瘤18F-FDG PET/CT及PET/MR显像临床应用指南(2021版)[3]。但是关于中期PET/CT预测DLBCL疗效和预后的价值,仍存在不少问题有待进一步探讨,例如最佳中期PET/CT时间点难以确定,各种中期PET/CT评估方法的优劣有待对比研究,国际预后指数(international prognosis index,IPI)虽广泛应用于淋巴瘤的预后分层,但在预测高危患者方面仍具有一定的局限性[2, 4-6]。另外,与非EN-DLBCL患者相比,EN-DLBCL患者病情通常更加高危,疗效和预后也更差[6-7],目前罕有以中期18F-FDG PET/CT专门预测EN-DLBCL疗效和预后的研究。本研究对比分析了基于中期18F-FDG PET/CT的几种评估指标在EN-DLBCL患者疗效和预后评估中的价值,以期寻找基于中期18F-FDG PET/CT的最佳评估指标。
-
回顾性分析2011年5月至2020年4月在北京医院经组织病理学检查或随访结果明确诊断为EN-DLBCL的患者77例,其中,男性35例、女性42例,年龄(62.7±16.2)岁。纳入标准:(1)基线PET/CT显像前未进行淋巴瘤相关治疗;(2)基线PET/CT显像有结外器官受累;(3)初始化疗3~4个周期时进行中期PET/CT显像;(4)初始治疗为6~8个周期的利妥昔单抗联合一线方案化疗。排除标准:(1)6~8个周期的初始化疗期间予以放疗或手术切除干预者;(2)PET显像无阳性病灶者;(3)DLBCL中枢神经系统受累者;(4)已知或疑诊活动性感染或患有其他肿瘤者。收集纳入研究的患者资料,包括基线PET/CT图像、中期PET/CT图像和临床资料[包括性别、年龄、有无B症状、临床Ann Arbor分期、初诊时乳酸脱氢酶(LDH)和β2微球蛋白水平、东部肿瘤协作组体能状态评分(ECOG PS)、IPI等],并完成随访。
本研究符合《赫尔辛基宣言》的原则。因本研究为回顾性临床研究,豁免签署患者知情同意书。
-
18F-FDG购自原子高科股份有限公司,放射化学纯度>95%。检查前患者空腹6 h以上,控制血糖水平<10 mmol/L,按体重静脉注射18F-FDG(7.40 MBq/kg),注药后休息50~70 min,排尿后行PET/CT扫描(德国Siemens Biograph mCT 型PET/CT)。扫描范围自颅底至股骨中段,先行CT扫描(电压120 kV,螺距1.2),随后行PET扫描(三维模式采集,每个床位采集2 min)。以CT数据行PET图像衰减校正,图像重建采用迭代法,获得轴位、冠状位、矢状位PET和CT图像,图像层厚3 mm。
-
所有图像由1位核医学主任医师与2位有7年以上工作经验的高年资主治医师共同阅片,意见不一致时,讨论得出最终意见。用北京麦迪克斯(MedEx)工作站勾画三维ROI,得到SUVmax。记录基线PET/CT和中期PET/CT所有阳性病灶中代谢活性最高的SUVmax作为基线SUVmax和中期SUVmax。
-
(1)中期SUVmax。利用ROC曲线选取灵敏度与特异度之和最大时所对应的最优点为最佳临界值,将患者分为中期SUVmax<最佳临界值组和SUVmax≥最佳临界值组。(2)ΔSUVmax%。ΔSUVmax%=[(基线SUVmax−中期SUVmax)/基线SUVmax]×100%。按照中华医学会核医学分会淋巴瘤18F-FDG PET/CT及PET/MR显像临床应用指南(2021版)推荐,采用ΔSUVmax70%为最佳临界值[3],将患者分为ΔSUVmax%<70%组和ΔSUVmax%≥70%组。(3)中期Deauville五分法评分。按照2009年第1次中期PET淋巴瘤国际工作会议推荐的Deauville五分法[8],记录选择病灶SUVmax:1分代表无残留病灶;2分代表残留病灶摄取≤纵隔血池摄取;3分代表纵隔血池摄取<残留病灶摄取≤肝脏摄取;4分代表残留病灶摄取轻度>肝脏摄取;5分代表残留病灶摄取明显>肝脏摄取(2~3倍以上)或出现新发病灶。根据中期Deauville五分法评分,将患者分为Deauville五分法评分1~3分组和4~5分组。(4)Lugano疗效评估。根据Lugano疗效评估标准[9] ,中期疗效评估结果包括:完全缓解、部分缓解、疾病稳定、疾病进展,并据此将患者分为缓解组(完全缓解+部分缓解)和未缓解组(疾病稳定或未缓解+疾病进展,含死亡患者)。
-
以北京医院管理信息系统、影像归档和通信系统或电话方式对患者进行随访,以基线PET/CT显像日期作为随访起点,进展、复发或死亡时间作为随访终点。观察指标为无进展生存期(progression free survival,PFS)及总生存期(overall survival,OS)。PFS是指患者从确诊至疾病复发、进展或末次随访的时间;OS是指患者从确诊至死亡或末次随访的时间。疾病复发或进展根据随访过程中的组织病理学检查及影像检查结果判定。
-
以SPSS20.0软件进行统计学分析。计数资料以频数和百分比表示,组间比较采用χ2检验或Fisher精确检验。采用ROC曲线,寻找中期SUVmax的最佳临界值。采用Kaplan-Meier法绘制生存曲线,Log-rank检验分析组间差异。预后单因素、多因素分析采用COX回归分析,将单因素分析中P<0.10的指标纳入多因素分析。P<0.05为差异有统计学意义。
-
77例EN-DLBCL患者中,明确组织病理学亚型者76例(另外1例组织病理学检查未进行亚型分类),包括生发中心来源30例(39.5%),非生发中心来源46例(60.5%)。IPI评分为低危、中低危、中高危、高危的患者分别为17例(22.1%)、12例(15.6%)、18例(23.4%)、30例(39.0%)。结外病变最常累及的4种脏器分别为脾脏(26例,33.8%)、骨髓(24例,31.2%)、胃(14例,18.2%)、肠(14例,18.2%)。初始化疗结束时,51例(66.2%)患者达到完全缓解、4例(5.2%)死亡,其余患者继续治疗。
患者中位随访时间为24个月,范围为4~105个月。至随访结束时,入组患者中有19例(24.7%)出现疾病进展、复发或死亡,包括11例(14.3%)死亡(其中1例为化疗后因心肌梗死死亡)。患者的一般资料见表1。
一般资料 例数(%) 性别 男 35(45.5) 女 42(54.5) 临床Ann Arbor分期 Ⅰ/Ⅱ期 21(27.3) Ⅲ/Ⅳ期 56(72.7) 初诊LDH水平 升高 41(53.2) 未升高 36(46.8) β2微球蛋白水平 升高 61(79.2) 未升高 16(20.8) 有无B症状 有 26(33.8) 无 51(66.2) ECOG PS评分 0~1分 63(81.8) 2~4分 14(18.2) IPI评分 低危+中低危 29(37.7) 中高危+高危 48(62.3) 结外病变数目 1个 34(44.2) >1个 43(55.8) 重要脏器是否受累 是 50(64.9) 否 27(35.1) Deauville五分法评分 1~3分 40(51.9) 4~5分 37(48.1) Lugano疗效评估 缓解 74(96.1) 未缓解 3(3.9) 初始化疗结束时临床疗效评估 完全缓解 51(66.2) 未完全缓解(部分缓解+疾病稳定或
未缓解+疾病进展,含死亡)26(33.8) 注:LDH为乳酸脱氢酶;ECOG PS为东部肿瘤协作组体能状态评分;IPI为国际预后指数;重要脏器指骨髓、胃、肠、肝或肺 表 1 77例结外弥漫大B细胞淋巴瘤患者的一般资料
Table 1. Clinical characteristics of 77 extranodal diffuse large B-cell lymphoma patients
-
ROC曲线结果显示,中期SUVmax的最佳临界值为4.9,因此将患者分为中期SUVmax<4.9组和中期SUVmax≥4.9组。
中期SUVmax<4.9组、Deauville五分法评分1~3分组患者初始化疗结束时的完全缓解率显著高于中期SUVmax≥4.9组(82.6%对41.9%,χ2=13.699,P<0.001)、Deauville五分法评分4~5分组(85.0%对45.9%,χ2=13.108,P<0.001);而以ΔSUVmax 70%、Lugano疗效评估结果分组的各组间完全缓解率的差异均无统计学意义,详见表2。Deauville五分法评分1~3分组的完全缓解率显著高于ΔSUVmax%≥70%组和Lugano疗效评估缓解组,且差异均有统计学意义(χ2=4.130、4.069,P=0.042、0.044);中期SUVmax<4.9组的完全缓解率高于ΔSUVmax%≥70%组和Lugano疗效评估缓解组,但差异均无统计学意义(χ2=3.345、3.282,P=0.067、0.070)。
评估指标 例数 完全缓解(n=51) 未完全缓解(n=26) χ2值 P值 中期SUVmax 中期SUVmax<4.9组 46 38(82.6) 8(17.4) 13.699 <0.001 中期SUVmax≥4.9组 31 13(41.9) 18(58.1) ΔSUVmax70% ΔSUVmax%≥70%组 57 38(66.7) 19(33.3) 0.018 0.892 ΔSUVmax%<70%组 20 13(65.0) 7(35.0) Deauville五分法评分 1~3分组 40 34(85.0) 6(15.0) 13.108 <0.001 4~5分组 37 17(45.9) 20(54.1) Lugano疗效评估 缓解组 74 50(67.6) 24(32.4) 0.368 0.544 未缓解组 3 1(33.3) 2(66.7) 注:FDG为氟脱氧葡萄糖;PET为正电子发射断层显像术;CT为计算机体层摄影术;EN-DLBCL为结外弥漫大B细胞淋巴瘤;SUVmax为最大标准化摄取值;ΔSUVmax为基线PET与中期PET的SUVmax差值;ΔSUVmax=[(基线SUVmax−中期SUVmax)/基线SUVmax]×100% 表 2 中期18F-FDG PET/CT各评估指标预测EN-DLBCL患者初始化疗结束时疗效的结果分析[例(%)]
Table 2. Results of various evaluation indicators of interm 18F-FDG PET/CT for predicting the efficacy of extranodal diffuse large B-cell lymphoma at the end of primary chemotherapy (case (%))
中期SUVmax<4.9、Deauville五分法评分1~3分预测EN-DLBCL初始化疗结束时疾病完全缓解的灵敏度分别为69.2%和76.9%,特异度分别为74.5%和66.7%,准确率分别为72.7%和70.1%,两指标间的差异均无统计学意义(χ2=0.759、0.391、0.127,均P>0.05)。
-
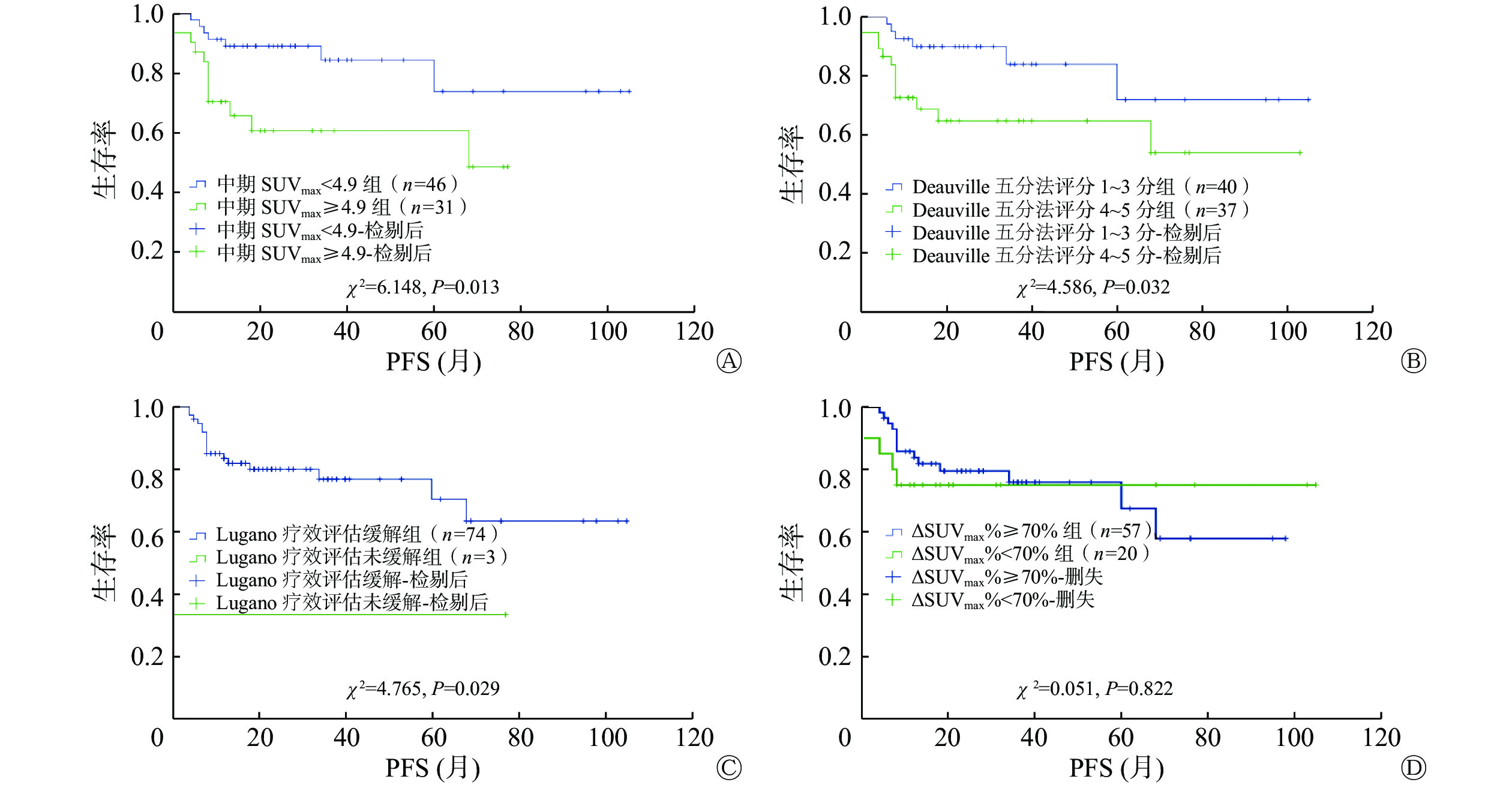
中期SUVmax<4.9组和中期SUVmax≥4.9组的2年PFS率分别为89.0%和60.6%,差异有统计学意义(χ2=6.148,P=0.013);2年OS率分别为92.5%和80.3%,差异无统计学意义(χ2=3.416,P=0.065)。ΔSUVmax%≥70%组和ΔSUVmax%<70%组的2年PFS率分别为79.5%和75.0%,差异无统计学意义(χ2=0.051,P=0.822);2年OS率分别为92.2%和74.4%,差异无统计学意义(χ2=3.331,P=0.068)。Deauville五分法评分1~3分组和4~5分组的2年PFS率分别为89.9%和64.7%,差异有统计学意义(χ2=4.586,P=0.032);2年OS率分别为93.8%和80.8%,差异无统计学意义(χ2=3.447,P=0.063)。Lugano疗效评估缓解组和未缓解组的2年PFS率分别为79.9%和33.3%,差异有统计学意义(χ2=4.765,P=0.029);2年OS率分别为89.7%和33.3%,差异有统计学意义(χ2=7.248,P=0.007)。中期18F-FDG PET/CT各评估指标预测EN-DLBCL的PFS的Kaplan-Meier生存曲线见图1。

图 1 中期18F-FDG PET/CT各评估指标预测77例EN-DLBCL患者PFS的Kaplan-Meier生存曲线
Figure 1. Kaplan-Meier plots of progression free survival in 77 patients with extranodal diffuse large B-cell lymphoma using assessment indicators of interim 18F-FDG PET/CT
EN-DLBCL患者PFS和OS的单因素COX回归分析结果见表3。将表3中P<0.10的评估指标纳入多因素COX回归分析,结果显示Lugano疗效评估、IPI评分是影响EN-DLBCL患者PFS和OS的独立预测指标,详见表4。
影响因素 PFS OS HR(95%CI) P值 HR(95%CI) P值 基线PET/CT 结外病变数目是否>1 4.388(1.409~13.668) 0.011 4.579(0.973~21.545) 0.054 是否有重要脏器受累 3.682(1.062~12.762) 0.040 5.863(0.749~45.896) 0.092 中期PET/CT SUVmax4.9分组 3.052(1.196~7.788) 0.020 3.009(0.877~10.327) 0.080 ΔSUVmax70%分组 0.890(0.319~2.482) 0.823 0.347(0.105~1.147) 0.083 Deauville五分法评分分组 2.737(1.038~7.221) 0.042 3.262(0.864~12.312) 0.081 Lugano疗效评估分组 4.595(1.016~20.783) 0.048 6.293(1.347~29.395) 0.019 初诊时临床特征 是否有B症状 2.609(1.045~6.517) 0.040 1.728(0.526~5.680) 0.368 LDH水平是否升高 4.143(1.365~12.573) 0.012 2.648(0.697~10.064) 0.153 IPI评分分组 7.040(1.611~30.761) 0.009 7.422(0.943~58.388) 0.057 注:EN-DLBCL为结外弥漫大B细胞淋巴瘤;PFS为无进展生存期;OS为总生存期;PET为正电子发射断层显像术;CT为计算机体层摄影术;SUVmax为最大标准化摄取值;ΔSUVmax为基线PET与中期PET的SUVmax差值;LDH为乳酸脱氢酶;IPI为国际预后指数;HR为风险比;CI为置信区间 表 3 影响EN-DLBCL患者PFS和OS的单因素COX回归分析结果
Table 3. Univariate COX analysis results of progression free survival and overall survival of patients with extranodal diffuse large B-cell lymphoma
影响因素 PFS OS HR(95%CI) P值 HR(95%CI) P值 中期SUVmax4.9分组 2.647(0.992~7.061) 0.052 − − Lugano疗效评估分组 12.179(1.616~91.780) 0.015 8.645(1.768~42.273) 0.008 IPI评分分组 14.330(2.251~91.213) 0.005 8.903(1.089~72.806) 0.041 注:−表示无此项数据;EN-DLBCL为结外弥漫大B细胞淋巴瘤;PFS为无进展生存期;OS为总生存期;SUVmax为最大标准化摄取值;IPI为国际预后指数;HR为风险比;CI为置信区间 表 4 影响EN-DLBCL患者PFS和OS的多因素COX回归分析结果
Table 4. Multivariate COX analysis results of progression free survival and overall survival of patients with extranodal diffuse large B-cell lymphoma
-
基于中期PET/CT的评价指标目前有很多种,但哪种指标在DLBCL预后评估中的价值更高仍存在争议。EN-DLBCL较非EN-DLBCL的疗效和预后均更差[6-7, 10],且目前很少有以中期PET/CT来专门评估EN-DLBCL疗效和预后的研究。本研究探讨了在DLBCL疗效和预后预测中较为广泛应用的4种中期PET/CT评估指标,包括SUVmax、ΔSUVmax70%、Deauville五分法评分及Lugano疗效评估,结果显示,经3~4个周期利妥昔单抗联合一线方案化疗后,中期SUVmax<4.9、Deauville五分法评分1~3分的EN-DLBCL患者的完全缓解率更高,且4种指标中Lugano疗效评估结果是EN-DLBCL患者远期预后的独立预测指标。
以中期SUVmax、Deauville五分法评分来评估EN-DLBCL的疗效和预后简单易行,适合临床常规使用。这2种指标都是评估化疗中期EN-DLBCL病灶的代谢活性。一般而言,18F-FDG摄取增高与DLBCL的疗效和预后呈负相关,但既往有关SUVmax预测DLBCL疗效和预后的研究均是针对所有DLBCL患者[10-11],不是专门针对EN-DLBCL患者。本研究基于中期PET/CT的几种评估指标预测EN-DLBCL初始化疗疗效和预后,结果显示中期SUVmax<4.9的患者初始化疗结束时的完全缓解率更高,与前述基于基线PET/CT对DLBCL的研究[10-11]结果类似。基线PET/CT的SUVmax对DLBCL患者PFS和OS的预测价值尚存在争议[11-15]。本研究中多因素COX回归分析结果提示,中期SUVmax对EN-DLBCL患者的PFS有一定的预测价值(P=0.052),但仍有待大样本、前瞻性研究进一步验证。
Deauville五分法评分最早用于淋巴瘤化疗中期疗效评估,其价值已得到普遍认可,但是对于其最佳临界值的选择尚有一定的争议,既往的研究分别将Deauville五分法评分以3、4、5分作为最佳临界值进行过探讨[16-21]。本研究结果显示,中期Deauville五分法评分以4为最佳临界值,是预测EN-DLBCL初始化疗结束时完全缓解的可靠指标,而且中期PET/CT Deauville五分法评分评估为4~5分的患者,其2年PFS率比Deauville五分法评分1~3分的患者更低,这与以往针对所有DLBCL患者的研究结果一致[16, 19, 22]。虽然本研究结果显示,中期SUVmax和Deauville五分法评分与EN-DLBCL患者的2年PFS率显著相关,但最终的多因素分析结果显示,只有Lugano疗效评估结果是影响EN-DLBCL患者2年PFS率和2年OS率的独立预测指标。这说明预测EN-DLBCL患者的远期预后需要动态PET/CT进行评估。这与既往对结外淋巴瘤、DLBCL的研究结果类似[14, 20, 23]。分析原因可能是因为治疗后EN-DLBCL的生长或凋亡是一个动态变化的过程,与中期SUVmax和Deauville五分法评分相比,Lugano疗效评估结果能够更为动态、立体地反映淋巴瘤细胞的侵袭性和代谢活性的变化,而这种动态变化与患者的预后关系更为密切。
ΔSUVmax%综合了化疗前、后淋巴瘤病灶的代谢信息,既往很多研究结果显示其对DLBCL患者的PFS和OS有预测价值[16-19]。有研究者推荐ΔSUVmax%的最佳临界值应随着化疗周期的推进而提高,2个周期化疗后其最佳临界值应为66%,4个周期化疗后应为70%~73%[3, 22, 24]。但是,本研究结果没有显示ΔSUVmax70%与初始化疗结束时的疗效或远期预后显著相关,可能是因为既往研究的对象为所有DLBCL患者,而本研究是专门针对EN-DLBCL患者开展的。目前仅有的一项针对中期PET/CT预测EN-DLBCL患者中期PET预后的研究结果[25]与本研究结果不一致,该研究结果提示ΔSUVmax65.7%是EN-DLBCL患者预后的独立预测指标。分析原因可能与该研究只纳入了ΔSUVmax%和中期Deauville五分法评分作为研究指标,没有将Lugano疗效评估结果纳入预测预后的指标体系,且该研究中患者病情较本研究中患者更轻,如年龄更小(中位年龄61岁对中位年龄67岁)、单个结外病变比例更高(62.6%对44.2%)、Lugano分期的Ⅰ/Ⅱ期比例比Ⅲ/Ⅳ期更高(46.0%对27.3%)等因素有关。
本研究入组患者因为高龄、病情重等原因,没有全部采用标准的利妥昔单抗、环磷酰胺、阿霉素、长春新碱、泼尼松(R-CHOP)方案进行治疗,这是本研究最大的局限性。因此,对于预后更差的EN-DLBCL患者,中期PET/CT的预后价值仍有必要进行大样本、多指标的前瞻性研究来进一步验证。
总之,基于中期PET/CT的4种评估指标中,中期SUVmax<4.9和Deauville五分法评分1~3分能较好地预测EN-DLBCL患者初始化疗结束时的疗效,而Lugano疗效评估结果则是远期PFS和OS的独立预测指标。
利益冲突 所有作者声明无利益冲突
作者贡献声明 李旭负责研究命题的提出与设计、方法的建立、研究过程的实施、试验数据的获取与分析、论文的撰写;刘甫庚、姚稚明负责研究命题的设计、论文的审阅与修改;陈聪霞、崔燕、冯茹、颜东岳负责患者的随访、试验数据的获取与分析
中期18F-FDG PET/CT预测结外弥漫大B细胞淋巴瘤疗效和预后的方法学研究
Methodological study of interim 18F-FDG PET/CT in predicting efficacy and prognosis in patients with extranodal diffuse large B-cell lymphoma
-
摘要:
目的 对比分析基于中期18F-氟脱氧葡萄糖(FDG) PET/CT的4项评估指标预测结外弥漫大B细胞淋巴瘤(EN-DLBCL)初始化疗疗效和预后的效能。 方法 回顾性分析2011年5月至2020年4月于北京医院经组织病理学检查或随访结果明确诊断为EN-DLBCL的77例初诊患者[其中,男性35例、女性42例,年龄(62.7±16.2)岁]的资料,包括治疗前基线PET/CT、初始化疗3~4个周期时的中期PET/CT和临床资料,并通过医院电子病历系统或电话随访。采用受试者工作特征(ROC)曲线确定中期PET/CT的最大标准化摄取值(SUVmax)的最佳临界值,将患者分为中期SUVmax<最佳临界值组和中期SUVmax≥最佳临界值组;按照中华医学会核医学分会淋巴瘤18F-FDG PET/CT及PET/MR显像临床应用指南推荐,以ΔSUVmax%=70%为最佳临界值,将患者分为ΔSUVmax%<70%组和ΔSUVmax%≥70%组;根据中期Deauville五分法评分,将患者分为Deauville五分法评分1~3分组和4~5分组;根据Lugano疗效评估标准,以中期疗效将患者分为缓解组和未缓解组。采用χ2检验、Kaplan-Meier生存分析和COX回归分析等方法分析基于中期PET/CT的SUVmax、Deauville五分法评分、Lugano疗效评估结果、ΔSUVmax%等指标对EN-DLBCL初始化疗疗效和预后预测的效能。 结果 (1)初始化疗结束时51例(66.2%)患者完全缓解;中期SUVmax<4.9组、Deauville五分法评分1~3分组的完全缓解率分别为82.6%(38/46)和85.0%(34/40),显著高于对应的其他组,差异均有统计学意义(χ2=13.699、13.108,均P<0.001);以ΔSUVmax70%和Lugano疗效评估结果进行分组的各组,其完全缓解率之间的差异均无统计学意义(χ2=0.018、0.368,均P>0.05)。(2)中位随访时间为24个月,范围为4~105个月,随访结束时19例(24.7%)患者疾病进展、复发或死亡;SUVmax<4.9组、Deauville五分法评分1~3分组、Lugano疗效评估缓解组患者的2年无进展生存期(PFS)均显著优于对应的其他组,差异均有统计学意义(χ2=6.148、4.586、4.765,均P<0.05);Lugano疗效评估缓解组患者的2年总生存期(OS)优于未缓解组,差异有统计学意义(χ2=7.248,P=0.007);以ΔSUVmax70%分组的患者之间的PFS和OS的差异均无统计学意义(χ2=0.051、3.331,均P>0.05)。多因素COX回归分析结果显示,Lugano疗效评估结果、国际预后指数评分是EN-DLBCL患者PFS(HR=12.179、14.330,P=0.015、0.005)和OS(HR=8.645、8.903,P=0.008、0.041)的独立预测指标。 结论 基于EN-DLBCL患者中期18F-FDG PET/CT的4项评估指标中,中期SUVmax<4.9和Deauville五分法评分1~3分能较好地预测EN-DLBCL患者初始化疗结束时的疗效是否为完全缓解,Lugano疗效评估结果是PFS和OS的独立预测指标。 -
关键词:
- 淋巴瘤,大B细胞,弥漫性 /
- 正电子发射断层显像术 /
- 体层摄影术,X线计算机 /
- 预后 /
- 最大标准化摄取值 /
- Deauville五分法 /
- Lugano疗效评估
Abstract:Objective To investigate the predictive accuracies of four indicators based on the interim 18F-fluorodeoxyglucose (FDG) PET/CT in terms of their efficacy and prognoses in patients with extranodal diffuse large B-cell lymphoma (EN-DLBCL). Methods Data of a total of seventy-seven newly diagnosed patients (35 males, 42 females; aged (62.7±16.2) years) with EN-DLBCL confirmed by histopathological examination or follow-up results were retrospectively analyzed from May 2011 to April 2020, including baseline PET/CT before treatment, interim PET/CT during initial chemotherapy for 3 to 4 cycles, and clinical data. Follow-up was performed through the hospital's electronic medical record system or phone call. Using the receiver operating characteristic (ROC) curve to select the optimal cutoff value for interim SUVmax, patients were divided into SUVmax < the cutoff value group and ≥ the cutoff group. Following the clinical practice guideline of 18F-FDG PET/CT and PET/MR in lymphoma (2021 edition), ΔSUVmax=70% was chosen as the cutoff value, patients were divided into ΔSUVmax%<70% group and ≥70% group. Based on the Deauville five-point scale, patients were divided into 1–3 group and 4–5 group. According to the Lugano classification criteria, patients were divided into the disease remission group and unrelieved group based on the interim response evaluation. The χ2 test, Kaplan-Meier, and Cox regression analysis were performed to analyze SUVmax, Deauville five-point scale, and the Lugano classification criteria based on interim PET/CT and ΔSUVmax% between baseline PET and interim PET in order to predict the efficacy of primary chemotherapy and prognosis of EN-DLBCL. Results (1) At the end of primary chemotherapy, 51 patients (66.2%) achieved complete remission (CR). The rates of CR in SUVmax<4.9 group and Deauville scores 1–3 group were 82.6% (38/46) and 85.0% (34/40), respectively, which were significantly higher than those of the other corresponding groups (χ2=13.699, 13.108, both P<0.001). No significant difference was found between the rates of CR of patients grouped by ΔSUVmax70% or the interim response evaluation based on the Lugano classification criteria (χ2=0.018, 0.368, both P>0.05). (2) The median follow-up time was 24 (4–105) months. In addition, 19 patients (24.7%) progressed, relapsed, or died at the end of follow-up. Patients in the SUVmax<4.9 group, Deauville scores 1–3 group, or remission group assessed by the Lugano classification criteria had significantly higher 2-year progression-free survival (PFS) than those in the other corresponding groups (χ2=6.148, 4.586, and 4.765, all P<0.05). The 2-year overall survival (OS) of the remission group was significantly higher than that of the nonremission group (χ2=7.248, P=0.007). No significant difference was found in the PFS or OS between patients grouped by ΔSUVmax70% (χ2=0.051, 3.331, both P>0.05). Furthermore, multivariate COX analysis confirmed that Lugano classification criteria and International Prognosis Index were independent predictors of PFS (HR=12.179, 14.330, P=0.015, 0.005) and OS (HR=8.645, 8.903, P=0.008, 0.041) in EN-DLBCL patients. Conclusion Among the four assessment indicators of interim PET/CT in patients with EN-DLBCL, the interim SUVmax<4.9 and the Deauville scores 1–3 were the better indicators for predicting CR at the end of primary chemotherapy, whereas the interim Lugano classification criteria can be considered an independent predictive factor of PFS and OS. -
表 1 77例结外弥漫大B细胞淋巴瘤患者的一般资料
Table 1. Clinical characteristics of 77 extranodal diffuse large B-cell lymphoma patients
一般资料 例数(%) 性别 男 35(45.5) 女 42(54.5) 临床Ann Arbor分期 Ⅰ/Ⅱ期 21(27.3) Ⅲ/Ⅳ期 56(72.7) 初诊LDH水平 升高 41(53.2) 未升高 36(46.8) β2微球蛋白水平 升高 61(79.2) 未升高 16(20.8) 有无B症状 有 26(33.8) 无 51(66.2) ECOG PS评分 0~1分 63(81.8) 2~4分 14(18.2) IPI评分 低危+中低危 29(37.7) 中高危+高危 48(62.3) 结外病变数目 1个 34(44.2) >1个 43(55.8) 重要脏器是否受累 是 50(64.9) 否 27(35.1) Deauville五分法评分 1~3分 40(51.9) 4~5分 37(48.1) Lugano疗效评估 缓解 74(96.1) 未缓解 3(3.9) 初始化疗结束时临床疗效评估 完全缓解 51(66.2) 未完全缓解(部分缓解+疾病稳定或
未缓解+疾病进展,含死亡)26(33.8) 注:LDH为乳酸脱氢酶;ECOG PS为东部肿瘤协作组体能状态评分;IPI为国际预后指数;重要脏器指骨髓、胃、肠、肝或肺 表 2 中期18F-FDG PET/CT各评估指标预测EN-DLBCL患者初始化疗结束时疗效的结果分析[例(%)]
Table 2. Results of various evaluation indicators of interm 18F-FDG PET/CT for predicting the efficacy of extranodal diffuse large B-cell lymphoma at the end of primary chemotherapy (case (%))
评估指标 例数 完全缓解(n=51) 未完全缓解(n=26) χ2值 P值 中期SUVmax 中期SUVmax<4.9组 46 38(82.6) 8(17.4) 13.699 <0.001 中期SUVmax≥4.9组 31 13(41.9) 18(58.1) ΔSUVmax70% ΔSUVmax%≥70%组 57 38(66.7) 19(33.3) 0.018 0.892 ΔSUVmax%<70%组 20 13(65.0) 7(35.0) Deauville五分法评分 1~3分组 40 34(85.0) 6(15.0) 13.108 <0.001 4~5分组 37 17(45.9) 20(54.1) Lugano疗效评估 缓解组 74 50(67.6) 24(32.4) 0.368 0.544 未缓解组 3 1(33.3) 2(66.7) 注:FDG为氟脱氧葡萄糖;PET为正电子发射断层显像术;CT为计算机体层摄影术;EN-DLBCL为结外弥漫大B细胞淋巴瘤;SUVmax为最大标准化摄取值;ΔSUVmax为基线PET与中期PET的SUVmax差值;ΔSUVmax=[(基线SUVmax−中期SUVmax)/基线SUVmax]×100% 表 3 影响EN-DLBCL患者PFS和OS的单因素COX回归分析结果
Table 3. Univariate COX analysis results of progression free survival and overall survival of patients with extranodal diffuse large B-cell lymphoma
影响因素 PFS OS HR(95%CI) P值 HR(95%CI) P值 基线PET/CT 结外病变数目是否>1 4.388(1.409~13.668) 0.011 4.579(0.973~21.545) 0.054 是否有重要脏器受累 3.682(1.062~12.762) 0.040 5.863(0.749~45.896) 0.092 中期PET/CT SUVmax4.9分组 3.052(1.196~7.788) 0.020 3.009(0.877~10.327) 0.080 ΔSUVmax70%分组 0.890(0.319~2.482) 0.823 0.347(0.105~1.147) 0.083 Deauville五分法评分分组 2.737(1.038~7.221) 0.042 3.262(0.864~12.312) 0.081 Lugano疗效评估分组 4.595(1.016~20.783) 0.048 6.293(1.347~29.395) 0.019 初诊时临床特征 是否有B症状 2.609(1.045~6.517) 0.040 1.728(0.526~5.680) 0.368 LDH水平是否升高 4.143(1.365~12.573) 0.012 2.648(0.697~10.064) 0.153 IPI评分分组 7.040(1.611~30.761) 0.009 7.422(0.943~58.388) 0.057 注:EN-DLBCL为结外弥漫大B细胞淋巴瘤;PFS为无进展生存期;OS为总生存期;PET为正电子发射断层显像术;CT为计算机体层摄影术;SUVmax为最大标准化摄取值;ΔSUVmax为基线PET与中期PET的SUVmax差值;LDH为乳酸脱氢酶;IPI为国际预后指数;HR为风险比;CI为置信区间 表 4 影响EN-DLBCL患者PFS和OS的多因素COX回归分析结果
Table 4. Multivariate COX analysis results of progression free survival and overall survival of patients with extranodal diffuse large B-cell lymphoma
影响因素 PFS OS HR(95%CI) P值 HR(95%CI) P值 中期SUVmax4.9分组 2.647(0.992~7.061) 0.052 − − Lugano疗效评估分组 12.179(1.616~91.780) 0.015 8.645(1.768~42.273) 0.008 IPI评分分组 14.330(2.251~91.213) 0.005 8.903(1.089~72.806) 0.041 注:−表示无此项数据;EN-DLBCL为结外弥漫大B细胞淋巴瘤;PFS为无进展生存期;OS为总生存期;SUVmax为最大标准化摄取值;IPI为国际预后指数;HR为风险比;CI为置信区间 -
[1] Shankland KR, Armitage JO, Hancock BW. Non-Hodgkin lymphoma[J]. Lancet, 2012, 380(9844): 848−857. DOI: 10.1016/S0140-6736(12)60605-9. [2] Zelenetz AD, Gordon LI, Chang JE, et al. NCCN guidelines® insights: B-cell lymphomas, version 5.2021[J]. J Natl Compr Canc Netw, 2021, 19(11): 1218−1230. DOI: 10.6004/jnccn.2021.0054. [3] 中华医学会核医学分会. 淋巴瘤18F-FDG PET/CT及PET/MR显像临床应用指南(2021版)[J]. 中华核医学与分子影像杂志, 2021, 41(3): 161−169. DOI: 10.3760/cma.j.cn321828-20210129-00018.
Chinese Society of Nuclear Medicine. Clinical practice guideline of 18F-FDG PET/CT and PET/MR in lymphoma (2021 edition)[J]. Chin J Nucl Med Mol Imaging, 2021, 41(3): 161−169. DOI: 10.3760/cma.j.cn321828-20210129-00018.[4] El-Galaly TC, Villa D, Gormsen LC, et al. FDG-PET/CT in the management of lymphomas: current status and future directions[J]. J Intern Med, 2018, 284(4): 358−376. DOI: 10.1111/joim.12813. [5] Sun N, Zhao JH, Qiao WL, et al. Predictive value of interim PET/CT in DLBCL treated with R-CHOP: meta-analysis[J/OL]. Biomed Res Int, 2015, 2015: 648572[2022-12-04]. https://www.hindawi.com/journals/bmri/2015/648572. DOI: 10.1155/2015/648572. [6] 陈雅姝, 刘敏, 王俊. 利妥昔单抗治疗弥漫大B细胞淋巴瘤的疗效及影响患者预后多因素分析[J]. 实用癌症杂志, 2020, 35(6): 1031−1034. DOI: 10.3969/j.issn.1001-5930.2020.06.043.
Chen YS, Liu M, Wang J. Curative effect of rituximab in the treatment of diffuse large B-cell lymphoma and multivariate analysis of factors influencing the prognosis[J]. Pract J Cancer, 2020, 35(6): 1031−1034. DOI: 10.3969/j.issn.1001-5930.2020.06.043.[7] Bobillo S, Joffe E, Lavery JA, et al. Clinical characteristics and outcomes of extranodal stage Ⅰ diffuse large B-cell lymphoma in the rituximab era[J]. Blood, 2021, 137(1): 39−48. DOI: 10.1182/blood.2020005112. [8] Meignan M, Gallamini A, Meignan M, et al. Report on the first international workshop on interim-PET scan in lymphoma[J]. Leuk Lymphoma, 2009, 50(8): 1257−1260. DOI: 10.1080/10428190903040048. [9] Barrington SF, Mikhaeel NG, Kostakoglu L, et al. Role of imaging in the staging and response assessment of lymphoma: consensus of the International Conference on Malignant Lymphomas Imaging Working Group[J]. J Clin Oncol, 2014, 32(27): 3048−3058. DOI: 10.1200/JCO.2013.53.5229. [10] Salvatore B, Fonti R, De Renzo A, et al. 2-deoxy-2-[18F]fluoro-D-glucose positron emission tomography/computed tomography in primary extranodal lymphomas: treatment response evaluation and prognosis[J]. Q J Nucl Med Mol Imaging, 2020, 64(2): 219−225. DOI: 10.23736/S1824-4785.18.03043-1. [11] Coskun N, Okudan B, Uncu D, et al. Baseline 18F-FDG PET textural features as predictors of response to chemotherapy in diffuse large B-cell lymphoma[J]. Nucl Med Commun, 2021, 42(11): 1227−1232. DOI: 10.1097/MNM.0000000000001447. [12] Baratto L, Wu FY, Minamimoto R, et al. Correlation of 18-fluorodeoxyglucose PET/computed tomography parameters and clinical features to predict outcome for diffuse large B-cell lymphoma[J]. Nucl Med Commun, 2021, 42(7): 792−799. DOI: 10.1097/MNM.0000000000001398. [13] 梁颖, 吴宁, 方艳, 等. 18F-FDG PET/CT显像SUVmax、MTV和TLG判断弥漫性大B细胞淋巴瘤的预后价值[J]. 中华核医学与分子影像杂志, 2015, 35(2): 97−101. DOI: 10.3760/cma.j.issn.2095-2848.2015.02.005.
Liang Y, Wu N, Fang Y, et al. Prognostic significance of SUVmax, MTV and TLG on 18F-FDG PET/CT imaging in patients with diffuse large B-cell lymphoma[J]. Chin J Nucl Med Mol Imaging, 2015, 35(2): 97−101. DOI: 10.3760/cma.j.issn.2095-2848.2015.02.005.[14] Zhu LL, Meng YK, Guo LL, et al. Predictive value of baseline 18F-FDG PET/CT and interim treatment response for the prognosis of patients with diffuse large B-cell lymphoma receiving R-CHOP chemotherapy[J]. Oncol Lett, 2021, 21(2): 132. DOI: 10.3892/ol.2020.12393. [15] Song MK, Chung JS, Lim SN, et al. Clinical impact of extranodal metabolic tumor volume in 240 diffuse large B cell lymphoma patients with extranodal involvement[J]. Ann Hematol, 2021, 100(5): 1221−1229. DOI: 10.1007/s00277-021-04498-9. [16] 高艳, 赵晋华, 宋建华, 等. △SUV法和Deauville五分法在弥漫性大B细胞淋巴瘤预后中的作用[J]. 中华核医学与分子影像杂志, 2016, 36(5): 420−425. DOI: 10.3760/cma.j.issn.2095-2848.2016.05.009.
Gao Y, Zhao JH, Song JH, et al. Prognostic value of △SUV and Deauville 5-point scoring in patients with diffuse large B-cell lymphoma[J]. Chin J Nucl Med Mol Imaging, 2016, 36(5): 420−425. DOI: 10.3760/cma.j.issn.2095-2848.2016.05.009.[17] 张玥伟, 范洋, 杨志, 等. 化疗早期及中期18F-FDG PET/CT显像对56例弥漫大B细胞淋巴瘤患者预后的评估价值[J]. 中华血液学杂志, 2015, 36(10): 824−829. DOI: 10.3760/cma.j.issn.0253-2727.2015.10.004.
Zhang YW, Fan Y, Yang Z, et al. The prognosis value of early and interim 18F-FDG-PET/CT scans in patients with diffuse large B-cell lymphoma[J]. Chin J Hematol, 2015, 36(10): 824−829. DOI: 10.3760/cma.j.issn.0253-2727.2015.10.004.[18] Adams HJA, Kwee TC. Prognostic value of interim FDG-PET in R-CHOP-treated diffuse large B-cell lymphoma: systematic review and meta-analysis[J]. Crit Rev Oncol/Hematol, 2016, 106: 55−63. DOI: 10.1016/j.critrevonc.2016.07.003. [19] 贺慧慧, 吴小红, 杜晓庆, 等. 18F-FDG PET/CT Deauville评分和IHP标准在弥漫性大B细胞淋巴瘤疗效评估中的应用[J]. 中华核医学与分子影像杂志, 2019, 39(5): 266−271. DOI: 10.3760/cma.j.issn.2095-2848.2019.05.003.
He HH, Wu XH, Du XQ, et al. Prognostic value of Deauville criteria and IHP criteria in 18F-FDG PET/CT for clinical evaluation at the end of treatment in diffuse large B-cell lymphoma[J]. Chin J Nucl Med Mol Imaging, 2019, 39(5): 266−271. DOI: 10.3760/cma.j.issn.2095-2848.2019.05.003.[20] Kim J, Song YS, Lee JS, et al. Risk stratification of diffuse large B-cell lymphoma with interim PET-CT based on different cutoff Deauville scores[J]. Leuk Lymphoma, 2018, 59(2): 340−347. DOI: 10.1080/10428194.2017.1339877. [21] Casasnovas RO, Meignan M, Berriolo-Riedinger A, et al. Early interim PET scans in diffuse large B-cell lymphoma: can there be consensus about standardized reporting, and can PET scans guide therapy choices?[J]. Curr Hematol Malig Rep, 2012, 7(3): 193−199. DOI: 10.1007/s11899-012-0129-y. [22] Rekowski J, Hüttmann A, Schmitz C, et al. Interim PET evaluation in diffuse large B-cell lymphoma using published recommendations: comparison of the deauville 5-point scale and the ΔSUVmax method[J]. J Nucl Med, 2021, 62(1): 37−42. DOI: 10.2967/jnumed.120.244145. [23] Zhao P, Yu T, Pan Z. Prognostic value of the baseline 18F-FDG PET/CT metabolic tumour volume (MTV) and further stratification in low-intermediate (L-I) and high-intermediate (H-I) risk NCCNIPI subgroup by MTV in DLBCL MTV predict prognosis in DLBCL[J]. Ann Nucl Med, 2021, 35(1): 24−30. DOI: 10.1007/s12149-020-01531-1. [24] 江茂情, 陈萍, 阮新忠, 等. 化疗中期18F-FDG PET/CT显像对弥漫性大B细胞淋巴瘤的预后评估效能[J]. 中华核医学与分子影像杂志, 2018, 38(6): 395−398. DOI: 10.3760/cma.j.issn.2095-2848.2018.06.004.
Jiang MQ, Chen P, Ruan XZ, et al. Prognostic efficiency of interim 18F-FDG PET/CT in patients with diffuse large B-cell lymphoma[J]. Chin J Nucl Med Mol Imaging, 2018, 38(6): 395−398. DOI: 10.3760/cma.j.issn.2095-2848.2018.06.004.[25] Baek DW, Cho HJ, Kim JH, et al. Quantitative assessment of interim PET/CT could have more prognostic relevance than visual assessment for predicting clinical outcome of extranodal diffuse large B cell lymphoma[J]. In Vivo, 2020, 34(4): 2127−2134. DOI: 10.21873/invivo.12018. -





 下载:
下载: