-
脾脏作为一种免疫器官,其血运丰富,肿瘤的发生率较低。脾脏硬化性血管瘤样结节性转化(sclerosing angiomatoid nodular transformation,SANT)是一种独特的良性增生性血管病变[1],在临床上较罕见。2004年,Martel等[2]首次描述了SANT的组织病理学特点并将其作为一种独立的疾病命名。笔者报道了2例脾脏SANT患者18F-FDG PET/CT显像的特点,并通过文献复习加深了对该病的认识,以充分认识SANT的诊断标准和影像学表现并进行准确诊断。
-
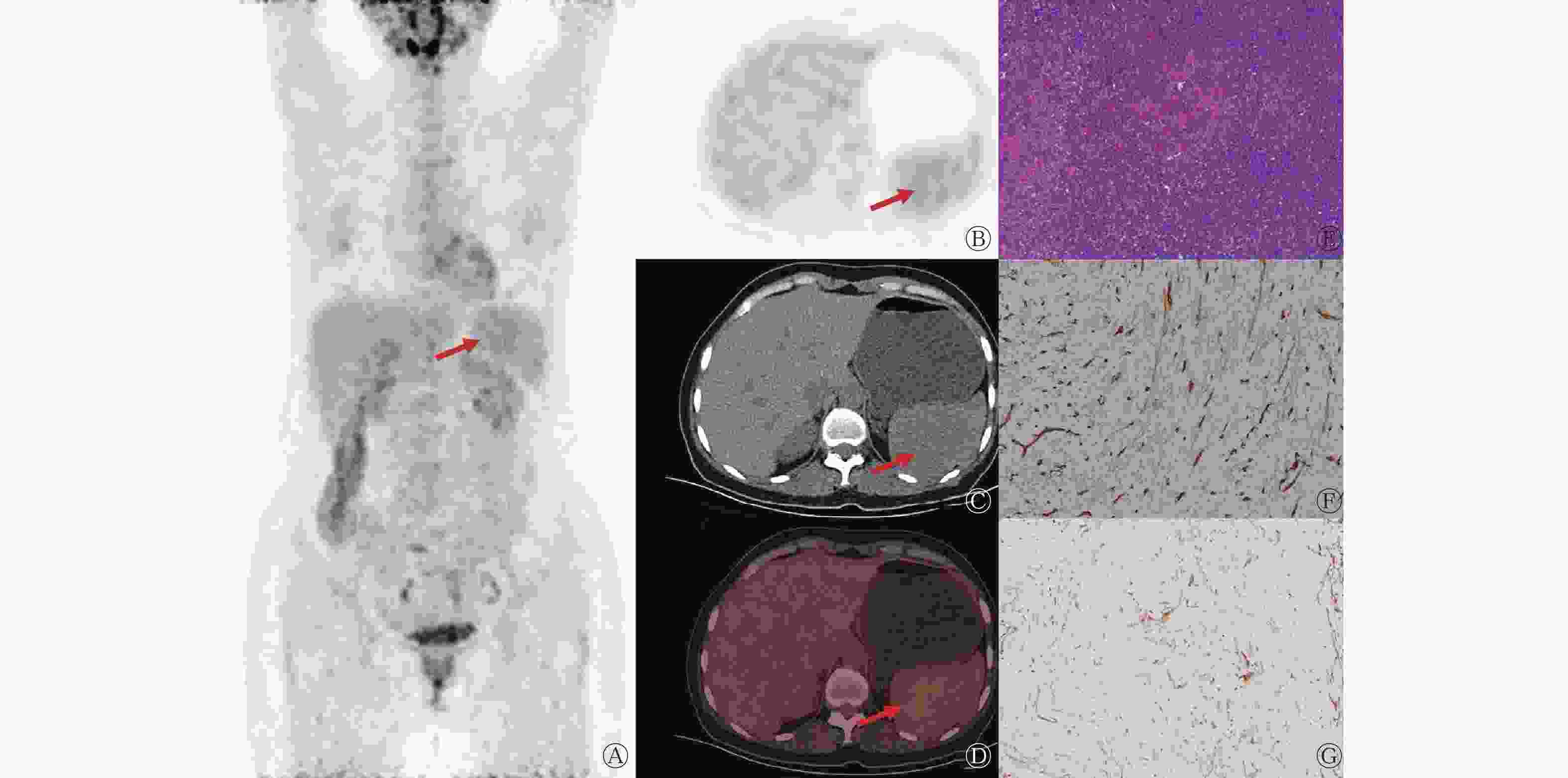
患者男性,21岁,因“体检超声提示脾脏占位性病变”就诊。患者体格检查未见明显异常;实验室检查结果示:癌胚抗原(1.25 ng/ml,正常值范围:0~5.00 ng/ml)、甲胎蛋白(0.91 ng/ml,正常值范围:0~10.00 ng/ml)、肿瘤相关抗原125(9.34 U/ml,正常值范围:0.01~35.00 U/ml)和肿瘤相关抗原199(11.90 U/ml,正常值范围:0.01~37.00 U/ml)的表达水平均未见升高;患者既往体健,无家族性遗传病史。患者CT检查结果示:脾脏体积增大,内见团块状软组织密度肿块,平扫CT值约为39 HU,最大截面积约为4.6 cm×4.5 cm,边界清晰;增强扫描动脉期、静脉期CT值分别为45、55 HU,病灶呈轻度强化(图1A~C)。18F-FDG PET/CT显像示脾脏内可见类圆形稍低密度软组织肿块,18F-FDG摄取稍增高,SUVmax约为3.3(脾脏本底SUVmax为2.0),最大截面积约为3.8 cm×4.1 cm,边界尚清晰(图1D~G)。患者行腹腔镜下脾脏切除术,术中可见距被膜约0.2 cm处一大小约5.0 cm × 4.7 cm × 3.8 cm的肿物,切面呈灰褐色、质软、边界清晰;组织病理学检查可见片状分布的新生毛细血管,细胞呈圆形或卵圆形,无异型性,部分呈结节状,可见中小血管内皮增生,管腔闭塞,间质广泛胶原化,伴较多淋巴细胞、浆细胞及少量嗜酸性粒细胞浸润(图1H、I)。组织病理学检查结果诊断为脾脏SANT。患者术后恢复良好,未出现复发及明显的并发症,目前仍在随访中。
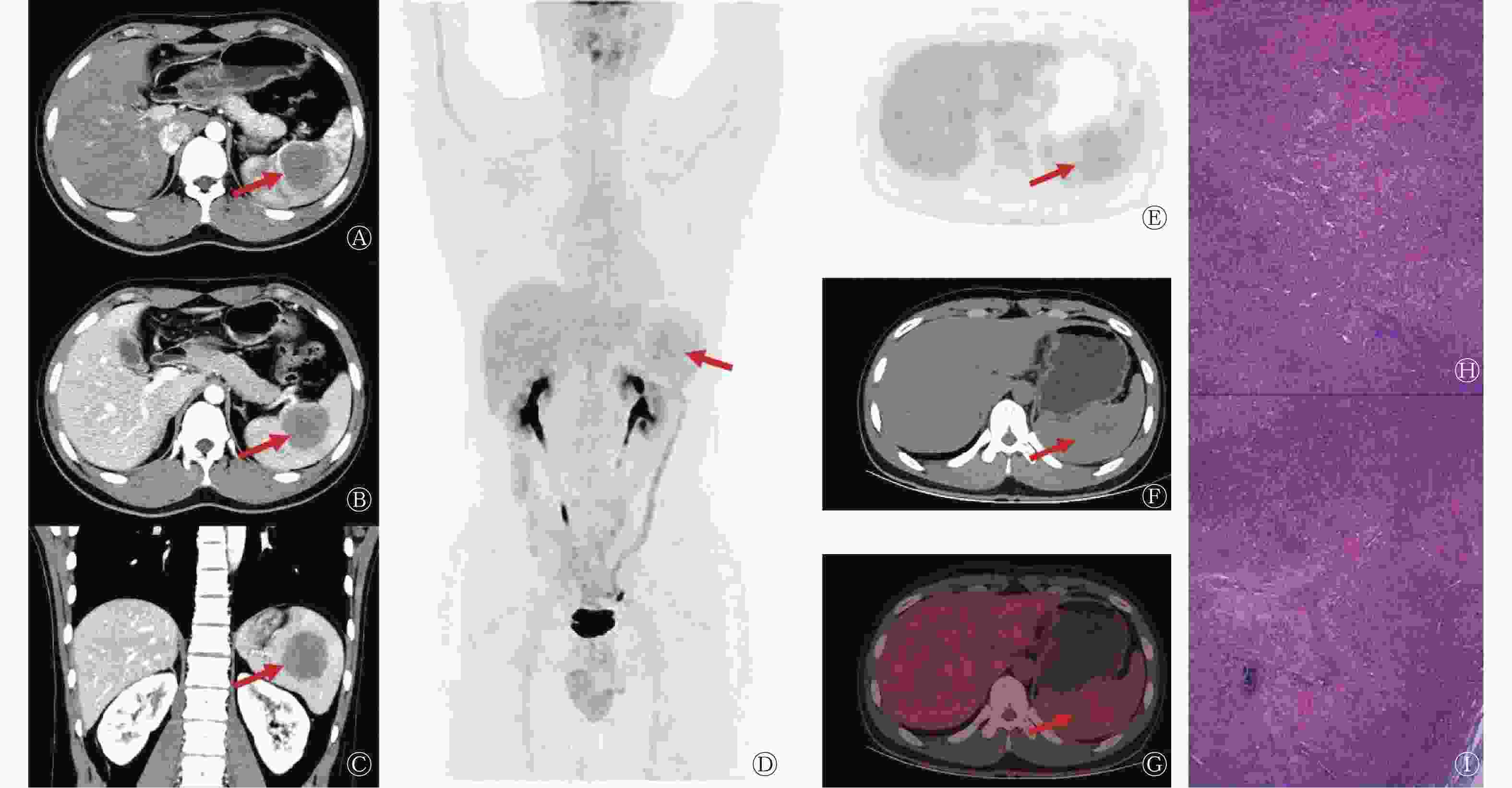
图 1 脾脏硬化性血管瘤样结节性转化患者(男性,21岁)的增强CT图、18F-FDG PET/CT图和组织病理学检查图
Figure 1. Enhanced CT, 18F-FDG PET/CT and histopathological examination images of a patient (male, 21 years old) with sclerosing angiomatoid nodular transformation of the spleen
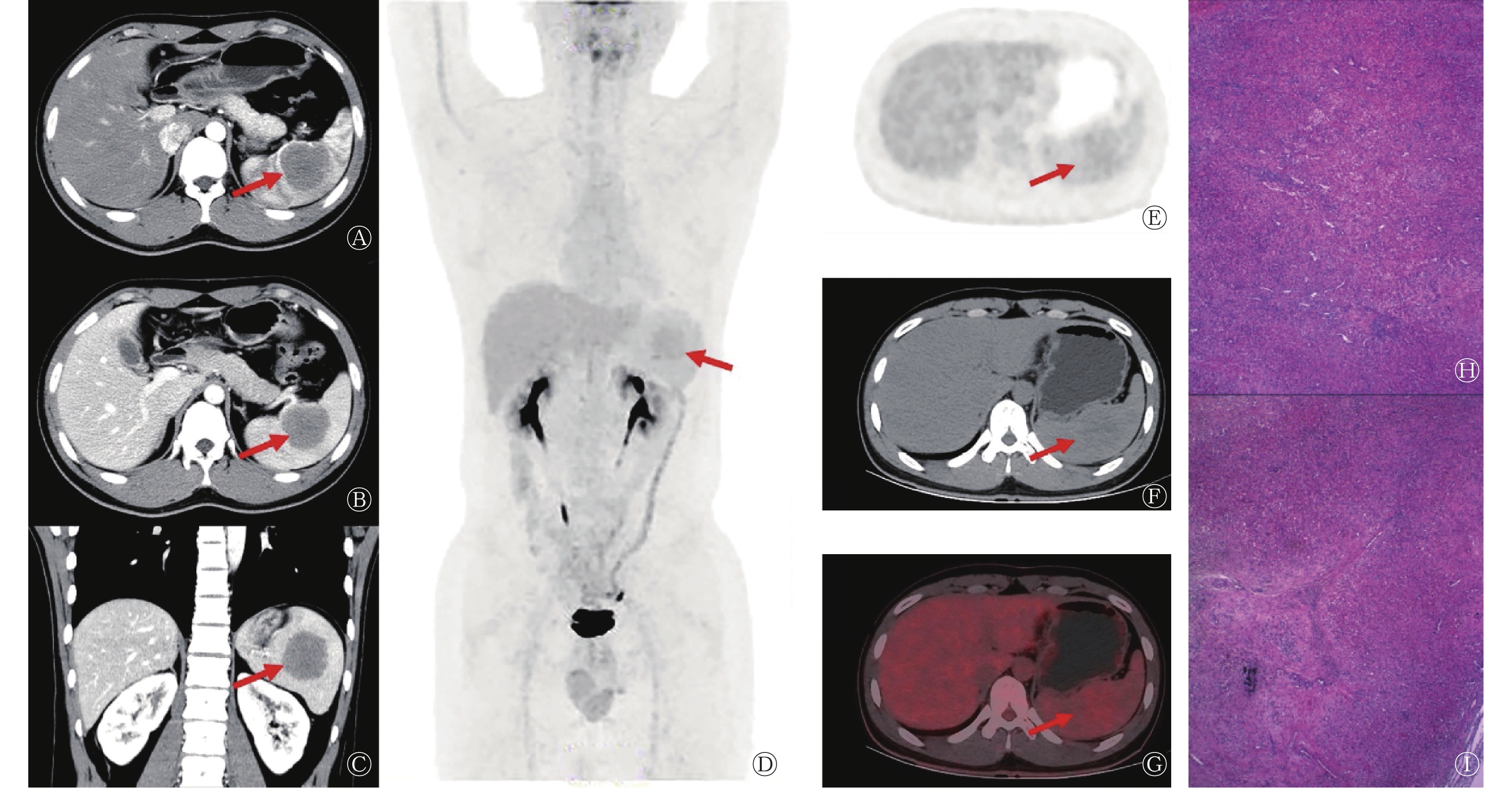
患者女性,41岁,因“左腰部酸胀5 d”就诊。患者5 d前无明显诱因出现左腰部酸胀感,发病初期至当地医院行增强CT检查,考虑为脾脏恶性占位。为进一步治疗前来郑州大学第一附属医院,入院后体格检查未见明显异常;实验室检查结果示癌胚抗原(1.71 ng/ml,正常值范围:0~5.00 ng/ml)、甲胎蛋白(4.01 ng/ml,正常值范围:0~10.00 ng/ml)、肿瘤相关抗原125(10.90 U/ml,正常值范围:0.01~35.00 U/ml)和肿瘤相关抗原199(4.93 U/ml,正常值范围:0.01~37.00 U/ml)表达水平均未见升高;患者既往体健,无家族性遗传病史。18F-FDG PET/CT显像示脾脏内可见类圆形稍低密度软组织肿块,18F-FDG摄取稍增高,SUVmax约为3.4(脾脏本底SUVmax为2.1),最大截面积约为5.6 cm×5.7 cm,边界欠清晰(图2A~D)。患者行腹腔镜下脾脏切除术,术中可见紧邻被膜处一大小约5.0 cm×4.5 cm×3.0 cm的肿物,切面呈灰红、灰白色,质地均匀,边界清晰;组织病理学检查可见片状分布的新生毛细血管,细胞呈圆形或梭形,未见核分裂象,周边可见纤维组织增生和散在的纤维母样细胞及慢性炎症细胞、嗜酸性粒细胞浸润(图2E);免疫组织化学检查结果示分化抗原簇(cluster of differentiation,CD)34(血管+)(图2F)、CD31(血管+)、CD4(+)、CD8(−/+)、CD68(组织细胞,+)、平滑肌肌动蛋白(SMA)(+)(图2G)、CD20(病灶+)、CD3(病灶+)、细胞增殖核抗原(Ki-67)(约10%,+)、神经系统特异性蛋白(S-100)(−);组织病理学检查结果诊断为脾脏SANT。患者术后恢复良好,未出现复发及明显的并发症,目前仍在随访中。
-
目前,SANT仅为一种描述性组织病理学诊断,其具体性质、发病机制和病因尚不明确,但可能涉及自身免疫性或反应性病变。SANT多见于中年女性,其临床表现缺乏特异性,大多数无临床症状,也可表现为腹痛或腹部不适。罗永竞等[3]报道了2例脾脏SANT患者,其临床症状均表现为门静脉高压和消化道出血。SANT的实验室检查结果通常显示血清肿瘤标志物水平在正常值范围内,可能伴有白细胞数量增加、红细胞沉降率升高以及血小板数量减少等症状[4]。本研究中2例患者的血清肿瘤标志物水平均在正常值范围内,临床表现均缺乏特异性。脾脏SANT的组织病理学表现为由增生性纤维组织和致密的胶原纤维分离的多个血管瘤样结节,间质内可见增生性成纤维细胞,结节为单个或多个融合,部分血管呈裂隙状,血管内可见炎症细胞和渗出的红细胞,部分血管内可见含铁血黄素的沉积。免疫组织化学检查结果表明,不同的免疫标志物(如CD31、CD34和CD8)显示SANT组织的血管结构非常复杂,包括小静脉、脾索型毛细血管和裂隙状血管,值得注意的是上皮细胞标志物未被检测到[5]。
组织病理学检查为脾脏SANT诊断的“金标准”,细针穿刺细胞学检查存在出血或脾破裂等并发症的风险,因此,临床上很少有行脾脏病灶细针穿刺细胞学检查的病例,特别是在无法确定病灶性质的情况下[6-7]。因此对脾脏行影像检查尤为重要。脾脏SANT多表现为单发肿块,偶尔可见多发[4, 8]。关于脾脏SANT超声、CT和MRI影像特征的研究较多,但关于18F-FDG PET/CT显像特征的报道较少见[6-8]。脾脏SANT超声多表现为脾脏内不均匀低回声肿块,彩色多普勒超声可见丰富的血流信号。CT平扫多表现为稍低密度结节或肿块,边缘光滑或呈分叶状;增强扫描可呈结节样、渐进性、向心性强化,动脉期及门静脉期相较正常脾脏实质密度降低,坏死、囊变、钙化较少见,典型病变可见“辐轮征”或“星芒征”,其中心的放射状低密度影为纤维组织。MRI的T1加权成像(weighted inmaging,WI)多呈等或稍低信号,T2WI多呈低信号,DWI呈低信号,中央纤维性瘢痕可呈延迟性强化[9-10]。
我们回顾了既往有关SANT患者 18F-FDG PET/CT表现的文献[7-8, 11–17],发现多数脾脏SANT患者的18F-FDG摄取较低且不均匀(呈结节样或环形),SUVmax为2.2~5.4,与恶性肿瘤的显像特征相反,可能与增生性纤维组织和致密的胶原纤维不摄取18F-FDG有关,这为SANT为良性病变提供了有力的证据,有助于其与恶性肿瘤的鉴别诊断。18F-FDG的摄取程度与血管瘤样结节中炎症细胞和含铁血黄素的巨噬细胞的数量有关[12],当脾脏肿瘤对18F-FDG摄取不高或稍高,且其他部位未见18F-FDG异常摄取时,应考虑SANT的可能[7]。
脾脏SANT应与血管瘤、错构瘤、淋巴瘤、转移瘤和血管肉瘤等相鉴别。血管瘤的影像特征:CT平扫呈等密度或低密度肿块,边缘较清晰,增强扫描动脉期呈结节样强化,随扫描时间延长呈向中心填充样强化;MRI的T1WI呈低信号或等信号,T2WI呈高信号,合并坏死、囊变、钙化和出血时信号不均匀;18F-FDG PET/CT显像示18F-FDG摄取与周围正常脾实质相仿或略低。错构瘤的影像特征:CT平扫表现为脾内或包膜下等或稍低密度肿块,少数伴有钙化或脂肪组织;MRI的T1WI呈等或混杂低信号,T2WI呈不均匀略高信号,抑脂序列呈低信号,明确脂肪成分存在对诊断有重要意义,增强MRI扫描早期呈弥漫不均匀斑块状强化,脂肪成分无强化;18F-FDG PET/CT显像示18F-FDG摄取多呈轻度增高。淋巴瘤的影像特征:CT平扫表现为脾脏局部或弥漫性增大,密度增高,可伴随囊变、坏死;MRI的T1WI呈等信号或等、低混合信号,无法与正常组织区分,弥漫型淋巴瘤增强MRI表现为脾肿大,其内区域呈高、低混合信号,肿块型淋巴瘤表现为低信号病灶,可多发,分布于整个脾脏,腹部淋巴结肿大有助于淋巴瘤的诊断;18F-FDG PET/CT显像示脾肿大伴18F-FDG摄取弥漫性增高或有局灶性增高灶。转移瘤的影像特征:CT平扫表现为多发性低密度占位性病变;MRI的T1WI呈稍低信号、T2WI呈稍高信号,增强MRI多表现为不同程度的环形强化,典型者可见“靶征”或“牛眼征”;18F-FDG PET/CT显像示全身多部位代谢增高灶。血管肉瘤的影像特征:CT平扫呈不均匀低密度肿块;MRI的T1WI呈稍低信号,T2WI呈高信号,病灶为圆形或椭圆形,边界不清,合并囊变、钙化、出血时信号多不均匀,动脉期呈轻度或明显不均匀环形强化,门静脉期及延迟期呈渐进性强化,有向中心逐渐填充的趋势,部分可见肝脏及其他远处转移;18F-FDG PET/CT显像示18F-FDG 代谢明显增高,内部可见出血、坏死。
脾脏上下极或远离脾门的良性占位行腹腔镜部分脾切除术是安全且有效的治疗方法,具有潜在的临床应用前景[18]。这种手术已被证明是治疗脾脏SANT的有效手段,且患者术后通常预后良好。迄今为止,鲜有文献报道复发或恶性转变的案例[12]。手术可能会提高脾切除术后感染等并发症发生的风险,因此,目前研究者尚未对病灶较小和无症状患者的治疗方式达成共识。
综上所述,脾脏SANT是一种罕见的良性增生性血管病变,其诊断依靠组织病理学检查结果,手术是其有效的治疗手段。当发现脾脏肿瘤对18F-FDG摄取不高,且其他部位未见18F-FDG异常摄取,在鉴别诊断时应考虑SANT的可能。
利益冲突 所有作者声明无利益冲突
作者贡献声明 黄文鹏负责论文的撰写与最终版本的修订;晁芳芳负责病例临床数据的收集与整理;李莉明负责图像的分析;高剑波负责论文的审阅;康磊负责论文的审阅与指导
脾脏硬化性血管瘤样结节性转化18F-FDG PET/CT显像2例
Sclerosing angiomatoid nodular transformation of the spleen in 18F-FDG PET/CT: two cases report
-
摘要: 脾脏硬化性血管瘤样结节性转化(SANT)是一种罕见的良性增生性血管病变,组织病理学检查为其诊断的“金标准”。笔者报道了2例行18F-氟脱氧葡萄糖(FDG) PET/CT显像的脾脏SANT病例,从临床、组织病理学、治疗、18F-FDG PET/CT显像等方面分析了该病的特点,并通过文献复习加深了对该病的认识,以充分认识SANT的诊断标准和影像学表现并进行准确诊断。Abstract: Sclerosing angiomatoid nodular transformation (SANT) of spleen is a rare benign proliferative vascular lesion, histopathology is the "gold standard" for diagnosis. The author reported two cases of splenic SANT with 18F-fluorodeoxyglucose (FDG) PET/CT imaging, and analyzed the clinical, histopathological, therapeutic, and 18F-FDG PET/CT imaging aspects of the disease and deepened the understanding of this disease through literature review. A full understanding of the diagnostic criteria and imaging manifestations of SANT can help to obtain more information and make an accurate diagnosis.
-
Key words:
-
-
[1] 侯珏, 黄丽萍. 常规超声及超声造影诊断脾硬化性血管瘤样结节性转化[J]. 中国医学影像技术, 2021, 37(12): 1806−1808. DOI: 10.13929/j.issn.1003-3289.2021.12.011.
Hou J, Huang LP. Ultrasonography and contrast-enhanced ultrasound for diagnosing sclerosing angiomatoid nodular transformation of spleen[J]. Chin J Med Imaging Technol, 2021, 37(12): 1806−1808. DOI: 10.13929/j.issn.1003-3289.2021. 12.011.[2] Martel M, Cheuk W, Lombardi L, et al. Sclerosing angiomatoid nodular transformation (SANT): report of 25 cases of a distinctive benign splenic lesion[J]. Am J Surg Pathol, 2004, 28(10): 1268−1279. DOI: 10.1097/01.pas.0000138004.54274.d3. [3] 罗永竞, 叶鹏, 缪洪飞, 等. 脾硬化性血管瘤样结节性转化合并症状性门静脉高压二例[J]. 中华放射学杂志, 2019, 53(1): 73−75. DOI: 10.3760/cma.j.issn.1005-1201.2019.01.015.
Luo YJ, Ye P, Miao HF, et al. An unusual portal hypertension caused by sclerosing angiomatoid nodular transformation: report of two cases[J]. Chin J Radiol, 2019, 53(1): 73−75. DOI: 10.3760/cma.j.issn.1005-1201.2019.01.015.[4] He CD, Yang W. Multifocal sclerosing angiomatoid nodular transformation of the spleen with splenomegaly and thrombocytopenia[J]. Balkan Med J, 2022, 39(1): 73−75. DOI: 10.4274/balkanmedj.galenos.2021.2021-8-14. [5] 刘周英, 杜俊, 张劲松, 等. 脾硬化性血管瘤样结节性转化3例临床病理学分析[J]. 中华病理学杂志, 2022, 51(8): 755−757. DOI: 10.3760/cma.j.cn112151-20220525-00449.
Liu ZY, Du J, Zhang JS, et al. Sclerosing angiomatoid nodular transformation of the spleen: a clinicopathological analysis of three cases[J]. Chin J Pathol, 2022, 51(8): 755−757. DOI: 10.3760/cma.j.cn112151-20220525-00449.[6] Vigorito R, Scaramuzza D, Pellegrinelli A, et al. Sclerosing angiomatoid nodular transformation (SANT) of the spleen: a case report on CT and MRI[J/OL]. BJR Case Rep, 2019, 5(2): 20180036[2022-11-27]. https://www.birpublications.org/doi/10.1259/bjrcr.20180036. DOI: 10.1259/bjrcr.20180036. [7] Nomura R, Tokumura H, Katayose Y, et al. Sclerosing angiomatoid nodular transformation of the spleen: lessons from a rare case and review of the literature[J]. Intern Med, 2019, 58(10): 1433−1441. DOI: 10.2169/internalmedicine.1948-18. [8] Feng YM, Huang YC, Tu CW, et al. Distinctive PET/CT features of splenic SANT[J]. Clin Nucl Med, 2013, 38(12): e465−e466. DOI: 10.1097/RLU.0b013e3182867581. [9] 韩丽珠, 李绪斌. 脾硬化性血管瘤样结节性转化的诊断分析[J]. 国际医学放射学杂志, 2017, 40(3): 326−329. DOI: 10.19300/j.2017.L5152.
Han LZ, Li XB. Diagnostic analysis of sclerosing angiomatoid nodular transformation of spleen[J]. Int J Med Radiol, 2017, 40(3): 326−329. DOI: 10.19300/j.2017.L5152.[10] 李蓉, 孙浩然. 脾硬化性血管瘤样结节性转化1例及文献复习[J]. 国际医学放射学杂志, 2018, 41(5): 590−593. DOI: 10.19300/j.2018.L6617.
Li R, Sun HR. Sclerosing angiomatoid nodular transformation of the spleen: a case report and literature review[J]. Int J Med Radiol, 2018, 41(5): 590−593. DOI: 10.19300/j.2018.L6617.[11] Lapa C, Steger U, Ritter CO, et al. Differentiation of an unclear splenic lesion in a patient with cholangiocarcinoma[J]. Clin Nucl Med, 2014, 39(5): 470−471. DOI: 10.1097/RLU.0000000000000403. [12] Imamura Y, Nakajima R, Hatta K, et al. Sclerosing angiomatoid nodular transformation (SANT) of the spleen: a case report with FDG-PET findings and literature review[J/OL]. Acta Radiol Open, 2016, 5(8): 2058460116649799[2022-11-27]. https://journals.sagepub.com/doi/10.1177/2058460116649799. DOI: 10.1177/2058460116649799. [13] Lee D, Wood B, Formby M, et al. F-18 FDG-avid sclerosing angiomatoid nodular transformation (SANT) of the spleen: case study and literature review[J]. Pathology, 2007, 39(1): 181−183. DOI: 10.1080/00313020601123904. [14] Koreishi AF, Saenz AJ, Fleming SE, et al. Sclerosing angiomatoid nodular transformation (SANT) of the spleen: a report of 3 cases[J]. Int J Surg Pathol, 2009, 17(5): 384−389. DOI: 10.1177/1066896909342568. [15] Subhawong TK, Subhawong AP, Kamel I. Sclerosing angiomatoid nodular transformation of the spleen: multimodality imaging findings and pathologic correlate[J]. J Comput Assist Tomogr, 2010, 34(2): 206−209. DOI: 10.1097/RCT.0b013e318 1bb4480. [16] Thacker C, Korn R, Millstine J, et al. Sclerosing angiomatoid nodular transformation of the spleen: CT, MR, PET, and 99mTc-sulfur colloid SPECT CT findings with gross and histopathological correlation[J]. Abdom Imaging, 2010, 35(6): 683−689. DOI: 10.1007/s00261-009-9584-x. [17] Kim HJ, Kim KW, Yu ES, et al. Sclerosing angiomatoid nodular transformation of the spleen: clinical and radiologic characteristics[J]. Acta Radiol, 2012, 53(7): 701−706. DOI: 10.1258/ar.2012.120180. [18] 李健, 赵龙栓, 邓毅磊. 脾脏硬化性血管瘤样结节性转化21例临床诊治分析及手术方案探讨[J]. 中华肝胆外科杂志, 2021, 27(5): 383−384. DOI: 10.3760/cma.j.cn113884-20200515-00271.
Li J, Zhao LS, Deng YL. Diagnosis, treatment and surgical plan analysis of 21 cases of spleen sclerosing angiomatoid nodular transformation[J]. Chin J Hepatob Surg, 2021, 27(5): 383−384. DOI: 10.3760/cma.j.cn113884-20200515-00271. -





 下载:
下载: