-
放疗在胸部肿瘤特别是肺癌患者中发挥着至关重要的作用,不管是早期不可手术切除肺癌的根治性治疗,还是可手术切除肺癌的联合治疗或者是晚期肺癌的姑息治疗,放疗都是重要的治疗方式之一[1-2]。然而辐射引起的放射性肺损伤又是胸部放疗最常见且最严重的剂量限制性不良反应,包括放射性肺炎和放射性肺纤维化,而放射性支气管炎在临床上并不常见,现将我院诊治的1例晚期肺癌患者经放疗后发生放射性支气管炎的结果结合文献复习报道如下。
-
患者男性,65岁,2021年2月因咳嗽、胸闷在中国人民解放军第305医院进行胸部CT检查,结果提示为左肺占位。电子支气管镜检查结果提示:左上叶固有支气管开口处见新生物,将管腔完全阻塞,并侵及左舌叶支气管开口,导致管腔狭窄。经活体组织病理学检查结果确诊为肺鳞癌,表皮生长因子受体(EGFR)基因、间变性淋巴瘤激酶(ALK)融合基因、ROS1融合基因等基因检测结果呈阴性, 程序化细胞死亡配体1(PD-L1)蛋白低表达(1%~5%)。经全身评估后诊断为左肺上叶鳞癌[T4N3M0(T4:肿瘤侵犯心脏;N3:锁骨上淋巴结有转移;M0:无远处转移)、Ⅲc期],给予多西他赛120 mg(第1天)+顺铂40 mg(第1~3天)全身化疗+帕博丽珠单抗200 mg(第1天)免疫治疗,21 d为1个周期,共治疗5个周期后,评估治疗效果为部分缓解。2021年8月于外院行胸部放疗15次(具体放疗方式、剂量不详),后每21天给予1次帕博丽珠单抗200 mg,维持治疗6个周期。患者既往有“腔隙性脑梗死、前列腺增生”病史。有吸烟史,吸烟指数45包/年。
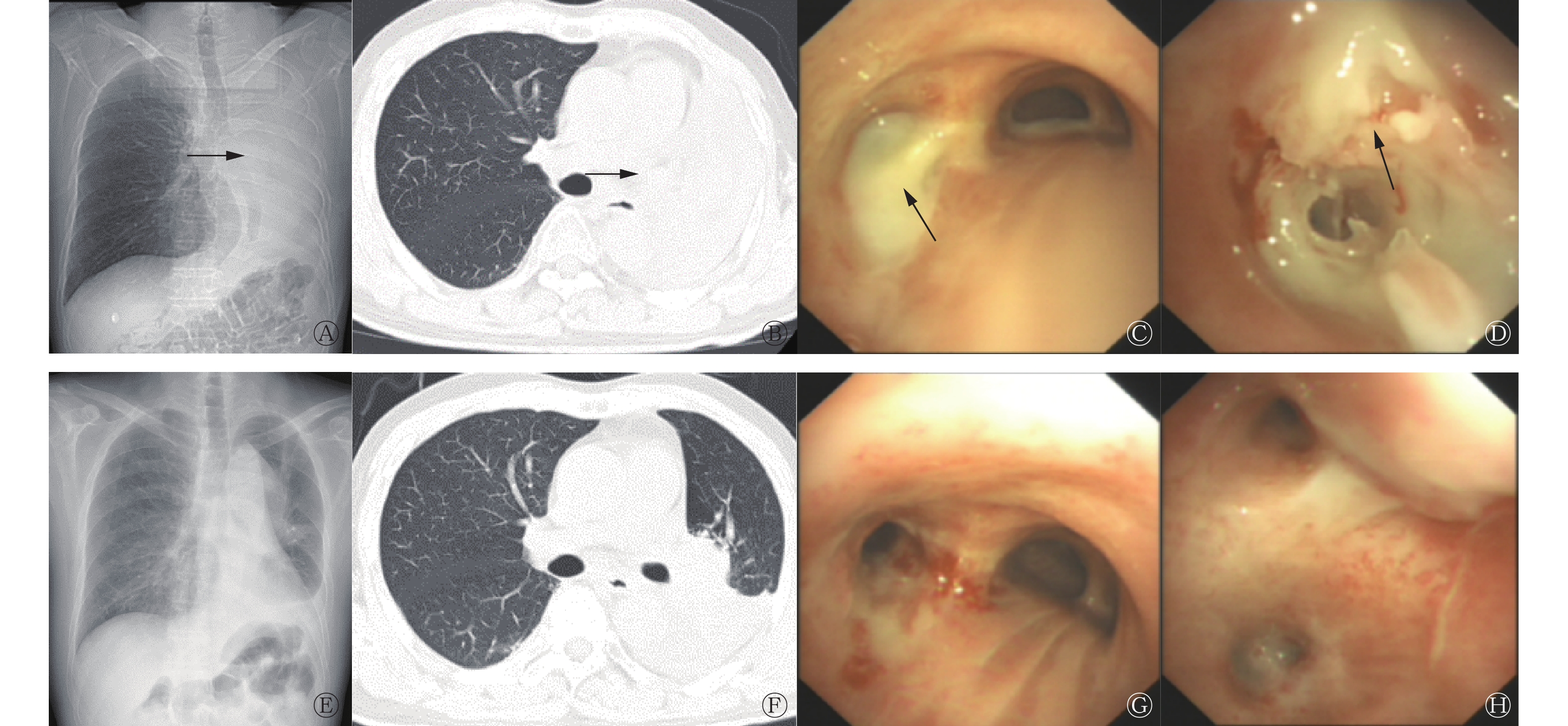
2022年3月21日患者行胸部X片检查,结果提示左肺完全不张(图1A),胸部CT检查结果示左侧主支气管阻塞伴左侧全肺不张(图1B),考虑为肿瘤进展。2022年3月23日行电子支气管镜检查,结果示左侧主支气管内大量白色胶冻样物质将管腔完全阻塞(图1C),给予一次性活检钳剥洋葱式清理,清理后见左肺上下叶支气管开口处被白色胶冻样物质阻塞(图1D)。予以活检钳反复多次清理后,左主支气管较前明显畅通(图1G),左肺上下叶支气管开口部分畅通(图1H)。复查胸片,结果示左肺上叶部分不张(图1E)。胸部CT结果显示,与镜下介入治疗前相比,左肺部分复张(图1F)。将清理的胶冻样物质送组织病理学检查,结果提示为纤维素样坏死组织(图2)。结合病史及组织病理学检查结果最终确诊为放射性支气管炎,给予支气管镜下活检钳反复多次清理治疗后,患者病情好转出院。

图 1 放射性支气管炎患者(男性,65岁)的X线、CT、支气管镜下表现图
Figure 1. X-ray, CT and bronchoscopy images of a patient (male, 65 years old) with radiation bronchitis

图 2 放射性支气管炎患者(男性,65岁)左侧主支气管胶冻样物质的组织病理学检查图(苏木精-伊红染色,×4)
Figure 2. Histopathological examination image of jelly like substance in left main bronchus of a patient (male, 65 years old) with radiation bronchitis (hematoxylin eosin staining, ×4)
随访:患者后因双侧锁骨上淋巴结进行性肿大、疼痛及左肺肿瘤病灶进展,给予白蛋白紫杉醇200 mg(第1、8天)+帕博丽珠单抗(可瑞达)200 mg(第1天)二线治疗,21 d为1个周期,共治疗3个周期,后肿瘤进展合并细菌性肺炎停止化疗及免疫治疗,给予对症支持治疗,患者于2022年11月27日死亡。
-
放射性肺损伤是由肺暴露于电离辐射下造成的,在早期可导致放射性肺炎,晚期可形成放射性肺纤维化;当射线累及气管、支气管时,可导致放射性支气管炎。放射性肺损伤的急性期多发生于放疗后1~2个月,慢性期往往发生于放疗9个月后。随着新型放疗技术的出现,如立体定向放疗、调强放疗等,放疗越来越精准,已大大降低了放射性肺损伤的发生率。有研究结果表明,接受精准胸部放疗的患者放射性肺损伤的发生率为10%~20%[1]。且随着支气管镜下消融技术的发展,如Nd:YAG激光治疗、氩等离子凝固术(氩气刀)、圈套电切术、冷冻治疗等,支气管内近距离放疗的需求下降,放射性支气管炎的发生鲜有报道。
放射性支气管炎临床上较少见,查阅国内外文献发现,关于放射性支气管炎发生的影响因素未见报道。放射性肺损伤的影响因素包括治疗相关因素、肿瘤相关因素、患者相关因素。治疗相关因素包括以下3个方面。(1)放疗:放疗技术、放射剂量学因素等与放射性肺损伤的发生率相关。适形调强放疗、立体定向放疗等新型放疗技术能更好地保护肺组织而减少肺损伤[2];Tsujino等[3]研究发现,肺总辐射剂量是引起放射性肺损伤的主要因素;肺平均辐射剂量为放射性肺损伤发生的最佳预测因子[4]。(2)化疗:化疗药物(如阿霉素、紫杉醇、博来霉素、环磷酰胺、长春新碱、丝裂霉素、吉西他滨等)联合放疗,更易导致肺损伤[5]。(3)免疫治疗:Antonia等[6]研究发现,放化疗结束后接受德瓦鲁单抗免疫治疗患者的肺炎和(或)放射性肺炎的发生率明显高于安慰剂组。肿瘤相关因素:肿瘤部位在肺中下段与放射性肺损伤的发生有更强的相关性[7];肿瘤组织学与放射性肺损伤之间的关系尚未见报道;肿瘤分期对放射性肺损伤的风险预测存在争议;肿瘤体积越大,对肺及周围组织的辐射体积越大,因此,影响放射性肺损伤发生的关键因素与肺辐射体积百分比有关[8]。患者相关因素:Zhao等[9]研究发现,高龄是胸部放疗后肺损伤发生的风险因子;性别与放射性肺损伤的关系尚未被证实;吸烟对接受放疗的患者具有保护作用[10];患者既往合并慢性阻塞性肺疾病、间质性肺疾病等可增加放射性肺损伤的发生率[11-12]。涂莉佳等[13]的研究结果显示,临床因素、治疗模式、遗传因素及功能肺的受照剂量等均为放射性肺损伤发生的危险因素。本病例为老年鳞癌患者,肿瘤分期为Ⅲc期,化疗序贯放疗,化疗方案采用多西他赛+顺铂+帕博丽珠单抗免疫治疗,放疗结束半年后发生放射性支气管炎,考虑是多种药物联合治疗导致了放射性支气管炎的发生。遗憾的是本例患者是在外院进行的15次放疗,其采用的放疗技术、剂量及肺辐射体积等放射参数与放射性支气管炎发生的相关性均不得而知。
支气管镜检查是诊断放射性支气管炎最直观、最重要的检查方法。Speiser和Spratling[14]将支气管镜下放射性支气管炎症的严重程度分为4级:1级为轻微的炎症、肿胀和薄的白膜;2级为白色纤维膜增加;3级为严重的炎症反应,伴有明显的膜性渗出物;4级为支气管炎症、纤维化导致管腔狭窄。Taulelle等[15]将放射性支气管炎分为5级,前4级与Speiser和Spratling[14]分级一致,5级为支气管壁坏死、瘘管形成。本例患者胸部影像学表现为左侧主支气管阻塞伴左肺完全不张。未行支气管镜检查前,结合既往病史考虑可能为肿瘤进展阻塞气道。支气管镜检查结果提示其气道内有白色胶冻样物质填充,经组织病理学检查结果确诊为放射性支气管炎。本例患者镜下已出现明显的渗出物,以致管腔狭窄、闭塞,经支气管镜下多次清理坏死物质,发现管壁增厚、管腔狭窄,按照Speiser和Spratling[14]的分级标准,本例患者的放射性支气管炎已发展至3~4级。Lee等[16]曾报道了1例给予高剂量支气管内近距离放疗的67岁左肺上叶肺癌患者,因持续咳嗽于34周时行支气管镜检查确诊为放射性支气管炎,患者于15个月后死于大咯血。大咯血和瘘管形成是放射性支气管炎最严重的分级。
放射性支气管炎的治疗以内镜下介入治疗为主,且治疗方式多样。利用一次性活检钳对病变部位进行反复清理是最简单易行的治疗方式,另外内镜下还有多种有创治疗方式,如氩气刀、冷冻治疗、微波治疗等。不管采用何种治疗方式,在操作的过程中,要注意把握活检钳或者各种探针对病灶进行剥离的方向及深浅,在保证安全的前提下最大程度地畅通气道,改善症状。本例患者支气管镜下左主支气管管腔已完全闭塞,予以活检钳反复清理,使得左主支气管、左下叶支气管基本畅通,左上叶本身由于肿瘤病变,未能进一步畅通。唐飞等[17]在支气管镜下介入治疗放射性气管支气管炎的临床疗效中观察到,镜下介入治疗可使气道通畅,气促指数、肺功能状况明显改善,且治疗安全可控,未出现大出血、气胸、穿孔、纵隔气肿等严重并发症。
通过对本例患者诊治过程的分析,我们认识到,当肺癌患者行放疗后出现胸闷、呼吸困难等症状时,除了要考虑放射性肺炎的可能,还要考虑有无放射性支气管炎的可能。支气管镜检查是最直观的诊断方式,支气管镜下介入治疗也是最直接有效的治疗方式。
利益冲突 所有作者声明无利益冲突
作者贡献声明 张令晖负责病例数据的收集与整理、医学随访、论文的起草与撰写;邓美玉负责论文的修改;于旭红负责病例影像及病理资料的收集与整理;徐巧玲负责论文设计的提出及最终版本的修订
肺癌放疗后致放射性支气管炎1例并文献复习
Radiation bronchitis after radiotherapy of lung cancer: a case report and literature review
-
摘要: 笔者报道了1例左肺鳞癌放疗后发生放射性支气管炎的少见病例,该病例经电子支气管镜检查确诊并行支气管镜下介入治疗。笔者分析了放射性支气管炎发生的影响因素,内镜下的诊断及治疗情况,并进行了文献复习。通过对该病例的治疗,以期分享该类型病例内镜下诊断和治疗的经验。Abstract: The authors reported a rare case of radiation bronchitis after radiotherapy of left lung squamous cell carcinoma. The case was confirmed by electronic Bronchoscopy and treated by interventional bronchoscopy. The authors analyzed the influencing factors of radiation bronchitis, endoscopic diagnosis and treatment, and reviewed the literature. Through the treatment of this case, the authors hoped to share experience in endoscopic diagnosis and treatment of this type of case.
-
Key words:
-
-
[1] von Reibnitz D, Yorke ED, Oh JH, et al. Predictive modeling of thoracic radiotherapy toxicity and the potential role of serum alpha-2-macroglobulin[J/OL]. Front Oncol, 2020, 10: 1395[2022-11-01]. https://www.frontiersin.org/articles/10.3389/fonc.2020.01395/full. DOI: 10.3389/fonc.2020.01395. [2] 喻冰琪, 王谨, 徐裕金, 等. 放疗技术与放射性肺损伤: 高剂量小体积还是低剂量大体积?[J]. 中国肺癌杂志, 2015, 18(12): 752−757. DOI: 10.3779/j.issn.1009-3419.2015.12.07.
Yu BQ, Wang J, Xu YJ, et al. Radiotherapy techniques and radiation pneumonitis: a lot to a little or a little to a lot?[J]. Chin J Lung Cancer, 2015, 18(12): 752−757. DOI: 10.3779/j.issn.1009-3419.2015.12.07.[3] Tsujino K, Hashimoto T, Shimada T, et al. Combined analysis of V20, VS5, pulmonary fibrosis score on baseline computed tomography, and patient age improves prediction of severe radiation pneumonitis after concurrent chemoradiotherapy for locally advanced non-small-cell lung cancer[J]. J Thorac Oncol, 2014, 9(7): 983−990. DOI: 10.1097/JTO.0000000000000187. [4] Harder EM, Park HS, Chen Z, et al. Pulmonary dose-volume predictors of radiation pneumonitis following stereotactic body radiation therapy[J]. Pract Radiat Oncol, 2016, 6(6): e353−e359. DOI: 10.1016/j.prro.2016.01.015. [5] Bielopolski D, Evron E, Moreh-Rahav O, et al. Paclitaxel-induced pneumonitis in patients with breast cancer: case series and review of the literature[J]. J Chemother, 2017, 29(2): 113−117. DOI: 10.1179/1973947815Y.0000000029. [6] Antonia SJ, Villegas A, Daniel D, et al. Durvalumab after chemoradiotherapy in stage Ⅲ non-small-cell lung cancer[J]. N Engl J Med, 2017, 377(20): 1919−1929. DOI: 10.1056/NEJMoa1709937. [7] Kong FMS, Wang SL. Nondosimetric risk factors for radiation-induced lung toxicity[J]. Semin Radiat Oncol, 2015, 25(2): 100−109. DOI: 10.1016/j.semradonc.2014.12.003. [8] Ren CB, Ji TL, Liu TT, et al. The risk and predictors for severe radiation pneumonitis in lung cancer patients treated with thoracic reirradiation[J/OL]. Radiat Oncol, 2018, 13(1): 69[2022-11-01]. https://ro-journal.biomedcentral.com/articles/10.1186/s13014-018-1016-z. DOI: 10.1186/s13014-018-1016-z. [9] Zhao J, Yorke ED, Li L, et al. Simple factors associated with radiation-induced lung toxicity after stereotactic body radiation therapy of the thorax: a pooled analysis of 88 studies[J]. Int J Radiat Oncol Biol Phys, 2016, 95(5): 1357−1366. DOI: 10.1016/j.ijrobp.2016.03.024. [10] Jin HK, Tucker SL, Liu HH, et al. Dose-volume thresholds and smoking status for the risk of treatment-related pneumonitis in inoperable non-small cell lung cancer treated with definitive radiotherapy[J]. Radiother Oncol, 2009, 91(3): 427−432. DOI: 10.1016/j.radonc.2008.09.009. [11] Inoue T, Shiomi H, Oh RJ. Stereotactic body radiotherapy for stage Ⅰ lung cancer with chronic obstructive pulmonary disease: special reference to survival and radiation-induced pneumonitis[J]. J Radiat Res, 2015, 56(4): 727−734. DOI: 10.1093/jrr/rrv019. [12] Ozawa Y, Abe T, Omae M, et al. Impact of preexisting interstitial lung disease on acute, extensive radiation pneumonitis: retrospective analysis of patients with lung cancer[J/OL]. PLoS One, 2015, 10(10): e0140437[2022-11-01]. https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0140437. DOI: 10.1371/journal.pone.0140437. [13] 涂莉佳, 郑泰浩, 廖荣鑫, 等. 肺癌患者放射性肺损伤相关危险因素的研究进展[J]. 重庆医学, 2022, 51(7): 1224−1229. DOI: 10.3969/j.issn.1671-8348.2022.07.029.
Tu LJ, Zheng TH, Liao RX, et al. Research progress on risk factors associated with radiation-induced lung injury in lung cancer patients[J]. Chongqing Med, 2022, 51(7): 1224−1229. DOI: 10.3969/j.issn.1671-8348.2022.07.029.[14] Speiser BL, Spratling L. Radiation bronchitis and stenosis secondary to high dose rate endobronchial irradiation[J]. Int J Radiat Oncol Biol Phys, 1993, 25(4): 589−597. DOI: 10.1016/0360-3016(93)90003-e. [15] Taulelle M, Chauvet B, Vincent P, et al. High dose rate endobronchial brachytherapy: results and complications in 189 patients[J]. Eur Respir J, 1998, 11(1): 162−168. DOI: 10.1183/09031936.98.11010162. [16] Lee SJ, Lee JY, Jung SH, et al. A case of radiation bronchitis induced massive hemoptysis after high-dose-rate endobronchial brachytherapy[J]. Tuberc Respir Dis, 2012, 73(6): 325−330. DOI: 10.4046/trd.2012.73.6.325. [17] 唐飞, 吕莉萍, 叶伟, 等. 支气管镜下介入治疗放射性气管支气管炎的临床疗效[J]. 安徽医学, 2017, 38(12): 1585−1587. DOI: 10.3969/j.issn.1000-0399.2017.12.025.
Tang F, Lyv LP, Ye W, et al. Clinical effect of interventional treatment of radiation tracheobronchitis under bronchoscope[J]. Anhui Med J, 2017, 38(12): 1585−1587. DOI: 10.3969/j.issn.1000-0399.2017.12.025. -





 下载:
下载: