-
肺癌是在中国乃至全世界发病率最高的恶性肿瘤,也是癌症患者死亡的首要原因[1]。在肺癌的所有病理类型中,非小细胞肺癌(non-small cell lung cancer,NSCLC)约占80%[2],70%的NSCLC患者在初诊时已进展到中晚期,数据显示,中晚期NSCLC患者的5年生存率仅为16%[3]。目前,化疗及分子靶向药物治疗已成为此类患者的主要治疗手段[4],在一定程度上可以控制疾病的进展,对患者的生存期及生存率有一定的积极影响。然而在实际临床工作中,患者发生获得性耐药从而导致病情进展的情况难以避免,这就促使临床工作者开始寻求其他有效的治疗手段[5]。近年来,肿瘤的免疫疗法兴起,其对NSCLC具有良好的治疗效果[6],其中以程序性死亡受体1(programmed death-1,PD-1)/程序性死亡受体配体1(programmed death-ligand 1,PD-L1)为代表的免疫检查点抑制剂在临床治疗中表现出良好的疗效[7]。
PD-L1作为一种跨膜糖蛋白,由290个氨基酸组成,属于B7-28超家族成员,PD-L1蛋白可在乳腺癌和NSCLC等多种恶性肿瘤细胞中过表达[8-9]。18F-FDG PET/CT作为一种将功能代谢显像与解剖结构显像相结合的影像检查方法,既能获得肿瘤组织结构的解剖信息,又可通过量化葡萄糖代谢获得肿瘤组织的代谢信息,其将PET与CT的优劣势互补,广泛应用于恶性肿瘤的诊断、疗效评价及预后评估[10]。本研究主要通过对NSCLC病灶PD-L1蛋白的表达水平与18F-FDG PET/CT的代谢指标进行分析,探讨二者之间是否存在一定的关系。
-
回顾性分析2020年1月至2021年7月在青岛大学第三临床医学院(青岛市市立医院)行18F-FDG PET/CT检查的55例初诊NSCLC患者的临床资料,其中男性34例、女性21例,年龄(66.5±9.3)岁,所有患者均于18F-FDG PET/CT检查后一周内获取组织病理学检查(穿刺活体检查11例、手术44例)结果,其中腺癌42例、鳞癌13例。根据国际肺癌研究协会(IASLC)制订的第8版肺癌分期标准[11],本组患者中T1期36例、>T1期19例。
纳入标准:(1)治疗前均行18F-FDG PET/CT检查;(2)年龄≥18岁;(3)穿刺活体检查或手术后组织病理学检查结果证实为NSCLC并进行PD-L1免疫组织化学检测;(4)治疗过程完整。排除标准:(1)既往有其他恶性肿瘤病史;(2)伴有糖尿病;(3)妊娠或哺乳期女性。
所有患者均于检查前签署了知情同意书。本研究符合《赫尔辛基宣言》的原则。
-
所有患者均采用美国GE公司生产的Discovery 710 Clarity PET/CT进行显像。显像前,患者均禁食6 h以上,控制血糖水平为4.0~8.0 mmol/L,经手背静脉注射18F-FDG(3.7 MBq/kg),暗室安静休息45~60 min,嘱患者排尿后行常规PET/CT检查。扫描范围从头顶至大腿中段(必要时加做双下肢扫描)。CT扫描电压为120 kV,电流为100 mA。PET扫描通常为7~8个床位,每个床位采集时间为1~2 min,采集方式为三维模式。应用CT数据进行衰减校正,采用迭代法进行重建,获得全身PET、CT及PET/CT融合图像。找到肺癌原发病灶,人工设置参数,系统勾画ROI,通过系统自带软件(PET VCAR)处理ROI,获得原发病灶SUV,取其平均值(SUVmean)和最大值(SUVmax);依据肿瘤PET/CT显像EANM指南2.0版[12]推荐,将41%SUVmax作为阈值获得肿瘤代谢体积(metabolic tumor volume,MTV),MTV与SUVmean相乘获得病灶糖酵解总量(total lesion glycolysis,TLG)。
-
采用免疫组织化学方法对NSCLC组织进行PD-L1的免疫组织化学染色。由2名副主任及以上级别的病理科医师对所有染色切片进行独立评估。选取高倍镜下(×400)具有代表性的10个视野,每个视野计数100个肿瘤细胞,计算PD-L1蛋白表达阳性的肿瘤细胞比例分数(tumor proportion score,TPS),以此来分析NSCLC细胞PD-L1蛋白的表达情况。以PD-L1蛋白表达阳性的TPS=1%为临界值,将患者分为PD-L1蛋白表达阳性组(TPS≥1%)和阴性组(TPS<1%);以PD-L1蛋白表达阳性的TPS=50%为临界值,将阳性组患者分为PD-L1高表达组(TPS≥50%)和低表达组(1%≤TPS<50%)。
-
采用SPSS 24.0软件进行统计学分析,符合正态分布的计量资料以
$\bar x\pm s $ 表示,组间比较采用两独立样本t检验;不符合正态分布的计量资料以M(Q1,Q3)表示;计数资料以频数(百分比)表示,组间比较采用卡方检验;对病灶SUVmax与PD-L1蛋白表达情况的关系行Pearson相关分析;对病灶TLG和MTV与PD-L1蛋白表达情况的关系行Spearman秩相关分析。勾画ROC曲线,以SUVmax的最佳临界值将入组患者分为高SUVmax组与低SUVmax组,观察2组的PD-L1蛋白表达情况。P<0.05为差异有统计学意义。 -
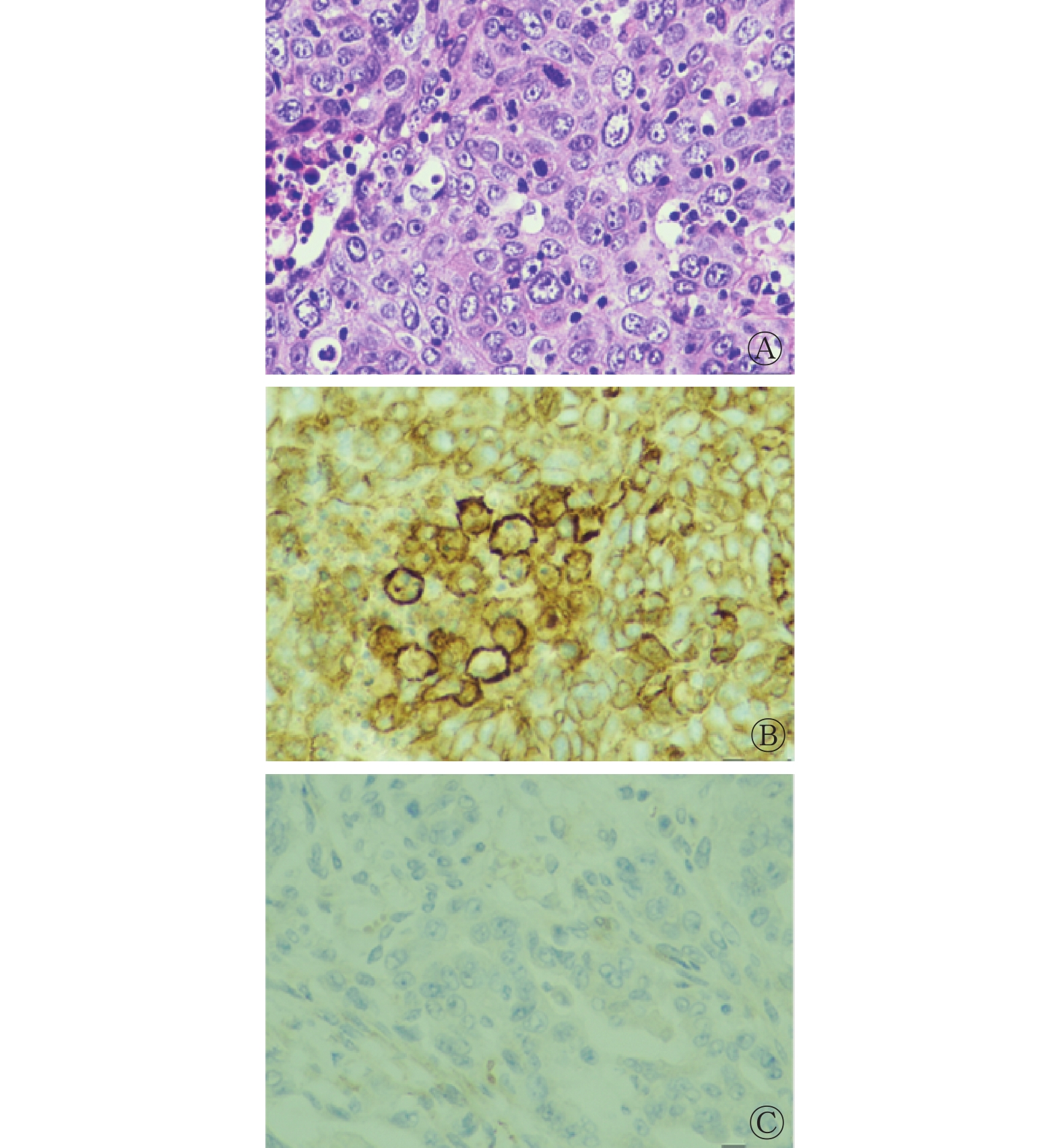
本研究中入组的55例NSCLC患者的肺结节均为实性结节;有肺门及纵隔高代谢淋巴结者31例、无肺门及纵隔高代谢淋巴结者24例;原发灶分期中,T1期36例、T2期12例、T3期3例、T4期4例;临床分期中,Ⅰ期10例、Ⅱ期31例、Ⅲ期8例、Ⅳ期6例。根据PD-L1蛋白表达情况进行的分组结果:PD-L1阳性组34例、阴性组21例,腺癌患者PD-L1蛋白表达阳性率为50.00%(21/42),鳞癌患者PD-L1蛋白表达阳性率为100%(13/13);PD-L1阳性组患者中,PD-L1蛋白高表达组13例、低表达组21例,高表达组中腺癌患者占38.46%(5/13),鳞癌患者占61.54%(8/13)。典型病例的组织病理学检查图见图1。

图 1 非小细胞肺癌患者(男性,70岁,TPS=90%)的组织病理学检查图
Figure 1. Histopathological examination images of non-small cell lung cancer patient (male, 70 years old, TPS=90%)
由表1可知,存在肺门及纵隔高代谢淋巴结的患者PD-L1蛋白表达阳性率高于无肺门及纵隔高代谢淋巴结的患者,且差异有统计学意义(χ2=10.668,P=0.001);而患者PD-L1蛋白表达情况在不同性别、年龄、癌组织是否累及胸膜以及肿瘤原发灶分期亚组之间的差异均无统计学意义(χ2=0.083~2.902,均P>0.05)。
一般资料 PD-L1蛋白表达情况[例(%)] χ2值 P值 阳性 阴性 年龄(岁) 0.083 0.774 ≥60 30(55) 14(25) <60 4(7) 7(13) 性别 2.902 0.088 男 24(44) 10(18) 女 10(18) 11(20) 有无肺门及纵隔高代谢淋巴结 10.668 0.001 有 25(45) 6(11) 无 9(17) 15(27) 癌组织是否累及胸膜 2.006 0.157 是 7(13) 8(14) 否 27(49) 13(24) 肿瘤原发灶分期 0.536 0.464 T1期 21(38) 15(27) >T1期 13(24) 6(11) 注:PD-L1为程序性死亡受体配体1 表 1 55例非小细胞肺癌患者的一般资料及其与PD-L1蛋 白表达之间的相关性
Table 1. General information of 55 patients with non-small cell lung cancer and its correlation with programmed death-ligand 1 protein expression
-
55例患者中,PD-L1蛋白表达阳性组的SUVmax为12.58±6.35,阴性组为5.60±4.83,阳性组SUVmax高于阴性组,且差异有统计学意义(t=2.576,P<0.05)。由图2可见,当SUVmax=5.15时,约登指数(灵敏度+特异度−1)最大(0.520),灵敏度和特异度分别为85.3%和66.7%。以SUVmax=5.15为临界值,高SUVmax组36例、低SUVmax组19例,高SUVmax组患者PD-L1蛋白表达阳性率为80.56%(29/36),PD-L1蛋白表达阳性的TPS为12.50%±3.21%;低SUVmax组患者PD-L1蛋白表达阳性率为28.16%(5/19),PD-L1蛋白表达阳性的TPS为1.28%±0.46%;高SUVmax组患者PD-L1蛋白表达阳性率及TPS均更高,且差异均有统计学意义(χ2=15.500,t=2.671,均P<0.05)。Pearson相关分析结果显示,病灶SUVmax与PD-L1蛋白表达阳性的TPS呈正相关(r=0.604,P<0.001)。典型病例的18F-FDG PET/CT图像见图3。
-
55例患者的原发病灶的MTV和TLG分别为3.66(1.35,11.07)cm3和16.20(5.20,72.30) g,PD-L1蛋白表达阳性组的MTV及TLG分别为5.46(1.68,12.70) cm3和37.65(8.73,94.18) g,阴性组分别为1.56(0.71,6.00) cm3和5.90(3.55,40.75) g,Spearman秩相关分析结果显示,MTV和TLG与PD-L1蛋白表达阳性的TPS均无相关性(r=0.083,P=0.563;r=0.102,P=0.476)。
-
葡萄糖是细胞的能量来源,18F-FDG作为PET/CT常用的显像剂,属于葡萄糖类似物,其被注入人体后可以被细胞摄取,从而起到显像的作用[13]。相关研究结果显示,多种细胞层面分子机制导致肿瘤细胞对葡萄糖的摄取增加,而葡萄糖经糖酵解后无法进行进一步反应,因此18F-FDG滞留于肿瘤细胞中,达到了肿瘤显像的目的[14]。临床上一般采用PET/CT代谢指标中的SUVmax来评价恶性肿瘤病灶的代谢情况,另外,MTV和TLG也可以在一定程度上反映恶性肿瘤的代谢情况。18F-FDG PET/CT既具有PET所独有的显示病灶代谢情况的优势,又具有CT可以显示病灶解剖结构及与周围结构的位置关系的优势,二者互补,使得18F-FDG PET/CT可以对早期恶性肿瘤组织进行准确诊断及明确分期,并且对恶性肿瘤放疗中靶区的勾画与确定亦起着重要作用[15]。有研究结果显示,NSCLC患者术前PET/CT代谢指标(SUVmax)以及原发灶PD-L1蛋白表达阳性的TPS均为单因素分析中与NSCLC预后呈负相关的因素,PD-L1蛋白表达阳性且SUVmax≥3.0的患者的预后最差,因此,结合原发灶PD-L1蛋白的表达情况以及术前PET/CT SUVmax,有助于对NSCLC患者的预后进行评估[16]。由此可见,18F-FDG PET/CT在晚期NSCLC患者的诊疗中起着重要作用。
NSCLC的发生发展机制复杂,目前尚不明确。有研究者认为,NSCLC的发生发展与许多原癌基因的激活及抑癌基因的失活密切相关[17-18]。人PD-1基因主要定位于9号染色体上,在人体免疫细胞中广泛表达,参与人体的自身免疫耐受,PD-L1是PD-1的配体,是负性共刺激因子,可以与PD-1结合,调控T细胞活性,PD-L1在多种肿瘤细胞中高表达,肿瘤细胞借助PD-1/PD-L1信号通路逃避T细胞的免疫作用[19]。因此,阻断PD-1/PD-L1通路在晚期NSCLC患者中显示出明显的抗肿瘤作用,该通路被认为是新的免疫治疗药物及联合治疗的明确靶点。本研究结果表明,NSCLC患者中PD-L1蛋白表达阳性组的SUVmax比阴性组明显升高,且差异有统计学意义(P<0.05),并且病灶的SUVmax与PD-L1蛋白表达阳性的TPS呈正相关(r=0.604,P<0.001),其原因可能是PD-L1与NSCLC细胞的快速增殖及细胞内磷酸化酶的活性增加等因素有关。而NSCLC病灶的PET/CT代谢指标TLG和MTV与PD-L1蛋白表达阳性的TPS未见明显相关性。由此得出,SUVmax可以作为PD-L1蛋白表达阳性的TPS的独立预测因素,这与Wu等[20]的研究结果一致。MTV与具有高代谢的原发病灶的体积有关,而原发病灶的体积与患者的发病时间长短及病情进展程度有关,具有个体差异,因此,MTV与PD-L1蛋白表达阳性的TPS无相关性;TLG为病灶MTV与SUVmean的乘积,由于MTV与PD-L1蛋白的表达无相关性,其再与另一个代谢指标(SUVmean)相乘,数值的离散程度更大,因此,TLG与病灶PD-L1蛋白的表达之间亦无相关性。上述结果表明,通过SUVmax能够初步预测NSCLC病灶的PD-L1蛋白表达的阴阳性及表达阳性的TPS。
本研究具有一定的局限性。(1)PD-L1蛋白的检测方法多样,目前已有5种单克隆抗体用于检测,分别为基于Dako平台的22C3、28-8和73-10以及基于Vantana平台的SP142和SP263。有研究结果显示,不同的免疫组织化学方法可能会影响检测的准确性[21]。(2)本研究为单一机构开展的回顾性分析,结果仍需要多中心研究进行进一步验证。
综上所述,NSCLC病灶18F-FDG PET/CT代谢指标SUVmax与PD-L1蛋白表达阳性的TPS呈正相关,通过病灶SUVmax可以初步预测PD-L1蛋白表达阳性的TPS,从而为PD-L1蛋白表达阳性的NSCLC患者的免疫治疗提供PET/CT代谢方面所特有的临床信息。
利益冲突 所有作者声明无利益冲突
作者贡献声明 刘建宇负责数据的收集、论文的撰写;郑飞波负责论文的审阅及最终版本的修订;朱宗平负责研究命题的提出与设计;石德道负责文献的查阅与整理
非小细胞肺癌PD-L1蛋白表达与18F-FDG PET/CT代谢指标的关系研究
Relationship between PD-L1 protein expression and 18F-FDG PET/CT metabolic markers in non-small cell lung cancer
-
摘要:
目的 探讨非小细胞肺癌(NSCLC)组织中程序性死亡配体1(PD-L1)蛋白表达与18F-氟脱氧葡萄糖(FDG) PET/CT代谢指标之间的关系,为NSCLC的免疫治疗提供PET/CT代谢层面的理论依据。 方法 回顾性收集并分析2020年1月至2021年7月于青岛大学第三临床医学院(青岛市市立医院)行18F-FDG PET/CT检查并被组织病理学检查(穿刺活体检查或手术)结果证实的55例NSCLC患者的临床资料,其中男性34例、女性21例,年龄(66.5±9.3)岁。 18F-FDG PET/CT检查于治疗前进行,采用PET体积计算机辅助判读图像处理系统对肺癌原发病灶行代谢指标的测定,包括最大标准化摄取值(SUVmax)、病灶糖酵解总量(TLG)和肿瘤代谢体积(MTV)。以PD-L1蛋白表达阳性的肿瘤细胞比例分数(TPS)=1%为临界值,将患者分为PD-L1蛋白表达阳性组(TPS≥1%)和阴性组(TPS<1%);以PD-L1蛋白表达阳性的TPS=50%为临界值,将阳性组患者分为PD-L1蛋白高表达组(TPS≥50%)和低表达组(1%≤TPS<50%)。符合正态分布的计量资料的组间比较采用两独立样本t检验;计数资料的组间比较采用卡方检验;对病灶SUVmax与PD-L1蛋白表达情况的关系行Pearson相关分析;对病灶TLG和MTV与PD-L1蛋白表达情况的关系行Spearman秩相关分析。勾画受试者工作特征(ROC)曲线,以SUVmax的最佳临界值将入组患者分为高SUVmax组与低SUVmax组,观察2组的PD-L1蛋白表达情况。 结果 NSCLC病灶SUVmax与PD-L1蛋白表达阳性的TPS呈正相关(r=0.604,P<0.001);而MTV和TLG与TPS均无相关性(r=0.083、0.102,均P>0.05)。55例患者中,PD-L1蛋白表达阳性组34例、阴性组21例,阳性组SUVmax高于阴性组(12.58±6.35 对 5.60±4.83,t=2.576,P<0.05)。ROC曲线结果显示,以SUVmax=5.15为最佳临界值,高SUVmax组36例、低SUVmax组19例,2组PD-L1蛋白表达阳性率分别为80.56%(29/36)和28.16%(5/19),PD-L1蛋白表达阳性的TPS分别为12.50%±3.21%和1.28%±0.46%,高SUVmax组患者PD-L1蛋白表达阳性率及TPS均更高,且差异均有统计学意义(χ2=15.500,t=2.671,均P<0.05)。 结论 NSCLC患者18F-FDG PET/CT中SUVmax与PD-L1蛋白表达阳性的TPS呈正相关,可为NSCLC的免疫治疗提供依据。 -
关键词:
- 癌,非小细胞肺 /
- B7-H1抗原 /
- 正电子发射断层显像术 /
- 体层摄影术,X线计算机 /
- 最大标准化摄取值 /
- 肿瘤代谢体积 /
- 病灶糖酵解总量
Abstract:Objective To investigate the relationship between programmed death-ligand 1 (PD-L1) protein expression in non-small cell lung cancer (NSCLC) tissues and 18F-fluorodeoxyglucose (FDG) PET/CT metabolic markers and to provide theoretical basis for NSCLC immunotherapy on PET/CT metabolic level. Methods The clinical data of 55 patients with NSCLC who underwent 18F-FDG PET/CT from January 2020 to July 2021 in Third Clinical Medical College of Qingdao University (Qingdao Municipal Hospital) and confirmed by histopathological examination (biopsy or surgery) were retrospectively collected and analyzed, including 34 males and 21 females, aged (66.5±9.3) years. 18F-FDG PET/CT examination was performed before treatment. The metabolic parameters of primary lung cancer lesions were measured using the PET volume computed assisted reading (VCAR) image processing system, including maximum standardized uptake value (SUVmax), total lesion glycolysis (TLG), and metabolic tumor volume (MTV). Taking the tumor proportion score (TPS) of tumor cells with a positive PD-L1 protein expression=1% as the threshold, patients were divided into positive PD-L1 protein expression group (TPS≥1%) and negative group (TPS<1%). With the threshold of TPS=50% for PD-L1 protein expression, patients in the positive group were divided into high PD-L1 protein expression group (TPS≥50%) and low expression group (1%≤TPS<50%). Two independent sample t-test was performed for the intergroup comparison of measurement data in accordance with normal distribution. Chi-square test was conducted for the intergroup comparison of counting data. Pearson correlation analysis was performed on the relationship between SUVmax and PD-L1 protein expression in lesions. Spearman rank correlation analysis was conducted on the relationship among TLG, MTV, and PD-L1 protein expression in lesions. The receiver operating characteristic (ROC) curve was drawn. Enrolled patients were divided into high and low SUVmax groups on the basis of the optimal critical value of SUVmax. PD-L1 protein expression was observed in both groups. Results A positive correlation was found between SUVmax and TPS of tumor cells with a positive PD-L1 protein expression in NSCLC lesions (r=0.604, P<0.001); no correlation was observed between MTV, TLG, and TPS (r=0.083, 0.102, both P>0.05). Among 55 patients, 34 were in the positive PD-L1 protein expression group and 21 in the negative group. The SUVmax in the positive group was higher than that in the negative group (12.58±6.35 vs. 5.60±4.83, t=2.576, P<0.05). The ROC curve results revealed that with SUVmax=5.15 as the optimal critical value, 36 cases were found in the high SUVmax group and 19 cases in the low SUVmax group. The positive expression rates of PD-L1 protein in the two groups were 80.56% (29/36) and 28.16% (5/19). The TPS of tumor cells with a positive PD-L1 protein expression were 12.50%±3.21% and 1.28%±0.46%, respectively. Patients in the high SUVmax group had a higher positive expression rates of PD-L1 protein and TPS, and the differences were statistically significant (χ2=15.500, t=2.671, both P<0.05). Conclusion A positive correlation is found between SUVmax in 18F-FDG PET/CT and TPS of tumor cells with a positive PD-L1 protein expression in patients with NSCLC, which can provide evidence for NSCLC immunotherapy. -
表 1 55例非小细胞肺癌患者的一般资料及其与PD-L1蛋 白表达之间的相关性
Table 1. General information of 55 patients with non-small cell lung cancer and its correlation with programmed death-ligand 1 protein expression
一般资料 PD-L1蛋白表达情况[例(%)] χ2值 P值 阳性 阴性 年龄(岁) 0.083 0.774 ≥60 30(55) 14(25) <60 4(7) 7(13) 性别 2.902 0.088 男 24(44) 10(18) 女 10(18) 11(20) 有无肺门及纵隔高代谢淋巴结 10.668 0.001 有 25(45) 6(11) 无 9(17) 15(27) 癌组织是否累及胸膜 2.006 0.157 是 7(13) 8(14) 否 27(49) 13(24) 肿瘤原发灶分期 0.536 0.464 T1期 21(38) 15(27) >T1期 13(24) 6(11) 注:PD-L1为程序性死亡受体配体1 -
[1] Ferlay J, Colombet M, Soerjomataram I, et al. Estimating the global cancer incidence and mortality in 2018: GLOBOCAN sources and methods[J]. Int J Cancer, 2019, 144(8): 1941−1953. DOI: 10.1002/ijc.31937. [2] Hsu WH, Yang JCH, Mok TS, et al. Overview of current systemic management of EGFR-mutant NSCLC[J]. Ann Oncol, 2018, 29 Suppl 1: Si3−i9. DOI: 10.1093/annonc/mdx702. [3] Valente IRS, Cortez PC, Neto EC, et al. Automatic 3D pulmonary nodule detection in CT images: a survey[J]. Comput Methods Programs Biomed, 2016, 124: 91−107. DOI: 10.1016/j.cmpb.2015.10.006. [4] Ruiz-Cordero R, Devine WP. Targeted therapy and checkpoint immunotherapy in lung cancer[J]. Surg Pathol Clin, 2020, 13(1): 17−33. DOI: 10.1016/j.path.2019.11.002. [5] Schabath MB, Cote ML. Cancer progress and priorities: lung cancer[J]. Cancer Epidemiol Biomarkers Prev, 2019, 28(10): 1563−1579. DOI: 10.1158/1055-9965.epi-19-0221. [6] Broderick SR. Adjuvant and neoadjuvant immunotherapy in non-small cell lung cancer[J/OL]. Thorac Surg Clin, 2020, 30(2): 215−220[2022-09-20]. https://www.thoracic.theclinics.com/article/S1547-4127(20)30001-3/fulltext. DOI: 10.1016/j.thorsurg.2020.01.001. [7] Fehrenbacher L, Spira A, Ballinger M, et al. Atezolizumab versus docetaxel for patients with previously treated non-small-cell lung cancer (POPLAR): a multicentre, open-label, phase 2 randomised controlled trial[J]. Lancet, 2016, 387(10030): 1837−1846. DOI: 10.1016/s0140-6736(16)00587-0. [8] Ai LY, Xu AT, Xu J. Roles of PD-1/PD-L1 pathway: signaling, cancer, and beyond[M]//Xu J. Regulation of cancer immune checkpoints. Singapore: Springer, 2020: 33−59. DOI: 10.1007/978-981-15-3266-5_3. [9] Ohaegbulam KC, Assal A, Lazar-Molnar E, et al. Human cancer immunotherapy with antibodies to the PD-1 and PD-L1 pathway[J]. Trends Mol Med, 2015, 21(1): 24−33. DOI: 10.1016/j.molmed.2014.10.009. [10] Bar-Shalom R, Rosengarten O, Heching N, et al. FDG PET/CT for treatment response assessment in cancer[J/OL]. Harefuah, 2021, 160(7): 462−467[2022-09-20]. https://pubmed.ncbi.nlm.nih.gov/34263575. [11] Goldstraw P, Chansky K, Crowley J, et al. The IASLC lung cancer staging project: proposals for revision of the TNM stage groupings in the forthcoming (Eighth) edition of the TNM classification for lung cancer[J]. J Thorac Oncol, 2016, 11(1): 39−51. DOI: 10.1016/j.jtho.2015.09.009. [12] Boellaard R, Delgado-Bolton R, Oyen WJG, et al. FDG PET/CT: EANM procedure guidelines for tumour imaging: version 2.0[J]. Eur J Nucl Med Mol Imaging, 2015, 42(2): 328−354. DOI: 10.1007/s00259-014-2961-x. [13] Zong RL, Xie DH, Li G, et al. Diagnostic value of 18F-FDG-PET/CT for the evaluation of solitary pulmonary nodules: a systematic review and meta-analysis[J]. Nucl Med Commun, 2017, 38(1): 67−75. DOI: 10.1097/mnm.0000000000000605. [14] Zhu L, Ploessl K, Zhou R, et al. Metabolic imaging of glutamine in cancer[J]. J Nucl Med, 2017, 58(4): 533−537. DOI: 10.2967/jnumed.116.182345. [15] Dubreuil J, Tordo J, Rubello D, et al. Diffusion-weighted MRI and 18F-FDG-PET/CT imaging: competition or synergy as diagnostic methods to manage sarcoma of the uterus? A systematic review of the literature[J]. Nucl Med Commun, 2017, 38(1): 84−90. DOI: 10.1097/mnm.0000000000000612. [16] Miyazawa T, Otsubo K, Sakai H, et al. Combining PD-L1 expression and standardized uptake values in FDG-PET/CT can predict prognosis in patients with resectable non-small-cell lung cancer[J]. Cancer Control, 2021, 28: 10732748211038314. DOI: 10.1177/10732748211038314. [17] Lara-Guerra H, Roth JA. Gene therapy for lung cancer[J/OL]. Crit Rev Oncog, 2016, 21(1/2): 115−124[2022-09-20]. http://www.begellhouse.com/journals/439f422d0783386a,3930394d2ef2dece,477a46d57c048b8e.html. DOI: 10.1615/CritRevOncog.2016016084. [18] Zhai XY, Zhang J, Tian YR, et al. The mechanism and risk factors for immune checkpoint inhibitor pneumonitis in non-small cell lung cancer patients[J/OL]. Cancer Biol Med, 2020, 17(3): 599−611[2022-09-20]. https://www.cancerbiomed.org/content/17/3/599. DOI: 10.20892/j.issn.2095-3941.2020.0102. [19] Cha JH, Chan LC, Li CW, et al. Mechanisms controlling PD-L1 expression in cancer[J]. Mol Cell, 2019, 76(3): 359−370. DOI: 10.1016/j.molcel.2019.09.030. [20] Wu XD, Huang Y, Zhao QP, et al. PD-L1 expression correlation with metabolic parameters of FDG PET/CT and clinicopathological characteristics in non-small cell lung cancer[J/OL]. EJNMMI Res, 2020, 10(1): 51[2022-09-20]. https://ejnmmires.springeropen.com/articles/10.1186/s13550-020-00639-9. DOI: 10.1186/s13550-020-00639-9. [21] Brody R, Zhang YD, Ballas M, et al. PD-L1 expression in advanced NSCLC: insights into risk stratification and treatment selection from a systematic literature review[J]. Lung Cancer, 2017, 112: 200−215. DOI: 10.1016/j.lungcan.2017.08.005. -





 下载:
下载: