-
近年来,核潜艇部队任务繁重,战备训练强度加大,发生核事故的潜在危险随之增加。核潜艇事故发生时可能伴随着核泄漏,艇员暴露于核辐射环境中[1-2]。快速上浮脱险因具有脱险深度大、操作简单、速度快等优点而被作为有效的潜艇脱险方式广泛应用,但快速上浮脱险过程中也存在减压病发生的风险[3]。减压病是由于外界环境压力迅速下降,导致机体组织内溶解的惰性气体溢出形成气泡,从而造成一系列病理反应的疾病[4-5]。快速上浮脱险导致的减压病主要累及心肺系统[6-7],而肺作为对电离辐射敏感的组织之一,在辐射暴露后数小时内即可产生早期辐射损伤[8]。艇员在受到一定剂量核辐射后,是否会增加随后快速上浮脱险所致减压病发生的风险,对于后续救治方案和流程的制定至关重要。
本研究以大鼠为研究对象,建立不同辐射剂量合并特定减压负荷的复合损伤动物模型,观察实验后大鼠的死亡情况,并检测其肺湿干重比、肺组织损伤程度以及肺泡灌洗液中炎症因子和氧化应激相关分子的变化,探讨辐射对快速上浮脱险致减压病发生风险以及肺组织损伤的影响,为失事核潜艇脱险艇员的一线救治提供一定的理论支持。
-
健康6周龄普通级雄性SD大鼠53只,体重为(199.3±10.4) g,由海军特色医学中心动物实验中心提供并饲养,购自上海市计划生育科学研究所实验动物经营部,实验动物许可证号SYXK(沪)2017-0019。实验前按大鼠体重分层后以随机数表法分为5组:空白对照组(10只)、单纯减压组(10只)、4 Gy照射+减压组(11只)、6 Gy照射+减压组(11只)以及8 Gy照射+减压组(11只)。动物适应性饲养7 d后进行实验,饲养期间(温度22 ℃、湿度50%)动物自由摄食及饮水,光照节律12 h/12 h。
-
快速上浮脱险减压舱购自烟台宏远氧业股份有限公司;低温高速离心机(5418R)购自德国 Eppendorf公司;精密电子天平(TB214)购自美国DENVER仪器公司;Multiskan 1550酶标仪购自美国Thermo Scientific公司。大鼠白细胞介素1β(interleukin-1β,IL-1β)、白细胞介素6(interleukin-6,IL-6)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)酶联免疫检测试剂盒购于上海基尔顿生物科技有限公司;超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)检测试剂盒购于南京建成生物工程研究所。
-
不同剂量照射组大鼠送至海军军医大学辐照中心,采用海军军医大学辐照中心60Co γ射线放射源进行照射,按分组剂量,分别进行4、6、8 Gy剂量一次性全身辐照构建大鼠急性放射病模型,辐射剂量率分别为0.43、0.64、0.86 Gy/min。空白对照组及单纯减压组在相同环境下不进行照射。
辐射结束后1 h将大鼠运送至海军特色医学中心潜水与高气压医学实验室,各减压组进行减压处理。将大鼠置于减压舱,模拟空气潜水,加压深度为57 m,停留45 min,随后快速匀速减压至大气压,减压时间为37 s。从减压舱中取出大鼠,在30 min内观察各组大鼠的死亡情况。
-
减压结束后3 h,以3%戊巴比妥钠注射大鼠腹腔进行麻醉,剂量40 mg/kg,完全麻醉后暴露气管,打开胸腔,结扎右侧肺门,对左侧肺组织进行生理盐水灌洗。用注射器吸取1.5 ml生理盐水,插入大鼠气管缓慢注入,待左肺完全膨胀、苍白后立即回抽灌洗液,反复3次,每次回收率> 80%。收集获得的肺泡灌洗液以3000 r/min离心15 min(离心半径10 cm),离心后吸取上清,−80 ℃贮存备用。
-
取大鼠右肺上叶,滤纸吸干表面血渍后,放在干燥称量纸上,精密电子天平称量肺湿重;随后将肺组织放入80 ℃烘箱内48 h,烘干至恒重,称量肺干重。计算大鼠肺湿干重比。
-
取大鼠右肺中叶,4%多聚甲醛固定,石蜡包埋,5 μm厚切片用苏木精-伊红染色进行组织病理学检测,以观察肺组织病理损伤的程度。
-
采用酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)分别测定各组大鼠肺泡灌洗液中炎症因子IL-1β、IL-6、TNF-α水平的变化。操作按照试剂盒说明书进行,酶标仪检测450 nm处吸光度值。
-
采用羟胺法测定大鼠肺泡灌洗液SOD活力,操作按照试剂盒说明书进行,使用酶标仪检测550 nm处吸光度值;采用硫代巴比妥酸法测定大鼠肺泡灌洗液MDA水平,操作按照试剂盒说明书进行,使用酶标仪检测532 nm处吸光度值;采用微量酶标法测定大鼠肺泡灌洗液GSH-Px水平,操作按照试剂盒说明书进行,使用酶标仪检测405 nm处吸光度值。
-
采用Graphpad Prism 9软件制图,应用SPSS 26.0软件进行统计学分析。符合正态分布的计量资料以
$ \bar{x} \pm s$ 表示,多组间比较采用单因素方差分析,符合方差齐性的进一步两两比较采用LSD-t检验,大鼠组间死亡率的比较采用卡方检验进行分析。P<0.05为差异有统计学意义。 -
由表1可知,单纯减压组和6 Gy照射+减压组各有1只大鼠死亡,4 Gy照射+减压组和8 Gy照射+减压组各有4只大鼠死亡。各组间大鼠死亡率的差异无统计学意义(χ2=7.925, P>0.05),但4 Gy照射+减压组和8 Gy照射+减压组大鼠的死亡率较单纯减压组存在上升趋势。
组别 数量(只) 死亡数量(只) 死亡率(%) 空白对照组 10 0 0 单纯减压组 10 1 10.0 4 Gy照射+减压组 11 4 36.4 6 Gy照射+减压组 11 1 10.0 8 Gy照射+减压组 11 4 36.4 表 1 不同辐射剂量暴露后大鼠减压病死亡情况
Table 1. Death of decompression sickness after exposure to different doses of radiation
-
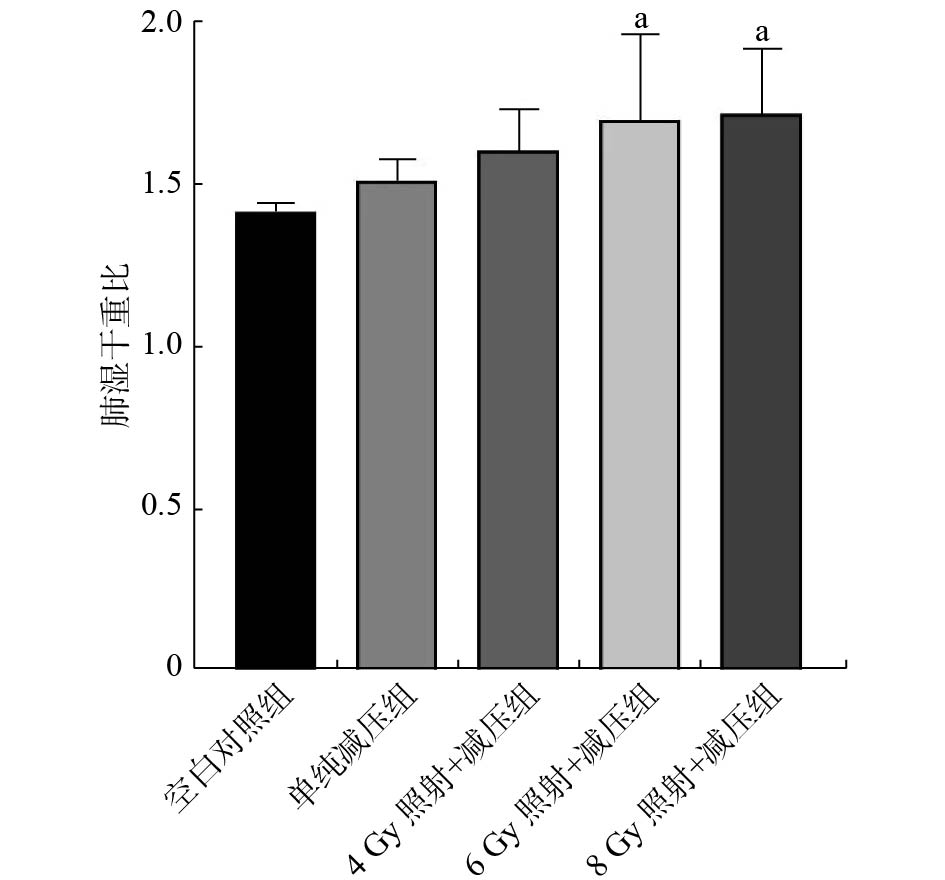
由图1可见,与空白对照组相比,各组大鼠肺湿干重比均有上升趋势,其中6 Gy照射+减压组和8 Gy照射+减压组的差异有统计学意义(F=3.096,LSD-t=2.758、2.959;均P<0.05);与单纯减压组相比,各照射组大鼠肺湿干重比均有上升趋势,但差异无统计学意义(LSD-t=0.901、1.818、2.020,均P>0.05)。
-
由图2可见,空白对照组大鼠肺泡及支气管结构基本正常,无炎性细胞浸润;单纯减压组大鼠可见轻度炎性细胞浸润和少量红细胞渗出;4 Gy照射+减压组大鼠肺间质有炎性细胞浸润,可见红细胞渗出,肺泡壁轻度增厚;6 Gy照射+减压组大鼠肺间质增生伴炎性细胞浸润,支气管内少量渗出物,肺泡壁增厚;8 Gy照射+减压组大鼠血管及支气管周围组织增生,内可见炎性细胞浸润及出血灶,部分血管周围明显可见渗出物,肺泡壁增厚,肺泡腔内明显可见渗出物。组织病理学检查结果提示,不同剂量辐射暴露后再进行减压会加重大鼠肺组织水肿及炎性损伤,其中6 Gy照射+减压组和8 Gy照射+减压组大鼠的损伤较为显著。
-
由图3可见,与空白对照组比较,各组大鼠肺泡灌洗液中IL-1β、IL-6、TNF-α水平均显著上升(均P<0.01);与单纯减压组比较,各照射组IL-1β、IL-6、TNF-α水平均显著上升(均P<0.01);与4 Gy照射+减压组比较,6 Gy照射+减压组IL-1β、IL-6、TNF-α水平均显著上升(均P<0.01);而与6 Gy照射+减压组比较,8 Gy照射+减压组IL-1β、IL-6、TNF-α水平则显著下降(均P<0.05);4 Gy照射+减压组与8 Gy照射+减压组比较,差异均无统计学意义(LSD-t=0.624、0.587、0.922,均P>0.05)。
-
由图4可见,与空白对照组比较,各组大鼠肺泡灌洗液中SOD活力、GSH-Px水平均显著下降(F=35.720、51.370,LSD-t=6.267~13.107;均P<0.01);与单纯减压组比较,各照射组大鼠SOD活力、GSH-Px水平显著下降(LSD-t=2.716~5.154,均P<0.01);各照射组间的差异无统计学意义,但6 Gy照射+减压组大鼠SOD活力、GSH-Px水平下降幅度最大。

图 4 不同剂量辐射暴露后各组大鼠肺泡灌洗液SOD活力、GSH-Px及MDA水平的变化
Figure 4. Changes of superoxide dismutase, glutathione peroxidase, malondialdehyde levels in bronchoalveolar lavage fluid in each group of rats after different doses of radiation exposure
与空白对照组比较,各组大鼠肺泡灌洗液MDA水平均显著上升(F=45.680,LSD-t=4.395~12.752;均P<0.01);与单纯减压组比较,各照射组大鼠MDA水平显著上升(LSD-t=3.198~8.017,均P<0.01);与4 Gy照射+减压组比较,6 Gy照射+减压组大鼠MDA水平显著上升(P<0.01),8 Gy照射+减压组的差异无统计学意义(LSD-t=0.541,P>0.05);而与6 Gy照射+减压组比较,8 Gy照射+减压组则显著下降(LSD-t=4.204,P<0.01)。
-
虽然核潜艇沉没事故发生后艇员幸存的可能性很小,但现代逃生技术的发展进一步提升了这种可能性。然而,目前国内外对核潜艇事故幸存艇员辐射与减压复合损伤情况的研究很少,而在北大西洋公约组织的援潜救生手册中也只是简单地描述了幸存艇员救治原则的重点在于放射性污染的清除[9]。实施快速上浮脱险时,不可避免地存在减压病发生的风险,这也是危及脱险艇员生命安全与健康的主要问题[10]。本研究旨在探讨大鼠受到一定剂量的辐射暴露后,再进行快速上浮脱险,是否会加重减压病发生的风险以及肺组织的损伤程度。在本研究中,4 Gy照射+减压组和8 Gy照射+减压组大鼠的死亡数较单纯减压组有所增加,但6 Gy照射+减压组大鼠的死亡数没有变化。这一结果提示大鼠受到一定剂量辐射暴露后再进行快速上浮脱险,会增加减压病的病死率;但6 Gy照射+减压组的情况提示个体对于减压反应的易感性差异所导致的死亡率差异并不能排除。关于减压病的相关研究结果表明,减压病的发生与机体组织内皮功能障碍、血小板激活以及白细胞激活密切相关,但个体对于减压压力的反应实际上才决定了减压病的发病率[4-5]。个体对于减压病易感性的差异是显而易见的,这种差异既存在于个体之间,也存在于个体内部,并且这种差异并不总是恒定的,其与体重、年龄、温度、身体状态等多种因素相关[5]。在本研究中,6 Gy照射+减压组大鼠的死亡率较4 Gy照射+减压组和8 Gy照射+减压组是降低的,结合减压病易感性的理论,我们认为这可能是不同组别间对于减压病的易感性差异所造成的。同时这一现象也提示,在进行相关人员的选拔和习服训练时,个体对于减压病的易感性差异是一个不可忽视的重要因素。
肺作为电离辐射中度敏感组织,在辐射暴露后数小时内即可产生早期辐射损伤[11-12],不可修复的DNA损伤和不可控的氧化应激都会导致肺组织细胞的损伤或凋亡,并进一步释放细胞因子,引发肺内炎症反应的级联放大[13-14]。对于减压病而言,血管内气泡的形成在减压病的发生机制中起核心作用[15-16]。静脉气泡导致血小板活化沉积和白细胞激活,并伴随着氧化应激和一系列炎症反应,最终导致肺组织损伤[17-18]。因此,肺作为辐射损伤和减压损伤的共同作用靶器官,辐射损伤可能加重后续快速上浮脱险所致减压病的发生风险和损伤程度。在本研究中,各照射组大鼠的肺组织病理损伤程度随着辐射剂量的增加而呈加重的趋势,且较单纯减压组更为严重。从肺湿干重比的结果来看,各照射组大鼠的肺湿干重比与单纯减压组相比,差异无统计学意义,但存在上升的趋势。该现象提示辐射暴露会加重快速上浮脱险所致的减压病肺损伤的严重程度,但辐射剂量与肺损伤程度的量效关系有待进一步研究验证。
辐射暴露和减压暴露均可导致不同程度的肺部炎症反应和氧化应激反应,并引起多种炎症因子以及氧化应激相关分子发生变化。TNF-α是由激活的巨噬细胞、中性粒细胞等产生,可触发其他炎性细胞因子(IL-1β、IL-6和GM-CSF等)的释放[19-20]。IL-1β则直接参与早期肺组织损伤和修复[21]。同时TNF-α和IL-1β可刺激多种趋化因子如IL-8、巨噬细胞炎性蛋白-1α(MIP-1α)的产生,在炎性细胞因子级联反应过程中发挥重要作用[22-23]。而IL-6作为一种多效性细胞因子,可导致多种自身免疫性和炎症性疾病的发生[24]。机体发生氧化应激反应时可生成MDA。MDA通过影响线粒体呼吸链复合物及关键酶的活性,会加剧机体损伤[25-26]。当机体内抗氧化体系(SOD、GSH-Px等)不足以清除电离辐射产生的自由基时,则出现氧化应激损伤。在本研究中,各照射组大鼠肺泡灌洗液中的炎症因子(IL-1β、IL-6、TNF-α)水平及MDA水平较单纯减压组均显著上升,而机体内抗氧化酶(SOD、GSH-Px)水平较单纯减压组则显著降低。本研究结果提示,辐射暴露会加重随后快速上浮脱险所致肺部炎症损伤和氧化应激损伤。6 Gy照射+减压组大鼠的肺泡灌洗液IL-1β、IL-6、TNF-α以及MDA水平上升幅度是各照射组中最大的,而SOD、GSH-Px水平的下降幅度也是最大的。由于减压后立即死亡的大鼠未被纳入此次实验范围,而6 Gy照射+减压组大鼠的死亡率在各照射组中是最低的,我们认为6 Gy照射+减压组大鼠对于快速上浮脱险所致减压病的易感性较低,以致出现较低的死亡率,但存活个体的肺泡灌洗液炎症因子和氧化应激相关分子的变化却最为显著。各组间炎症因子水平和氧化应激分子均存在显著差异,或许能够比组织病理损伤更早地预测辐射复合减压损伤的复合效应。致死性复合损伤的原因不仅仅是肺组织炎症渗出,也可能是炎症因子和氧化应激导致的血管舒缩反应。
综上所述,辐射暴露会加重随后的快速上浮脱险所致减压病的发生风险,肺组织炎症反应和氧化应激反应造成的肺组织损伤,会导致幸存艇员待援能力的下降和救治效率的不足,提示复合损伤幸存艇员早期的抗炎和抗氧化应激措施应该得到重视。而6 Gy照射+减压组大鼠的存活个体损伤最重,但总体死亡率却最低,则提示个体对于减压病发生的易感性对于其脱险尤为重要,下一步可以深入研究其易感机制并应用于人员选拔和习服训练。
利益冲突 所有作者声明无利益冲突
作者贡献声明 刘光盛负责现场的实验、数据的统计与分析、论文的撰写;刘敏、赖宏豪负责文献的查阅、现场的实验;陈锐勇、何颖负责实验的设计与指导、论文的审阅与修改
辐射合并减压暴露致大鼠急性肺损伤的效应观察
Effects of radiation combined with decompression exposure on acute lung injury in rats
-
摘要:
目的 探讨不同剂量辐射暴露对快速上浮脱险致大鼠减压病急性肺损伤及死亡率的影响。 方法 53只SD大鼠按体重分层后以随机数表法分为5组:空白对照组(10只)、单纯减压组(10只)、4 Gy照射+减压组(11只)、6 Gy照射+减压组(11只)以及8 Gy照射+减压组(11只)。照射组大鼠先进行4、6、8 Gy不同剂量60Co γ射线全身照射,空白对照组及单纯减压组大鼠在相同环境下不进行照射;照射结束后1 h各减压组再进行减压处理实验(57 m停留45 min后,37 s快速减压至大气压),观察各组大鼠死亡率、肺湿干重比、肺组织病理损伤程度以及肺泡灌洗液中炎症因子和氧化应激相关分子水平的变化。各组大鼠死亡率的比较采用卡方检验,其他指标的比较采用单因素方差分析,进一步两两比较采用LSD-t检验。 结果 与空白对照组比较,各实验组大鼠死亡数量和肺湿干重比均增加,6 Gy照射+减压组和8 Gy照射+减压组大鼠肺湿干重比显著增加,且差异有统计学意义(F=3.096,LSD-t=2.758、2.959;均P<0.05);各实验组大鼠肺组织病理损伤明显,其中6 Gy照射+减压组和8 Gy照射+减压组更为显著;各实验组大鼠肺泡灌洗液中白细胞介素1β(IL-1β)、白细胞介素6(IL-6)、肿瘤坏死因子α(TNF-α)和丙二醛(MDA)水平显著增加,且差异有统计学意义(F=45.680~78.270,均P<0.01),超氧化物歧化酶(SOD)活力和谷胱甘肽过氧化物酶(GSH-Px)水平显著下降,且差异有统计学意义(F=35.720、51.370,均P<0.01)。与单纯减压组比较,4 Gy照射+减压组和8 Gy照射+减压组大鼠死亡数量增加,但死亡率的差异无统计学意义(χ2=7.925,P>0.05);各照射组大鼠肺湿干重比虽有上升趋势,但差异无统计学意义(LSD-t=0.901、1.818、2.020,均P>0.05);各照射组大鼠肺组织病理损伤有不同程度的加重,其中8 Gy照射+减压组损伤程度最重;各照射组大鼠肺泡灌洗液中炎症因子(IL-1β、IL-6、TNF-α)和氧化应激相关分子(SOD、GSH-Px、MDA)均变化显著(LSD-t=3.081~8.265,均P<0.01),其中6 Gy照射+减压组变化最为显著。 结论 辐射会加重快速上浮脱险造成的肺组织炎症和氧化应激损伤,表现为肺组织病理损伤程度加重及死亡率增加,从而增加快速上浮脱险致减压病发生的风险。 Abstract:Objective To investigate the effects of different doses of radiation exposure on acute lung injury and mortality from decompression sickness (DCS) induced by rapid floating escape in rats. Methods A total of 53 Sprague-Dawley rats were stratified in accordance with body weight and divided into 5 groups by using a random number table method. The groups were as follows: blank control group (10 rats), simple decompression group (10 rats), 4 Gy irradiation with decompression group (11 rats), 6 Gy irradiation with decompression group (11 rats), and 8 Gy irradiation with decompression group (11 rats). The animals in the irradiation groups were given different doses of 60Co γ whole-body radiation and then exposed to decompression treatment (i.e., after staying at a depth of 57 m for 45 min, the rats were made to ascend quickly to atmospheric pressure within 37 s) 1 h after irradiation. The mortality rate, lung wet-dry weight ratio, degree of lung tissue pathological damage, and changes in levels of inflammatory factors and oxidative stress-related molecules in the alveolar lavage fluid were observed in each group of rats. Mortality rates among groups were compared using Chi-square test, while the remaining variables were analyzed using one-way ANOVA. Further comparison between two groups using LSD t-test. Results Compared with that in the blank control group, the number of animal deaths and the lung wet-dry weight ratio increased in each experimental group, with the lung wet-dry weight ratio increasing significantly in the 6 Gy and 8 Gy irradiation with decompression groups (F=3.096, LSD-t=2.758, 2.959; all P<0.05). The pathological damage of lung tissues in each experimental group was evident, and those in the 6 Gy and 8 Gy irradiation with decompression groups were more significant among the irradiation groups. The interleukin-1β (IL-1β), interleukin-6 (IL-6), tumor necrosis factor-α (TNF-α), and malondialdehyde (MDA) in the bronchoalveolar lavage fluid of each experimental group were significantly increased (F=45.680–78.270, all P<0.01), whereas superoxide dismutase (SOD) and glutathione peroxidase (GSH-Px) were significantly decreased (F=35.720, 51.370; both P<0.01). Compared with that in the simple decompression group, the number of animal deaths in the 4 Gy and 8 Gy irradiation with decompression groups increased, but no statistical difference was noted in the mortality rate (χ2=7.925, P>0.05). Although the lung wet-dry weight ratio of the rats in each irradiation group exhibited an upward trend, no statistically significant difference was found (LSD-t=0.901, 1.818, 2.020; all P>0.05). The pathological damage of lung tissues was aggravated to different degrees, and the damage degree of the 8 Gy irradiation with decompression group was the most serious. Inflammatory factors (IL-1β, IL-6, and TNF-α) and oxidative stress-related molecules (SOD, GSH-Px, and MDA) in bronchoalveolar lavage fluid changed significantly (LSD-t=3.081–8.265, all P<0.01). Among which, the 6 Gy irradiation with decompression group exhibited the most significant change. Conclusions Nuclear radiation can worsen lung tissue inflammation and oxidative stress damage caused by rapid floating escape. Such effect is manifested as aggravated lung tissue pathological damage and increased mortality, increasing the risk of DCS caused by rapid floating escape. -
表 1 不同辐射剂量暴露后大鼠减压病死亡情况
Table 1. Death of decompression sickness after exposure to different doses of radiation
组别 数量(只) 死亡数量(只) 死亡率(%) 空白对照组 10 0 0 单纯减压组 10 1 10.0 4 Gy照射+减压组 11 4 36.4 6 Gy照射+减压组 11 1 10.0 8 Gy照射+减压组 11 4 36.4 -
[1] 王霖, 李小玲, 任慧峰, 等. 创建核潜艇事故应急医学救援体系的实践与探讨[J]. 中国急救复苏与灾害医学杂志, 2015, 10(10): 955−956. DOI: 10.3969/j.issn.1673-6966.2015.10.016.
Wang L, Li XL, Ren HF, et al. Practice and discussion on establishing emergency medical rescue system for nuclear submarine accidents[J]. Chin J Emerg Resusc Disaster Med, 2015, 10(10): 955−956. DOI: 10.3969/j.issn.1673-6966.2015.10.016.[2] Brown JE, Amundsen I, Bartnicki J, et al. Impacts on the terrestrial environment in case of a hypothetical accident involving the recovery of the dumped Russian submarine K-27[J]. J Environ Radioact, 2016, 165: 1−12. DOI: 10.1016/j.jenvrad.2016.08.015. [3] 许骥, 方以群, 包晓辰, 等. 核辐射对大深度快速上浮脱险致减压病大鼠相关指标的影响[J]. 中国应用生理学杂志, 2021, 37(5): 486−489, 505. DOI: 10.12047/j.cjap.6086.2021.059.
Xu J, Fang YQ, Bao XC, et al. Effect of nuclear radiation on rat model of decompression sickness induced by large depth rapid floating escape[J]. Chin J Appl Physiol, 2021, 37(5): 486−489, 505. DOI: 10.12047/j.cjap.6086.2021.059.[4] Vann RD, Butler FK, Mitchell SJ, et al. Decompression illness[J]. Lancet, 2011, 377(9760): 153−164. DOI: 10.1016/S0140-6736(10)61085-9. [5] Mahon RT, Regis DP. Decompression and decompression sickness[J/OL]. Compr Physiol, 2014, 4(3): 1157−1175[2022-08-21]. https://onlinelibrary.wiley.com/doi/10.1002/cphy.c130039. DOI: 10.1002/cphy.c130039. [6] 攸璞, 方以群, 王海涛, 等. 快速上浮脱险致减压病动物肺组织病理改变的研究[J]. 军事医学, 2014, 38(7): 490−492. DOI: 10.7644/j.issn.1674-9960.2014.07.004.
You P, Fang YQ, Wang HT, et al. Pathological changes in lung tissue during fast floating escape-induced decompression sickness[J]. Mil Med Sci, 2014, 38(7): 490−492. DOI: 10.7644/j.issn.1674-9960.2014.07.004.[7] 王楠, 毕珂, 包晓辰, 等. 减压病大鼠模型心脏血流动力学的改变[J]. 军事医学, 2020, 44(5): 345−348. DOI: 10.7644/j.issn.1674-9960.2020.05.006.
Wang N, Bi K, Bao XC, et al. Changes of cardiac hemodynamics in rats with decompression sickness[J]. Mil Med Sci, 2020, 44(5): 345−348. DOI: 10.7644/j.issn.1674-9960.2020.05.006.[8] Beach TA, Groves AM, Williams JP, et al. Modeling radiation-induced lung injury: lessons learned from whole thorax irradiation[J]. Int J Radiat Biol, 2020, 96(1): 129−144. DOI: 10.1080/09553002.2018.1532619. [9] 李珂娴, 范正平, 雷呈祥. 国外核潜艇事故应急医学处理特点[J]. 中国辐射卫生, 2008, 17(2): 215−216. DOI: 10.3969/j.issn.1004-714X.2008.02.050.
Li KX, Fan ZP, Lei CX. Peculiarity of the emergent medicine management for nuclear submarine accidents abroad[J]. Chin J Radiol Health, 2008, 17(2): 215−216. DOI: 10.3969/j.issn.1004-714X.2008.02.050.[10] Wang HT, Fang YQ, You P, et al. PDTC ameliorates decompression induced-lung injury caused by unsafe fast buoyancy ascent escape via inhibition of NF-κB pathway[J]. Undersea Hyperb Med, 2018, 45(3): 351−362. DOI: 10.22462/05.06.2018.10. [11] Śliwińska-Mossoń M, Wadowska K, Trembecki Ł, et al. Markers useful in monitoring radiation-induced lung injury in lung cancer patients: a review[J/OL]. J Pers Med, 2020, 10(3): 72[2022-08-21]. https://www.mdpi.com/2075-4426/10/3/72. DOI: 10.3390/jpm10030072. [12] Liu XL, Shao CL, Fu JM. Promising biomarkers of radiation-induced lung injury: a review[J/OL]. Biomedicines, 2021, 9(9): 1181[2022-08-21]. https://www.mdpi.com/2227-9059/9/9/1181. DOI: 10.3390/biomedicines9091181. [13] Giuranno L, Ient J, De Ruysscher D, et al. Radiation-induced lung injury (RILI)[J/OL]. Front Oncol, 2019, 9: 877[2022-08-21]. 10.3389/fonc.2019.00877/full">https://www.frontiersin.org/articles/10.3389/fonc.2019.00877/full. DOI: 10.3389/fonc.2019.00877. [14] Arroyo-Hernández M, Maldonado F, Lozano-Ruiz F, et al. Radiation-induced lung injury: current evidence[J/OL]. BMC Pulm Med, 2021, 21(1): 9[2022-08-21]. https://bmcpulmmed.biomedcentral.com/articles/10.1186/s12890-020-01376-4. DOI: 10.1186/s12890-020-01376-4. [15] Yu XH, Xu JJ, Liu WW, et al. Protective effects of pulmonary surfactant on decompression sickness in rats[J]. J Appl Physiol (1985), 2021, 130(2): 400−407. DOI: 10.1152/japplphysiol.00807.2020. [16] Zhang K, Zhang HD, Yi HJ, et al. The protective effects of 1,3-butanediol acetoacetate diester on decompression sickness in rats[J]. J Appl Physiol (1985), 2021, 131(2): 435−441. DOI: 10.1152/japplphysiol.00035.2021. [17] Thom SR, Yang M, Bhopale VM, et al. Intramicroparticle nitrogen dioxide is a bubble nucleation site leading to decompression-induced neutrophil activation and vascular injury[J]. J Appl Physiol (1985), 2013, 114(5): 550−558. DOI: 10.1152/japplphysiol.01386.2012. [18] Thom SR, Bennett M, Banham ND, et al. Association of microparticles and neutrophil activation with decompression sickness[J]. J Appl Physiol (1985), 2015, 119(5): 427−434. DOI: 10.1152/japplphysiol.00380.2015. [19] Malaviya R, Laskin JD, Laskin DL. Anti-TNFα therapy in inflammatory lung diseases[J]. Pharmacol Ther, 2017, 180: 90−98. DOI: 10.1016/j.pharmthera.2017.06.008. [20] Guo Y, Hu K, Li YX, et al. Targeting TNF-α for COVID-19: recent advanced and controversies[J/OL]. Front Public Health, 2022, 10: 833967[2022-08-21]. https://www.frontiersin.org/articles/10.3389/fpubh.2022.833967/full. DOI: 10.3389/fpubh.2022.833967. [21] Xiong SQ, Hong ZG, Huang LS, et al. IL-1β suppression of VE-cadherin transcription underlies sepsis-induced inflammatory lung injury[J]. J Clin Invest, 2020, 130(7): 3684−3698. DOI: 10.1172/JCI136908. [22] Ni YF, Wang J, Yan XL, et al. Histone deacetylase inhibitor, butyrate, attenuates lipopolysaccharide-induced acute lung injury in mice[J]. Respir Res, 2010, 11(1): 33. DOI: 10.1186/1465-9921-11-33. [23] Wang HT, Fang YQ, You P, et al. Expression changes of inflammatory factors in the rat lung of decompression sickness induced by fast buoyancy ascent escape[J]. Undersea Hyperb Med, 2015, 42(1): 15−22. [24] Yang ML, Wang CT, Yang SJ, et al. IL-6 ameliorates acute lung injury in influenza virus infection[J/OL]. Sci Rep, 2017, 7: 43829[2022-08-21]. https://www.nature.com/articles/srep43829. DOI: 10.1038/srep43829. [25] Santivasi WL, Xia F. Ionizing radiation-induced DNA damage, response, and repair[J]. Antioxid Redox Signal, 2014, 21(2): 251−259. DOI: 10.1089/ars.2013.5668. [26] Nardi J, Nascimento S, Göethel G, et al. Inflammatory and oxidative stress parameters as potential early biomarkers for silicosis[J]. Clin Chim Acta, 2018, 484: 305−313. DOI: 10.1016/j.cca.2018.05.045. -






 下载:
下载: