-
心血管疾病已成为全球范围内危害人类健康的公共卫生问题[1]。随着我国人口老龄化和城镇化速度的加快,心血管疾病的发病率和病死率呈现逐年升高趋势。统计数据显示,2019年我国心血管疾病患者数约为 3.3 亿,心血管疾病在我国已成为首要疾病死因,在农村和城市中因心血管疾病死亡的人数分别占所有因病死亡人数的46.74%和44.26%,且该数据仍呈上升趋势[2]。早期诊断和治疗可以有效降低心血管疾病患者的病死率。研究结果表明,心脏神经系统功能障碍在心血管疾病的病理和生理过程中起着重要作用,其与急慢性心肌缺血、心力衰竭等常见心脏疾病的早期发病机制及预后密切相关[3-4]。许多心脏疾病患者神经系统的改变往往发生在临床症状出现之前。传统的影像检查技术难以观察到自主神经系统的变化,而核素显像技术能够非常灵敏地反映心脏自主神经系统的变化[5]。我们就心脏自主神经系统进行概述,并综述了几种11C标记的心脏交感神经受体显像剂的研究新进展。
-
自主神经系统在调节心血管功能方面起着至关重要的作用。自主神经受到刺激后释放神经递质,例如肾上腺素、去甲肾上腺素(norepinephrine,NE)、血管加压素、脑钠肽和肾素血管紧张素-醛固酮系统的成分。这些神经递质可以通过控制心输出量、血管张力和血容量来维持身体器官和组织的正常循环。另外,他们作为“信使”将信号传递给交感神经和副交感神经系统,产生心脏和血管神经的应答反应,并对监测整个心血管系统的体积和压力变化的压力感受器以及酸度和氧合变化的化学感受器的输入信号做出反应,以应对疼痛、恐惧或运动等压力。在身体负荷(例如低血容量或心输出量减少引起的心脏收缩功能障碍)的情况下,神经体液调节过程可能通过血管收缩、心脏收缩力增加、心率加快和细胞外容量扩张来进行代偿[6]。虽然在大多数情况下,这些调节过程是有益的,但在诸如心力衰竭等疾病情况下,过度的神经激素活动会导致器官重塑,对疾病的发生和发展产生不良后果[4]。
-
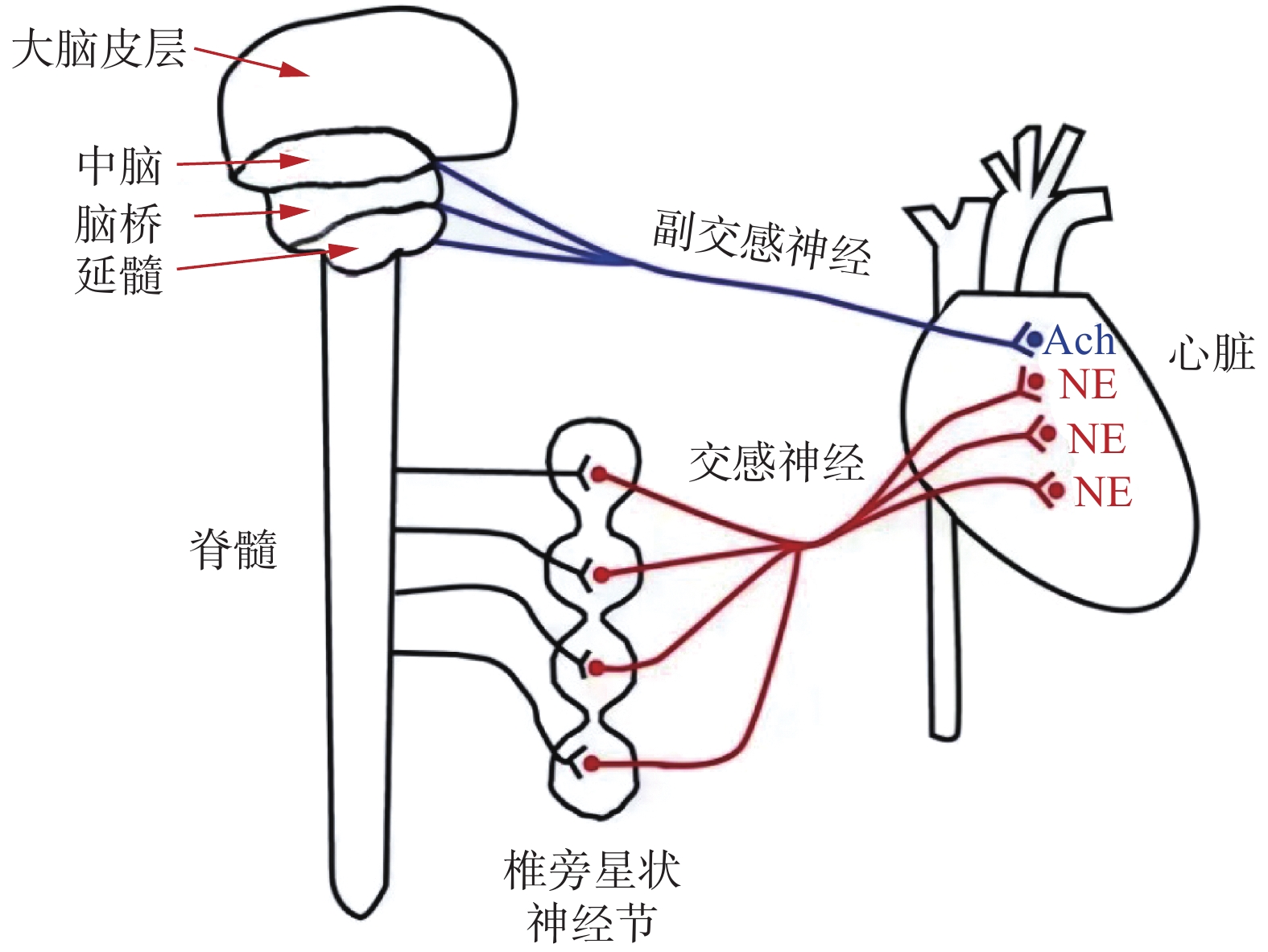
心脏自主神经系统主要包括交感神经系统和副交感神经系统,二者均通过神经末梢释放神经递质,并作用于心肌细胞浆膜中的神经受体,从而发挥调节心率和心肌收缩力等功能。交感神经和副交感神经纤维支配心脏的活动,交感节前神经纤维从脊髓胸腰上段(T1~L3)发出,与节后椎旁星状神经节形成突触,神经节后神经元的轴突最终形成上、中、下心交感神经,延伸至心脏基底部,支配右心室和左心室的前部和外侧部。副交感节前神经起源于中脑、桥脑和延髓的神经元,它的节前纤维在副交感神经节中交换神经元,再由此发出节后纤维,至平滑肌、心肌和腺体[7]。心脏自主神经系统的解剖示意图见图1。
放射性核素标记NE和乙酰胆碱的类似物已被合成,能够无创性评估心脏神经分布的完整性,获取疾病状态下心脏神经系统的组织病理和生理信息。但由于心脏中胆碱能神经元的密度低且分布不均匀,难以设计出合适的显像剂,导致有关副交感神经显像方面的研究较少。相比之下,心脏交感神经支配丰富,放射性核素标记NE的类似物相对容易合成,且心脏的神经支配以交感神经为主,交感神经功能的改变与心脏功能的异常密切相关。因此,目前对于交感神经显像方面的研究较为广泛。
-
20世纪40年代以来,人们对交感神经元突触中NE的合成和释放进行了广泛研究[8]。NE由酪氨酸合成,酪氨酸首先被主动转运到曲张体中,然后通过酪氨酸羟化酶(TH)转化为二羟基苯丙氨酸 (DOPA),之后转化为多巴胺 。多巴胺通过囊泡单胺转运蛋白(vesicular monoamine transporter,VMAT) 储存在囊泡中,并通过多巴胺-β-羟化酶 (DβH) 转化为 NE。神经刺激导致囊泡内容物通过胞吐释放,释放的NE与肌细胞膜中的突触后膜β受体结合,后者通过刺激性G 蛋白刺激腺苷酸环化酶(AC),腺苷酸环化酶(AC)活性增强导致细胞内环磷酸腺苷(cAMP)的水平升高,从而激活蛋白激酶 A,最终导致L 型 Ca2+ 通道的 Ca2+ 内流增加,引起心肌细胞收缩力增强。NE还可以与突触前α2受体结合,从而抑制 NE 的进一步释放。80%~90%的未结合的NE将被去甲肾上腺素转运蛋白 (norepinephrine transporter,NET) 重摄取回突触前神经末梢(即摄取-1通路),并被单胺氧化酶(monoamine oxidase,MAO)降解为二羟苯乙醇(DHPG)或被VMAT重新包装成囊泡。小部分释放到突触间隙内的NE还可以通过摄取-2通路被非神经组织摄取[9-10]。释放到突触间隙内的NE主要与突触后膜的β受体结合发挥对心脏的正性变时、变力、变传导作用。在疾病状态下,β受体的密度减小、功能下调。NE的合成、释放、摄取过程的示意图见图2。
-
心血管疾病是进行性的,随着年龄的增长,心脏内纤维组织增多、冠状动脉内膜增厚、管腔狭窄及心脏瓣膜增厚挛缩等生理学和形态学的变化可能会使心血管功能发生改变,导致心血管疾病的发生风险增高。任何心脏损伤的情况都会导致心脏交感神经元的损伤,这些神经元比其他心肌组织对损伤更敏感,需要更长的时间才能恢复。因此,神经受体显像可以为心脏疾病状况的诊断提供独特的影像参考。
目前常用的突触前的交感神经受体显像剂为儿茶酚胺类或其类似物,经由NET转运,聚集于交感神经末梢,能够模拟神经元运输和储存NE的过程来反映心脏交感神经活动,对心脏疾病的诊断、治疗及药物作用机制的研究提供了具有重要价值的信息。而突触后的交感神经受体显像剂一般为肾上腺素受体类,分为α受体类和β受体类,能够反映突触后的神经功能。123I-间碘苄胍SPECT显像一直被广泛应用于观察交感神经末梢分布的完整性和功能状态,但PET较SPECT具有更高的时间及空间分辨率、更高的灵敏度和更优的定量效能,正逐步成为神经显像的主要手段。近年来11C标记的心脏交感神经受体显像剂发展迅速,这是因为11C标记的放射性显像剂的标记方法简单,获得的放射性显像剂较稳定,临床上使用起来也比较方便,而且目前国内已经能够通过全自动化标记的方法获得11C标记的放射性显像剂。目前应用较多的11C标记的放射性显像剂包括11C-羟基麻黄素(11C-meta-hydroxyephedrine, 11C-HED)、11C-苯肾上腺素(11C-phenylephrine, 11C-PHEN),以及具有较大发展前景的N-11C-甲基多巴胺(N-11C-methyl-dopamine, 11C-MDA)、11C-4-[3-[(1,1-二甲基乙基)氨基]2-羟丙氧基]-1,3-双氢-2H-苯并咪唑-2-one(11C-4-[3-[(1,1-dimethylethyl)amino]2-hydroxypropoxy]-1,3-dihydro-2H-benzimidazol-2-one, 11C-CGP12177)。我们综述了以上几种显像剂的研究新进展。
-
11C-HED是11C标记的儿茶酚胺类似物,是目前用于评估心脏交感神经末梢完整性的PET显像剂中最重要的一种[11]。11C-HED可直接通过11C-碘代甲烷与间羟胺的甲基化反应合成,并由高效液相色谱或柱色层分离纯化制备[12]。作为NE的类似物,11C-HED与NE有相同的神经细胞摄取机制,可以通过突触前膜并经NET快速转运到交感神经元,使心脏显像,从而评估心脏交感神经系统的功能[10]。
在大鼠体内进行的生物学分布实验结果显示,11C-HED在大鼠心脏中的摄取率较高,清除率较低,在摄取-1阻断剂去甲丙咪嗪的作用下其摄取被阻断,这证明11C-HED是通过摄取-1通路被心肌细胞摄取,且心脏对11C-HED的摄取和保留只发生在交感神经末梢[13]。11C-HED 具有较高的结合亲和力 (Ki=20.9 μmol/L)[14]和对摄取-1的高选择性(约90%)[15],且不被MAO降解,重摄取后部分重新包装,并通过被动扩散或内源性 NE 的主动释放回到突触间隙。因此,11C-HED的保留量能反映突触前神经元的功能[16]。
Pietilä等[17]回顾性分析了46例 美国纽约心脏学会(NYHA)分级为Ⅱ~Ⅲ级慢性心力衰竭(chronic heart failure, CHF)患者的生存数据,结果显示CHF 患者的 11C-HED 保留量显著低于健康受试者(0.184±0.061对 0.283±0.044,P<0.0001);NYHA分级为Ⅲ 级 CHF 患者的 11C-HED 保留量低于 NYHA分级为Ⅱ级 CHF 患者(0.143±0.014对0.193±0.009,P=0.015)。Olgin等[18]使用11C-HED对持续性心房颤动犬模型进行显像,结果显示用苯酚触发心房颤动的区域11C-HED摄取缺陷。另外,11C-HED 也被用于评估复极延迟综合征(长QT 综合征)的严重程度[19]。Aoki等[20]使用11C-HED对19例心肌梗死患者进行PET显像以评价交感神经功能的改变状况,结果显示11C-HED 保留量与左心室射血分数呈正相关(r=0.566,P<0.05),与收缩期纵向应变峰值呈负相关(r=−0.561,P<0.05),11C-HED PET可为评价心血管疾病及预后提供更好的影像数据。
11C-HED PET不仅能够用于评估各种疾病状况下的心脏交感神经支配状况,其在预后评价方面也有应用。在一项名为PAREPET的临床试验中[3],11C-HED PET被证实能够识别心脏交感神经损伤,且在预测心源性猝死的风险分层方面表现出独立于左心室射血分数和梗死面积的预后价值,因而可以更好地识别最有可能从植入式除颤仪中获益的患者[21]。在左心室功能不全患者中,心脏整体11C-HED保留量较低也被看作是总体生存率较差的预测指标[22]。
11C-HED在健康人群的心肌内分布均匀,因此可以用于准确评估局部神经元缺陷。目前,心脏交感神经分布异常已在多种心脏疾病患者中得到证实,包括心衰[17, 23]、心律失常[18-19, 24]、心肌梗死[20]、糖尿病心脏神经病变[25]及心脏移植患者[26-27]。11C-HED显像成为对心衰和缺血性心肌病患者心源性死亡风险分层最有前景的技术之一,能够更精确地识别适合植入心脏除颤仪的心衰患者,并能对心脏再同步化治疗后的心衰患者和心脏移植患者进行疗效评估及预后估测。
-
11C-PHEN也是一种常用的11C标记的显像剂,在心肌内有较高摄取,可定位于心脏交感神经。11C-PHEN与11C-HED在化学结构上相近,由NET输送到神经膨体并存储在囊泡中,但因缺少1个α-甲基导致其易受到MAO的氧化而脱氨[28]。与11C-HED相比,11C-PHEN对摄取-1的结合亲和力较低(Ki=109 nmol/L)[14],具有高冲洗率和低保留率。
在大鼠体内进行的生物学分布实验结果显示,大鼠的心、肝、脾在11C-PHEN 注入后30 min仍有较高的放射性摄取,但与11C-HED相比,11C-PHEN的摄取慢、清除快[29]。Raffel和Wieland[30]在大鼠离体心脏中进行的机制研究结果显示,11C-PHEN被NET摄取到交感神经元,其速率比11C-HED稍慢,11C-PHEN进入神经元后被VMAT存储于囊泡中;由于脂溶性低,11C-PHEN弥散出囊泡的速率也比11C-HED稍慢,弥散出囊泡后很快被MAO降解为甲胺并从神经元中清除。在此之前,该团队在14名健康志愿者中进行了研究,结果显示,使用11C-PHEN得到的图像与使用11C-HED得到的图像在质量和均匀性上不相上下,二者在心肌中的分布相似,但11C-PHEN的保留指数只有11C-HED的一半;当受试者口服MAO后,二者在心肌中的摄取均明显降低,证明11C-PHEN也定位于心脏交感神经[31]。因此,采用心脏11C-PHEN PET显像可以反映交感神经功能,并可能提供 11C-HED PET无法获得的心脏交感神经元功能状态的信息,例如心脏MAO代谢情况等。
Bravo 等[27]研究了心脏移植手术后的患者移植心脏摄取 11C-HED、11C-肾上腺素和 11C-PHEN的差异,结果证实了亚细胞神经元成分的恢复不是同时发生的。关于11C-PHEN能否准确评估心肌内MAO代谢情况的研究目前仍较少,还有待进一步研究证实。
-
多巴胺是一种内源性神经递质,对NET具有高结合亲和力 (Ki=8.1 μmol/L) 和高转运效率(Km=0.24 μmol/L)[32],其在突触前神经元内转化为 NE,易受神经元内和神经元外代谢的影响。11C-MDA 为肾上腺素在体内代谢的中间产物(儿茶酚胺的类似物),以盐酸多巴胺为合成前体,经Tracerlab-Fx合成器合成,作为多巴胺衍生物,11C-MDA能准确反映心脏交感神经的变化。
2014年,何玉林等[33]成功合成了11C-MDA,并在昆明小鼠体内进行了生物学分布实验,结果显示:心肌对11C-MDA的摄取在注射后2 min达到(8.78±1.18) %ID/g,注射后30 min仍有(3.38±0.33) %ID/g,肺对11C-MDA的摄取在注射后2 min达到(3.78±0.58) %ID/g,注射后30 min为(2.16±0.17) %ID/g,证实了11C-MDA具有较高的心肌摄取率和较低的肺摄取率;在健康的中华小型猪中进行的11C-MDA PET/CT显像结果显示,11C-MDA在心肌中明显摄取,注射盐酸丙咪嗪后心肌摄取被明显阻断。11C-MDA的合成简便、成本低廉、心肌摄取率高,提示其将是一种具有潜在临床应用价值的心脏交感神经受体显像剂。
2017年,周伟娜等[34]采用交感神经受体显像剂11C-MDA及心肌血流灌注探针13N-Ammonia在巴马小型猪急性心肌缺血模型中进行研究,分别于造模前和造模后1 d及1、3、6个月行11C-MDA和13N-Ammonia PET/CT心肌显像,计算并比较2种显像剂心肌显像的缺损分数、缺血/正常区域放射性计数比值和缺损体积,结果显示:11C-MDA心肌显像的缺损分数及缺损体积在造模后的前3个月逐渐增高,6个月时下降;而13N-Ammonia 心肌显像的缺损分数及缺损体积在造模后逐渐减低,提示心肌缺血再灌注恢复要早于心脏交感神经恢复;通过比较造模后不同时间的左心室垂直长轴图像发现,造模后前3个月左心室11C-MDA的稀疏和缺损范围逐渐增大,造模后6个月缺损范围缩小,且左心室放射性分布稀疏和缺损区范围均大于同期13N-Ammonia心肌显像结果,证实利用11C-MDA PET/CT显像可以更早地反映心脏交感神经再生功能的异常,对预防致命性室性心律失常及减少不良心脏事件的发生有着积极作用。目前11C-MDA还处于临床Ⅰ期试验阶段,未来有望成为早期诊断及尽早干预心血管疾病的有利工具。
-
当心脏处于病理状态时,β受体的密度减低、功能下调。11C-CGP12177作为一种水溶性非选择性β受体拮抗剂[35],对β受体有很高的亲和力,能选择性地与心肌表面β受体结合,是目前应用最广泛的突触后显像剂。11C-CGP12177 在血液中清除迅速,且对 β1受体 (Kd=0.3 nmol/L) 和 β2受体 (Kd=0.9 nmol/L)有较高的结合亲和力及较高的心脏特异性结合率(80%~90%)[36],因而具有良好的心脏显像特性。11C-CGP12177通常与11C-HED联合使用,可以对病变心肌的交感神经支配状况进行更完整地评估[37]。
在大鼠体内外进行的临床前评估结果证实,11C-CGP12177是理想的肾上腺受体显像剂[38],能够通过测量直接调节左心室收缩功能的心肌β-肾上腺素能受体 (β-adrenergic receptor,β-AR) 的密度来评估突触后交感神经元功能。Link等[39]将11C-CGP12177与11C-HED联合显像以评估19名正常人与9例充血性CHF患者整体和局部的心脏交感神经功能,结果显示:正常人与CHF患者的突触前功能有显著差异,而突触后功能无显著差异;正常人心脏的突触前功能与突触后功能匹配良好,但在CHF患者中二者存在显著差异和匹配不一致的情况。由此可见,11C-CGP12177心脏显像有助于了解心脏疾病的局部交感神经功能。
有研究者将11C-HED 与11C-CGP12177联合在Brugada综合征患者中进行了相关试验,结果证实了Brugada综合征自主神经支配功能障碍的假说[24]。Tsukamoto等[40]在特发型扩张性心肌病患者中行11C-CGP12177 PET显像,结果显示,心肌β-AR密度的减低与心力衰竭的严重程度相关。Naya等[41]利用11C-CGP12177评估了心肌β-AR密度与长期卡维地洛治疗对左心室功能影响的关系,结果证实通过11C-CGP12177 PET评估心肌β-AR密度,可预测长期卡维地洛治疗后心功能的改善情况。同样,11C-CGP12177在非缺血性心肌病[42]与心肌梗死后左心室扩张[43]中的研究结果均显示可通过测量β-AR密度对疾病严重程度进行分级并预测预后。作为β受体拮抗剂,11C-CGP12177 PET显像可定量分析β受体密度,反映心脏收缩功能的变化,研究不同心脏疾病的不同神经改变。但由于其合成过程较为复杂,阻碍了其在核医学显像中的广泛应用。
-
综上所述,11C 标记的心脏交感神经受体显像剂在心肌梗死、缺血性心脏病、肥厚型心肌病、扩张型心肌病、充血性心力衰竭及糖尿病心脏自主神经损害中均有潜在的应用价值。这几种显像剂中11C-HED的研究最为深入,但其临床应用受限。既往研究结果表明,心房颤动与心脏自主神经系统的异常活动之间存在很强的相关性[44-45], 11C-MDA作为新研发的显像剂,不受合成前体和合成方法的限制,可以用于评估持续性心房颤动的神经元异常位点,指导临床进行更精确的射频消融,有较好的临床应用前景。随着显像剂的发展和显像技术的提升,PET将在心血管疾病的诊断、监测及治疗中发挥越来越重要的作用。
心脏自主神经系统的研究仍然是一个不断发展的领域,使用核医学心脏自主神经受体显像能够可视化和量化心脏病潜在的分子方面的重要信息,提供其他心脏检查方法无法提供的视角,确定疾病的严重程度,其作为疾病治疗和预后评估的工具能够对临床决策提供指导。在过去30年中,神经受体显像剂的研究广泛开展,并在临床应用中得到推广,这项研究有望在未来依据患者不同心脏状态个性化选择植入设备,如植入式心脏起搏器、植入式心律转复除颤器、植入式心脏再同步治疗器、植入式心电事件监测系统。随着显像技术模式的转变,心血管疾病无创显像的常用显像剂的选择变得尤为重要,其可揭示心脏自主神经支配障碍和心律失常之间的关联,以此优化心血管疾病患者的治疗干预。综上,具有显像、靶向和治疗功能的新型PET显像剂的开发仍将是心脏PET领域未来研究的关键,将为心血管疾病的治疗提供新的方案。
利益冲突 所有作者声明无利益冲突
作者贡献声明 张敏负责文献的检索、综述的撰写;何玉林、王相成、王雪梅负责命题的提出、综述的审阅与修改
11C标记的心脏交感神经受体显像剂的研究进展
Research progress of 11C labeled cardiac sympathetic nerve receptor imaging agents
-
摘要: 自主神经系统在调节心血管功能方面起着至关重要的作用,完整的神经支配是心血管功能正常发挥的基础。许多心脏疾病在出现临床症状之前已经出现了神经系统的改变,放射性核素标记的神经递质类似物PET显像可对此进行评估,其可以灵敏地反映心脏自主神经功能的完整性、神经元的分泌功能及活性,以便对心脏疾病进行早期诊断和及时干预。近年来11C标记的心脏交感神经受体显像剂发展迅速,笔者综述了其中几种显像剂的研究新进展。Abstract: It is crucial that the autonomic nervous system plays a crucial role in regulating cardiovascular function and intact innervation is the basis for normal cardiovascular function. Many cardiac diseases have had neurological alterations before the development of organic lesions, which can be evaluated by PET imaging of radionuclide labeled neurotransmitter analogues. It can sensitively reflect the integrity of cardiac autonomic nervous function, the secretory function and activity of neurons, and provide early diagnosis and timely intervention for cardiovascular disease. In recent years, carbon-11 labeled cardiac sympathetic nerve receptor imaging agents have developed rapidly. The author reviews the new progress of several imaging agents.
-
[1] Balakumar P, Maung-UK, Jagadeesh G. Prevalence and prevention of cardiovascular disease and diabetes mellitus[J]. Pharmacol Res, 2016, 113: 600−609. DOI: 10.1016/j.phrs.2016.09.040. [2] 中国心血管健康与疾病报告编写组. 中国心血管健康与疾病报告2020概要[J]. 中国循环杂志, 2021, 36(6): 521−545. DOI: 10.3969/j.issn.1000-3614.2021.06.001.
Chinese Cardiovascular Health and Disease Report Compilation Group. Report on cardiovascular health and diseases burden in China: an updated summary of 2020[J]. Chin Circ J, 2021, 36(6): 521−545. DOI: 10.3969/j.issn.1000-3614.2021.06.001.[3] Fallavollita JA, Heavey BM, Luisi AJ Jr, et al. Regional myocardial sympathetic denervation predicts the risk of sudden cardiac arrest in ischemic cardiomyopathy[J]. J Am Coll Cardiol, 2014, 63(2): 141−149. DOI: 10.1016/j.jacc.2013.07.096. [4] Francis GS. Neurohormonal control of heart failure[J]. Cleve Clin J Med, 2011, 78 Suppl 1: S75−79. DOI: 10.3949/ccjm.78.s1.13. [5] Boogers MJ, Fukushima K, Bengel FM, et al. The role of nuclear imaging in the failing heart: myocardial blood flow, sympathetic innervation, and future applications[J]. Heart Fail Rev, 2011, 16(4): 411−423. DOI: 10.1007/s10741-010-9196-0. [6] Travin MI. Application of cardiac neurohormonal imaging to heart failure, transplantation, and diabetes[J]. Curr Cardiovasc Imaging Rep, 2015, 8(4): 8. DOI: 10.1007/s12410-015-9323-3. [7] Carrió I. Cardiac neurotransmission imaging[J]. J Nucl Med, 2001, 42(7): 1062−1076. DOI: 10.1016/B978-0-323-05796-7.00073-4. [8] Chen XY, Kudo T, Lapa C, et al. Recent advances in radiotracers targeting norepinephrine transporter: structural development and radiolabeling improvements[J]. J Neural Transm (Vienna), 2020, 127(6): 851−873. DOI: 10.1007/s00702-020-02180-4. [9] Jamali HK, Waqar F, Gerson MC. Cardiac autonomic innervation[J]. J Nucl Cardiol, 2017, 24(5): 1558−1570. DOI: 10.1007/s12350-016-0725-7. [10] Nomura Y, Matsunari I, Takamatsu H, et al. Quantitation of cardiac sympathetic innervation in rabbits using 11C-hydroxyephedrine PET: relation to 123I-MIBG uptake[J]. Eur J Nucl Med Mol Imaging, 2006, 33(8): 871−878. DOI: 10.1007/s00259-006-0105-7. [11] Thackeray JT, Bengel FM. Assessment of cardiac autonomic neuronal function using PET imaging[J]. J Nucl Cardiol, 2013, 20(1): 150−165. DOI: 10.1007/s12350-012-9644-4. [12] 尹大一, 刘健, 张晓军, 等. 11C-(-)间羟基麻黄素的合成及Micro PET显像[J]. 同位素, 2012, 25(1): 21−26.
Yin DY, Liu J, Zhang XJ, et al. Radiosynthesis of 11C-meta-(-)hydroxyephedrine and micro PET imaging[J]. J Isotopes, 2012, 25(1): 21−26.[13] Langer O, Halldin C. PET and SPET tracers for mapping the cardiac nervous system[J]. Eur J Nucl Med Mol Imaging, 2002, 29(3): 416−434. DOI: 10.1007/s002590100640. [14] Raffel DM, Chen W. Binding of [3H] mazindol to cardiac norepinephrine transporters: kinetic and equilibrium studies[J]. Naunyn Schmiedebergs Arch Pharmacol, 2004, 370(1): 9−16. DOI: 10.1007/s00210-004-0949-y. [15] Law MP, Osman S, Davenport RJ, et al. Biodistribution and metabolism of [N-methyl-11C]-m-hydroxyphedrine in the rat[J]. Nucl Med Biol, 1997, 24(5): 417−424. DOI: 10.1016/S0969-8051(97)80009-1. [16] Tipre DN, Fox JJ, Holt DP, et al. In vivo PET imaging of cardiac presynaptic sympathoneuronal mechanisms in the rat[J]. J Nucl Med, 2008, 49(7): 1189−1195. DOI: 10.2967/jnumed.107.050252. [17] Pietilä M, Malminiemi K, Ukkonen H, et al. Reduced myocardial carbon-11 hydroxyephedrine retention is associated with poor prognosis in chronic heart failure[J]. Eur J Nucl Med, 2001, 28(3): 373−376. DOI: 10.1007/s002590000449. [18] Olgin JE, Sih HJ, Hanish S, et al. Heterogeneous atrial denervation creates substrate for sustained atrial fibrillation[J]. Circulation, 1998, 98(23): 2608−2614. DOI: 10.1161/01.cir.98.23.2608. [19] Mazzadi AN, André-Fouët X, Duisit J, et al. Cardiac retention of [11C]HED in genotyped long QT patients: a potential amplifier role for severity of the disease[J]. Am J Physiol Heart Circ Physiol, 2003, 285(3): H1286−H1293. DOI: 10.1152/ajpheart.00276.2003. [20] Aoki H, Matsunari I, Nomura Y, et al. Myocardial sympathetic innervation, function, and oxidative metabolism in non-infarcted myocardium in patients with prior myocardial infarction[J]. Ann Nucl Med, 2013, 27(6): 523−531. DOI: 10.1007/s12149-013-0716-6. [21] Geraldes V, Goncalves-Rosa N, Tavares C, et al. Reversing gene expression in cardiovascular target organs following chronic depression of the paraventricular nucleus of hypothalamus and rostral ventrolateral medulla in spontaneous hypertensive rats[J]. Brain Res, 2016, 1646: 109−115. DOI: 10.1016/j.brainres.2016.05.041. [22] Fujita W, Matsunari I, Aoki H, et al. Prediction of all-cause death using 11C-hydroxyephedrine positron emission tomography in Japanese patients with left ventricular dysfunction[J]. Ann Nucl Med, 2016, 30(7): 461−467. DOI: 10.1007/s12149-016-1081-z. [23] Kataoka K, Tomiya Y, Sakamoto A, et al. Altered autonomic nervous system activity in women with unexplained recurrent pregnancy loss[J]. J Obstet Gynaecol Res, 2015, 41(6): 912−918. DOI: 10.1111/jog.12653. [24] Kies P, Wichter T, Schäfers M, et al. Abnormal myocardial presynaptic norepinephrine recycling in patients with Brugada syndrome[J]. Circulation, 2004, 110(19): 3017−3022. DOI: 10.1161/01.CIR.0000146920.35020.44. [25] Stevens MJ, Raffel DM, Allman KC, et al. Regression and progression of cardiac sympathetic dysinnervation complicating diabetes: an assessment by C-11 hydroxyephedrine and positron emission tomography[J]. Metabolism, 1999, 48(1): 92−101. DOI: 10.1016/s0026-0495(99)90016-1. [26] Bengel FM, Ueberfuhr P, Ziegler SI, et al. Serial assessment of sympathetic reinnervation after orthotopic heart transplantation. A longitudinal study using PET and C-11 hydroxyephedrine[J]. Circulation, 1999, 99(14): 1866−1871. DOI: 10.1161/01.cir.99.14.1866. [27] Bravo PE, Lautamäki R, Carter D, et al. Mechanistic insights into sympathetic neuronal regeneration: multitracer molecular imaging of catecholamine handling after cardiac transplantation[J]. Circ Cardiovasc Imaging, 2015, 8(8): e003507. DOI: 10.1161/CIRCIMAGING.115.003507. [28] Cohn JN, Levine TB, Olivari MT, et al. Plasma norepinephrine as a guide to prognosis in patients with chronic congestive heart failure[J]. N Engl J Med, 1984, 311(13): 819−823. DOI: 10.1056/NEJM198409273111303. [29] Del Rosario RB, Jung YW, Caraher J, et al. Synthesis and preliminary evaluation of [11C]-(-)-phenylepnrine as a functional heart neuronal PET agent[J]. Nucl Med Biol, 1996, 23(5): 611−616. DOI: 10.1016/0969-8051(96)00057-1. [30] Raffel DM, Wieland DM. Influence of vesicular storage and monoamine oxidase activity on [11C]phenylephrine kinetics: studies in isolated rat heart[J]. J Nucl Med, 1999, 40(2): 323−330. [31] Raffel DM, Corbett JR, del Rosario RB, et al. Clinical evaluation of carbon-11-phenylephrine: MAO-sensitive marker of cardiac sympathetic neurons[J]. J Nucl Med, 1996, 37(12): 1923−1931. DOI: 10.1097/00004424-199612000-00009. [32] Raffel DM, Chen W, Jung YW, et al. Radiotracers for cardiac sympathetic innervation: transport kinetics and binding affinities for the human norepinephrine transporter[J]. Nucl Med Biol, 2013, 40(3): 331−337. DOI: 10.1016/j.nucmedbio.2012.11.014. [33] He YL, Zhou WN, Wang XG, et al. The synthesis of a new cardiac sympathetic nerve imaging agent N-[11C]CH3-dopamine and biodistribution study[J]. J Radioanal Nucl Chem, 2014, 301(2): 469−474. DOI: 10.1007/s10967-014-3152-8. [34] 周伟娜, 何玉林, 王相成, 等. 急性心肌缺血模型的11C-甲基多巴胺心脏受体显像[J]. 中华核医学与分子影像杂志, 2017, 37(5): 265−268. DOI: 10.3760/cma.j.issn.2095-2848.2017.05.003.
Zhou WN, He YL, Wang XC, et al. Cardiac neuroceptor imaging on acute myocardial ischemia model using 11C-methyldopamine[J]. Chin J Nucl Med Mol Imaging, 2017, 37(5): 265−268. DOI: 10.3760/cma.j.issn.2095-2848.2017.05.003.[35] Delforge J, Syrota A, Lançon JP, et al. Cardiac beta-adrenergic receptor density measured in vivo using PET, CGP 12177, and a new graphical method[J]. J Nucl Med, 1991, 32(4): 739−748. [36] Van Waarde A, Meeder JG, Blanksma PK, et al. Uptake of radioligands by rat heart and lung in vivo: CGP 12177 does and CGP 26505 does not reflect binding to β-adrenoceptors[J]. Eur J Pharmacol, 1992, 222(1): 107−112. DOI: 10.1016/0014-2999(92)90469-k. [37] Wichter T, Schäfers M, Rhodes CG, et al. Abnormalities of cardiac sympathetic innervation in arrhythmogenic right ventricular cardiomyopathy: quantitative assessment of presynaptic norepinephrine reuptake and postsynaptic β-adrenergic receptor density with positron emission tomography[J]. Circulation, 2000, 101(13): 1552−1558. DOI: 10.1161/01.cir.101.13.1552. [38] Nishijima KI, Kuge Y, Motoki N, et al. In vitro and in vivo characterization of high specific activity S-(−)[11C]CGP-12177, a radioligand for β-adrenoreceptor, in rats[J]. Int Congress Ser, 2004, 1264: 261−266. DOI: 10.1016/j.ics.2003.12.103. [39] Link JM, Stratton JR, Levy W, et al. PET measures of pre- and post-synaptic cardiac beta adrenergic function[J]. Nucl Med Biol, 2003, 30(8): 795−803. DOI: 10.1016/j.nucmedbio.2003.09.002. [40] Tsukamoto T, Morita K, Naya M, et al. Decreased myocardial β-adrenergic receptor density in relation to increased sympathetic tone in patients with nonischemic cardiomyopathy[J]. J Nucl Med, 2007, 48(11): 1777−1782. DOI: 10.2967/jnumed.107.043794. [41] Naya M, Tsukamoto T, Morita K, et al. Myocardial β-adrenergic receptor density assessed by 11C-CGP12177 PET predicts improvement of cardiac function after carvedilol treatment in patients with idiopathic dilated cardiomyopathy[J]. J Nucl Med, 2009, 50(2): 220−225. DOI: 10.2967/jnumed.108.056341. [42] Eisenhofer G, Esler MD, Meredith IT, et al. Sympathetic nervous function in human heart as assessed by cardiac spillovers of dihydroxyphenylglycol and norepinephrine[J]. Circulation, 1992, 85(5): 1775−1785. DOI: 10.1161/01.cir.85.5.1775. [43] Fuccio C, Nanni C, Martignani C, et al. 11C-HED PET/CT: Evaluation of the variation of cardiac adrenergic activity in patients with idiopathic heart failure disease after cardiac resynchronization therapy (CRT)[J]. J Nucl Med, 2011, 52(S1): 1141. [44] 鲁志兵, 江洪. 心脏内在自主神经系统在心房颤动发生机制中的作用[J]. 中华心律失常学杂志, 2011, 15(1): 70−73. DOI: 10.3760/cma.j.issn.1007-6638.2011.01.016.
Lu ZB, Jiang H. Role of the intrinsic cardiac autonomic nervous system on mechanism of atrial fibrillation[J]. Chin J Cardiac Arrhythmiol, 2011, 15(1): 70−73. DOI: 10.3760/cma.j.issn.1007-6638.2011.01.016.[45] Chen PS, Chen LS, Fishbein MC, et al. Role of the autonomic nervous system in atrial fibrillation: pathophysiology and therapy[J]. Circ Res, 2014, 114(9): 1500−1515. DOI: 10.1161/CIRCRESAHA.114.303772. -






 下载:
下载: