-
副肿瘤性天疱疮(paraneoplastic pemphigus,PNP)是一种与副肿瘤性自身免疫相关的皮肤黏膜疾病[1]。PNP的发生多与血液系统恶性肿瘤或淋巴增生性疾病有关,其典型的临床症状包括顽固性口腔炎、多形性皮损,常伴有除皮肤外的全身多器官受累。笔者报道了1例与纵隔巨大胸腺瘤相关的PNP病例。
-
患者女性,67岁,于2021年8月因“全身红斑糜烂3月余”入院。2021年5月前患者无明显诱因出现全身红斑,皮肤损害,大水疱伴疼痛、瘙痒,至当地医院给予抗过敏止痒治疗后皮肤损害症状稍好转。2021年7月患者双手、双前臂出现红斑、大水疱,破溃后形成红色糜烂面伴渗液、瘙痒、疼痛,至当地医院治疗并对皮肤行活体组织病理学检查,考虑为寻常型天疱疮,给予甲强龙(120 mg)+人免疫球蛋白(每天15 g,共5 d)治疗后,患者面部皮肤损害愈合结痂,但躯干及双上肢皮肤损害无明显改善。体格检查:颈部、前胸、腹部、背部散在数个红色糜烂面,面积大,全身散在结痂、色素沉着,舌边缘见浅溃疡,自身免疫性疱病严重程度评分(ABSIS)为39分。实验室检查:白细胞计数为12.76×109/L(3.50×109~9.50×109/L),中性粒细胞计数为8.23×109/L(1.80×109~6.30×109/L),纤维蛋白原水平为16.30 g/L(2.00~4.00 g/L),D-二聚体水平为2.83 mg/L(0~0.50 mg/L),红细胞沉降率为44 mm/h(0~20 mm/h),超敏C反应蛋白水平为20.22 mg/L(0~3.00 mg/L) ,Dsg1、Dsg3抗体水平均>200 RU/ml(<20 RU/ml),鼠膀胱间接免疫荧光(IIF)(−)。患者有纵隔占位病史10余年。不排除PNP。给予美卓乐(每天54 mg)+甲氨蝶呤(每周10 mg)治疗,辅以黄连素纱布换药和高锰酸钾药浴治疗。
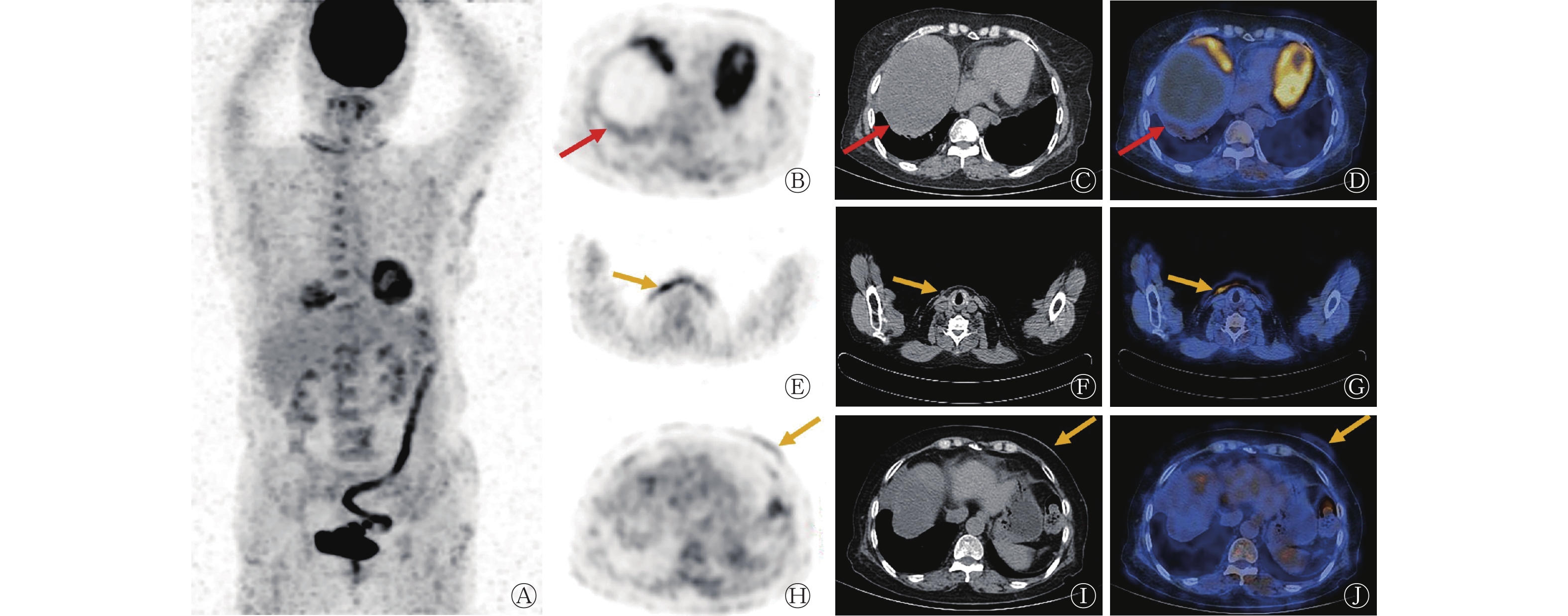
患者CT检查结果:右侧纵隔内巨大囊实性占位,边界清楚,大小为13.9 cm×9.7 cm×13.9 cm,增强CT示实性成分呈渐进性明显强化,平扫期、动脉期、静脉期的CT值分别为24 、42 、72 HU,右肺受压膨胀不全,以右肺中叶为著,纵隔向左侧偏移。为明确全身情况,进一步行18F-FDG PET/CT显像,结果显示,右侧纵隔内巨大囊实性肿物,大小为14.0 cm×9.6 cm×13.7 cm,其内大部分呈水样密度区,CT值为12 HU,放射性分布减低缺损,部分囊壁不均匀增厚,18F-FDG摄取呈不同程度增高,SUVmax=5.7,肿物凸向右侧胸腔,相应右肺受压体积变小,邻近胸膜黏连。多处皮肤轻度增厚伴邻近皮下脂肪层密度轻度增大,18F-FDG摄取轻度增高,SUVmax=4.2。双侧腋窝多发淋巴结18F-FDG摄取轻度增高,短径0.4~0.9 cm,以左侧腋窝为著,部分淋巴结18F-FDG摄取轻度增高,SUVmax=1.6(图1)。考虑纵隔占位伴PNP,双侧腋窝淋巴结炎。

图 1 副肿瘤性天疱疮伴发纵隔巨大胸腺瘤患者(女性,67岁)的18F-FDG PET/CT图
Figure 1. 18F-FDG PET/CT images of a patient (female, 67 years old) with paraneoplastic pemphigus with mediastinal giant thymoma
根据18F-FDG PET/CT显像结果,患者由内科治疗转至胸外科行单孔腹腔镜右侧入路纵隔肿物切除术,术前给予人丙种免疫球蛋白(每天20 g,共3 d)冲击治疗。术中见肿瘤位于纵隔右侧,囊实性,伴水肿、坏死、出血,大小为11.0 cm×9.1 cm×6.0 cm,其旁未见萎缩的胸腺组织。术后组织病理学检查结果:可见梭形、卵圆形肿瘤细胞,异型性不明显,内见纤维组织(图2A);免疫组织化学检查结果示:波形蛋白(Vimentin)(−)、Sall-like蛋白4(SALL4)(−)、人配对盒蛋白(PAX8)(−)、CD56(−)、嗜铬素A(CgA)(−)、突触素(Syn)(−)、CD5(−)、CD117(−)、末端脱氧核苷酸转移酶(TdT)(−);角蛋白(AE1/AE3)(+)、CK19(+)、p63(+)、淋巴细胞CD3(+)、CD20(+)。诊断为A型胸腺瘤。皮肤病灶活体组织病理学检查结果示:广泛基底层上棘层松解,部分区域见基底细胞水肿,表皮内坏死角质形成细胞,真皮浅层苔藓样淋巴细胞浸润(图2B)。结合患者的病史、临床表现和影像检查结果,诊断为PNP。患者随访8个月,皮肤病变好转,病灶有消退,目前情况良好。
-
PNP是一种与肿瘤相关的皮肤黏膜自身免疫性疾病,在临床上较罕见[1]。PNP由Anhalt等[2]于1990年首次提出并命名,其临床表现和免疫表型与寻常型天疱疮相似。PNP导致的自身免疫反应可表现在肺部等器官,因此PNP也被称为副肿瘤性自身免疫多器官综合征[3]。PNP多与血液系统恶性肿瘤或淋巴增生性疾病相关,既往研究结果表明,PNP多伴发于非霍奇金淋巴瘤(40%)、Castleman病(15%~37%)和慢性淋巴细胞白血病(7%~18%)[1]。本例患者伴发于胸腺瘤,较为少见。
PNP的发病机制为原发肿瘤产生的自身抗体与表皮抗原发生免疫应答反应,从而导致皮肤黏膜发生损害[4]。PNP与HLA Ⅱ HLA-DRB1*03和HLA-Cw*14基因相关[5-6]。PNP患者可以产生针对各种靶抗原的自身抗体,其中主要包括Plakin家族蛋白。免疫荧光检查结果显示,PNP患者的免疫球蛋白自身抗体和(或)补体沿表皮细胞间隙和基底膜带沉积[6-8]。鼠膀胱间接免疫荧光(IIF)检查是一种对PNP具有高度特异性的诊断方法,其可以将PNP与其他不含抗Plakin自身抗体的天疱疮区分开。与天疱疮相比,PNP具有不同的人类白细胞抗原Ⅱ(HLA-Ⅱ)等位基因易感性。
PNP以体液免疫和细胞免疫介导的多形性黏膜皮疹为特征,有2种主要的临床表型,即水泡和苔藓样皮疹,可发生在人体任何部位,其最典型的表现是口腔黏膜的广泛糜烂。口腔黏膜的广泛糜烂通常为首发症状,患者还可表现为累及咽部、喉部和食道的黏膜炎,部分患者可观察到肛门受累[1]。本例患者全身红斑糜烂,外院根据患者的临床表现及组织病理学检查结果诊断为天疱疮,因未见明显的口腔溃疡、结膜溃疡症状,医师排除了与肿瘤相关的PNP的可能。
PNP的诊断基于临床表现、组织病理学检查和免疫荧光检查。Svoboda等[9]回顾PNP的既往研究,对其诊断标准进行了修订,修订后的诊断标准包括3个主要标准和2个次要标准。主要标准包括:(1)黏膜病变累及皮肤;(2)体内伴发潜在的肿瘤;(3)血清中抗Plakin自身抗体阳性。次要标准包括:(1)出现棘层松解和(或)苔藓样界面皮炎的组织学特征;(2)免疫荧光检查示细胞间和(或)基底膜染色。满足所有3个主要标准或2个主要及2个次要标准可诊断为PNP。
近年来,PET/CT广泛用于肿瘤恶性程度的判断、临床分期和疗效的评估[10-11],其在PNP的诊断中具有重要价值。在原发肿瘤不明的情况下,PET/CT具有全身显像的独特优势,有助于发现隐匿性的恶性肿瘤,其不仅能够提供解剖定位及功能代谢信息,并且有助于指导临床医师精准地选择活检部位,提高穿刺活检的准确性。另外,PET/CT可帮助医师对原发肿瘤进行正确分期。Seki等[12]研究发现,18F-FDG PET/CT显像的SUVmax可以反映胸腺上皮肿瘤的分类,作为PNP患者治疗前预测预后的参数。本例患者为老年女性,以全身红斑糜烂起病,18F-FDG PET/CT显像表现为纵隔肿物伴坏死,18F-FDG摄取水平中度增高;双侧腋窝多发淋巴结18F-FDG摄取水平轻度增高,考虑与PNP所致的炎症病变有关。18F-FDG PET/CT显像有助于临床医师了解胸腺瘤或其他肿瘤与PNP的内在联系,了解患者的全身情况,有助于治疗方案的确定。
目前,PNP的治疗仍未有标准和临床指南可供参考。与良性肿瘤相关的PNP,如局限性Castleman病和良性胸腺瘤患者,在完整切除原发肿瘤后1~2年内皮肤损害可改善或完全缓解。对于与恶性肿瘤相关的PNP患者,切除原发肿瘤并不能控制或改善皮肤损害,其使用最广泛的治疗方法是全身皮质类固醇激素,也可与其他免疫抑制剂如环孢素、环磷酰胺、硫唑嘌呤和霉酚酸酯等联合应用,皮肤损害可在免疫抑制药物治疗后得到改善[9, 13]。PNP预后较差,病死率高,5年总生存率仅为38%,免疫抑制治疗导致的严重感染等并发症和自身免疫介导的闭塞性毛细支气管炎导致的呼吸衰竭是患者死亡的主要原因[1]。
综上所述,对PNP缺乏了解可能会延误原发肿瘤的诊断和治疗。本例患者行18F-FDG PET/CT显像可辅助临床医师了解胸腺瘤与PNP的内在联系,提高了术前的诊断准确率,为患者进行下一步治疗提供了重要依据。临床上,对于多形性皮肤损害的患者,应考虑PNP的可能,及时行18F-FDG PET/CT显像,以期尽早发现其伴发的潜在或隐匿性肿瘤。
利益冲突 所有作者声明无利益冲突
作者贡献声明 黄文鹏负责论文的撰写与最终版本的修订;邱永康负责病例临床数据的收集与整理;陈钊负责病理资料的收集与整理;廖栩鹤负责影像资料的收集与整理;张旭初负责影像图像的分析;康磊负责论文设计的提出与论文的审阅;范岩负责论文的审阅与指导
副肿瘤性天疱疮伴发纵隔巨大胸腺瘤18F-FDG PET/CT显像1例
Paraneoplastic pemphigus with mediastinal giant thymoma 18F-FDG PET/CT imaging: a case report
-
摘要: 副肿瘤性天疱疮(PNP)是一种与肿瘤相关的皮肤黏膜自身免疫性疾病,其伴发纵隔巨大胸腺瘤在临床较罕见。笔者报道了1例PNP患者,从临床、组织病理学、治疗、18F-氟脱氧葡萄糖(FDG) PET/CT显像等方面分析了PNP的特点,通过文献复习加深了对该病的认识。多形性皮肤损害患者应考虑PNP的可能,其诊断基于临床表现、组织病理学检查以及免疫荧光检查。笔者通过PET/CT显像发现隐匿性的恶性肿瘤,辅助临床医师了解胸腺瘤与PNP的内在联系,提高术前的诊断准确率,并为治疗方案的选择提供重要依据。Abstract: Paraneoplastic pemphigus (PNP) is a tumor-related autoimmune disease affecting the skin and mucosa, while the occurrence of mediastinal giant thymoma with PNP is infrequent in clinical practice. In this study, the authors presents a case of PNP and conducts a comprehensive analysis of its clinical, histopathological, therapeutic, and 18F-fluorodeoxyglucose (FDG) PET/CT imaging characteristics, thereby deepening the understanding of this disease through literature review. The possibility of PNP should be considered in patients with polymorphic skin lesions, the diagnosis of which is based on clinical presentation, histopathologic examination, and immunofluorescence. The autors found occult malignant tumors by PET/CT imaging, which assisted clinicians to understand the intrinsic connection between thymoma and PNP, improved the diagnostic accuracy of preoperative diagnosis, and provided an important basis for the choice of treatment plan.
-
Key words:
-
-
[1] Kim JH, Kim SC. Paraneoplastic pemphigus: paraneoplastic autoimmune disease of the skin and mucosa[J/OL]. Front Immunol, 2019, 10: 1259[2022-06-07]. https://www.frontiersin.org/articles/10.3389/fimmu.2019.01259/full. DOI: 10.3389/fimmu.2019.01259. [2] Anhalt GJ, Kim SC, Stanley JR, et al. Paraneoplastic pemphigus-an autoimmune mucocutaneous disease associated with neoplasia[J]. N Engl J Med, 1990, 323(25): 1729−1735. DOI: 10.1056/NEJM199012203232503. [3] Tirado-Sánchez A, Bonifaz A. Paraneoplastic Pemphigus. A life-threatening autoimmune blistering disease[J]. Actas Dermosifiliogr, 2017, 108(10): 902−910. DOI: 10.1016/j.ad.2017.04.024. [4] Paolino G, Didona D, Magliulo G, et al. Paraneoplastic pemphigus: insight into the autoimmune pathogenesis, clinical features and therapy[J/OL]. Int J Mol Sci, 2017, 18(12): 2532[2022-06-07]. https://www.mdpi.com/1422-0067/18/12/2532. DOI: 10.3390/ijms18122532. [5] Liu Q, Bu DF, Li D, et al. Genotyping of HLA-Ⅰ and HLA-Ⅱ alleles in Chinese patients with paraneoplastic pemphigus[J]. Br J Dermatol, 2008, 158(3): 587−591. DOI: 10.1111/j.1365-2133.2007.08361.x. [6] Costan VV, Popa C, Hâncu MF, et al. Comprehensive review on the pathophysiology, clinical variants and management of pemphigus (Review)[J]. Exp Ther Med, 2021, 22(5): 1335. DOI: 10.3892/etm.2021.10770. [7] Amber KT, Valdebran M, Grando SA. Paraneoplastic autoimmune multiorgan syndrome (PAMS): beyond the single phenotype of paraneoplastic pemphigus[J]. Autoimmun Rev, 2018, 17(10): 1002−1010. DOI: 10.1016/j.autrev.2018.04.008. [8] Didona D, Fania L, Didona B, et al. Paraneoplastic dermatoses: a brief general review and an extensive analysis of paraneoplastic pemphigus and paraneoplastic dermatomyositis[J/OL]. Int J Mol Sci, 2020, 21(6): 2178[2022-06-07]. https://www.mdpi.com/1422-0067/21/6/2178. DOI: 10.3390/ijms21062178. [9] Svoboda SA, Huang SM, Liu XY, et al. Paraneoplastic pemphigus: revised diagnostic criteria based on literature analysis[J]. J Cutan Pathol, 2021, 48(9): 1133−1138. DOI: 10.1111/cup.14004. [10] Li YC, Zhang Y, Fang Q, et al. Radiomics analysis of [18F]FDG PET/CT for microvascular invasion and prognosis prediction in very-early- and early-stage hepatocellular carcinoma[J]. Eur J Nucl Med Mol Imaging, 2021, 48(8): 2599−2614. DOI: 10.1007/s00259-020-05119-9. [11] Khiewvan B, Ziai P, Houshmand S, et al. The role of PET/CT as a prognosticator and outcome predictor in lung cancer[J]. Expert Rev Respir Med, 2016, 10(3): 317−330. DOI: 10.1586/17476348.2016.1147959. [12] Seki N, Sakamoto S, Karube Y, et al. ¹8F-fluorodeoxyglucose positron emission tomography for evaluation of thymic epithelial tumors: utility for World Health Organization classification and predicting recurrence-free survival[J]. Ann Nucl Med, 2014, 28(3): 257−262. DOI: 10.1007/s12149-014-0804-2. [13] Frew JW, Murrell DF. Current management strategies in paraneoplastic pemphigus (paraneoplastic autoimmune multiorgan syndrome)[J]. Dermatol Clin, 2011, 29(4): 607−612. DOI: 10.1016/j.det.2011.06.016. -





 下载:
下载: