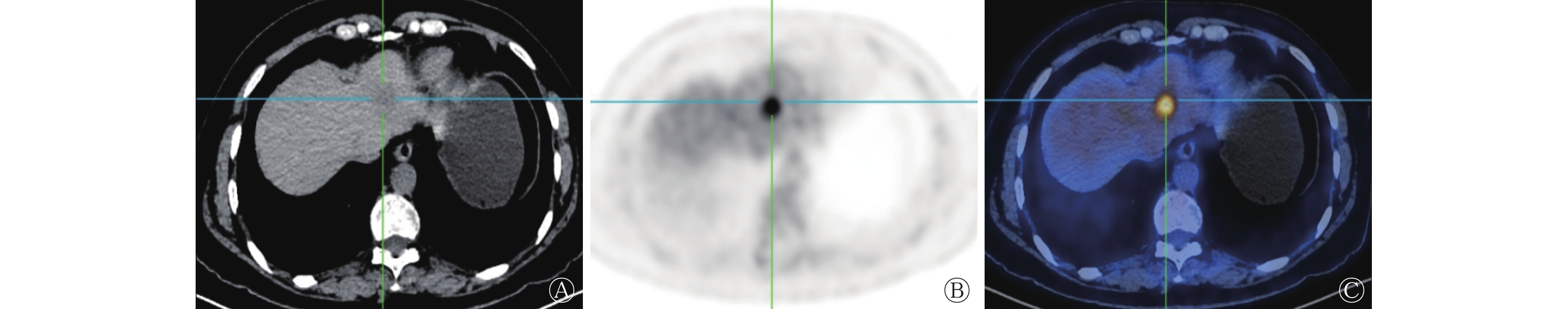
-
肝反应性淋巴样组织增生(reactive lymphoid hyperplasia,RLH)是一种罕见的良性病变,与肝原发黏膜相关淋巴样组织(mucosa-associated lymphoid tissue,MALT)淋巴瘤[1]、肝细胞癌、胆管癌和转移性肝癌相鉴别[2-5]。目前关于肝RLH的18F-FDG PET/CT显像的研究非常少见,国内尚未见有相关文献报道,国外文献也仅有病例报告及文献荟萃[6-9]。肝RLH的18F-FDG PET/CT显像特征尚不明确,本研究旨在提高临床医师对肝RLH的诊断及鉴别诊断能力。
-
回顾性分析2016年9月至2021年7月于复旦大学附属中山医院行18F-FDG PET/CT双时相显像并经手术标本或穿刺组织病理学检查结果确诊为肝RLH的7例患者的临床资料和影像资料,其中男性2例、女性5例,年龄(60.4±3.7)岁,范围为46~77岁。纳入标准:(1)经手术或穿刺组织病理学检查、免疫组织化学检查及基因检测结果确诊为肝RLH;(2)在手术或穿刺组织病理学检查前行18F-FDG PET/CT双时相显像。排除标准:(1)穿刺组织病理学检查结果显示MALT增生性病变且未作免疫组织化学检查;(2)在行18F-FDG PET/CT检查前,肝脏病灶做过治疗的患者;(3)18F-FDG PET/CT图像质量差。患者既往史:乙肝病史2例;自身免疫性肝炎伴肝硬化1例,术前均被误诊为肝癌;4例有肿瘤病史,术前均被误诊为肝转移瘤。7例患者甲胎蛋白、癌胚抗原和糖类抗原19-9等肿瘤标志物均为阴性。本研究经复旦大学附属中山医院生物医学研究伦理委员会批准(批准号:B2021-366)。因本研究为回顾性研究,豁免签署患者知情同意书。
-
应用美国GE公司Discovery VCT 64 PET/CT显像仪。18F-FDG由上海原子科兴药业有限公司提供,放射化学纯度>95%。患者于检查前空腹6 h以上,按体重静脉注射18F-FDG 3.7~5.5 MBq/kg,嘱患者在安静环境中休息1 h后行18F-FDG PET/CT显像。先行CT平扫,扫描范围自颅顶至股骨中部。CT采用螺旋采集模式,采集参数:管电流140 mA、管电压120~140 kV、螺距0.516、矩阵512×512、球管转速0.33 s/圈、重建层厚1.5 mm、间距1.25 mm。随后行PET扫描,患者体位保持不变,在同一范围内采用三维模式采集,采集参数:层厚3.75 mm,2 min/床位,共采集6~7个床位。延迟显像在注射18F-FDG后2~2.5 h内进行,以肝脏为中心进行局部采集。根据CT图像完成对PET图像的衰减校正后进行有序子集最大期望值迭代法重建,得到横断面、冠状面、矢状面的CT、PET和PET/CT融合图像。采用GE Advantage工作站自带的软件在病灶18F-FDG摄取最浓聚的位置勾画ROI,计算SUVmax和滞留指数(retention index,RI)。RI=(延迟显像SUVmax−早期显像SUVmax)/早期显像SUVmax×100%。
-
18F-FDG PET/CT图像由1位核医学科主任医师与2位有9年以上工作经验的主治医师独立阅片,意见不一致时经协商达成一致。观察肝背景、肝病灶数、病灶部位、大小、密度、CT值、形态、边界、早期及延迟显像的SUVmax、RI等。结合彩超及MRI定位肝等密度病灶。
-
采用苏木精-伊红染色法和免疫组织化学染色法观察肝RLH的组织形态;采用原位杂交法检测EB病毒编码miRNA;采用荧光原位杂交(fluorescence in situ hybridization,FISH)技术检测MALT1基因;采用免疫球蛋白基因重排检测技术分析基因克隆性重排情况。
-
以治疗时间为起点,术后或穿刺组织病理学检查后对患者进行定期门诊或电话随访。术后第1年每6个月复查1次,以后每年复查1次,记录患者末次复查肿瘤是否复发及转移的情况。
-
应用IBM SPSS 25.0软件对数据进行统计学分析。符合正态分布的计量资料以
$ \bar x\pm s $ 表示,组间比较采用两独立样本t检验,比较病灶CT值与邻近肝实质CT值的差异;非正态分布的计量资料以M(Q1,Q3)表示;定性资料以频数表示。P<0.05为差异有统计学意义。 -
由表1可知,7例肝RLH患者中,71.4%(5/7)患者为单发病灶、28.6%(2/7)患者为多发病灶,共11个病灶,均位于肝包膜下,其中位于肝左叶5个、肝右叶6个。7个病灶呈类圆形、4个呈椭圆形,均无清晰边界。CT平扫结果显示,11个病灶密度均匀,长径(14.9±1.2) mm,范围5.5~19.2 mm。结合彩超及MRI发现的2个等密度病灶中,1个病灶18F-FDG高摄取合并肝硬化,另1个病灶18F-FDG低摄取无肝硬化。9个病灶呈低密度,CT值为(42.1±3.1) HU,低于邻近肝实质的CT值(55.9±1.5) HU,二者差异有统计学意义(t=−7.36,Ρ<0.001)。
患者
序号既往史 性别 年龄
(岁)病灶数
(个)病灶部位 形态 长径
(mm)CT值
(HU)早期显像
SUVmax延迟显像
SUVmaxRI(%) 肝左叶 肝右叶 椭圆形 类圆形 1 慢性乙型肝炎 男 59 3 2 1 2 1 16.9±1.9 41.7±3.1 6.2±1.1 6.6±2.7 3.3 2 慢性乙型肝炎 男 46 3 1 2 1 2 16.1±3.4 42.6±4.7 2.5±0.8 2.1±0.7 −1.4 3 自身免疫性肝炎合并肝硬化 女 77 1 − 1 1 − 15.0 45.0a 6.4 7.3 14.1 4 结肠癌 女 52 1 − 1 − 1 5.5 54.1a 1.4 2.2 57.1 5 乳腺癌 女 66 1 1 − − 1 17.0 43.7 7.7 8.9 15.8 6 肾乳头状癌 女 64 1 − 1 − 1 16.0 44.5 4.9 5.5 12.2 7 贲门平滑肌瘤 女 59 1 1 − − 1 12.0 41.0 5.6 6.1 8.9 注:a表示病灶CT值接近邻近肝实质;−表示无此项数据。FDG为氟脱氧葡萄糖;PET为正电子发射断层显像术;CT为计算机体层摄影术;SUVmax为最大标准化摄取值;RI为滞留指数 表 1 7例肝反应性淋巴样组织增生患者(11个病灶)的临床资料及18F-FDG PET/CT影像特征
Table 1. Clinical data and 18F-FDG PET/CT imaging features of 7 patients with reactive lymphoid hyperplasia of the liver (11 lesions)
-
18F-FDG PET/CT显像结果显示,11个病灶中,63.6%(7/11)病灶的18F-FDG摄取高于肝实质(典型病例图见图1),其中85.7%(6/7)病灶延迟显像的SUVmax升高,14.3%(1/7)病灶延迟显像的SUVmax降低。18F-FDG PET/CT 早期、延迟显像病灶的SUVmax分别为6.2±0.4和6.8±0.7,RI为12.2%(8.9%,15.5%);36.4%(4/11)病灶的18F-FDG摄取低于或邻近肝实质(典型病例图见图2),18F-FDG PET/CT延迟显像与早期显像病灶的SUVmax无明显变化,分别为2.2±0.4和2.1±0.4。
-
7例肝RLH患者中,1例经穿刺活体组织病理学检查结果确诊为肝RLH,6例经手术组织病理学检查结果确诊为肝RLH。部分肝切除标本的切面呈灰白色,界限清晰,无出血、坏死情况。病变区MALT明显增生伴淋巴滤泡形成,生发中心扩大,核无异型性,周围肝组织汇管区MALT增生(图3)。免疫组织化学检查结果显示,T细胞表面标志物分化抗原簇(cluster of differentiation,CD)3或CD4阳性表达;B细胞表面标志物CD20或CD79a在淋巴滤泡中阳性表达,这提示多克隆性,T细胞与B细胞分布未见异常。生发中心的淋巴细胞B淋巴细胞瘤2阴性表达,CD10阳性表达。1例EB病毒编码miRNA的FISH检测结果为阳性,这提示EB病毒MALT反应性增生,其他6例EB病毒编码miRNA的FISH检测结果均为阴性;FISH方法检测MALT1基因无异常,基因重排结果显示未见免疫球蛋白重基因座(IgH)及T细胞受体克隆性重排。
-
5例单发病灶患者均行手术切除,术后半年至1年电话问诊或影像检查复诊均未发现复发和转移;1例多发病灶患者经肝穿刺活体组织病理学检查结果确诊并进行保守治疗1年后复查的MRI无变化;1例多发病灶患者术后2年余复查的MRI显示新增2个病灶(非手术区),新增最大病灶的长径为18 mm。
-
肝RLH是一种较罕见的良性病变,我们在Pubmed数据库中以“reactive lymphoid hyperplasia”“pseudolymphoma”为关键词,在 MeSH 数据库中以 “liver neoplasm” 为主题词,在中国知网及万方数据库中以“肝反应性淋巴增生”和“肝假性淋巴瘤”为关键词检索文献,剔除重复病例后发现,目前国内外文献报道的病例数合计不超过100例,其性质虽属于良性,但也有恶性病变的可能性[10]。肝RLH的发病机制尚不明确,多数文献报道可能与免疫系统疾病[3, 10-11]、合并慢性肝脏疾病[12]或伴有恶性肿瘤有关[13]。本研究结果与文献报道结果[13]相符,2例伴有乙型肝炎;1例伴有自身免疫性肝炎合并肝硬化;4例伴有肿瘤病史,其中1例手术组织病理学检查结果显示EB病毒感染、1例免疫球蛋白G4阳性。本研究中所有肝RLH患者肿瘤标志物均为阴性,这有助于鉴别肝细胞癌及胆管癌,前者多伴甲胎蛋白水平升高,后者多伴糖类抗原19-9水平升高。
肝RLH可发生于肝脏任何部位,本研究中肝左右叶的发生率接近,均位于肝包膜下,可能与病灶沿血管末梢生长有关[14-19],多数为中老年女性,71.4%(5/7)为单发病灶,28.6%(2/7)为多发病灶,病灶长径为(14.9±1.2) mm,均与文献[3-5, 7, 10]报道的结果一致。本研究中,CT平扫结果显示,81.8%(9/11) 肝RLH病灶呈低密度,这与多数文献[3, 9, 12, 20]报道的结果一致;18.2%(2/11)病灶呈等密度,其中1个合并肝硬化背景,1个肝背景未见异常,以往文献仅Zhong等[6]报道过1例肝RLH病灶呈等密度。本研究中所有病灶密度皆均匀、无坏死、囊变,此特点对于转移瘤的鉴别诊断具有重要的价值。肝RLH呈类圆形或椭圆形,边界均模糊,这可能与病变无纤维包膜、淋巴细胞浸润沿着周围的门静脉束延伸的组织病理学特征有关[1],这不同于胆管癌,后者多呈分叶状、CT表现为纤维组织从胆道向肝实质生长,纤维组织边界多清晰[21]。由于组织病理学特征相似,上述肝RLH的CT影像特征均可见于肝MALT淋巴瘤[1, 21]。
本研究中,63.6%(7/11)的病灶表现为18F-FDG 摄取高于肝实质,36.4%(4/11 )的病灶为8F-FDG低摄取,这与以往文献[6-7, 9]报道的肝RLH多为8F-FDG高摄取一致;18F-FDG高摄取的病灶早期及延迟显像的SUVmax分别为6.2±0.4和6.8±0.7,这与以往文献[6-9]报道相似。通过18F-FDG PET/CT显像不仅能发现肝RLH病灶,其还有助于与其他肝恶性肿瘤相鉴别[19, 22],肝MALT淋巴瘤与其他侵袭性淋巴瘤相比,其18F-FDG摄取强度较低[23-28],与肝RLH类似。本研究18F-FDG高摄取病灶中,85.7%(6/7)病灶延迟显像的SUVmax升高,RI为12.2(8.9,15.5)%,这与Zhang等[8]的研究结果相似,1个肝RLH病灶早期和延迟显像的SUVmax分别为4.81和5.24,RI为8.9%,这说明肝RLH与肝恶性肿瘤有相似的18F-FDG PET/CT双时相显像特征[29],因此肝RLH的诊断及鉴别诊断,还需要结合临床、实验室检查等,尤其是与肝MALT淋巴瘤相鉴别时,只能通过免疫组织化学检查和遗传学分析法进行明确区分[1]。
本研究中我们还发现,同1例患者多发病灶的18F-FDG摄取相同或不相同,这与Zhang等[8]的研究结果一致,1例肝RLH多发病灶患者中,2个小病灶无明显18F-FDG摄取,1个大病灶18F-FDG高摄取,不同之处是本研究即使病灶大小相近,其摄取可能相近也可能相差很大,我们猜测其可能与病灶中增生性淋巴滤泡、淋巴细胞和其他炎症细胞数目的不同有关。本研究还存在不足之处:肝RLH本身为罕见病,所纳入的样本量较少,结果可能存在偏倚,需在今后加大样本量继续进行研究。
总之,肝RLH病灶多位于肝包膜下,呈均匀稍低密度灶,边界模糊,18F-FDG PET/CT显像显示病灶多数18F-FDG高摄取,少部分呈等摄取或低摄取,延迟显像SUVmax多升高,多发病灶18F-FDG摄取可能相近也可能相差很大。这可能与肝恶性肿瘤有类似的双时相显像特征有关,最终仍需结合组织病理学检查、免疫组织化学检查及基因学检查结果进行确诊。
利益冲突 所有作者声明无利益冲突
作者贡献声明 赵小二负责研究命题的设计、论文的撰写、最终版本的修订;陈伶俐、纪元负责数据的获取与分析;曾蒙苏负责论文的审阅;王明亮负责数据的分析、统计学分析方法的指导
肝反应性淋巴样组织增生18F-FDG PET/CT双时相显像表现
18F-FDG PET/CT dual-phase imaging characteristics of reactive lymphoid hyperplasia of liver
-
摘要:
目的 探讨肝反应性淋巴样组织增生(RLH)的18F-氟脱氧葡萄糖(FDG) PET/CT双时相显像表现。 方法 回顾性分析2016年9月至2021年7月于复旦大学附属中山医院行18F-FDG PET/CT双时相显像并经手术标本或穿刺组织病理学检查结果确诊为肝RLH的7例患者的临床资料和影像资料,其中男性2例、女性5例,年龄(60.4±3.7)岁。观察肝RLH的 18F-FDG PET/CT显像表现,分别测量及计算病灶长径、病灶与邻近肝脏的CT值、早期显像及延迟显像的最大标准化摄取值(SUVmax)、肝本底 SUVmax、滞留指数(RI)。符合正态分布的计量资料的比较采用两独立样本t检验。 结果 7例肝RLH患者中,71.4%(5/7)患者为单发病灶、28.6%(2/7)患者为多发病灶,共11个病灶,均位于肝包膜下,其形态呈类圆形或椭圆形,边界模糊,长径5.5~19.2(14.9±1.2) mm。CT平扫结果显示,11个病灶密度均匀,其中2个病灶呈等密度,9个病灶呈低密度,其CT值为(42.1±3.1) HU,低于邻近肝实质的CT值(55.9±1.5) HU,且二者的差异有统计学意义(t=−7.36,Ρ<0.001)。18F-FDG PET/CT显像结果显示,63.6%(7/11)病灶的18F-FDG摄取高于肝实质,其中85.7%(6/7)病灶延迟显像的SUVmax升高,14.3%(1/7)病灶延迟显像的SUVmax降低,早期、延迟显像病灶的SUVmax分别为6.2±0.4和6.8±0.7,RI为12.2%(8.9%,15.5%);36.4%(4/11)病灶的18F-FDG 摄取低于或邻近肝实质,延迟显像病灶的SUVmax无明显变化,早期、延迟显像病灶的SUVmax分别为2.2±0.4和2.1±0.4。 结论 肝RLH病灶多位于肝包膜下,呈均匀稍低密度灶,边界模糊。18F-FDG PET/CT显像显示多数病灶18F-FDG高摄取,少数病灶呈等摄取或低摄取,延迟显像SUVmax多升高,多发病灶18F-FDG摄取相近或相差很大。 -
关键词:
- 假淋巴瘤 /
- 肝 /
- 正电子发射断层显像术 /
- 体层摄影术,X线计算机 /
- 氟脱氧葡萄糖F18 /
- 最大标准化摄取值
Abstract:Objective To explore 18F-flurodexyglucose (FDG) PET/CT dual-phase imaging characteristics of reactive lymphoid hyperplasia (RLH) of the liver. Methods The clinical and imaging data of 7 patients with liver RLH diagnosed by 18F-FDG PET/CT dual-phase imaging in Zhongshan Hospital Affiliated with Fudan University from September 2016 to July 2021 were analyzed retrospectively. The patients comprised 2 males and 5 females, aged (60.4±3.7) years. The 18F-FDG PET/CT imaging findings of the lesions were observed. The length and diameter of the lesions, CT values of the lesions and the adjacent liver, maximum standardized uptake value (SUVmax), liver background SUVmax, and retention index (RI) were measured and calculated. The measurement data in accordance with normal distribution were compared by two independent sample t-test. Results Among the 7 patients with liver RLH, 71.4% (5/7) patients had a single lesion, whereas 28.6% (2/7) patients had multiple lesions, amounting to 11 lesions in total, all of which were located under the liver capsule. The shape of the lesions was quasi-round or oval, the boundary was blurred, and the length diameter of lesions was 5.5–19.2 (14.9±1.2) mm. The results of the CT plain scan showed that the density of 11 lesions was homogeneous, of which 2 lesions showed isodensity and 9 lesions were hypodense. The CT value of 11 lesions was lower than that of adjacent hepatic parenchyma (42.1±3.1) HU, which was lower than that of adjacent hepatic parenchyma (55.9±1.5) HU, and the difference between them was statistically significant (t=−7.36, P<0.001). The results of 18F-FDG PET/CT imaging showed that the 18F-FDG uptake of 63.6% (7/11) lesions was higher than that of liver parenchyma, of which SUVmax of 85.7% (6/7) lesions increased, and SUVmax of 14.3% (1/7) lesions decreased. The SUVmax values of early imaging and delayed imaging lesions were 6.2±0.4 and 6.8±0.7, respectively. RI was 12.2% (8.9%, 15.5%). The 18F-FDG uptake of 36.4% lesions was lower than or adjacent to the liver parenchyma, and SUVmax of delayed imaging had no significant change. SUVmax of early imaging and delayed imaging were 2.2±0.4 and 2.1±0.4, respectively. Conclusions Most of the liver RLH lesions were located under the liver capsule, showing homogeneous and slightly low-density lesions, and the boundary was blurred. 18F-FDG PET/CT imaging showed high 18F-FDG uptake in most lesions, equal or low uptake in a few lesions, increased SUVmax in delayed imaging, and similar or different patterns of 18F-FDG uptake in multiple lesions. -
表 1 7例肝反应性淋巴样组织增生患者(11个病灶)的临床资料及18F-FDG PET/CT影像特征
Table 1. Clinical data and 18F-FDG PET/CT imaging features of 7 patients with reactive lymphoid hyperplasia of the liver (11 lesions)
患者
序号既往史 性别 年龄
(岁)病灶数
(个)病灶部位 形态 长径
(mm)CT值
(HU)早期显像
SUVmax延迟显像
SUVmaxRI(%) 肝左叶 肝右叶 椭圆形 类圆形 1 慢性乙型肝炎 男 59 3 2 1 2 1 16.9±1.9 41.7±3.1 6.2±1.1 6.6±2.7 3.3 2 慢性乙型肝炎 男 46 3 1 2 1 2 16.1±3.4 42.6±4.7 2.5±0.8 2.1±0.7 −1.4 3 自身免疫性肝炎合并肝硬化 女 77 1 − 1 1 − 15.0 45.0a 6.4 7.3 14.1 4 结肠癌 女 52 1 − 1 − 1 5.5 54.1a 1.4 2.2 57.1 5 乳腺癌 女 66 1 1 − − 1 17.0 43.7 7.7 8.9 15.8 6 肾乳头状癌 女 64 1 − 1 − 1 16.0 44.5 4.9 5.5 12.2 7 贲门平滑肌瘤 女 59 1 1 − − 1 12.0 41.0 5.6 6.1 8.9 注:a表示病灶CT值接近邻近肝实质;−表示无此项数据。FDG为氟脱氧葡萄糖;PET为正电子发射断层显像术;CT为计算机体层摄影术;SUVmax为最大标准化摄取值;RI为滞留指数 -
[1] 刘冲, 李霄, 李海, 等. 肝脏原发黏膜相关淋巴组织结外边缘区淋巴瘤及肝脏假性淋巴瘤的临床病理特征[J]. 中华病理学杂志, 2018, 47(1): 39−44. DOI: 10.3760/cma.j.issn.0529-5807.2018.01.008.
Liu C, Li X, Li H, et al. Clinicopathologic features of primary hepatic marginal zone lymphoma of mucosa-associated lymphoid tissue and hepatic pseudolymphoma[J]. Chin J Pathol, 2018, 47(1): 39−44. DOI: 10.3760/cma.j.issn.0529-5807.2018.01.008.[2] Lv A, Liu W, Qian HG, et al. Reactive lymphoid hyperplasia of the liver mimicking hepatocellular carcinoma incidental finding of two cases[J]. Int J Clin Exp Pathol, 2015, 8(5): 5863−5869. [3] Calvo J, Carbonell N, Scatton O, et al. Hepatic nodular lymphoid lesion with increased IgG-4-positive plasma cells associated with primary biliary cirrhosis: a report of two cases[J]. Virchows Arch, 2015, 467(5): 613−617. DOI: 10.1007/s00428-015-1841-5. [4] Kwon YK, Jha RC, Etesami K, et al. Pseudolymphoma (reactive lymphoid hyperplasia) of the liver: a clinical challeng[J]. World J Hepatol, 2015, 7(26): 2696−2702. DOI: 10.4254/wjh.v7.i26.2696. [5] Taguchi K, Kuroda S, Kobayashi T, et al. Pseudolymphoma of the liver: a case report and literature review[J]. Surg Case Rep, 2015, 1(1): 107. DOI: 10.1186/s40792-015-0110-9. [6] Zhong X, Dong A, Dong H, et al. FDG PET/CT in 2 cases of hepatic pseudolymphoma[J]. Clin Nucl Med, 2018, 43(5): e166−e169. DOI: 10.1097/RLU.0000000000002053. [7] Suzumura K, Hatano E, Okada T, et al. Hepatic pseudolymphoma with fluorodeoxyglucose uptake on positron emission tomography[J]. Case Rep Gastroenterol, 2017, 10(3): 826−835. DOI: 10.1159/000481936. [8] Zhang B, Zou M, Lu Z, et al. Imaging manifestations of intrahepatic reactive lymphoid hyperplasia: a case report and literature review[J]. Front Oncol, 2021, 11: 694934. DOI: 10.3389/fonc.2021.694934. [9] Kanno H, Sakai H, Hisaka T, et al. A case of reactive lymphoid hyperplasia of the liver in a patient with autoimmune hepatitis[J]. Surgical Case Reports, 2020, 6(1): 90. DOI: 10.1186/s40792-020-00856-3. [10] Okubo H, Maekawa H, Ogawa K, et al. Pseudolymphoma of the liver associated with Sjogren's syndrome[J]. Scand J Rheumatol, 2001, 30(2): 117−119. DOI: 10.1080/03009740151095466. [11] Yang CT, Liu KL, Lin MC, et al. Pseudolymphoma of the liver: report of a case and review of the literature[J]. Asian J Surg, 2017, 40(1): 74−80. DOI: 10.1016/j.asjsur.2013.07.013. [12] Kunimoto H, Morihara D, Nakane SI, et al. Hepatic pseudolymphoma with an occult hepatitis B virus infection[J]. Intern Med, 2018, 15, 57(2): 223−230. DOI: 10.2169/internalmedicine.8981-17. [13] Seitter S, Goodman ZD, Friedman TM, et al. Intrahepatic reactive lymphoid hyperplasia: a case report and review of the literature[J]. Case Rep Surg, 2018, 2018: 9264251. DOI: 10.1155/2018/9264251. [14] 徐孙旺, 陈炜, 王坚. 肝假性淋巴瘤一例[J]. 中华肝胆外科杂志, 2018, 24(6): 370, 375. DOI: 10.3760/cma.j.issn.1007-8118.2018.06.003.
Xu SW, Chen W, Wang J. Hepatic pseudolymphoma: a case report[J]. Chin J Hepatobiliary Surg, 2018, 24(6): 370, 375. DOI: 10.3760/cma.j.issn.1007-8118.2018.06.003.[15] Zhou Y, Wang X, Xu C, et al. Hepatic pseudolymphoma: imaging features on dynamic contrast-enhanced MRI and diffusion-weighted imaging[J]. Abdom Radiol, 2018, 43(9): 2288−2294. DOI: 10.1007/s00261-018-1468-5. [16] Sonomura T, Anami S, Takeuchi T, et al. Reactive lymphoid hyperplasia of the liver: perinodular enhancement on contrast-enhanced computed tomography and magnetic resonance imaging[J]. World J Gastroenterol, 2015, 7, 21(21): 6759−6763. DOI: 10.3748/wjg.v21.i21.6759. [17] Takahashi Y, Seki H, Sekino Y. Pseudolymphoma with atrophic parenchyma of the liver: report of a case[J]. Int J Surg Case Rep, 2018, 49: 136−139. DOI: 10.1016/j.ijscr.2018.06.033. [18] Caputo D, Cartillone M, Coppola R. All that glitters are not gold! Reactive lymphoid hyperplasia mimicking colorectal liver metastases: description of a case and literature review[J]. Updates Surg, 2017, 69(1): 113−115. DOI: 10.1007/s13304-017-0416-1. [19] 毛武剑, 石洪成. 18F-FDG PET/CT在结直肠癌肝转移诊治中的应用价值[J]. 中华核医学与分子影像杂志, 2019, 39(9): 560−563. DOI: 10.3760/cma.j.issn.2095-2848.2019.09.014.
Mao WJ, Shi HC. Value of 18F-FDG PET/CT in the diagnosis and treatment of colorectal cancer liver metastases[J]. Chin J Nucl Med Mol Imaging, 2019, 39(9): 560−563. DOI: 10.3760/cma.j.issn.2095-2848.2019.09.014.[20] 戴辰晨, 朱小东, 陈伶俐, 等. 肝假性淋巴瘤19例临床分析[J]. 中华肝胆外杂志, 2019, 25(5): 337−339. DOI: 10.3760/cma.j.issn.1007-8118.2019.05.005.
Dai CC, Zhu XD, Chen LL, et al. A clinical analysis of 19 patients with hepatic pseudolymphoma[J]. Chin J Hepatobiliary Surg, 2019, 25(5): 337−339. DOI: 10.3760/cma.j.issn.1007-8118.2019.05.005.[21] Ippolito D, Porta M, Maino C, et al. Diagnostic approach in hepatic lymphoma: radiological imaging findings and literature review[J]. Cancer Res Clin Oncol, 2020, 146(6): 1545−1558. DOI: 10.1007/s00432-020-03205-x. [22] 邬心爱, 邬永军, 王雪梅, 等. 18F-FDG双时相及 18F-FDG联合 11C-CHO PET/CT多模态显像在原发性肝细胞肝癌中的诊断价值[J]. 国际放射医学核医学杂志, 2021, 45(3): 139−146. DOI: 10.3760/cma.j.cn121381-202001020-00025.
Wu XA, Wu YJ, Wang XM, et al. Diagnostic value of 18F-FDG dual-phase and 18F-FDG combined with 11C-CHO PET/CT multimodality imaging in primary hepatocellular carcinoma[J]. Int J Radia Med Nucl Med, 2021, 45(3): 139−146. DOI: 10.3760/cma.j.cn121381-202001020-00025.[23] Park YK, Choi JE, Jung WY, et al. Mucosaassociated lymphoid tissue (MALT) lymphoma as an unusual cause of malignant hilar biliary stricture: a case report with literature review[J]. World J Surg Oncol, 2016, 14(1): 167. DOI: 10.1186/s12957-016-0928-z. [24] Bohlok A, De Grez T, Bouazza F, et al. Primary hepatic lymphoma mimicking a hepatocellular carcinoma in a cirrhotic patient: case report and systematic review of the literature[J]. Case Rep Surg, 2018, 2018: 9183717. DOI: 10.1155/2018/9183717. [25] Chen YY, Chen YF, Chen CH. A long-term follow-up of primary hepatic mucosa-associated lymphoid tissue lymphoma[J]. Dig Liver Dis, 2020, 52(11): 1365−1366. DOI: 10.1016/j.dld.2020.04.024. [26] Dong A, Xiao Z, Yang J, et al. CT, MRI, and 18F-FDG PET/CT findings in untreated pulmonary and hepatic B-cell lymphoma of mucosa-associated lymphoid tissue (MALT) over a five-year period: a case report[J]. Medicine (Baltimore), 2016, 95(12): e3197. DOI: 10.1097/MD.0000000000003197. [27] Bao C, Wei J, Zhao X, et al. Prognostic value of fluorine-18-fluorodeoxyglucose positron emission tomography/computed tomography in primary hepatic mucosaassociated lymphoid tissue lymphoma: a case report and review of the literature[J]. Medicine (Baltimore), 2018, 97(10): e9877. DOI: 10.1097/MD.0000000000009877. [28] Albano D, Giubbini R, Bertagna F. 18F-FDG PET/CT and primary hepatic MALT: a case series[J]. Abdom Radiol (NY), 2016, 41(10): 1956−1959. DOI: 10.1007/s00261-016-0800-1. [29] 吴冰, 韩磊, 姜磊, 等. 18F-FDG PET/CT双时相显像在肝细胞肝癌诊断中的应用价值[J]. 中华核医学与分子影像杂志, 2014, 34(1): 58−59. DOI: 10.3760/cma.j.issn.2095-2848.2014.01.017.
Wu B, Han L, Jiang L, et al. Application value of 18F-FDG PET/CT dual-phase imaging in the diagnosis of hepatocellular carcinoma[J]. Chin J Nucl Med Mol Imaging, 2014, 34(1): 58−59. DOI: 10.3760/cma.j.issn.2095-2848.2014.01.017. -






 下载:
下载: