-
PET显像是核医学领域中先进的临床影像检查技术,在疾病的无创显像方面具有独特的优势,特别是在肿瘤、冠状动脉粥样硬化性心脏病和脑部疾病这三大类疾病的早期诊疗中显示出重要的价值。18F-FDG是目前最常用的PET显像剂,已被成功地应用于临床对肿瘤的良恶性鉴别、肿瘤恶性程度的评价和治疗效果的监测等方面。但18F-FDG存在特异性差、某些肿瘤摄取低以及存在炎症病变摄取等问题,其在肿瘤的鉴别诊断中会造成一定的假阳性或假阴性结果[1]。肿瘤细胞不仅表现出对葡萄糖利用的增加,其对氨基酸的摄取和利用也有增加。有研究者提出,18F-FDG摄取呈阴性的肿瘤可能通过不同的代谢途径——谷氨酰胺代谢途径来进行代谢[2]。谷氨酰胺进入肿瘤细胞后,首先被谷氨酰胺酶转化为谷氨酸,谷氨酸随后被谷氨酸脱氢酶再除去一个氨基,生成α-酮戊二酸,进入缩短的三羧酸循环,产生代谢底物和能量,维持肿瘤细胞的快速生长和增殖需要。因此,谷氨酰胺与谷氨酸在肿瘤的适应性中间代谢中发挥着重要的作用[3]。
-
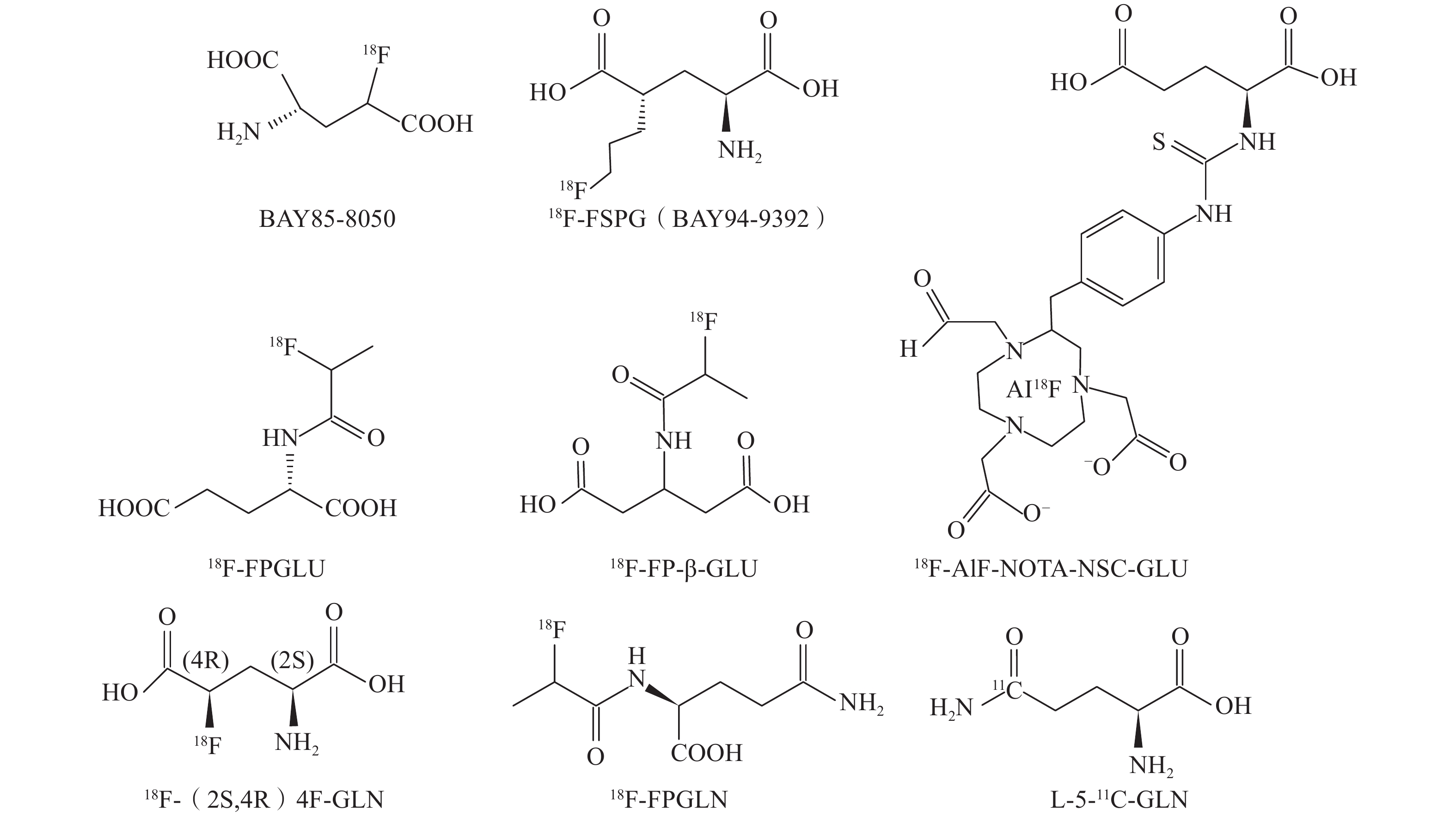
谷氨酰胺是谷氨酸的酰胺,谷氨酸羧基碳上的一个羟基被氨基取代即得到谷氨酰胺,二者结构非常相似。谷氨酰胺是肿瘤细胞主要的“呼吸燃料”和重要氮源[4]。有研究结果显示,谷氨酰胺与谷氨酸转运体在许多肿瘤细胞中过度表达,而在正常组织或炎症组织中低表达或不表达[5-6]。由于肿瘤细胞对谷氨酰胺和谷氨酸的需求量远大于正常组织,将用正电子核素标记的谷氨酸与谷氨酰胺类似物引入体内,会导致肿瘤细胞对其的选择性摄取,滞留在肿瘤细胞中的谷氨酸与谷氨酰胺类似物将发生代谢或以原型形式存在,因此肿瘤细胞中被标记的谷氨酸与谷氨酰胺类似物的浓度可以反映出细胞代谢及谷氨酰胺与谷氨酸转运体的表达情况,从而实现活体PET分子显像[7]。本文综述了谷氨酸与谷氨酰胺类似物PET显像剂的基本原理、常见的PET显像剂及其临床前与临床中的应用。常见的谷氨酸与谷氨酰胺类似物PET显像剂的结构式见图1。

图 1 常见的谷氨酸与谷氨酰胺类似物PET显像剂的结构式
Figure 1. Structure of common glutamate and glutamine analogue PET agents
谷氨酰胺可以通过多种氨基酸转运系统进行跨膜转运,分别是系统 A、N、ASC、B0,+、b0,+、L和y+L,共包含15个转运体,其中丙氨酸-丝氨酸-半胱氨酸转运体2(ASCT2)似乎是许多肿瘤细胞中谷氨酰胺摄取最多和不受调节的转运体。除系统b0,+ 和L 外,其他均为Na+依赖性氨基酸转运系统,由Na+/K+-ATP酶提供跨膜转运所需的能量。这些转运体是非特异性的,它们是多种氨基酸的转运体,对某些氨基酸的亲和力甚至远大于谷氨酰胺[4]。谷氨酰胺进入肿瘤细胞后通常以原型形式存在或者参与蛋白质的合成[8],因而能在肿瘤细胞内滞留更长的时间。
谷氨酸转运系统主要包括Na+依赖性氨基酸转运系统XAG-、ASC和非Na+依赖性氨基酸转运系统XC-,其中系统XAG-和XC-较为重要[9]。系统XC-包括4F2hc和xCT 2种转运体,是非Na+依赖性和Cl−依赖性的胱氨酸/谷氨酸逆向转运系统,为细胞内谷胱甘肽的合成提供半胱氨酸。系统XAG-包括 5种高亲和力的兴奋性氨基酸转运体(excitatory amino acid transporters,EAAT),分别为EAAT1、EAAT2、EAAT3、EAAT4和EAAT5,XAG-是一种转运谷氨酸时伴随着质子与K+交换的Na+依赖性氨基酸转运系统,可除去由系统XC-或其他方式释放到细胞外间隙的谷氨酸,维持细胞外谷氨酸平衡。系统XAG-也可为细胞内提供谷氨酸和半胱氨酸,并与细胞内甘氨酸和由系统XC-转入的半胱氨酸结合形成谷胱甘肽。谷胱甘肽是一种可对抗细胞内氧化应激状态的重要分子,在活性氧作用下可转化为氧化型谷胱甘肽,由此可见,系统XAG-和XC-与氧化应激密切相关,二者共同维持着细胞内外谷氨酸的动态平衡[10]。在病理状态下,肿瘤组织中系统XAG-和XC-相应转运体表达上调,导致细胞内外谷氨酸失衡,因此,系统XAG-和XC-可被看作潜在的肿瘤鉴别诊断的重要靶标。
-
4-18F-氟谷氨酸(即BAY85-8050)是一种靶向系统XC-的谷氨酸类似物PET显像剂,其在健康志愿者体内的生物学分布显示,肾脏、胰腺和心脏对其存在大量摄取,从注射后约20 min开始,骨摄取量随时间延长而增加,BAY85-8050在其他器官组织内无明显蓄积,主要通过肾脏清除,且随尿液排出[11]。BAY85-8050是18F-(2S,4S)-氟谷氨酸和18F-(2S,4R)-氟谷氨酸对映异构体,由于肿瘤细胞对显像剂的摄取是具有高度立体选择性的,这使得对BAY85-8050生物数据的分析变得复杂,而且这2种结构在体内均表现出脱氟的情况,限制了其进一步的临床应用[12]。为了能够利用PET显像观察过度表达系统XC-相应转运体的肿瘤,需要有一种不仅代谢稳定,而且能与系统XC-相应转运体特异性相互作用的PET显像剂——18F-FSPG,即BAY94-9392。与BAY85-8050相比,该显像剂结构单一,而且稳定性更好,其特征是在人体内可以从除胰腺和肾脏外的大多数正常组织中快速清除;在低背景吸收条件下,二者具有一致的生物学分布模式[13]。18F-FSPG通过系统XAG-与XC-进行转运,其中系统XC-占主导地位,其摄取与疾病导致的氧化应激状态密切相关。目前,对18F-FSPG已经进行了广泛的临床前与临床试验研究。有研究结果显示,18F-FSPG能够无创地监测自身免疫性脑脊髓炎小鼠体内系统XC-相应转运体的活性,而系统XC-相应转运体的表达与机体内氧化应激、免疫细胞运输和多发性硬化症的临床症状相关,因此,18F-FSPG作为一种灵敏工具在判断三者临床症状之间的联系中具有巨大的潜力[14]。在临床试验方面,18F-FSPG在非小细胞肺癌、肝细胞癌、颅内恶性肿瘤、结节病、胰腺导管腺癌和前列腺癌的PET显像中均显示出较高的肿瘤检出率和肿瘤/背景比值,具有良好的肿瘤可视化效果,甚至在某些肿瘤的检测中优于18F-FDG,例如肝细胞癌和脑肿瘤,这与临床前试验结果一致,且患者对18F-FSPG的耐受性良好,无相关不良事件,具有良好的临床应用价值[15-20]。鉴于氧化还原机制在肿瘤发生、治疗反应和耐药性发展中的重要性,18F-FSPG有望发展成为一种靶向多种肿瘤的临床常规使用的PET显像剂。
-
18F-FPGLU可以识别高代谢活性的肿瘤,是一种潜在的谷氨酸类似物PET显像剂。体外细胞和体内动物实验结果表明,18F-FPGLU主要通过系统XAG-和XC-进行转运,EAAT1是18F-FPGLU在肿瘤PET显像中的重要转运体[21]。18F-FPGLU在小鼠体内表现出相对较好的药代动力学特性,在S180纤维肉瘤、SPC-A-1和LTEP-a-2人肺腺癌小鼠模型中,18F-FPGLU均显示出良好的摄取和肿瘤/背景比值[22]。Sun等[23]采用改进的商业FDG合成器,将前体(2S)-二甲基2-(2-溴-溴丙酰胺)戊二酸酯通过两步水解合成18F-FPGLU,优化了其合成路线,并与18F-FDG显像进行比较,评估其在携带SMCC-7721人肝细胞癌裸鼠中的价值,PET显像结果显示,18F-FPGLU在肿瘤中为预期的高摄取和长时间滞留,其显像结果优于18F-FDG。综上,18F-FPGLU可能是一种很有前景的肺腺癌和肝细胞癌的PET显像剂,但需要更多的临床前和临床试验来进一步证明其应用价值。
-
研究结果显示,β-氨基酸及其类似物具有强大的生物活性,如β-谷氨酸可以作为谷氨酰胺合成酶的底物,以及谷氨酸能神经元的选择性抑制剂。与对应的α-氨基酸类似物相比,这些β-氨基酸类似物被证明对多种蛋白水解酶具有良好的稳定性。Liu等[24]在改进的FDG合成器上,将前体4(二乙基3-(2-溴丙酰胺)戊二酸酯)通过两步反应合成了一种新型β-氨基酸类似物PET显像剂——18F-FP-β-GLU;小动物PET研究结果显示,18F-FP-β-GLU在SPC-A-1人肺腺癌荷瘤小鼠模型中表现出快速的肿瘤摄取和良好的肿瘤/肺比值;在肾脏和膀胱中发现了较高的放射性积聚,这表明该显像剂主要通过泌尿系统被清除。综上,与18F-FPGLU PET显像特征相比,18F-FP-β-GLU在SPC-A-1人肺腺癌荷瘤小鼠模型中具有相似的肿瘤靶向效果和生物学分布特征,但其从体内清除相对容易,因此,18F-FP-β-GLU可能是一种潜在的肿瘤PET显像剂。
-
肝癌在我国是一种常见的恶性肿瘤,其早期表现很不典型,往往容易被忽视。早诊断早治疗可以改善肝癌患者的预后、延长有效生存期,但肝癌的早期诊断缺乏理想的影像检查方法。目前临床上最常用的葡萄糖代谢PET显像剂18F-FDG对肝细胞癌的诊断效果有限,容易出现一定的假阴性或假阳性结果,而谷氨酸类似物PET显像剂可以在一定程度上弥补18F-FDG在临床应用中的不足。Lin等[25]利用18F-AlF络合前体NOTA-NSC-GLU,合成18F-AlF-NOTA-NSC-GLU,这是一种靶向肝癌的PET显像剂,与其他氨基酸显像剂的合成相比,其合成方法简单,耗时较短;18F-AlF-NOTA-NSC-GLU主要通过系统XAG-进行转运,部分通过系统B0,+和XC-进行转运,几乎不参与蛋白质的合成;定量结果显示,HepG2 肝细胞癌荷瘤裸鼠模型在注射18F-AlF-NOTA-NSC-GLU 30 min 后肿瘤清晰可见,肿瘤组织对其摄取高于周围正常组织,肿瘤/肝脏摄取比值稍高于注射18F-FDG 60 min后的摄取比值,该结果表明18F-AlF-NOTA-NSC-GLU在肝细胞癌PET显像中具有潜在的应用价值。
-
目前,大多数研究报道的谷氨酰胺类似物PET显像剂的显像原理均是针对氨基酸转运体的增加,但是由于它们在结构上与谷氨酰胺有所差异,因此,不太可能对肿瘤谷氨酰胺代谢的增加具有特异性。18F-(2S,4R)4F-GLN是一种定位于谷氨酰胺代谢途径的PET显像剂,主要通过氨基酸转运系统ASC,特别是其亚型丙氨酸-丝氨酸-半胱氨酸转运体2(ASCT2)进行跨膜转运。18F-(2S,4R)4F-GLN进入细胞后,参与蛋白质的合成,并被大量整合到蛋白质中,因而能在体内滞留更长时间[26]。体外细胞摄取实验结果显示,18F-(2S,4R)4F-GLN在9L胶质瘤细胞中具有相对较高的摄取率和滞留率,对在皮下注射9L胶质瘤细胞形成异种移植物的F344大鼠中进行的PET显像结果显示,18F-(2S,4R)4F-GLN浓聚于肿瘤组织中,其摄取量明显高于周围肌肉和肝脏组织[27]。与健康受试者相比,18F-(2S,4R)4F-GLN在癌症患者大多数正常器官中的SUVmax较低,尤其是在肺、肌肉、脾和心脏中,但在肝脏和骨组织中具有较高的摄取[28]。一项纳入了25例不同癌症(乳腺癌、胰腺癌、肾癌、神经内分泌癌、肺癌、结肠癌、淋巴瘤、胆管癌和胶质瘤等)患者的临床试验结果表明, 18F-(2S,4R)4F-GLN可以作为靶向谷氨酰胺代谢异常的几种不同类型癌症的显像剂,其在体内的无创性检测具有较高的安全性和可行性[29]。在进展性胶质瘤患者中,18F-(2S,4R)4F-GLN显示出较高的肿瘤/背景比值,其在肿瘤周围正常脑组织中的摄取极少;18F-(2S,4R)4F-GLN被胶质瘤选择性摄取,可用于评估体内胶质瘤的代谢情况,并作为胶质瘤临床诊断的一个有价值的工具[30]。 在一项针对脑转移瘤患者的临床试验中,18F-(2S,4R)4F-GLN在正常大脑组织中表现出低摄取,且其在脑转移瘤患者中的摄取率与病灶检出率均高于18F-FDG,结果表明 18F-(2S,4R)4F-GLN可以提供有价值的代谢信息,特别是与脑转移瘤病理学相关的谷氨酰胺的摄取信息,在脑转移瘤患者中是一种很有前途的PET显像剂。但由于其在正常肝脏组织和骨组织中也有摄取,在肝脏和骨转移病灶中应用时需要更加谨慎[31]。一项关于 18F-(2S,4R)4F-GLN在乳腺癌患者中的初步研究结果显示,其诊断效能优于18F-FDG,可用于乳腺癌的无创显像[32]。
-
当致癌基因C-myc被激活时,肿瘤细胞可能会将谷氨酰胺作为其主要能量来源,利用线粒体内缩短的三羧酸循环产生能量,这一代谢途径称为谷氨酰胺代谢[4]。Tang等[33]将4-硝基苯基-2-18F-氟丙酸盐(18F-NFP)通过两步反应合成了一种新的谷氨酰胺类似物PET显像剂——18F-FPGLN,在正常昆明小鼠体内测定18F-FPGLN的生物学分布,结果显示其在血液中高摄取,在肝和肺中中度摄取,而在其他器官(如心脏、胰腺、肠、胃、脾脏、骨骼和肌肉)中的摄取水平相对较低,另外,18F-FPGLN主要在肾脏内代谢,并通过膀胱迅速排出,其在体外比在体内表现出更好的稳定性;体外细胞实验结果显示,18F-FPGLN主要通过Na+依赖性氨基酸转运系统XAG-、B0,+、ASC和N以及非Na+依赖性氨基酸转运系统XC-和L进行转运,几乎不涉及系统A,且未整合到蛋白质中;PET显像研究结果显示,18F-FPGLN在SPC-A-1人肺腺癌异种移植物中大量积聚,使肿瘤清晰可见,与背景(肌肉和肺)形成高对比,且未在体内脱氟。以上结果表明,18F-FPGLN是一种潜在的肿瘤PET显像剂,需要进一步开展与其他常用放射性显像剂和常规显像方式进行比较的研究来确定其诊断价值。
-
L-5-11C-GLN是一种用于研究肿瘤对谷氨酰胺摄取和代谢情况的PET显像剂。与常见的18F标记的谷氨酰胺类似物PET显像剂相比,L-5-11C-GLN的一个潜在优势在于其能够检测骨转移,因为正常骨组织会摄取体内游离的18F。PET/CT显像结果表明,L-5-11C-GLN在正常小鼠中的生物学分布显示有明显的胰腺摄取,很可能是由于胰腺内的外分泌功能和高蛋白质周转率;另外,L-5-11C-GLN还在移植9L胶质瘤的大鼠和移植自发性乳腺肿瘤的转基因小鼠中显示出明显的肿瘤摄取和长时间滞留[34]。一项对9例确诊转移性结直肠癌患者PET/CT显像的临床试验结果显示,所有患者对L-5-11C-GLN的耐受性良好,没有观察到安全性问题,L-5-11C-GLN在肺、脑、骨和肝转移灶中逐渐积聚并使肿瘤达到可视化程度,这表明其可以无创地显示多个器官中的转移性结直肠癌病变[35],但还需要进一步的研究来获取更多的信息,阐明其对其他癌症的潜在应用价值。
综上,常见的谷氨酸与谷氨酰胺类似物PET显像剂的转运机制及其应用见表1。
显像剂 转运机制 应用 BAY85-8050[11-12] 转运系统XC-和XAG- 健康志愿者 18F-FSPG(BAY94-9392)[13-20] 转运系统XC- 肝细胞癌、乳腺癌、脑肿瘤患者等 18F-FPGLU[21-23] 转运系统XAG-和XC- 荷人肺腺癌(SPC-A-1)裸鼠、荷人肝细胞癌(SMCC-7721)裸鼠 18F-FP-β-GLU[24] − 荷人肺腺癌(SPC-A-1)裸鼠 18F-AlF-NOTA-NSC-GLU[25] 转运系统XAG-、ASC和B0,+ 荷人肝细胞癌(HepG2)裸鼠 18F-(2S,4R)4F-GLN[26-32] 转运系统L和ASC 胶质瘤、乳腺癌、脑转移瘤患者等 18F-FPGLN[33] 转运系统XAG-、B0,+、ASC、N、XC-和L 荷人肺腺癌(SPC-A-1)裸鼠 L-5-11C-GLN[34-35] 转运系统ASC 转移性结直肠癌患者 注: -表示无此项数据;BAY85-8050为4-18F-氟谷氨酸;18F-FSPG为(4S)-4-(3-18F-氟丙基)-L-谷氨酸;18F-FPGLU为N-(2-18F-氟丙酰基)-L-谷氨酸;18F-FP-β-GLU为N-(2-18F-氟丙酰基)-β-谷氨酸;18F-AlF-NOTA-NSC-GLU为18F-氟化铝-1,4,7-三氮杂环壬烷-1,4,7-三乙酸-2-S-(4-异硫氰基苄基)-L-谷氨酸;18F-(2S,4R)4F-GLN为18F-(2S,4R)4-氟谷氨酰胺;18F-FPGLN为N-(2-18F-氟丙酰基)-L-谷氨酰胺;L-5-11C-GLN为L-5-11C-谷氨酰胺 表 1 常见的谷氨酸与谷氨酰胺类似物PET显像剂的转运机制及其应用
Table 1. Transport mechanism and application of common PET imaging agents of glutamate and glutamine analogue
-
肿瘤往往通过增加营养消耗来促进其异常生长,某些肿瘤细胞可以利用谷氨酰胺和下游的谷氨酸的分解代谢来满足其增加的能量和生物合成需求[36]。谷氨酸与谷氨酰胺类似物PET显像剂通过氨基酸转运与蛋白质合成进入肿瘤细胞内,在肝细胞癌、脑肿瘤、胶质瘤以及其他多种肿瘤的鉴别诊断中具有优势,可以弥补18F-FDG显像的一些不足,例如:靶向系统XC-的18F-FSPG在肝细胞瘤和非小细胞肺癌显像方面优于18F-FDG[15-16];在肿瘤显像方面,基于氧化还原机制在肿瘤的发生、对治疗的反应和耐药性的产生中的重要性,18F-FSPG可能显示出其特殊的价值。
但是目前已经开发的谷氨酸与谷氨酰胺类似物PET显像剂的数量较少,一些显像剂的作用机制不明确,而且大多局限于临床前试验,其临床价值尚缺乏临床试验数据支持。目前,谷氨酸与谷氨酰胺类似物PET显像剂主要应用于肿瘤的无创显像检测,而在其他疾病,如心血管疾病、脑部疾病等中的应用较少。因此,开发出更多种类的谷氨酸与谷氨酰胺类似物PET显像剂或者在现有显像剂的结构基础上进行改良,并且通过进一步的实验或与其他常用的PET显像剂和常规显像方式进行比较来确定其作用机制和诊断价值,将有助于提高患者检测的灵敏度和准确率,为患者的无创显像提供更多的选择。
利益冲突 所有作者声明无利益冲突
作者贡献声明 梁浩然负责综述命题的提出与设计、文献的查阅、综述的撰写与修订;徐万帮负责综述的修订;唐刚华负责综述命题的提出、综述撰写的指导和审阅
谷氨酸与谷氨酰胺类似物PET显像剂研究进展
Research progress of glutamate and glutamine analog PET imaging agents
-
摘要: 谷氨酰胺是血浆中浓度最高的氨基酸,肿瘤细胞的生长与增殖依赖于谷氨酰胺及其中间代谢产物(如谷氨酸、乳酸、脯氨酸、氨等),肿瘤细胞的生长速度与细胞内谷氨酰胺和谷氨酸的浓度密切相关,谷氨酰胺与谷氨酸在肿瘤代谢中起着重要作用。肿瘤细胞摄取谷氨酸与谷氨酰胺类似物PET显像剂的机制主要涉及氨基酸转运与蛋白质合成。谷氨酸与谷氨酰胺类似物PET显像剂在肝细胞癌、脑肿瘤、胶质瘤以及其他多种肿瘤的鉴别诊断中具有优势,可以弥补18F-氟脱氧葡萄糖 PET显像的一些不足。笔者主要对谷氨酸与谷氨酰胺类似物PET显像剂的研究进展进行综述。
-
关键词:
- 谷氨酸 /
- 谷氨酰胺 /
- 类似物 /
- 正电子发射断层显像术 /
- 放射性示踪剂
Abstract: Glutamine has the highest concentration of amino acid in plasma, and the growth and proliferation of tumor cells depend on glutamine and its intermediate metabolites, such as glutamate, lactate, proline, and ammonia. The growth rate of tumor cells is closely related to the intracellular concentrations of glutamine and glutamate, which play an important role in tumor metabolism. The mechanism of glutamate and glutamine analog PET imaging agents uptaked by tumor cells primarily involves amino acid transport and protein synthesis. Glutamate and glutamine analog PET imaging agents have advantages in the differential diagnosis of hepatocellular carcinoma, brain tumors, glioma, and many other tumors, which can compensate for some deficiencies of 18F-fluorodeoxyglucose PET imaging. This paper primarily reviews the research progress of glutamate and glutamine analog PET imaging agents.-
Key words:
- Glutamic acid /
- Glutamine /
- Analogs /
- Positron-emission tomography /
- Radioactive tracers
-
表 1 常见的谷氨酸与谷氨酰胺类似物PET显像剂的转运机制及其应用
Table 1. Transport mechanism and application of common PET imaging agents of glutamate and glutamine analogue
显像剂 转运机制 应用 BAY85-8050[11-12] 转运系统XC-和XAG- 健康志愿者 18F-FSPG(BAY94-9392)[13-20] 转运系统XC- 肝细胞癌、乳腺癌、脑肿瘤患者等 18F-FPGLU[21-23] 转运系统XAG-和XC- 荷人肺腺癌(SPC-A-1)裸鼠、荷人肝细胞癌(SMCC-7721)裸鼠 18F-FP-β-GLU[24] − 荷人肺腺癌(SPC-A-1)裸鼠 18F-AlF-NOTA-NSC-GLU[25] 转运系统XAG-、ASC和B0,+ 荷人肝细胞癌(HepG2)裸鼠 18F-(2S,4R)4F-GLN[26-32] 转运系统L和ASC 胶质瘤、乳腺癌、脑转移瘤患者等 18F-FPGLN[33] 转运系统XAG-、B0,+、ASC、N、XC-和L 荷人肺腺癌(SPC-A-1)裸鼠 L-5-11C-GLN[34-35] 转运系统ASC 转移性结直肠癌患者 注: -表示无此项数据;BAY85-8050为4-18F-氟谷氨酸;18F-FSPG为(4S)-4-(3-18F-氟丙基)-L-谷氨酸;18F-FPGLU为N-(2-18F-氟丙酰基)-L-谷氨酸;18F-FP-β-GLU为N-(2-18F-氟丙酰基)-β-谷氨酸;18F-AlF-NOTA-NSC-GLU为18F-氟化铝-1,4,7-三氮杂环壬烷-1,4,7-三乙酸-2-S-(4-异硫氰基苄基)-L-谷氨酸;18F-(2S,4R)4F-GLN为18F-(2S,4R)4-氟谷氨酰胺;18F-FPGLN为N-(2-18F-氟丙酰基)-L-谷氨酰胺;L-5-11C-GLN为L-5-11C-谷氨酰胺 -
[1] 李凤林, 罗志福. 氨基酸类肿瘤显像剂氟-18标记方法[J]. 中国药学杂志, 2017, 52(23): 2053−2061. DOI: 10.11669/cpj.2017.23.001.
Li FL, Luo ZF. Review of the labeling methods of fluorinated amino acid with 18F for tumor imaging[J]. Chin Pharm J, 2017, 52(23): 2053−2061. DOI: 10.11669/cpj.2017.23.001.[2] Shanware NP, Mullen AR, DeBerardinis RJ, et al. Glutamine: pleiotropic roles in tumor growth and stress resistance[J]. J Mol Med, 2011, 89(3): 229−236. DOI: 10.1007/s00109-011-0731-9. [3] Zhu L, Ploessl K, Zhou R, et al. Metabolic imaging of glutamine in cancer[J]. J Nucl Med, 2017, 58(4): 533−537. DOI: 10.2967/jnumed.116.182345. [4] Yang LF, Venneti S, Nagrath D. Glutaminolysis: a hallmark of cancer metabolism[J]. Annu Rev Biomed Eng, 2017, 19: 163−194. DOI: 10.1146/annurev-bioeng-071516-044546. [5] 裴亚萍, 杨艳莉, 李娜, 等. 谷氨酰胺代谢在肿瘤治疗中的研究进展[J]. 江苏医药, 2021, 47(11): 1174−1178. DOI: 10.19460/J.cnki.0253-3685.2021.11.024.
Pei YP, Yang YL, Li N, et al. Research progress of glutamine metabolism in tumor treatment[J]. Jiangsu Med J, 2021, 47(11): 1174−1178. DOI: 10.19460/J.cnki.0253-3685.2021.11.024.[6] Lin WY, Wang CQ, Liu GP, et al. SLC7A11/xCT in cancer: biological functions and therapeutic implications[J/OL]. Am J Cancer Res, 2020, 10(10): 3106−3126[2022-04-24]. https://pubmed.ncbi.nlm.nih.gov/33163260. [7] 聂大红, 唐刚华. 肿瘤氨基酸代谢PET显像研究进展[J]. 同位素, 2015, 28(4): 214−224. DOI: 10.7538/tws.2015.28.04.0214.
Nie DH, Tang GH. Research progress of amino acid metabolism PET imaging in tumor[J]. J Isot, 2015, 28(4): 214−224. DOI: 10.7538/tws.2015.28.04.0214.[8] Rajagopalan KN, DeBerardinis RJ. Role of glutamine in cancer: therapeutic and imaging implications[J]. J Nucl Med, 2011, 52(7): 1005−1008. DOI: 10.2967/jnumed.110.084244. [9] Rodríguez-Campuzano AG, Ortega A. Glutamate transporters: critical components of glutamatergic transmission[J]. Neuropharmacology, 2021, 192: 108602. DOI: 10.1016/j.neuropharm.2021.108602. [10] Robert SM, Sontheimer H. Glutamate transporters in the biology of malignant gliomas[J]. Cell Mol Life Sci, 2014, 71(10): 1839−1854. DOI: 10.1007/s00018-013-1521-z. [11] Smolarz K, KrauseBJ, Graner FP, et al. Biodistribution and radiation dosimetry in healthy volunteers of a novel tumour-specific probe for PET/CT imaging: BAY 85-8050[J]. Eur J Nucl Med Mol Imaging, 2013, 40(12): 1861−1868. DOI: 10.1007/s00259-013-2502-z. [12] Ploessl K, Wang LM, Lieberman BP, et al. Comparative evaluation of 18F-labeled glutamic acid and glutamine as tumor metabolic imaging agents[J]. J Nucl Med, 2012, 53(11): 1616−1624. DOI: 10.2967/jnumed.111.101279. [13] Mosci C, Kumar M, Smolarz K, et al. Characterization of physiologic 18F FSPG uptake in healthy volunteers[J]. Radiology, 2016, 279(3): 898−905. DOI: 10.1148/radiol.2015142000. [14] Hoehne A, James ML, Alam IS, et al. [18F]FSPG-PET reveals increased cystine/glutamate antiporter (Xc-) activity in a mouse model of multiple sclerosis[J/OL]. J Neuroinflammation, 2018, 15(1): 55[2022-04-24]. https://jneuroinflammation.biomedcentral.com/articles/10.1186/s12974-018-1080-1. DOI: 10.1186/s12974-018-1080-1. [15] Baek S, Choi CM, Ahn SH, et al. Exploratory clinical trial of (4S)-4-(3-[18F]fluoropropyl)-L-glutamate for imaging xc− transporter using positron emission tomography in patients with non–small cell lung or breast cancer[J]. Clin Cancer Res, 2012, 18(19): 5427−5437. DOI: 10.1158/1078-0432.CCR-12-0214. [16] Baek S, Mueller A, Lim YS, et al. (4S)-4-(3-18F-Fluoropropyl)-L-glutamate for imaging of xC- transporter activity in hepatocellular carcinoma using PET: preclinical and exploratory clinical studies[J]. J Nucl Med, 2013, 54(1): 117−123. DOI: 10.2967/jnumed.112.108704. [17] Mittra ES, Koglin N, Mosci C, et al. Pilot preclinical and clinical evaluation of (4S)-4-(3-[18F]Fluoropropyl)-L-glutamate (18F-FSPG) for PET/CT imaging of intracranial malignancies[J/OL]. PLoS One, 2016, 11(2): e0148628[2022-04-24]. https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0148628. DOI: 10.1371/journal.pone.0148628. [18] Chae SY, Choi CM, Shim TS, et al. Exploratory clinical investigation of (4S)-4-(3-18F-Fluoropropyl)-L-glutamate PET of inflammatory and infectious lesions[J]. J Nucl Med, 2016, 57(1): 67−69. DOI: 10.2967/jnumed.115.164020. [19] Cheng MF, Huang YY, Ho BY, et al. Prospective comparison of (4S)-4-(3-18F-fluoropropyl)-L-glutamate versus 18F-fluorodeoxyglucose PET/CT for detecting metastases from pancreatic ductal adenocarcinoma: a proof-of-concept study[J]. Eur J Nucl Med Mol Imaging, 2019, 46(4): 810−820. DOI: 10.1007/s00259-018-4251-5. [20] Park SY, Na SJ, Kumar M, et al. Clinical evaluation of (4S)-4-(3-[18F]Fluoropropyl)-L-glutamate (18F-FSPG) for PET/CT imaging in patients with newly diagnosed and recurrent prostate cancer[J]. Clin Cancer Res, 2020, 26(20): 5380−5387. DOI: 10.1158/1078-0432.CCR-20-0644. [21] Tang CH, Pan QY, Gao SY, et al. Excitatory glutamate transporter EAAC1 as an important transporter of N-(2-[18F]fluoropropionyl)-L-glutamate in oncology PET imaging[J]. Nucl Med Biol, 2020, 84/85: 55−62. DOI: 10.1016/j.nucmedbio.2020.02.003. [22] Hu KZ, Du K, Tang GH, et al. Radiosynthesis and biological evaluation of N-[18F]labeled glutamic acid as a tumor metabolic imaging tracer[J/OL]. PLoS One, 2014, 9(3): e93262[2022-04-24]. https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0093262. DOI: 10.1371/journal.pone.0093262. [23] Sun AX, Liu SY, Tang XL, et al. Simple and rapid radiosynthesis of N-18F-labeled glutamic acid as a hepatocellular carcinoma PET tracer[J]. Nucl Med Biol, 2017, 49: 38−43. DOI: 10.1016/j.nucmedbio.2017.02.003. [24] Liu SY, Sun AX, Zhang ZW, et al. Facile radiosynthesis of 18F-labeled β-glutamic acid as a new PET tracer for imaging lung cancer[J]. J Radioanal Nucl Chem, 2017, 312(2): 233−239. DOI: 10.1007/s10967-017-5220-3. [25] Lin LP, Xiang XH, Su S, et al. Biological evaluation of [18F]AlF-NOTA-NSC-GLU as a positron emission tomography tracer for hepatocellular carcinoma[J/OL]. Front Chem, 2021, 9: 630452[2022-04-24]. https://www.frontiersin.org/articles/10.3389/fchem.2021.630452/full. DOI: 10.3389/fchem.2021.630452. [26] Hassanein M, Hight MR, Buck JR, et al. Preclinical evaluation of 4-[18F]Fluoroglutamine PET to assess ASCT2 expression in lung cancer[J]. Mol Imaging Biol, 2016, 18(1): 18−23. DOI: 10.1007/s11307-015-0862-4. [27] Wu ZH, Zha ZH, Li GX, et al. [18F](2S,4S)-4-(3-Fluoropropyl)glutamine as a tumor imaging agent[J]. Mol Pharm, 2014, 11(11): 3852−3866. DOI: 10.1021/mp500236y. [28] Xu XX, Zhu H, Liu F, et al. Dynamic PET/CT imaging of 18F-(2S, 4R)4-fluoroglutamine in healthy volunteers and oncological patients[J]. Eur J Nucl Med Mol Imaging, 2020, 47(10): 2280−2292. DOI: 10.1007/s00259-019-04543-w. [29] Dunphy MPS, Harding JJ, Venneti S, et al. In vivo PET assay of tumor glutamine flux and metabolism: in-human trial of 18F-(2S, 4R)-4-fluoroglutamine[J]. Radiology, 2018, 287(2): 667−675. DOI: 10.1148/radiol.2017162610. [30] Venneti S, Dunphy MP, Zhang HW, et al. Glutamine-based PET imaging facilitates enhanced metabolic evaluation of gliomas in vivo[J]. Sci Transl Med, 2015, 7(274): 274ra17. DOI: 10.1126/scitranslmed.aaa1009. [31] Xu XX, Zhu H, Liu F, et al. Imaging brain metastasis patients with 18F-(2S, 4R)-4-fluoroglutamine[J]. Clin Nucl Med, 2018, 43(11): e392−e399. DOI: 10.1097/RLU.0000000000002257. [32] Liu F, Xu XX, Zhu H, et al. PET imaging of 18F-(2S, 4R)4-fluoroglutamine accumulation in breast cancer: from xenografts to patients[J]. Mol Pharm, 2018, 15(8): 3448−3455. DOI: 10.1021/acs.molpharmaceut.8b00430. [33] Tang CH, Tang GH, Gao SY, et al. Radiosynthesis and preliminary biological evaluation of N-(2-[18F]fluoropropionyl)-L-glutamine as a PET tracer for tumor imaging[J/OL]. Oncotarget, 2016, 7(23): 34100−34111[2022-04-24]. https://www.oncotarget.com/article/9115/text. DOI: 10.18632/oncotarget.9115. [34] Qu WC, Oya S, Lieberman BP, et al. Preparation and characterization of L-[5-11C]-glutamine for metabolic imaging of tumors[J]. J Nucl Med, 2012, 53(1): 98−105. DOI: 10.2967/jnumed.111.093831. [35] Cohen AS, Grudzinski J, Smith GT, et al. First-in-human PET imaging and estimated radiation dosimetry of L-[5-11C]-glutamine in patients with metastatic colorectal cancer[J]. J Nucl Med, 2022, 63(1): 36−43. DOI: 10.2967/jnumed.120.261594. [36] McCormick PN, Greenwood HE, Glaser M, et al. Assessment of tumor redox status through (S)-4-(3-[18F]fluoropropyl)-L-glutamic acid PET imaging of system xc- activity[J]. Cancer Res, 2019, 79(4): 853−863. DOI: 10.1158/0008-5472.CAN-18-2634. -





 下载:
下载: