-
人血清白蛋白(human serum albumin,HSA)是人血浆中含量最高的蛋白质,成年人正常参考值为40~55 g/L,其在体内的主要作用是维持血液的渗透压和运输小分子物质。在临床上,HSA作为血浆容量扩充剂广泛用于治疗出血、休克、烧伤、恶性肿瘤和红细胞、白细胞增多症等[1];作为药物载体,HSA是一种安全可靠的生物材料,可避免难溶性药物被血液清除。在临床上,HSA偶联药物被广泛应用,如HSA结合型紫杉醇作为一种新型紫杉醇类药物,以其独特的剂型优势,显示出良好的疗效及安全性。近年来有多种HSA结合型核医学分子探针被开发,在临床前和临床研究中表现出优异的特性。我们就HSA结合型分子探针的研究进展进行综述。
-
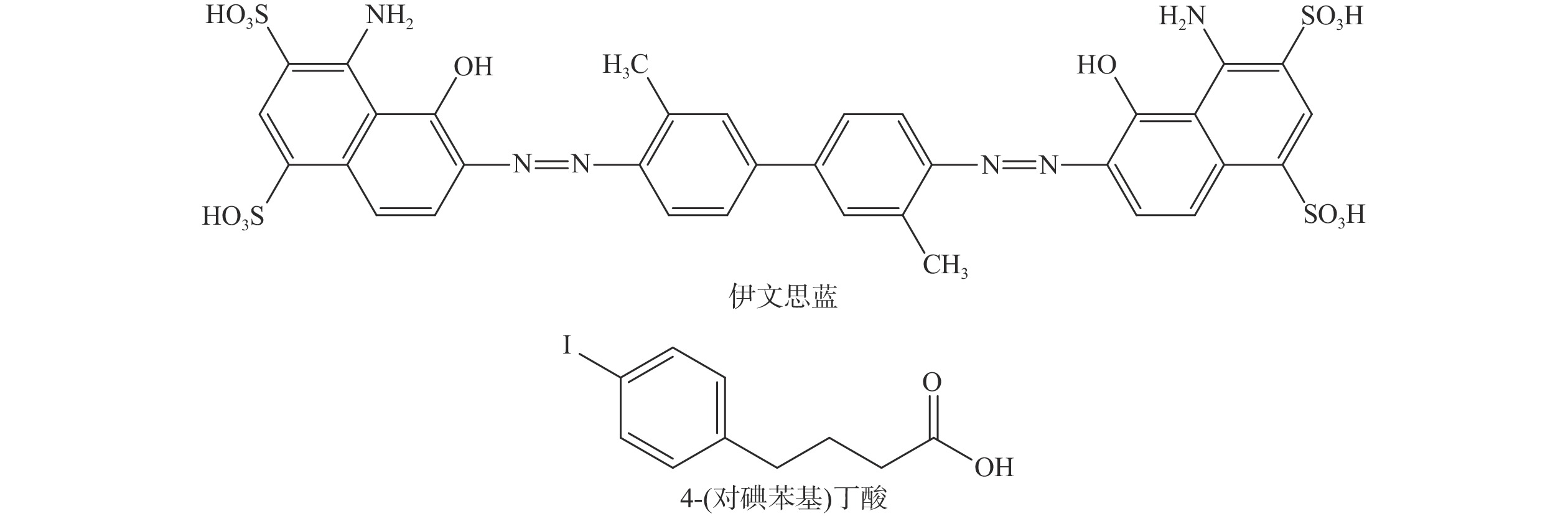
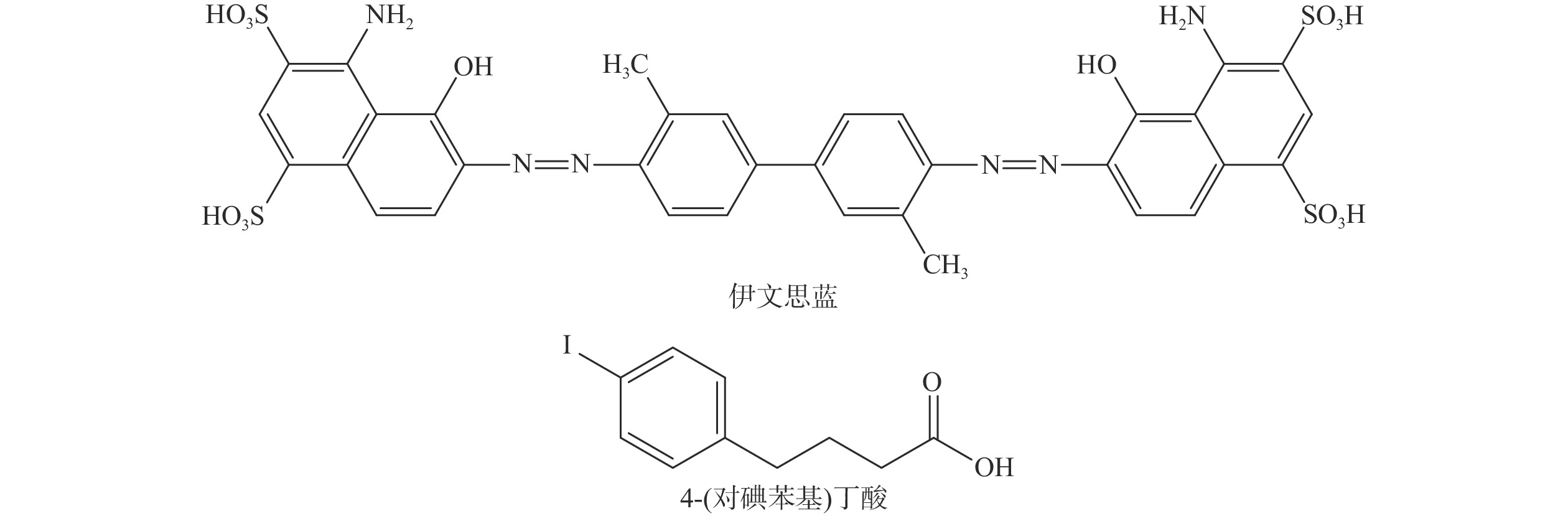
新型分子探针的发展推动了核医学的进步。近年来,HSA结合型分子探针的研究进展迅速,其具有独特的临床应用潜力。目前用于HSA结合的修饰基团有伊文思蓝(evans blue,EB)、4-(对碘苯基)丁酸[4-(p-iodophenyl)butyric acid,IPBA]、脂肪酸等,其中基于EB和IPBA的分子探针研究较多,EB和IPBA的分子结构见图1。
-
EB是突触囊泡通过谷氨酸转运体吸收L-谷氨酸的有效抑制剂,同时也是一种离子型谷氨酸受体拮抗剂,属于一种常用的偶氮染料制剂,其在血液中与HSA有很高的亲和力,常作为示踪剂用于观察血脑屏障的完整性,也可用于测定血容量和评价心功能。
-
EB与HSA的亲和力在微摩尔级别,1单位的HSA分子可以结合14单位的EB,由于血液中富含HSA,静脉注射EB后,其几乎都与HSA结合,代谢清除速度非常缓慢。因此,化合物偶联EB后间接具有了与HSA结合的能力。目前已有文献报道了精氨酸-甘氨酸-天冬氨酸(arg-gly-asp,RGD)肽[4]、艾塞那肽(Exendin-4)[5]、奥曲肽[6]、前列腺特异性膜抗原(prostate-specific membrane antigen,PSMA)[7]、成纤维细胞活化蛋白抑制剂(fibroblast activation protein inhibitor,FAPI)[8]能与EB偶联,这大大延长了分子探针在体内的循环时间,使肿瘤的靶向治疗效果得到明显提升。
奥曲肽经EB修饰标记177Lu后得到177Lu-1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸-伊文思蓝-奥曲肽(简称177Lu-DOTA-EB-TATE),其耐受性良好,在受试者身上未发现严重的不良反应。与177Lu-1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸-奥曲肽(简称177Lu-DOTA-TATE)相比,177Lu-DOTA-EB-TATE在体内的循环时间明显延长,并且其在肿瘤部位的T/NT提高了7.9倍。177Lu-DOTA-EB-TATE的全身有效吸收剂量为(0.205±0.161) mSv/MBq,而177Lu-DOTA-TATE为(0.174±0.072) mSv/MBq;同时177Lu-DOTA-EB-TATE在肾脏和骨髓中的吸收剂量均明显增加,分别为177Lu-DOTA-TATE的3.2倍和18.2倍;注射更少剂量的177Lu-DOTA-EB-TATE可实现与177Lu-DOTA-TATE相同的效果[6]。其他多肽如RGD、PSMA偶联EB后也显示出类似的结果[2, 9]。
Chen等[10]发现,在U87MG胶质瘤模型动物中,肿瘤对64Cu-EB-RGD的摄取量约为64Cu-RGD的10倍[注射24 h后:(16.60±1.99) %ID/g对(1.06±0.03) %ID/g];MDA-MB-435乳腺癌和HT-29结肠癌肿瘤模型对64Cu-EB-RGD的摄取量也高于64Cu-RGD。此外,在U87MG模型动物中应用90Y-EB-RGD进行治疗研究(给药剂量分别为2×1.85、2×3.7、2×7.4 MBq)时观察到剂量依赖性效应;注射2×7.4 MBq的 90Y-EB-RGD可使肿瘤完全消退,而较低剂量的给药只能延缓模型动物的肿瘤生长。
-
68Ga-1,4,7-三氮杂环壬烷-1,4,7-三乙酸-伊文思蓝(简称NEB)的PET显像可发现淋巴转运的变化,用于淋巴系统相关疾病的诊断。11例下肢淋巴水肿患者(分为Ⅰ~Ⅲ期)的PET显像显示血管和淋巴结异常摄取68Ga-NEB;术前进行68Ga-NEB PET显像与磁共振淋巴造影术(magnetic resonance lymphography,MRL),可提供有利于手术的三维图像;与99Tcm-硫胶体相比,68Ga-NEB PET图像的分辨率更高,患者等待检查的时间更短,淋巴管分布的图像更加清晰,术后分析结果显示,68Ga-NEB PET图像的优势在于能够区分淋巴水肿的严重程度与分期,且结果与组织病理学检查结果一致[11]。因此,对淋巴管疾病患者进行个体化治疗时建议行68Ga-NEB PET/MRL显像以便制定治疗计划。另有个案报道68Ga-NEB PET显像可用于乳糜瘘的诊断及疗效评估[12]。
-
EB可作为血池造影剂来评价心脏功能。对心梗模型动物(结扎了左前降支冠状动脉)进行18F-NEB PET显像,检查小鼠心动周期,基于图像的计算结果显示心梗小鼠左心室收缩末容积显著高于对照小鼠(仅进行手术,未结扎冠状动脉),左心室射血分数显著低于正常小鼠[(60.24±6.88)%对(79.54±2.95)%],与超声检查结果具有高度一致性[13]。
-
外周动脉疾病会导致四肢组织缺血,而血管通透性在靶向药物的给药中起着关键作用,如何有效恢复血液流通是个重要问题。通过18F-NEB PET显像可直观反映血管通透性和血液流通情况。对下肢缺血模型小鼠术后第1、3、5、7、10 、14天分别进行18F-NEB PET显像检测血管通透性,其结果与组织病理学检查结果一致[14]。
人胶质瘤U87MG模型小鼠注射18F-NEB后,肿瘤组织呈现18F-NEB 高摄取,60 min连续动态扫描结果显示,18F-NEB在肿瘤组织中的摄取水平逐渐升高,而在血液中的摄取水平逐渐下降,数学分析计算出的参数肿瘤血管通透因子(Ps)可用于定量评价肿瘤组织中血管的通透性和血容量,该参数可用于患者的筛查,评价抗血管生成药物的应答,指导靶向药物的递送[15]。
-
IPBA最初用于改善多肽和药物的药代动力学特性,IPBA偶联的氨基酸与HSA的结合常数在微摩尔级别[16]。目前基于IPBA与HSA的结合型探针大多应用于临床前研究。
-
最早采用IPBA修饰进行核医学研究的化合物为叶酸。有研究结果显示,经177Lu标记后,IPBA修饰的叶酸比未修饰叶酸在模型动物肿瘤部位的摄取值更高(注射后4 h的摄取值为17.56 %ID/g),肾蓄积显著减少,IPBA修饰的叶酸在肾脏的摄取值为28 %ID/g,而未修饰的叶酸注射后4 h在肾脏的摄取值为70 %ID/g,这使得SPECT图像质量优异;治疗后结果显示,IPBA修饰叶酸的核素治疗组中5例模型动物有4例肿瘤完全缓解,并且动物的存活时间显著延长[17]。
IPBA修饰的PSMA分子177Lu-PSMA-IPBA-01169(简称177Lu-HTK01169)与靶点的亲和力非常高,Ki值为0.04 nmol,而177Lu-PSMA-617的Ki值为0.24 nmol。SPECT显像结果和生物学分布研究结果显示,177Lu-PSMA-617和177Lu-HTK01169均通过肾脏排泄,177Lu-PSMA-617具有快速血液清除特性[注射后1 h血液中的摄取值为(0.68±0.23) %ID/g],注射后1 h肿瘤摄取达到峰值(15.1 %ID/g),120 h后逐渐降至7.91 %ID/g,177Lu-HTK01169注射24 h后肿瘤摄取达到峰值(55.9 %ID/g),并一直维持至试验结束(120 h);剂量学计算结果显示,177Lu-HTK01169在肿瘤部位的辐射剂量是177Lu-PSMA-617的8.3倍[18]。使用177Lu-PSMA-617(18.5 MBq)治疗的小鼠中位生存期为58 d;而采用18.5、9.3、4.6、2.3 MBq 177Lu-HTK01169治疗的小鼠中位生存期分别为120、103、61 、28 d[19]。177Lu-HTK01169大大提高了肿瘤的核素靶向治疗效果[18]。
-
131I-IPBA制备简便,反应10 min即可获得非常高的放射性标记产率(>99%)和良好的放射化学纯度(>98%)。其以高亲和力(IC50=46.5 μmol)与HSA结合,并具有良好的稳定性[20]。生物学分布研究结果表明,131I-IPBA主要聚积在血液中,并具有良好的滞留性[30 min时的摄取值为(10.51±2.58) %ID/g,4 h时为(4.63±0.17) %ID/g],胶质瘤U87MG模型动物的131I-IPBA SPECT图像可以清晰地显示血池、淋巴结和肿瘤,并且T/NT很高[19]。131I-IPBA属于放射性碘HSA结合剂,具有较长的血液半衰期和良好的稳定性,可用于修饰多种HSA结合放射性配体,并发展成为一种多用途的治疗药物。
-
AS相关炎症的早期检测可以降低与之相关疾病的发生率,其与非酒精性脂肪肝之间存在着相关性。在AS和脂肪肝的发展过程中,巨噬细胞的活化会造成斑块的不稳定和临床并发症的发生,其特征是活化巨噬细胞不间断地聚集叶酸受体β并在几种并发症中高表达。通过131I-IPBF(131I-IPBA偶联的叶酸)可实现叶酸受体β的显像,从而用于AS斑块和非酒精性脂肪肝的无创检测。131I-IPBF的体外测定结果显示,其与血浆蛋白具有中等强度的结合力,并可被活化的巨噬细胞特异性摄取;正常小鼠的药代动力学研究结果显示,131I-IPBF的血液清除半衰期为8.14 h,在Raw 264.7小鼠单核巨噬细胞白血病细胞中测定的Kd值为(43.94±9.83) nmol;131I-IPBF SPECT显像结果显示,其在模型动物的晚期斑块和脂肪肝中具有高摄取率[20]。131I-IPBF在高危AS斑块中的特异性摄取,可用于监测AS斑块和伴随的脂肪肝的发生。
-
由于IPBA修饰基团与HSA结合的优良性能,许多类似物被设计出来用于改变药物在体内的药代动力学特性,如4-(对甲基苯基)丁酸、4-(对氯苯基)丁酸和4-(对甲氧基苯基)丁酸等。
Kramer等[21]对4-(对甲基苯基)丁酸修饰的PSMA进行研究,经177Lu标记后进行的临床试验结果显示,177Lu-PSMA-白蛋白结合型(简称ALB)-56的耐受性良好,未观察到严重不良反应;SPECT显像结果显示,177Lu-PSMA-ALB-56在血液中的循环时间较长,注射48 h后在肿瘤病灶中的摄取值最高。他们发现,与经典的PSMA放射性配体(如PSMA-617和PSMA-I&T)的体内分布数据相比,177Lu-PSMA-ALB-56在病灶内的浓集剂量[(6.64±6.92) Gy/GBq]高达2.3倍,唾液腺体分布剂量[(0.87±0.43) Gy/GBq]相似,肾脏和红骨髓的分布剂量[(2.54±0.94) Gy/GBq和(0.29±0.07) Gy/GBq]稍高。这说明4-(对甲基苯基)丁酸修饰PSMA进行核素靶向治疗是可行的,并且会显著提升治疗效果。
通过筛选不同的修饰基团来提高PSMA类核素治疗药物的肿瘤摄取,不同的基团用来修饰PSMA以优化亲和力并改善肿瘤与肾脏的分布比值。9-蒽基丙氨酸修饰的PSMA在注射1 h后肿瘤摄取值最高,达到(23.1±6.11) %ID/g;4-(对氯苯基)丁酸和N-(4-(对甲氧基苯基)丁酸修饰的PSMA分别被命名为HTK03121和HTK03123;177Lu-HTK03121和177Lu-HTK03123具有极高的肿瘤摄取值[(104±20.3) %ID/g和(70.8±23.7) %ID/g)],并且该摄取值在注射后维持了120 h;剂量测定计算结果显示,177Lu-HTK03121和177Lu-HTK03123在肿瘤部位的吸收剂量分别为177Lu-PSMA-617的18.7倍和12.7倍,在肾脏的吸收剂量仅高出177Lu-PSMA-617 6.4倍和6.3倍,这使得肿瘤与肾脏的吸收剂量比值分别提高了2.9倍和2.0倍[22]。
-
HSA作为药物载体的应用非常广泛,包括化疗药物和生物制剂,很多化合物和蛋白被筛选出来用于与HSA结合。除EB和IPBA外,近年来用于核医学诊疗研究的有以下几种。
-
通过噬菌体技术筛选出的蛋白ABD035对HSA显示出了良好的亲和力(Kd=5.0×10−13 mol/L)[23]。通过蛋白工程技术,将ABD035与纳米抗体ZHER2:2891偶联,然后进行螯合基团1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸(DOTA)的化学修饰形成新的抗体(ABY-027),该抗体的亲和力与ZHER2:2891一致(74 pmol 对76 pmol),该纳米抗体经过177Lu标记后,在模型动物肾脏和肝脏的摄取显著降低(为原来抗体的1/2和1/3), 48 h后肿瘤摄取值是 ABD-(ZHER2:342)2的2倍,显示出更加优异的治疗潜力[24]。
ABD035偶联的人类表皮生长因子受体2型(HER-2)配基ADAPT6经177Lu标记后,模型鼠48 h的肾脏摄取降低至原来的1/14,肿瘤摄取为177Lu-DOTA-ADAPT6的3倍;相较于177Lu-DOTA-ADAPT6,荷瘤鼠单次注射18 MBq 177Lu-DOTA-ADAPT6-ABD035,中位存活率提高了2倍以上[25]。因此,探针与ABD035的融合设计为放射性核素靶向治疗药物开发提供了非常有意义的探索。
-
脂肪酸作为功能基团用于HSA载药已经有较长的应用历史,近年来主要应用于抗肿瘤药物如紫杉醇[26]、血糖控制药物[27–30]以及其他药物的修饰改造。月桂酸(C12)和棕榈酸(C16)2种脂肪酸分别与FAPI-04偶联成FAPI-C12和FAPI-C16,用68Ga、86Y和177Lu对2种化合物进行放射性标记,结果显示,与177Lu-FAPI-04相比,86Y-FAPI-C12和86Y-FAPI-C16具有更长的循环时间和更高的肿瘤摄取;177Lu-FAPI-C16在24 h时的肿瘤摄取值比177Lu-FAPI-C12更高[(11.22±1.18) %ID/g 对 (7.54±0.97) %ID/g)],二者均比177Lu-FAPI-04[(1.24±0.54) %ID/g]高,这2种修饰均改变了药物的药代动力学特性,提高了肿瘤摄取值[31]。
-
2014—2021年,经国内外伦理委员会或药监部门审批进入临床试验或已上市的基于HSA的显像药物或者治疗药物详见表1。
药物名称 原理 用途 临床试验分期或批准上市机构 开展时间 数据来源 患者可能出现的
不良反应68Ga-NEB 68Ga标记的EB衍生物 血池显像和淋巴造影 Ⅰ期 2014年 NCT02496013
NCT04273334− 89Zr-GSK3128349 89Zr标记的HSA结合抗体 抗体的药代动力学和分布研究 Ⅰ期 2016年 NCT02829307 − 177Lu-DOTA-EB-TATE 177Lu标记的EB修饰的生长抑素受体配基 神经内分泌瘤的靶向治疗 Ⅰ期 2017年
2018年NCT03308682
NCT03478358血小板减少、贫血,未观察到3/4级血液毒性 177Lu-EB-PSMA-617 177Lu标记的EB修饰的PSMA配基 前列腺癌的核素靶向治疗 Ⅰ期 2021年 NCT04996602 1~2级白细胞减少、疲劳 177Lu-PSMA-ALB-56 177Lu标记的4-(对甲基苯基)丁酸修饰的PSMA配基 前列腺癌的核素靶向治疗 Ⅰ期 2017年 智利圣地亚哥大都市东区伦理委员会批准(20171107) 贫血、1~2级白细胞减少、轻度恶心 99Tcm-MAA 99Tcm标记的聚合白蛋白 静脉造影、肺灌注显像 中国NMPA批准上市 − 中国药典2020版[32] 荨麻疹、胸闷、气喘 131I-HSA 131I标记的HSA 血容量测定、血池显像等 美国FDA批准上市 − 美国FDA 数据库 − 注:NEB为1,4,7-三氮杂环壬烷-1,4,7-三乙酸-伊文思蓝;GSK3128349为英国葛兰素史克公司抗体3128349;DOTA为1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸;EB为伊文思蓝;TATE为奥曲肽;PSMA为前列腺特异性膜抗原;ALB为白蛋白结合型;MAA为聚合白蛋白;HSA为人血清白蛋白;NMPA为国家药品监督管理局;FDA为食品药品监督管理局;NCT为全球临床试验。−表示暂未检索到的数据 表 1 2014—2021年已上市或已开展临床试验的人血清白蛋白结合型放射性药物
Table 1. Human serum albumin binding radiopharmaceuticals that have been approved for marketing or undergoing clinical trials from 2014 to 2021
-
利用放射性核素衰变产生的射线对肿瘤进行诊断和治疗的方法已经成为核医学的主要研究内容。其关键在于如何将放射性核素定向导入肿瘤组织,提高肿瘤诊疗的准确性,这要求放射性药物在靶部位能特异性浓集,且靶向性好。近年来基于HSA结合的设计策略,多种探针被设计出来用于淋巴显像、心肌功能评价、AS斑块的检测、改变探针的药代动力学特点从而延长其在体内的循环时间等,很多探针已经被用于临床试验研究。这些探针的设计和改造需要注意以下几个方面的问题:(1)探针的设计与评价要关注骨髓、腺体等敏感脏器和组织的受照射剂量,因探针循环时间显著增长,这些脏器所受剂量较使用未修饰探针时的辐射剂量显著增加,需要测算给药剂量与敏感脏器吸收剂量之间的关系,确保用药安全。(2)HSA结合型探针用于肿瘤的靶向治疗研究刚刚起步,临床数据较少,已经发表的文章大多侧重于指出HSA结合型探针的优势与价值,忽略了可能出现的不良反应。常规的核素靶向治疗药物具有的不良反应包括3/4级血液学毒性,如贫血、血小板减少和白细胞减少;非血液学毒性,如肝肾毒性、胃肠道症状(如恶心、呕吐)、干燥综合征、疲劳等。有文献报道,177Lu-PSMA-617有3%~14%具有3/4级血液学毒性,另有一部分表现为口腔干燥症和恶心等[33-34]。而177Lu-EB-PSMA-617的首次临床试验未观察到明显的肾毒性、肝毒性或血液学毒性,患者存在一定程度的白细胞减少,40%的患者出现疲劳症状[35]。而177Lu-PSMA-ALB-56的相关研究结果证实,没有患者出现相关口干、疲劳、恶心、食欲不振、肾毒性、肝毒性或严重血液学毒性,其中有40%(4/10)患者出现贫血症状[21]。177Lu-DOTA-EB-TATE的临床研究未观察到严重的血液毒性和肾脏毒性[36]。有研究者建议,需要对肾脏和骨髓采取保护措施[37]。经过HSA修饰后的放射性药物未发现严重的血液毒性反应,但肾脏、胰腺、腮腺等高摄取脏器和组织需要被关注并对其采取保护措施。(3)目前进行的基于HSA结合的核医学诊疗策略大多集中在临床前和Ⅰ、Ⅱ期临床研究,缺乏大型的前瞻性Ⅲ期随机对照研究来证明HSA结合型探针比传统药物具有更好的疗效,但基于现有的临床研究可以预测未来的Ⅲ期临床试验的疗效,希望未来的Ⅲ期临床试验可以明确治疗方案和给药剂量。优化探针的药代动力学,使得用更小的剂量达到同样的效果,或用同样剂量实现更好效果;进一步优化剂量学研究,根据剂量学相关基因型等进行个性化治疗,并减少不良反应。(4)目前进行的临床试验大多使用的是β粒子发射体核素,而α粒子凭借较高的传能线密度、较强的相对生物学效应及较低的毒性和不良反应,将来有可能被推向临床,特别是223RaCl2获得NMPA的批文及在临床上的应用,为α核素HSA结合型药物的发展开辟了广阔的空间。
利益冲突 所有作者声明无利益冲突
作者贡献声明 韩彦江负责综述的撰写、图片的处理与审核;王猛、徐万帮负责综述的审阅与修订;智生芳负责文献的查阅、写作思路的拟定、综述撰写的指导
人血清白蛋白结合型分子探针在核医学诊疗中的研究进展
Research progress of human serum albumin binding molecular probe in diagnosis and treatment of nuclear medicine
-
摘要: 人血清白蛋白(HSA)是一种多功能蛋白质,能结合和运输多种内源性和外源性化合物,也可作为药物载体用于肿瘤的靶向给药。通过在药物分子中添加功能性化学基团可实现药物与HSA的结合,增加药物在血液中的循环时间,同时不会显著影响药物的生物活性,这种方法可以提高放射性治疗药物在肿瘤部位的浓集程度并延长浓集时间,改善其靶向治疗的效果。HSA结合型分子探针还可用于心脏功能和血管通透性评价以及淋巴显像。笔者综述了近年来各种HSA结合型分子探针在核医学诊疗中的研究进展。Abstract: Human serum albumin (HSA) is a multi-functional protein, which is able to bind and transport a variety of endogenous and exogenous compounds. HSA can be used as a drug carrier in the targeted delivery of cancer drug therapy. To bind to HSA, a large variety of strategies has been developed through adding functional chemical groups to the drug molecule, thus changing the pharmacokinetics, increasing the circulation time of the drug in the blood without significantly affecting its biological activity. This strategy can increase the concentration and prolong the time of radiotherapeutic drugs at the tumor site and improve the effect of radionuclide targeted therapy. Drugs binding to HSA has been exploited to evaluate cardiac function, vascular permeability, and lymphography. In this review article, the recent developments of various ligands binding to HSA in the diagnosis and treatment of nuclear medicine are reviewed.
-
Key words:
- Serum albumin, human /
- Nuclear medicine /
- Molecular probes
-
表 1 2014—2021年已上市或已开展临床试验的人血清白蛋白结合型放射性药物
Table 1. Human serum albumin binding radiopharmaceuticals that have been approved for marketing or undergoing clinical trials from 2014 to 2021
药物名称 原理 用途 临床试验分期或批准上市机构 开展时间 数据来源 患者可能出现的
不良反应68Ga-NEB 68Ga标记的EB衍生物 血池显像和淋巴造影 Ⅰ期 2014年 NCT02496013
NCT04273334− 89Zr-GSK3128349 89Zr标记的HSA结合抗体 抗体的药代动力学和分布研究 Ⅰ期 2016年 NCT02829307 − 177Lu-DOTA-EB-TATE 177Lu标记的EB修饰的生长抑素受体配基 神经内分泌瘤的靶向治疗 Ⅰ期 2017年
2018年NCT03308682
NCT03478358血小板减少、贫血,未观察到3/4级血液毒性 177Lu-EB-PSMA-617 177Lu标记的EB修饰的PSMA配基 前列腺癌的核素靶向治疗 Ⅰ期 2021年 NCT04996602 1~2级白细胞减少、疲劳 177Lu-PSMA-ALB-56 177Lu标记的4-(对甲基苯基)丁酸修饰的PSMA配基 前列腺癌的核素靶向治疗 Ⅰ期 2017年 智利圣地亚哥大都市东区伦理委员会批准(20171107) 贫血、1~2级白细胞减少、轻度恶心 99Tcm-MAA 99Tcm标记的聚合白蛋白 静脉造影、肺灌注显像 中国NMPA批准上市 − 中国药典2020版[32] 荨麻疹、胸闷、气喘 131I-HSA 131I标记的HSA 血容量测定、血池显像等 美国FDA批准上市 − 美国FDA 数据库 − 注:NEB为1,4,7-三氮杂环壬烷-1,4,7-三乙酸-伊文思蓝;GSK3128349为英国葛兰素史克公司抗体3128349;DOTA为1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸;EB为伊文思蓝;TATE为奥曲肽;PSMA为前列腺特异性膜抗原;ALB为白蛋白结合型;MAA为聚合白蛋白;HSA为人血清白蛋白;NMPA为国家药品监督管理局;FDA为食品药品监督管理局;NCT为全球临床试验。−表示暂未检索到的数据 -
[1] Matos MJ. Learning from nature: the role of albumin in drug delivery[J]. Future Med Chem, 2018, 10(9): 983−985. DOI: 10.4155/fmc-2018-0053. [2] Lau J, Jacobson O, Niu G, et al. Bench to bedside: albumin binders for improved cancer radioligand therapies[J]. Bioconjug Chem, 2019, 30(3): 487−502. DOI: 10.1021/acs.bioconjchem.8b00919. [3] Battogtokh G, Kang JH, Ko YT. Long-circulating self-assembled cholesteryl albumin nanoparticles enhance tumor accumulation of hydrophobic anticancer drug[J]. Eur J Pharm Biopharm, 2015, 96: 96−105. DOI: 10.1016/j.ejpb.2015.07.013. [4] Gapizov SS, Petrovskaya LE, Shingarova LN, et al. Fusion with an albumin-binding domain improves pharmacokinetics of an αvβ3-integrin binding fibronectin scaffold protein[J]. Biotechnol Appl Biochem, 2019, 66(4): 617−625. DOI: 10.1002/bab.1762. [5] Kaeppeli SAM, Jodal A, Gotthardt M, et al. Exendin-4 derivatives with an albumin-binding moiety show decreased renal retention and improved GLP-1 receptor targeting[J]. Mol Pharm, 2019, 16(9): 3760−3769. DOI: 10.1021/acs.molpharmaceut.9b00271. [6] Zhang JJ, Wang H, Jacobson O, et al. Safety, pharmacokinetics, and dosimetry of a long-acting radiolabeled somatostatin analog 177Lu-DOTA-EB-TATE in patients with advanced metastatic neuroendocrine tumors[J]. J Nucl Med, 2018, 59(11): 1699−1705. DOI: 10.2967/jnumed.118.209841. [7] Kelly JM, Amor-Coarasa A, Ponnala S, et al. Albumin-binding PSMA ligands: implications for expanding the therapeutic window[J]. J Nucl Med, 2019, 60(5): 656−663. DOI: 10.2967/jnumed.118.221150. [8] Wen XJ, Xu PF, Shi MQ, et al. Evans blue-modified radiolabeled fibroblast activation protein inhibitor as long-acting cancer therapeutics[J/OL]. Theranostics, 2022, 12(1): 422−433[2022-04-19]. https://www.thno.org/v12p0422.htm. DOI: 10.7150/thno.68182. [9] Deberle LM, Tschan VJ, Borgna F, et al. Albumin-binding PSMA radioligands: impact of minimal structural changes on the tissue distribution profile[J/OL]. Molecules, 2020, 25(11): 2542[2022-04-19]. https://www.mdpi.com/1420-3049/25/11/2542. DOI: 10.3390/molecules25112542. [10] Chen HJ, Jacobson O, Niu G, et al. Novel "add-on" molecule based on Evans blue confers superior pharmacokinetics and transforms drugs to theranostic agents[J]. J Nucl Med, 2017, 58(4): 590−597. DOI: 10.2967/jnumed.116.182097. [11] Long X, Zhang JJ, Zhang DM, et al. Microsurgery guided by sequential preoperative lymphography using 68Ga-NEB PET and MRI in patients with lower-limb lymphedema[J]. Eur J Nucl Med Mol Imaging, 2017, 44(9): 1501−1510. DOI: 10.1007/s00259-017-3676-6. [12] Peng L, Zhao JL, Mao F, et al. 68Ga-NEB PET/CT can be a new method for diagnosing chylous fistula: case reports of a rare complication after breast cancer surgery[J]. Medicine, 2020, 99(29): e21201. DOI: 10.1097/MD.0000000000021201. [13] Niu G, Lang LX, Kiesewetter DO, et al. In vivo labeling of serum albumin for PET[J]. J Nucl Med, 2014, 55(7): 1150−1156. DOI: 10.2967/jnumed.114.139642. [14] Wang Y, Lang LX, Huang P, et al. In vivo albumin labeling and lymphatic imaging[J]. Proc Natl Acad Sci U S A, 2015, 112(1): 208−213. DOI: 10.1073/pnas.1414821112. [15] Chen HJ, Tong X, Lang LX, et al. Quantification of tumor vascular permeability and blood volume by positron emission tomography[J/OL]. Theranostics, 2017, 7(9): 2363−2376[2022-04-19]. https://www.thno.org/v07p2363.htm. DOI: 10.7150/thno.19898. [16] Dumelin CE, Trüssel S, Buller F, et al. A portable albumin binder from a DNA-encoded chemical library[J]. Angew Chem, 2008, 120(17): 3240−3245. DOI: 10.1002/ange.200704936. [17] Müller C, Struthers H, Winiger C, et al. DOTA conjugate with an albumin-binding entity enables the first folic acid-targeted 177Lu-radionuclide tumor therapy in mice[J]. J Nucl Med, 2013, 54(1): 124−131. DOI: 10.2967/jnumed.112.107235. [18] Kuo HT, Merkens H, Zhang ZX, et al. Enhancing treatment efficacy of 177Lu-PSMA-617 with the conjugation of an albumin-binding motif: preclinical dosimetry and endoradiotherapy studies[J]. Mol Pharm, 2018, 15(11): 5183−5191. DOI: 10.1021/acs.molpharmaceut.8b00720. [19] Wen XJ, Shi CR, Xu D, et al. Radioiodinated portable albumin binder as a versatile agent for in vivo imaging with single-photon emission computed tomography[J]. Mol Pharm, 2019, 16(2): 816−824. DOI: 10.1021/acs.molpharmaceut.8b01116. [20] Wen XJ, Shi CR, Yang L, et al. A radioiodinated FR-β-targeted tracer with improved pharmacokinetics through modification with an albumin binder for imaging of macrophages in AS and NAFL[J]. Eur J Nucl Med Mol Imaging, 2022, 49(2): 503−516. DOI: 10.1007/s00259-021-05447-4. [21] Kramer V, Fernández R, Lehnert W, et al. Biodistribution and dosimetry of a single dose of albumin-binding ligand [177Lu]Lu-PSMA-ALB-56 in patients with mCRPC[J]. Eur J Nucl Med Mol Imaging, 2021, 48(3): 893−903. DOI: 10.1007/s00259-020-05022-3. [22] Kuo HT, Lin KS, Zhang ZX, et al. 177Lu-labeled albumin-binder-conjugated PSMA-targeting agents with extremely high tumor uptake and enhanced tumor-to-kidney absorbed dose ratio[J]. J Nucl Med, 2021, 62(4): 521−527. DOI: 10.2967/jnumed.120.250738. [23] Jonsson A, Dogan J, Herne N, et al. Engineering of a femtomolar affinity binding protein to human serum albumin[J]. Protein Eng Des Sel, 2008, 21(8): 515−527. DOI: 10.1093/protein/gzn028. [24] Orlova A, Jonsson A, Rosik D, et al. Site-specific radiometal labeling and improved biodistribution using ABY-027, a novel HER2-targeting affibody molecule–albumin-binding domain fusion protein[J]. J Nucl Med, 2013, 54(6): 961−968. DOI: 10.2967/jnumed.112.110700. [25] Garousi J, Von Witting E, Borin J, et al. Radionuclide therapy using ABD-fused ADAPT scaffold protein: proof of principle[J]. Biomaterials, 2021, 266: 120381. DOI: 10.1016/j.biomaterials.2020.120381. [26] Callmann CE, LeGuyader CLM, Burton ST, et al. Antitumor activity of 1, 18-octadecanedioic acid-paclitaxel complexed with human serum albumin[J]. J Am Chem Soc, 2019, 141(30): 11765−11769. DOI: 10.1021/jacs.9b04272. [27] Zhang JH, Dong YZ, Ju DW, et al. Design, synthesis and biological evaluation of double fatty chain-modified glucagon-like peptide-1 conjugates[J]. Bioorg Med Chem, 2021, 44: 116291. DOI: 10.1016/j.bmc.2021.116291. [28] Wolff M, Schüler A, Gast K, et al. Self-assembly of exendin-4-derived dual peptide agonists is mediated by acylation and correlated to the length of conjugated fatty acyl chains[J]. Mol Pharm, 2020, 17(3): 965−978. DOI: 10.1021/acs.molpharmaceut.9b01195. [29] Han J, Huang X, Sun LD, et al. Novel fatty chain-modified glucagon-like peptide-1 conjugates with enhanced stability and prolonged in vivo activity[J]. Biochem Pharmacol, 2013, 86(2): 297−308. DOI: 10.1016/j.bcp.2013.05.012. [30] Lee JY, Park T, Hong E, et al. Genetic engineering of novel super long-acting Exendin-4 chimeric protein for effective treatment of metabolic and cognitive complications of obesity[J]. Biomaterials, 2020, 257: 120250. DOI: 10.1016/j.biomaterials.2020.120250. [31] Zhang P, Xu MX, Ding J, et al. Fatty acid-conjugated radiopharmaceuticals for fibroblast activation protein-targeted radiotherapy[J]. Eur J Nucl Med Mol Imaging, 2022, 49(6): 1985−1996. DOI: 10.1007/s00259-021-05591-x. [32] 国家药典委员会. 中华人民共和国药典2020年版(二部)[M]. 北京: 中国医药科技出版社, 2020: 1897−1898.
Chinese Pharmacopoeia Commission. China Pharmacopoeia 2020 (Volume Ⅱ)[M]. Beijing: China Medical Science Press, 2020: 1897−1898.[33] Hofman MS, Violet J, Hicks RJ, et al. [177Lu]-PSMA-617 radionuclide treatment in patients with metastatic castration-resistant prostate cancer (LuPSMA trial): a single-centre, single-arm, phase 2 study[J]. Lancet Oncol, 2018, 19(6): 825−833. DOI: 10.1016/S1470-2045(18)30198-0. [34] Rahbar K, Ahmadzadehfar H, Kratochwil C, et al. German multicenter study investigating 177Lu-PSMA-617 radioligand therapy in advanced prostate cancer patients[J]. J Nucl Med, 2017, 58(1): 85−90. DOI: 10.2967/jnumed.116.183194. [35] Zang J, Fan XR, Wang H, et al. First-in-human study of 177Lu-EB-PSMA-617 in patients with metastatic castration-resistant prostate cancer[J]. Eur J Nucl Med Mol Imaging, 2019, 46(1): 148−158. DOI: 10.1007/s00259-018-4096-y. [36] Liu QX, Cheng YJ, Zang J, et al. Dose escalation of an Evans blue-modified radiolabeled somatostatin analog 177Lu-DOTA-EB-TATE in the treatment of metastatic neuroendocrine tumors[J]. Eur J Nucl Med Mol Imaging, 2020, 47(4): 947−957. DOI: 10.1007/s00259-019-04530-1. [37] Hänscheid H, Hartrampf PE, Schirbel A, et al. Intraindividual comparison of [177Lu]Lu-DOTA-EB-TATE and [177Lu]Lu-DOTA-TOC[J]. Eur J Nucl Med Mol Imaging, 2021, 48(8): 2566−2572. DOI: 10.1007/s00259-020-05177-z. -





 下载:
下载: