-
黏膜相关淋巴组织(mucosa-associated lymphoid tissue,MALT)淋巴瘤是结外淋巴瘤的一种少见类型。肺MALT淋巴瘤是最常见的原发性肺淋巴瘤,发病年龄约为60岁,偶发于年轻患者[1]。其恶性程度低、进展缓慢、影像表现缺乏特异性、误诊率较高。目前,肺癌是引起全球男性及女性癌症相关死亡的首要原因,其中非小细胞肺癌(non-small cell lung cancer,NSCLC)占原发性肺癌的85%[2]。PET/CT能同时提供解剖及代谢信息,在肿瘤的诊断、分期、疗效评价、预后预测等方面有广泛的应用。美国国立综合癌症网络(national comprehensive cancer network,NCCN)指南推荐将PET/CT作为NSCLC的初始评估及诱导治疗后的再分期评估的常用方法[3]。目前,关于PET/CT对肺癌和肺部炎性结节鉴别诊断的相关研究较多,但关于炎症型NSCLC与肺MALT淋巴瘤的鉴别诊断研究较少,在临床工作中,二者的鉴别有一定难度。本研究通过对比炎症型NSCLC与肺MALT淋巴瘤的PET/CT影像表现,旨在提高对这2种疾病诊断的准确性。
-
回顾性分析2015年1月至2020年12月于福建医科大学附属协和医院行18F-FDG PET/CT并经组织病理学检查确诊为肺MALT淋巴瘤或炎症型NSCLC的54例患者的临床资料,其中肺MALT淋巴瘤患者21例,男性13例、女性8例,年龄56~74(66.2±5.8)岁;炎症型NSCLC患者33例,男性20例、女性13例,年龄48~84(64.6±9.6)岁。纳入标准:(1)初诊患者,接受PET/CT检查前未进行抗肿瘤治疗;(2)肺部病变表现为类炎症改变,包括实变型和(或)肿块型;(3)均于检查前后2周内行活体组织病理学检查,获取常规组织病理学和(或)免疫组化结果。排除标准:(1)临床资料不完整;(2)图像质量不佳;(3)既往有其他恶性肿瘤病史。所有患者均于检查前签署了知情同意书。本研究符合《赫尔辛基宣言》的原则。
-
采用美国GE公司Discovery LS PET/CT仪,18F-FDG购自南京江原安迪科正电子研究发展有限公司福州分公司,放射化学纯度>90%。患者检查前禁食6 h以上,控制血糖在3.9~7.5 mmol/L。患者经静脉注射185~370 MBq 18F-FDG后,安静休息45~60 min,排空膀胱后取仰卧位扫描。扫描范围自颅顶至大腿根部。CT扫描参数:管电压120 kV、管电流150 mA、矩阵512×512、层厚4.25 mm。PET扫描参数:采用二维模式采集,采集时间为2.5 min/床位。应用CT数据进行衰减校正后得到PET/CT融合显像。
-
由2名具有5年以上工作经验的核医学科PET/CT医师独立阅片,意见不一致时经讨论协商达成一致。在OsiriX 9.0软件上手动勾画CT及PET的ROI,测量并分析病变最大截面的长径及短径(根据CT肺窗图像测量)、CT值、SUVmax、峰值标准化摄取值(peak standardized uptake value, SUVpeak)。影像征象分析病变形态(实变型表现为肺实质密度均一性增高,导致肺血管和气道壁边缘不清;肿块型表现为病变被肺实质完全包围,界限清楚且长径≥3 cm)、空气支气管征(在不透亮、不含空气的肺组织的衬托下,低密度的支气管显示为充气的结构)、病变位置(单侧或双侧)、淋巴结及脾脏的代谢情况(SUVmax>2.5为高代谢)。
-
应用SPSS 21.0软件进行统计学分析。符合正态分布的计量资料以
$\bar x\pm s $ 表示,方差齐时采用独立样本t检验,方差不齐时采用校正t检验;计数资料以例(%)表示,2组间的比较采用χ2检验。P<0.05为差异有统计学意义。 -
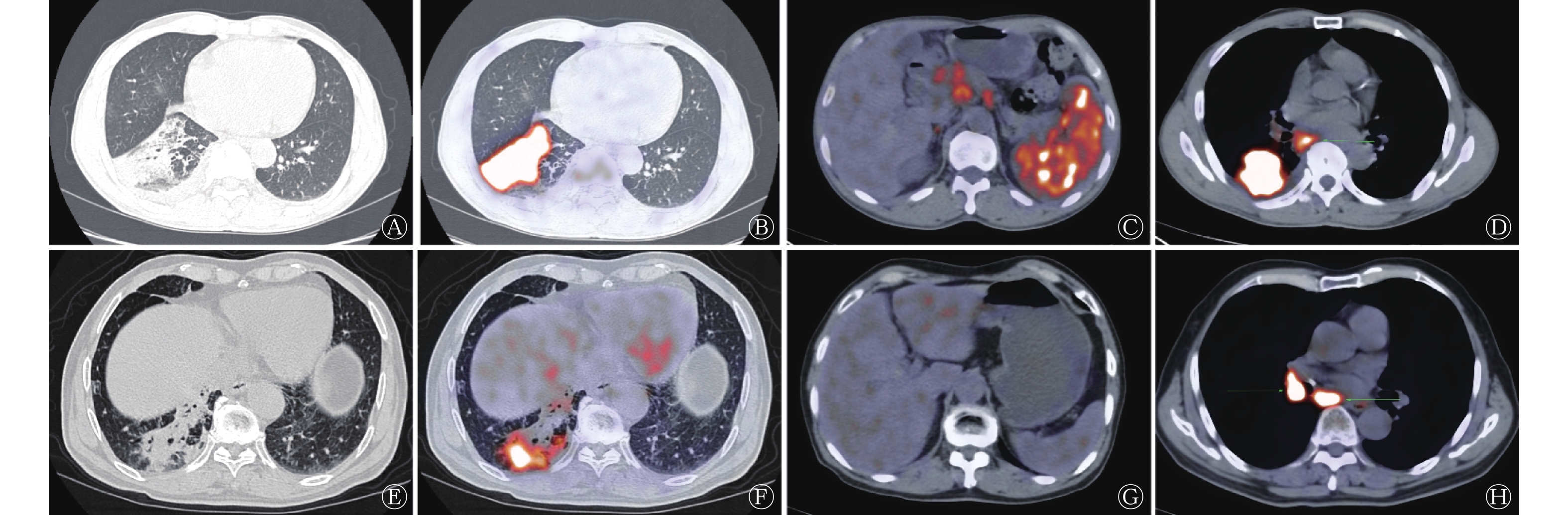
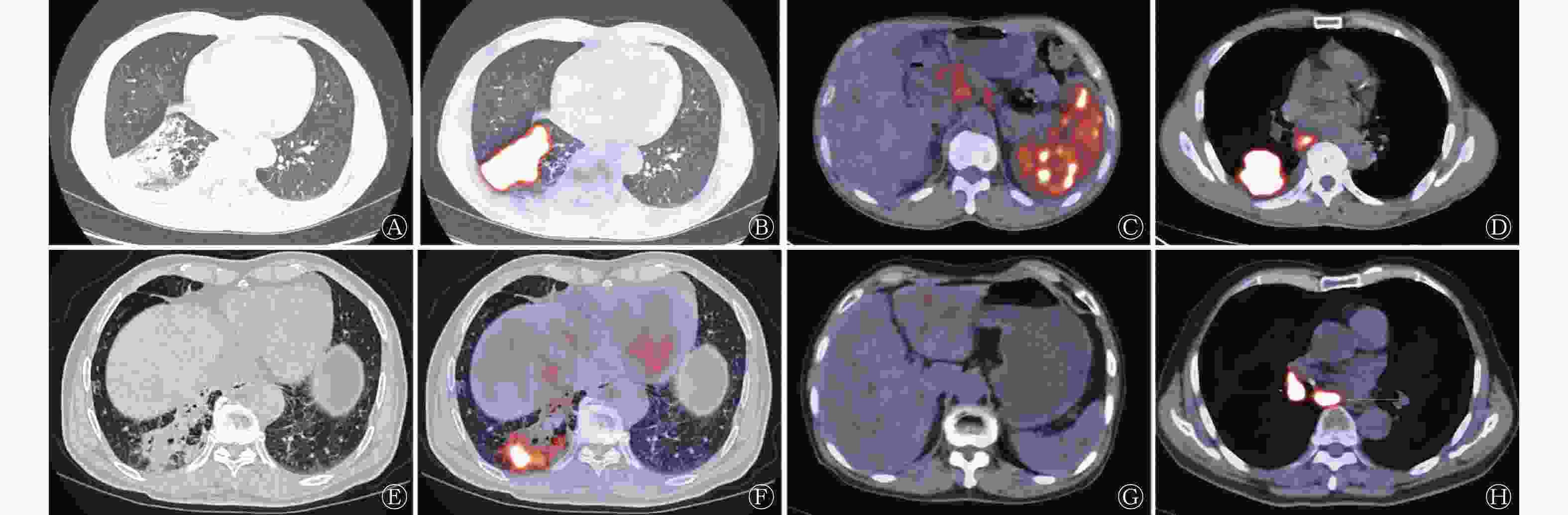
由表1可知,21例肺MALT淋巴瘤患者中,肿块型少于实变型,33例炎症型NSCLC患者中,肿块型稍多于实变型,二者的差异有统计学意义(P=0.037);肺MALT淋巴瘤患者中空气支气管征的比例高于炎症型NSCLC,但差异无统计学意义(P=0.318);肺MALT淋巴瘤合并高代谢淋巴结的比例明显低于炎症型NSCLC,但差异无统计学意义(P=0.070);肺MALT淋巴瘤患者单侧发病的比例低于双侧发病,炎症型NSCLC患者单侧发病的比例高于双侧发病,二者的差异有统计学意义(P<0.001);肺MALT淋巴瘤患者中脾脏高代谢者11例,炎症型NSCLC患者中均未见脾脏高代谢者,二者差异有统计学意义(P<0.001)。肺MALT淋巴瘤与炎症型NSCLC典型病例的PET/CT显像对比见图1。
患者类型 病变形态 空气支气管征 合并高代谢淋巴结 病变位置 脾脏高代谢 肿块型 实变型 单侧 双侧 肺MALT淋巴瘤(n=21) 6(28.6) 15(71.4) 19(90.5) 3(14.3) 5(23.8) 18(85.7) 11(52.4) 炎症型NSCLC(n=33) 19(57.6) 14(42.4) 25(75.8) 16(48.5) 28(84.8) 5(15.2) 0 χ2值 4.342 0.996 3.288 26.133 21.708 P值 0.037 0.318 0.070 <0.001 <0.001 注:MALT为黏膜相关淋巴组织;NSCLC为非小细胞肺癌 表 1 肺MALT淋巴瘤与炎症型NSCLC患者的影像征象比较 [例(%)]
Table 1. Comparison of imaging signs between pulmonary mucosa-associated lymphoid tissue lymphoma patients and inflammatory-type non-small cell lung cancer patients (case (%))
-
由表2可知,肺MALT淋巴瘤患者的肿瘤长径及短径均较炎症型NSCLC患者短,但差异无统计学意义(均P>0.05);肺MALT淋巴瘤患者的CT值较炎症型NSCLC患者高,SUVmax和SUVpeak均较炎症型NSCLC患者低,且差异均有统计学意义(均P<0.01)。
患者类型 病变长径(cm) 病变短径(cm) CT值(HU) SUVmax SUVpeak 肺MALT淋巴瘤(n=21) 5.89±2.14 3.88±1.98 45.4±10.5 5.71±2.10 4.48±2.31 炎症型NSCLC(n=33) 6.26±2.75 4.21±1.56 21.6±50.1 9.89±4.53 7.46±4.44 t值 −1.46 −1.87 30.89 −4.58 −3.23 P值 0.156 0.064 <0.001 <0.001 0.002 注:MALT为黏膜相关淋巴组织;NSCLC为非小细胞肺癌;PET为正电子发射断层显像术;CT为计算机体层摄影术; SUVmax为最大标准化摄取值;SUVpeak为峰值标准化摄取值 表 2 肺MALT淋巴瘤与炎症型NSCLC患者病变的PET/CT参数比较(
$\bar x \pm s $ Table 2. Comparison of PET/CT parameters of lesions between pulmonary mucosa-associated lymphoid tissue lymphoma patients and inflammatory-type non-small cell lung cancer patients (
$\bar x \pm s $ -
肺MALT淋巴瘤是原发性肺淋巴瘤最常见的类型,占原发性肺淋巴瘤的90%[4],属于非霍奇金淋巴瘤。2000年,世界卫生组织(WHO)淋巴造血系统肿瘤分类将其命名为肺黏膜相关淋巴组织结外边缘区B细胞淋巴瘤[5]。肺MALT淋巴瘤为低度恶性肿瘤,组织病理学检查结果显示肿瘤细胞呈克隆性、单一性弥漫增生,主要为中性细胞样淋巴细胞、反应性淋巴滤泡细胞及淋巴滤泡细胞的克隆化,形成淋巴上皮病变。肺MALT淋巴瘤的治疗效果及预后较好,但影像表现缺乏特异性,误诊率较高,确诊需依赖于组织病理学检查[6-8]。炎症型NSCLC又称为实变型NSCLC,在组织病理学及影像上表现为非支气管阻塞性的弥漫性实质性浸润,常被误认为炎症性肺实变[9-10]。
肺MALT淋巴瘤的CT表现多样,包括孤立性或多灶性、圆形或节段性病变,可能位于肺门中央区,周围无小叶倾向。最常见的CT图像表现为单发或多发性的实性病变[11],其次是结节和肿块,其他罕见表现包括磨玻璃样病变和肺间质改变。肺MALT淋巴瘤最常见的伴随表现是空气支气管征和支气管扩张,空洞、钙化、肺囊性病变和胸腔积液不常见。本研究中,实变型是肺MALT淋巴瘤最常见的疾病表现形态,其次是肿块型。本研究中50%以上的患者有空气支气管征;肺MALT淋巴瘤常表现为多发性和双肺发病,双侧肺叶病变的发生率为85.7%(18/21)。
炎症型肺癌以实变为特征,实变可以是一个肺叶的实变,也可以表现为不完全的肺叶实变,但后者可发展为整个肺叶的实变,故完全肺叶实变和不完全肺叶实变是病变进展的不同时期。炎症型NSCLC最常见的CT表现是实变区内出现近端无阻塞的空气支气管征,这也是实变型肺癌容易被误诊为肺部炎症的常见原因之一。高分辨率CT显示实变区周围的磨玻璃影与正常肺组织分界清晰,其内可见细网状间质增厚,即“铺路石征”。炎症型NSCLC以单侧发病为主,双侧发病者多见于多原发性肺癌或转移。这符合本研究中的炎症型NSCLC患者以单侧病变为主(84.8%,28/33),其原因主要与肺癌的生物学行为相关。肺MALT淋巴瘤的平均CT值高于炎症型NSCLC,这可能与组织的成分不同有关,因肺MALT淋巴瘤大多是实性病变,而炎症型NSCLC的肿瘤形态及密度多样,实变中含有坏死的成分,故肺MALT淋巴瘤的平均CT值高于炎症型NSCLC。
18F-FDG PET/CT常用于肺部肿瘤的诊断与评估,但其在肺MALT淋巴瘤中的临床应用价值尚有争议[12]。但最新一项研究结果显示,当结外MALT淋巴瘤病灶位于18F-FDG低生理性摄取部位时,18F-FDG PET/CT的检出率较高,并且SUVmax可以用于预测患者无进展生存期[13]。肺MALT淋巴瘤在18F-FDG PET/CT上可表现为高代谢,但代谢程度低于侵袭性淋巴瘤,如弥漫大B细胞淋巴瘤,且延迟显像代谢比早期显像更高[14]。当肺MALT淋巴瘤的CT图像表现为磨玻璃影、空气支气管征及肿块长径<5 cm时,其对18F-FDG的摄取较低[15]。肺MALT淋巴瘤18F-FDG摄取的差别与组织学特征有关,具有浆细胞分化的肺MALT淋巴瘤具有更高的18F-FDG摄取[16]。2017年,一项18F-FDG PET/CT、细胞增殖核抗原Ki-67(Ki-67)评分和浆细胞分化对胃外MALT淋巴瘤作用的研究结果显示,24例肺MALT淋巴瘤患者的18F-FDG PET/CT摄取与Ki-67评分及浆细胞分化显著相关[17]。在Albano等[18]的研究中,61%的肺MALT淋巴瘤病灶在PET显像中表现为相对高活性,而病灶的代谢活性与病灶大小及Ki-67评分密切相关。另有研究者也提出了类似的观点,肺MALT淋巴瘤组织中Ki-67的表达与PET/CT半定量参数(SUVmax、平均标准化摄取值、肿瘤高代谢体积和病变部位糖酵解总量)显著相关[19]。本研究中,肺MALT淋巴瘤的SUVmax为5.71±2.10,相对较低,参考上述研究结果,这可能与本研究中肺MALT淋巴瘤患者空气支气管征的比例较高(19/21)、肿瘤长径及短径[(5.89±2.14) cm、(3.88±1.98) cm]较小、Ki-67的评分较低有关。有研究结果显示,SUVmax>10的肺MALT淋巴瘤患者有较高的向弥漫大B细胞淋巴瘤转化的风险以及较低的总生存率[20]。而在小细胞肺癌中,Wainer等[21]的研究结果显示,当SUVmax>8时患者预后较差,尤其是对于男性患者。研究结果显示,炎症型NSCLC的SUVmax为9.89±4.53,与以上研究结果基本接近。肺MALT淋巴瘤与炎症型NSCLC患者的SUVmax有显著的差异,这对鉴别2种疾病有较大的帮助。
SUVpeak是指以SUVmax为圆心、体积为1 cm3的球体的SUV的平均值,该参数不依赖于单个像素,所以不太受到噪声和扫描时间的影响,具有更好的稳定性及可重复性[22]。本研究结果显示,肺MALT淋巴瘤的SUVpeak低于炎症型NSCLC,且差异有统计学意义,我们推测可能同样与本研究中肺MALT淋巴瘤患者的空气支气管征比例、病变范围、Ki-67评分有关,后期可进行深入研究。
淋巴瘤常有脾脏浸润,PET/CT显像表现为弥漫性或局灶结节样、肿块样高代谢病变。在本研究中,肺MALT淋巴瘤中具有脾脏高代谢的患者均表现为弥漫性高代谢改变,在炎症型NSCLC患者中均未见到脾脏高代谢。
淋巴结是淋巴瘤及肺癌的常见浸润或转移途径,其在PET/CT显像中表现为代谢增高、体积增大,但淋巴瘤的淋巴结侵犯体积较肺癌的更大,并且大多无坏死、密度比较均匀、肿大的淋巴结可相互融合。本研究中,肺MALT淋巴瘤及炎症型NSCLC均有不同程度的高代谢淋巴结,以炎症型NSCLC更多见,但二者的差异无统计学意义。这或许与本研究中的病例数较为局限有关,未来可纳入更多病例进一步研究。
肺MALT淋巴瘤患者的CT值稍高于炎症型NSCLC患者,密度不均多提示炎症型NSCLC;SUVmax及SUVpeak在一定程度上可区分肺MALT淋巴瘤及炎症型NSCLC,实变型及肿块型肺MALT淋巴瘤比炎症型NSCLC的SUV低。综上所述,SUVmax、SUVpeak、脾脏代谢情况均可以作为鉴别肺MALT淋巴瘤与炎症型NSCLC的PET/CT参数。此外,CT图像中的病变形态、病变位置、CT 值也可以辅助临床鉴别工作,而淋巴结代谢情况、空气支气管征及CT病变范围对于二者的鉴别意义不大。
利益冲突 所有作者声明无利益冲突
作者贡献声明 柯梢柏负责论文命题的设计、文献的整理、论文的撰写与修订;林莉莉负责数据的采集与整理、研究过程的实施;季仲友负责论文的选题、研究方案的设计;李昂负责数据的统计分析、研究方案的设计
18F-FDG PET/CT在肺黏膜相关淋巴组织淋巴瘤与炎症型非小细胞肺癌鉴别诊断中的价值
Differential diagnostic value of 18F-FDG PET/CT between pulmonary mucosa-associated lymphoid tissue lymphoma and inflammatory-type non-small cell lung cancer
-
摘要:
目的 探讨18F-氟脱氧葡萄糖(FDG) PET/CT的影像特征在肺黏膜相关淋巴组织(MALT)淋巴瘤及炎症型非小细胞肺癌(NSCLC)中的鉴别诊断价值。 方法 回顾性分析2015年1月至2020年12月于福建医科大学附属协和医院行18F-FDG PET/CT、肺部表现为类炎症改变并经组织病理学检查确诊的21例肺MALT淋巴瘤患者[男性13例、女性8例,年龄56~74(66.2±5.8)岁]及33例炎症型NSCLC患者[男性20例、女性13例,年龄48~84(64.6±9.6)岁]的临床资料。手动勾画CT及PET的感兴趣区,测量病变最大截面的长径及短径、CT值、最大标准化摄取值(SUVmax)和峰值标准化摄取值(SUVpeak),分析影像征象(病变形态、支气管征、病变位置、淋巴结及脾脏的代谢情况)。采用χ2检验、独立样本t检验及校正t检验比较2组间的差异。 结果 21例肺MALT淋巴瘤患者中,肿块型少于实变型(28.6%对71.4%),33例炎症型NSCLC患者中,肿块型多于实变型(57.6%对42.4%),二者的差异有统计学意义(χ2=4.342,P=0.037);肺MALT淋巴瘤患者中空气支气管征的比例高于炎症型NSCLC患者(90.5%对75.8%),合并高代谢淋巴结的比例明显低于炎症型NSCLC(14.3%对48.5%),二者的差异均无统计学意义( χ2= 0.996、3.288,均 P>0.05);肺MALT淋巴瘤患者中单侧发病的比例低于双侧发病(23.8%对85.7%),炎症型NSCLC患者中,单侧发病的比例高于双侧发病(84.8%对15.2%),二者的差异有统计学意义(χ2=26.133,P<0.001);肺MALT淋巴瘤患者中脾脏高代谢者11例(52.4%),炎症型NSCLC患者中未见脾脏高代谢者,二者的差异有统计学意义(χ2=21.708,P<0.001)。肺MALT淋巴瘤患者的长径和短径较炎症型NSCLC患者短 [(5.89±2.14) cm对(6.26±2.75) cm、(3.88±1.98) cm对(4.21±1.56) cm],二者的差异均无统计学意义(t=−1.46、−1.87,均P>0.05)。肺MALT淋巴瘤患者的CT值高于炎症型NSCLC患者[(45.4±10.5) HU对(21.6±50.1) HU],且差异有统计学意义(t=30.89,P<0.001);肺MALT淋巴瘤患者的SUVmax和SUVpeak较炎症型NSCLC患者低[(5.71±2.10)对(9.89±4.53)、(4.48±2.31)对(7.46±4.44)],且差异均有统计学意义(t=−4.58、−3.23,均P<0.01)。 结论 18F-FDG PET/CT对于肺MALT淋巴瘤和炎症型NSCLC的鉴别诊断具有重要的价值,其中SUVmax、SUVpeak、脾脏代谢情况以及CT图像中的病变形态、病变位置、CT值等可作为参考指标。 -
关键词:
- 氟脱氧葡萄糖F18 /
- 正电子发射断层显像术 /
- 体层摄影术,X线计算机 /
- 癌,非小细胞肺 /
- 淋巴瘤,B细胞,边缘区 /
- 肺肿瘤
Abstract:Objective To investigate the imaging features of 18F-fluorodeoxyglucose (FDG) PET/CT in pulmonary mucosa-associated lymphoid tissue (MALT) lymphoma and differential diagnosis value in inflammatory-type non-small cell lung cancer (NSCLC). Methods Retrospectively analyzed the clinical data of 21 patients with pulmonary MALT lymphoma (13 males and 8 females, aged 56~74(66.2±5.8) and 33 patients with inflammatory-type NSCLC (20 males and 13 females, aged 48~84(64.6±9.6)), respectively, who underwent 18F-FDG PET/CT from January 2015 to December 2020 at Fujian Medical University Union Hospital. In addition, the included patients were those whose lungs showed inflammation-like changes and were confirmed by histopathological examination. The CT and PET regions of interest were manually outlined. Then, the long and short diameters of the largest cross-sections of the lesions, CT values, maximum standardized uptake values (SUVmax), and peak standardized uptake values (SUVpeak) were measured. Moreover, the imaging signs (lesion morphology, bronchial signs, location of lesion onset, lymph node and spleen metabolism) were analyzed. The differences between the two groups were subsequently compared using the χ2 test, independent samples t-test, and corrected t-test. Results There were fewer masses than solids in 21 patients with pulmonary MALT lymphoma (28.6% vs.71.4%) and more masses than solids in 33 patients with inflammatory-type NSCLC (57.6% vs. 42.4%), with a statistically significant difference between the two groups (χ2=4.342, P=0.037); the proportion of bronchial signs was higher in patients with pulmonary MALT lymphoma than that in patients with inflammatory-type NSCLC (90.5% vs. 75.8%), and the proportion of combined hypermetabolic lymph nodes was significantly lower than that in inflammatory-type NSCLC (14.3% vs. 48.5%), with no statistically significant difference between the two group (χ2=0.996, 3.288; both P>0.05); there were fewer unilateral than bilateral morbidities in patients with pulmonary MALT lymphoma (23.8% vs. 85.7%) and more unilateral than bilateral in patients with inflammatory-type NSCLC (84.8% vs.15.2%), with a statistically significant difference between the two groups (χ2=26.133, P<0.001); 11 cases of splenic hypermetabolism in patients with pulmonary MALT lymphoma (52.4%) and none in inflammatory-type NSCLC, with a statistically significant difference between the two groups (χ2=21.708, P<0.001). The mean long and short diameters of patients with pulmonary MALT lymphoma were shorter than those of patients with inflammatory-type NSCLC [(5.89±2.14) cm vs. (6.26±2.75) cm, (3.88±1.98) cm vs. (4.21±1.56) cm], with no statistically significant difference between the two groups (t=−1.46, −1.87; both P>0.05). CT values were higher in patients with pulmonary MALT lymphoma than that in patients with inflammatory-type NSCLC [(45.4±10.5) HU vs.(21.6±50.1) HU], and the difference between them was statistically significant (t=30.89, P<0.001); SUVmax and SUVpeak were lower in patients with pulmonary MALT lymphoma than those in patients with inflammatory-type NSCLC [(5.71±2.10) vs. (9.89±4.53), (4.48±2.31) vs. (7.46±4.44)], and the differences between them were statistically significant (t=−4.58, −3.23; both P<0.01). Conclusions 18F-FDG PET/CT is of great value for the differential diagnosis of pulmonary MALT lymphoma and inflammatory-type NSCLC, in which SUVmax, SUVpeak, spleen metabolism, lesion morphology, lesion onset, and CT value in CT images can be used as reference indicators. -
表 1 肺MALT淋巴瘤与炎症型NSCLC患者的影像征象比较 [例(%)]
Table 1. Comparison of imaging signs between pulmonary mucosa-associated lymphoid tissue lymphoma patients and inflammatory-type non-small cell lung cancer patients (case (%))
患者类型 病变形态 空气支气管征 合并高代谢淋巴结 病变位置 脾脏高代谢 肿块型 实变型 单侧 双侧 肺MALT淋巴瘤(n=21) 6(28.6) 15(71.4) 19(90.5) 3(14.3) 5(23.8) 18(85.7) 11(52.4) 炎症型NSCLC(n=33) 19(57.6) 14(42.4) 25(75.8) 16(48.5) 28(84.8) 5(15.2) 0 χ2值 4.342 0.996 3.288 26.133 21.708 P值 0.037 0.318 0.070 <0.001 <0.001 注:MALT为黏膜相关淋巴组织;NSCLC为非小细胞肺癌 表 2 肺MALT淋巴瘤与炎症型NSCLC患者病变的PET/CT参数比较(
$\bar x \pm s $ Table 2. Comparison of PET/CT parameters of lesions between pulmonary mucosa-associated lymphoid tissue lymphoma patients and inflammatory-type non-small cell lung cancer patients (
$\bar x \pm s $ 患者类型 病变长径(cm) 病变短径(cm) CT值(HU) SUVmax SUVpeak 肺MALT淋巴瘤(n=21) 5.89±2.14 3.88±1.98 45.4±10.5 5.71±2.10 4.48±2.31 炎症型NSCLC(n=33) 6.26±2.75 4.21±1.56 21.6±50.1 9.89±4.53 7.46±4.44 t值 −1.46 −1.87 30.89 −4.58 −3.23 P值 0.156 0.064 <0.001 <0.001 0.002 注:MALT为黏膜相关淋巴组织;NSCLC为非小细胞肺癌;PET为正电子发射断层显像术;CT为计算机体层摄影术; SUVmax为最大标准化摄取值;SUVpeak为峰值标准化摄取值 -
[1] Sirajuddin A, Raparia K, Lewis VA, et al. Primary pulmonary lymphoid lesions: radiologic and pathologic findings[J]. Radiographics, 2016, 36(1): 53−70. DOI: 10.1148/rg.2016140339. [2] Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394−424. DOI: 10.3322/caac.21492. [3] Ettinger DS, Aisner DL, Wood DE, et al. NCCN guidelines insights: non-small cell lung cancer, version 5.2018[J]. J Natl Compr Canc Netw, 2018, 16(7): 807−821. DOI: 10.6004/jnccn.2018.0062. [4] Deng W, Wan Y, Yu JQ. Pulmonary MALT lymphoma has variable features on CT[J/OL]. Sci Rep, 2019, 9(1): 8657[2021-02-16]. https://www.nature.com/articles/s41598-019-45144-9. DOI: 10.1038/s41598-019-45144-9. [5] Ferraro P, Trastek VF, Adlakha H, et al. Primary non-Hodgkin's lymphoma of the lung[J]. Ann Thorac Surg, 2000, 69(4): 993−997. DOI: 10.1016/s0003-4975(99)01535-0. [6] Kawashima T, Nishimura H, Akiyama H, et al. Primary pulmonary mucosa-associated lymphoid tissue lymphoma combined with idiopathic thrombocytopenic purpura and amyloidoma in the lung[J]. J Nippon Med Sch, 2005, 72(6): 370−374. DOI: 10.1272/jnms.72.370. [7] 彭思达, 谭获, 黄振倩, 等. 肺黏膜相关淋巴组织样淋巴瘤7例并临床诊断与分析[J]. 中国肿瘤临床, 2014, 41(14): 922−924. DOI: 10.3969/j.issn.1000-8179.20131268.
Peng SD, Tan H, Huang ZQ, et al. Clinical diagnosis and analysis of primary pulmonary mucosa-associated lymphoid tissue lymphoma: a report of seven cases[J]. Chin J Clin Oncol, 2014, 41(14): 922−924. DOI: 10.3969/j.issn.1000-8179.20131268.[8] 陈勃江, 高俊, 唐源, 等. 肺粘膜相关淋巴组织边缘区B细胞淋巴瘤的临床病理分析[J]. 中国肺癌杂志, 2011, 14(5): 446−451. DOI: 10.3779/j.issn.1009-3419.2011.05.12.
Chen BJ, Gao J, Tang Y, et al. Clinicopathological analysis of pulmonary marginal zone B-cell lymphoma of mucosa-associated lymphoid tissue[J]. Chin J Lung Cancer, 2011, 14(5): 446−451. DOI: 10.3779/j.issn.1009-3419.2011.05.12.[9] Jung JI, Kim H, Park SH, et al. CT differentiation of pneumonic-type bronchioloalveolar cell carcinoma and infectious pneumonia[J]. Br J Radiol, 2001, 74(882): 490−494. DOI: 10.1259/bjr.74.882.740490. [10] Akata S, Fukushima A, Kakizaki D, et al. CT scanning of bronchioloalveolar carcinoma: specific appearances[J]. Lung Cancer, 1995, 12(3): 221−230. DOI: 10.1016/0169-5002(95)00445-7. [11] Albano D, Borghesi A, Bosio G, et al. Pulmonary mucosa-associated lymphoid tissue lymphoma: 18F-FDG PET/CT and CT findings in 28 patients[J]. Br J Radiol, 2017, 90(1079): 20170311. DOI: 10.1259/bjr.20170311. [12] Albano D, Durmo R, Treglia G, et al. 18F-FDG PET/CT or PET role in MALT lymphoma: an open issue not yet solved-a critical review[J]. Clin Lymphoma Myeloma Leuk, 2020, 20(3): 137−146. DOI: 10.1016/j.clml.2019.10.006. [13] Cohen D, Perry C, Hazut-Krauthammer S, et al. Is there a role for [18F]FDG PET-CT in staging MALT lymphoma?[J/OL]. Cancers, 2022, 14(3): 750[2022-02-16]. https://www.mdpi.com/2072-6694/14/3/750. DOI: 10.3390/cancers14030750. [14] 雷强, 李新春, 万齐, 等. 肺黏膜相关淋巴组织淋巴瘤的CT、PET/CT表现及预后随访[J]. 中国临床医学影像杂志, 2018, 29(9): 620−623, 639. DOI: 10.12117/jccmi.2018.09.004.
Lei Q, Li XC, Wan Q, et al. Pulmonary mucosa-associated lymphoid tissue lymphoma: CT and PET/CT imaging findings and follow-up[J]. J China Clin Med Imag, 2018, 29(9): 620−623, 639. DOI: 10.12117/jccmi.2018.09.004.[15] Husnain M, Kuker R, Reis IM, et al. Clinical and radiological characteristics of patients with pulmonary marginal zone lymphoma: a single center analysis[J/OL]. Cancer Med, 2020, 9(14): 5051−5064[2022-02-16]. https://onlinelibrary.wiley.com/doi/10.1002/cam4.3096. DOI: 10.1002/cam4.3096. [16] Hoffmann M, Wöhrer S, Becherer A, et al. 18F-Fluoro-deoxy-glucose positron emission tomography in lymphoma of mucosa-associated lymphoid tissue: histology makes the difference[J]. Ann Oncol, 2006, 17(12): 1761−1765. DOI: 10.1093/annonc/mdl295. [17] Albano D, Bosio G, Giubbini R, et al. 18F-FDG PET/CT and extragastric MALT lymphoma: role of Ki-67 score and plasmacytic differentiation[J]. Leuk Lymphoma, 2017, 58(10): 2328−2334. DOI: 10.1080/10428194.2017.1298754. [18] Albano D, Bosio G, Camoni L, et al. Prognostic role of baseline 18F-FDG PET/CT parameters in MALT lymphoma[J]. Hematol Oncol, 2019, 37(1): 39−46. DOI: 10.1002/hon.2563. [19] Zhao J, Wang HQ. Correlation between 18F-FDG PET/CT semiquantitative parameters and Ki-67 expression in pulmonary mucosa-associated lymphoid tissue lymphoma[J]. J Med Imaging Radiat Oncol, 2021, 65(2): 188−194. DOI: 10.1111/1754-9485.13146. [20] Yang XB, Min XX, He WM. Sequential development of multifocal recurrent non-Hodgkin's lymphoma of mucosa-associated lymphoid tissue and diffuse large B-Cell lymphoma in a single patient: a case report[J]. Medicine, 2018, 97(21): e10845. DOI: 10.1097/MD.0000000000010845. [21] Wainer Z, Daniels MG, Callahan J, et al. Sex and SUVmax: sex-dependent prognostication in early non-small cell lung cancer[J]. J Nucl Med, 2012, 53(11): 1676−1685. DOI: 10.2967/jnumed.112.105197. [22] Mercieca S, Belderbos J, Van Loon J, et al. Comparison of SUVmax and SUVpeak based segmentation to determine primary lung tumour volume on FDG PET-CT correlated with pathology data[J]. Radiother Oncol, 2018, 129(2): 227−233. DOI: 10.1016/j.radonc.2018.06.028. -





 下载:
下载: