-
前列腺癌(prostate cancer,PCa)是男性常见的恶性肿瘤之一,其发病率位居恶性肿瘤的第六位、病死率位居第九位,且发病率逐年上升[1]。PCa起病隐匿,临床上常难以与前列腺增生等相鉴别。多参数磁共振成像(multi-parametric magnetic resonance imaging,mpMRI)是PCa最重要的影像学检查方法,有助于提高肿瘤的检出率,明确肿瘤诊断及临床分期[2]。根治性切除术是局部早期PCa患者首选的治疗方案[3-4],但部分PCa患者术后易出现生化复发(biochemical recurrence,BCR),进而导致预后不良。BCR是指患者行PCa根治性切除术后,连续2次血清前列腺特异性抗原(prostate specific antigen, PSA)水平≥0.2 ng/ml[5]。明确PCa患者术后BCR的危险因素具有重要的临床指导意义,且一直是研究的热点。既往有研究结果表明,术后Gleason评分>7、病理包膜侵犯、切缘阳性及术前PSA水平>10 ng/ml均为BCR的高危因素[6-7]。本研究探讨了mpMRI特征和临床因素与PCa术后BCR的相关性,旨在对BCR风险进行评估。
-
回顾性分析2013年9月至2020年10月于青岛大学附属医院行PCa根治性切除术前行mpMRI检查的152例男性患者的影像学资料和临床资料,年龄44~82(69.0±7.2)岁。纳入标准:(1)经组织病理学检查证实为PCa;(2)具有术前mpMRI影像,包含T1加权像(T1 weighted image,T1WI)、T2加权像(T2 weighted image,T2WI)、弥散加权成像(diffusion weighted imaging,DWI)及增强成像,且DWI图像B值≥1000;(3)进行定期随访,复查PSA,术后1年内每3个月1次,之后每6个月1次。排除标准:(1)有其他恶性肿瘤病史;(2)mpMRI检查前行PCa相关治疗;(3)随访资料缺失。收集患者的临床资料及实验室检查结果,包括年龄、身体质量指数(body mass index,BMI)、术前PSA水平及前列腺特异性抗原密度(prostate specific antiqen density,PSAD)水平、术后病理包膜及精囊是否受到侵犯、切缘是否阳性、Gleason评分等。按照是否发生BCR将患者分为BCR组和非BCR组。
所有患者均签署了知情同意书。本研究已获得青岛大学附属医院伦理委员会的批准(批准号:QYFYWZLL26653)。
-
使用德国Siemens Skyra 3.0T MRI扫描仪、腹部相控阵线圈进行检查。所有患者行前列腺高分辨率扫描。扫描参数包括横断面快速自旋回波-T1加像权(turbospin echo-T1 weighted image, TSE-T1WI):重复时间(time of repetition,TR)500 ms、回波时间(time of echo,TE)13 ms、视野(field of view,FOV)200 mm×200 mm、矩阵256×256、层厚3 mm、层间距0.3 mm。横断面TSE-T2WI及冠状面TSE-T2WI:TR 4170 ms、TE 100 ms、FOV 200 mm×200 mm(横断面)、200 mm×200 mm(冠状面)、矩阵256×256、层厚3 mm、层间距0.3 mm。横断面DWI:TR 3020 ms、TE 67 ms、FOV 200 mm×200 mm、矩阵256×256、层厚3 mm、层间距0.3 mm、扫描时间422 s,B值分别为0、1000 s/mm2。动态增强扫描:采用三维容积式内插值法屏气检查序列(3D-VIBE),横断面扫描,TR 4.8 ms、TE 1.7 ms、FOV 260 mm×260 mm、矩阵256×256、层厚3 mm、层间距0.3 mm,每期26层,动态增强扫描40期,扫描时间160 s。
-
由2名具有5年以上前列腺MRI影像诊断经验的影像专业医师在未知组织病理学检查结果的情况下根据前列腺影像报告和数据系统(prostate imaging reporting and data system,PI-RADS)分析PCa的MRI特征,主要包括PI-RADS评分、前列腺体积、肿瘤最大径、肿瘤部位、是否累及包膜或精囊、临床T分期。采用最新的PI-RADS V2.1进行评分[8],对纳入患者的mpMRI图像进行评分,评分结果不一致经协商达成一致意见后作出最终评分。前列腺体积=0.52×前后径×左右径×上下径。其中最大左右径在横断面T2WI上测量,最大前后径及最大上下径在矢状面T2WI上测量。肿瘤最大径为在T2WI上显示的病灶最大的截面,同时以DWI或增强序列进行辅助并记录其长度。若为多个病灶,则选取最大病灶。
-
随访起始时间为患者行前列腺根治性切除术的日期,截止时间为2021年3月31日,将发生BCR作为随访终点。通过电话以及查阅患者在本院的诊治信息等方式进行随访,随访内容主要包括患者的症状、体征、影像学检查、实验室检查等。
-
应用SPSS 25.0软件进行统计学分析。应用X-tile 3.6.1软件确定连续变量的最佳临界值。符合正态分布的计量资料以
$\bar x \pm s $ 表示。采用Log-rank检验对术后BCR的危险因素进行单因素分析,采用Cox比例风险回归模型对在单因素分析中得到有统计学意义的术前因素进行多因素分析,筛选出术后BCR的独立危险因素。P<0.05为差异有统计学意义。 -
通过X-tile 3.6.1软件进行数据分析,最后确定连续变量的最佳临界值分别为年龄64岁、BMI 21.2 kg/m2、术前PSA水平17.2 ng/ml、术前PSAD水平2.0 ng/(ml·cm3)、前列腺体积24.9 cm3和肿瘤最大径18.0 mm。
-
152例PCa患者中,BCR组患者41例、非BCR患者111例。所有患者的随访时间为13(7~61)个月。41例患者出现BCR,BCR发生率为27%(41/152)。BCR组与非BCR组患者的mpMRI征象和临床信息见表1。
因素 BCR组(n=41) 非BCR组(n=111) χ2值 P值 年龄(岁) 3.008 0.083 ≤64 13 21 >64 28 90 BMI(kg/m2) 10.681 0.001 ≤21.2 9 6 >21.2 32 105 术前PSA水平(ng/ml) 13.562 <0.001 ≤17.2 6 57 >17.2 35 54 术前PSAD水平[ng(ml·cm3)] 7.410 0.006 ≤2.0 29 101 >2.0 12 10 穿刺Gleason评分 8.105 0.004 ≤7 12 60 >7 29 51 术后Gleason评分 5.910 0.015 ≤7 11 55 >7 30 56 PI-RADS评分 19.681 <0.001 ≤4 8 65 >4 33 46 前列腺体积(cm3) 3.839 0.050 ≤24.9 12 15 >24.9 29 96 肿瘤部位 19.881 <0.001 外周带 14 68 中央腺体 14 30 二者均有 13 13 肿瘤最大径(mm) 23.531 <0.001 ≤18.0 12 77 >18.0 29 34 MRI累及包膜 14.017 <0.001 是 26 32 否 15 79 MRI累及精囊 0.061 0.804 是 5 9 否 36 102 病理包膜侵犯 5.734 0.017 是 28 45 否 13 66 病理精囊侵犯 4.224 0.040 是 13 17 否 28 94 切缘阳性 0.030 0.862 是 24 66 否 17 45 临床T分期 12.318 0.002 ≤T2c 15 75 T3a 20 25 T3b及T4 6 11 注:BMI为身体质量指数;PSA为前列腺特异性抗原;PSAD为前列腺特异性抗原密度;PI-RADS为前列腺影像报告和数据系统;MRI为磁共振成像;BCR为生化复发 表 1 152例前列腺癌患者根治性切除术后生化复发的 单因素分析
Table 1. Univariate analysis of biochemical recurrence after radical prostatectomy in 152 patients with prostate cancer
-
单因素分析结果显示,BMI、术前PSA及PSAD水平、穿刺和术后Gleason评分、PI-RADS评分、肿瘤部位、肿瘤最大径、MRI累及包膜、病理包膜侵犯和精囊侵犯、临床T分期是术后BCR的危险因素(均P<0.05,表1)。
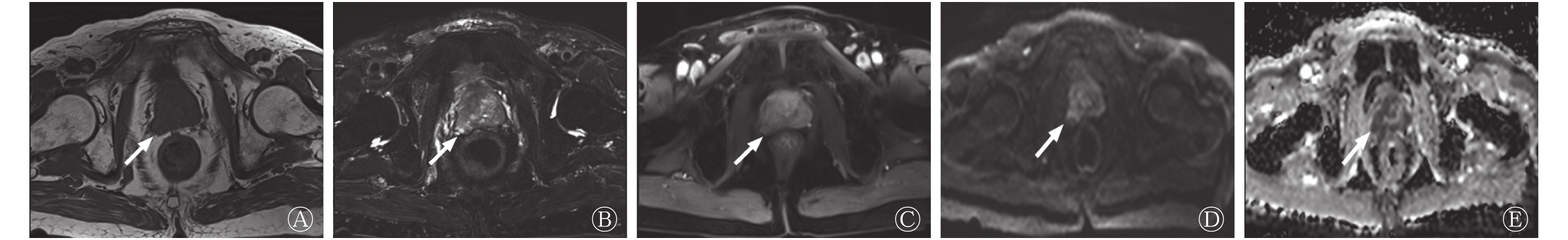
多因素分析结果显示,BMI、术前PSA水平及MRI累及包膜是PCa术后BCR的独立危险因素(均P<0.05,表2)。PCa患者根治性切除术前的mpMRI见图1。
因素 B值 SE Wald HR 95%CI P值 BMI 1.175 0.414 8.042 3.238 1.437~7.293 0.005 术前PSA水平 0.984 0.479 4.221 2.675 1.046~6.841 0.040 术前PSAD水平 −0.073 0.412 0.032 0.929 0.414~2.085 0.859 穿刺Gleason评分 0.236 0.398 0.352 1.266 0.581~2.760 0.553 PI-RADS评分 0.761 0.633 1.444 2.139 0.619~7.397 0.230 肿瘤最大径 0.476 0.575 0.684 1.610 0.521~4.971 0.408 肿瘤部位 0.240 0.247 0.941 1.271 0.783~2.064 0.332 MRI累及包膜 1.155 0.559 4.264 3.175 1.061~9.502 0.039 临床T分期 −0.678 0.405 2.800 0.508 0.230~1.123 0.094 注:BMI为身体质量指数;PSA为前列腺特异性抗原;PSAD为前列腺特异性抗原密度;PI-RADS为前列腺影像报告和数据系统;MRI为磁共振成像;HR为风险比 表 2 152例前列腺癌患者根治性切除术后生化复发的 多因素分析
Table 2. Multivariate analysis of biochemical recurrence after radical prostatectomy in 152 patients with prostate cancer
-
近年来,我国PCa患者的发病率逐年上升,根治性切除术是其较为重要的治疗方式。行根治性切除术后,约20%~30% PCa患者会出现BCR[5]。BCR作为评价预后的重要指标,是临床医师关注的重点。既往的研究结果显示,术前PSA水平、术后Gleason评分及病理T分期与BCR均有相关性[9-10]。
本研究结果显示,术前PSA水平(临界值17.2 ng/ml)是术后BCR的独立危险因素。瞿旻等[9]对883例行前列腺根治性切除术的患者术后BCR的危险因素进行分析,结果显示,术前PSA(临界值10 ng/ml)水平是术后出现BCR的高危因素。马帅军等[11]对558例行前列腺根治性切除术患者的临床资料进行分析,结果表明,术前PSA(临界值20 ng/ml)水平是术后BCR的独立危险因素。本研究结果与上述研究结果基本一致,其PSA临界值的差异可能与纳入患者数量不足(可能导致统计学结果偏倚)以及分层方式不同(瞿旻等[9]将PSA水平分为<4、4~<10、≥10 ng/ml;马帅军等[11]将PSA水平分为<10、10~20、>20 ng/ml)有关。
Cao和Ma[12]对接受前列腺根治性切除术的26479例患者进行随访的16项研究中发现,BMI每增加5 kg/m2 ,BCR的风险增加21%,BMI与BCR具有显著相关性(RR:1.21,95%CI:1.11~1.31,P<0.01)。同时有研究结果表明,随着BMI的升高,5年未出现BCR患者的生存率进行性下降,这说明较高的BMI是术后BCR的独立危险因素[13-15]。而本研究结果表明,BMI是术后BCR的独立危险因素,其原因可能是由于针对BMI数值进行二分类,导致某一范围内出现BCR的患者占比较高所致。本研究样本量不足,还需大样本数据进行验证及评估。
本研究采用PI-RADS V2.1进行评分,结果表明,其是术后BCR的危险因素。Zhang等[16]对205例行前列腺根治性切除术患者的临床资料进行分析,结果显示,PI-RADS评分是术后BCR的独立危险因素。在本研究的多因素分析结果中,PI-RADS评分未能成为独立危险因素,其原因可能与分层方式不同(Zhang等[16]将PI-RADS评分分为2、3、4、5分)及高危患者BCR发生率不一(Zhang等[16]研究纳入PI-RADS评分仅为5分的患者,BCR发生率达60.63%)相关。
既往的研究是由组织病理学检查最终确诊包膜是否受侵犯,少部分是通过影像观察包膜受累情况与术后BCR之间的关系。本研究结果表明,MRI累及包膜是前列腺根治性切除术后BCR的独立危险因素。这与Ho等[17]研究结果一致。前列腺包膜侵犯关乎患者治疗方案的选择及预后[18]。PCa诊疗指南肯定了mpMRI对于包膜侵犯的价值[19]。根据术前mpMRI图像,肿瘤未侵犯包膜者可行保留神经的根治切除术;有侵犯包膜的高风险,如临床T2c期、T3期或Gleason评分>7分的患者可行不保留神经的根治性切除术,同时行术前或术后新辅助治疗,可降低BCR的发生率[19]。
本研究的不足:(1)随访时间较短,需要更长时间的随访进行验证;(2)本研究为单中心回顾性研究,样本量较小,后续需扩大样本量验证结论。
综上所述,低BMI、术前高PSA水平及MRI累及包膜与PCa根治性切除术后BCR密切相关,有望对术后患者BCR风险进行分层,进而指导PCa治疗。
利益冲突 所有作者声明无利益冲突
作者贡献声明 李晓旭负责数据的采集、论文的撰写;杨光杰负责研究命题的提出、论文的修改;张琦负责患者的随访;夏连爽负责数据的统计与分析;王振光负责命题的设计、研究的指导、论文的审阅
多参数MRI特征和临床因素与前列腺癌术后生化复发风险的相关性分析
The correlation analysis of multi-parametric MRI features and clinical factors with the risk of biochemical recurrence after radical prostatectomy
-
摘要:
目的 探究多参数MRI(mpMRI)特征和临床因素与前列腺癌(PCa)根治性切除术后生化复发(BCR)风险的相关性。 方法 回顾性分析2013年9月至2020年10月于青岛大学附属医院行PCa根治性切除术前行mpMRI检查的152例男性患者的影像学资料及临床资料,年龄44~82(69.0±7.2)岁。根据前列腺影像报告和数据系统(PI-RADS)分析MRI特征,主要包括PI-RADS评分、前列腺体积、肿瘤最大径、肿瘤部位、是否累及包膜或精囊、mpMRI临床T分期。采用最新的PI-RADS V2.1进行mpMRI图像评分。将发生BCR作为随访的终点。应用X-tile统计软件确定连续变量的最佳临界值。采用Log-rank检验和Cox比例风险回归模型对PCa术后BCR的独立危险因素进行单因素和多因素分析。 结果 中位随访时间13个月,术后BCR发生率为27%(41/152)。单因素分析结果显示,身体质量指数(BMI)、术前前列腺特异性抗原(PSA)水平及前列腺特异性抗原密度(PSAD)水平、穿刺和术后Gleason评分、PI-RADS评分、肿瘤部位、肿瘤最大径、MRI累及包膜、病理包膜侵犯和精囊侵犯、mpMRI临床T分期是PCa术后BCR的危险因素(χ2=4.224~23.531,均P<0.05)。多因素分析结果显示,BMI 、术前PSA水平及MRI累及包膜是PCa术后BCR的独立危险因素(HR=3.238、2.675、3.175,95%CI:1.437~7.293、1.046~6.841、1.061~9.502,均P<0.05)。 结论 低BMI、术前高PSA水平及MRI累及包膜与PCa根治性切除术后BCR密切相关。 Abstract:Objective To investigate the correlation of multi-parametric magnetic resonance imaging (mpMRI) features and clinical factors with the risk of biochemical recurrence (BCR) after radical prostatectomy. Methods A retrospective analysis was performed on the imaging data and clinical data of 152 male patients who were aged 44–82 (69.0±7.2) years and underwent mpMRI before radical prostatectomy in the Affiliated Hospital of Qingdao University from September 2013 to October 2020. Magnetic resonance imaging (MRI) features were analyzed according to the Prostate Imaging Report and Data System (PI-RADS), which mainly included PI-RADS score, prostate volume, maximum tumor diameter, tumor site, involvement of capsule and seminal vesicle, and mpMRI clinical T staging. mpMRI images were scored using the latest prostate PI-RADS V2.1. The occurrence of BCR was used as the end point of follow-up. X-tile statistical software was used to determine the optimal critical value of continuous variables. Univariate and multivariate analyses were performed using log-rank test and Cox proportional risk regression model to analyze the independent risk factors of BCR after radical prostatectomy. Results The median follow-up was 13 months, and BCR rate was 27% (41/152). The results of univariate analysis showed that body mass index (BMI), preoperative prostate specific antigen (PSA) levels and prostate specific antiqen density (PSAD) levels, biopsy and postoperative pathologica Gleason score, PI-RADS score, tumor site, maximum diameter of tumor lesion, MRI involvement of the capsule, pathological capsule invasion, seminal vesicle invasion, and mpMRI clinical T stage were the risk factors for BCR (χ2=4.224–23.531, all P<0.05). The results of multivariate analysis showed that BMI, preoperative PSA levels, and MRI involvement of the capsule were independent risk factors for BCR after radical prostatectomy (HR=3.238, 2.675, 3.175; 95%CI: 1.437–7.293, 1.046–6.841, 1.061–9.502; all P<0.05). Conclusion Low BMI, high PSA level, and MRI involvement of the capsule were closely associated with BCR after radical prostatectomy. -
表 1 152例前列腺癌患者根治性切除术后生化复发的 单因素分析
Table 1. Univariate analysis of biochemical recurrence after radical prostatectomy in 152 patients with prostate cancer
因素 BCR组(n=41) 非BCR组(n=111) χ2值 P值 年龄(岁) 3.008 0.083 ≤64 13 21 >64 28 90 BMI(kg/m2) 10.681 0.001 ≤21.2 9 6 >21.2 32 105 术前PSA水平(ng/ml) 13.562 <0.001 ≤17.2 6 57 >17.2 35 54 术前PSAD水平[ng(ml·cm3)] 7.410 0.006 ≤2.0 29 101 >2.0 12 10 穿刺Gleason评分 8.105 0.004 ≤7 12 60 >7 29 51 术后Gleason评分 5.910 0.015 ≤7 11 55 >7 30 56 PI-RADS评分 19.681 <0.001 ≤4 8 65 >4 33 46 前列腺体积(cm3) 3.839 0.050 ≤24.9 12 15 >24.9 29 96 肿瘤部位 19.881 <0.001 外周带 14 68 中央腺体 14 30 二者均有 13 13 肿瘤最大径(mm) 23.531 <0.001 ≤18.0 12 77 >18.0 29 34 MRI累及包膜 14.017 <0.001 是 26 32 否 15 79 MRI累及精囊 0.061 0.804 是 5 9 否 36 102 病理包膜侵犯 5.734 0.017 是 28 45 否 13 66 病理精囊侵犯 4.224 0.040 是 13 17 否 28 94 切缘阳性 0.030 0.862 是 24 66 否 17 45 临床T分期 12.318 0.002 ≤T2c 15 75 T3a 20 25 T3b及T4 6 11 注:BMI为身体质量指数;PSA为前列腺特异性抗原;PSAD为前列腺特异性抗原密度;PI-RADS为前列腺影像报告和数据系统;MRI为磁共振成像;BCR为生化复发 表 2 152例前列腺癌患者根治性切除术后生化复发的 多因素分析
Table 2. Multivariate analysis of biochemical recurrence after radical prostatectomy in 152 patients with prostate cancer
因素 B值 SE Wald HR 95%CI P值 BMI 1.175 0.414 8.042 3.238 1.437~7.293 0.005 术前PSA水平 0.984 0.479 4.221 2.675 1.046~6.841 0.040 术前PSAD水平 −0.073 0.412 0.032 0.929 0.414~2.085 0.859 穿刺Gleason评分 0.236 0.398 0.352 1.266 0.581~2.760 0.553 PI-RADS评分 0.761 0.633 1.444 2.139 0.619~7.397 0.230 肿瘤最大径 0.476 0.575 0.684 1.610 0.521~4.971 0.408 肿瘤部位 0.240 0.247 0.941 1.271 0.783~2.064 0.332 MRI累及包膜 1.155 0.559 4.264 3.175 1.061~9.502 0.039 临床T分期 −0.678 0.405 2.800 0.508 0.230~1.123 0.094 注:BMI为身体质量指数;PSA为前列腺特异性抗原;PSAD为前列腺特异性抗原密度;PI-RADS为前列腺影像报告和数据系统;MRI为磁共振成像;HR为风险比 -
[1] 中国抗癌协会泌尿男生殖系统肿瘤专业委员会前列腺癌学组. 前列腺癌筛查中国专家共识(2021年版)[J]. 中国癌症杂志, 2021, 31(5): 435−440. DOI: 10.19401/j.cnki.1007-3639.2021.05.010.
Prostate Cancer Group, Urogenital Tumor Professional Committee, Chinese Anti-cancer Association. Chinese expert consensus on prostate cancer screening (2021 Edition)[J]. Chin Oncol, 2021, 31(5): 435−440. DOI: 10.19401/j.cnki.1007-3639.2021.05.010.[2] Fan Y, Zhai LY, Meng YS, et al. Contemporary epstein criteria with biopsy-naïve multiparametric magnetic resonance imaging to prevent incorrect assignment to active surveillance in the PI-RADS Version 2.0 era[J]. Ann Surg Oncol, 2018, 25(12): 3510−3517. DOI: 10.1245/s10434-018-6720-2. [3] Hegarty J, Beirne PV, Walsh E, et al. Radical prostatectomy versus watchful waiting for prostate cancer[J/OL]. Cochrane Database Syst Rev, 2010, (11): Cd006590[2021-12-06]. https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD006590.pub2/full. DOI: 10.1002/14651858.CD006590.pub2. [4] 姜丰泽, 王梁, 戴志红, 等. 腹腔镜前列腺癌根治术治疗局限性前列腺癌的效果研究[J]. 癌症进展, 2018, 16(15): 1907−1910.
Jiang FZ, Wang L, Dai ZH, et al. Clinical effect of laparoscopic radical prostatectomy on localized prostate cancer[J]. Oncol Prog, 2018, 16(15): 1907−1910.[5] Heidenreich A, Bastian PJ, Bellmunt J, et al. EAU guidelines on prostate cancer. Part 1: screening, diagnosis, and local treatment with curative intent-update 2013[J]. Eur Urol, 2014, 65(1): 124−137. DOI: 10.1016/j.eururo.2013.09.046. [6] Brockman JA, Alanee S, Vickers AJ, et al. Nomogram predicting prostate cancer-specific mortality for men with biochemical recurrence after radical prostatectomy[J]. Eur Urol, 2015, 67(6): 1160−1167. DOI: 10.1016/j.eururo.2014.09.019. [7] Savdie R, Horvath LG, Benito RP, et al. High Gleason grade carcinoma at a positive surgical margin predicts biochemical failure after radical prostatectomy and may guide adjuvant radiotherapy[J]. BJU Int, 2012, 109(12): 1794−1800. DOI: 10.1111/j.1464-410X.2011.10572.x. [8] Turkbey B, Rosenkrantz AB, Haider MA, et al. Prostate imaging reporting and data system version 2.1: 2019 update of prostate imaging reporting and data system version 2[J]. Eur Urol, 2019, 76(3): 340−351. DOI: 10.1016/j.eururo.2019.02.033. [9] 瞿旻, 高旭, 侯建国, 等. 前列腺癌患者根治术后生化复发危险因素的单中心研究[J]. 中华泌尿外科杂志, 2015, 36(8): 573−577. DOI: 10.3760/cma.j.issn.1000-6702.2015.08.004.
Qu M, Gao X, Hou JG, et al. Risk factors for biochemical recurrence after radical prostatectomy: a single center analysis[J]. Chin J Urol, 2015, 36(8): 573−577. DOI: 10.3760/cma.j.issn.1000-6702.2015.08.004.[10] 梁迎春, 许宁, 吴宇鹏, 等. 前列腺尖部形态对腹腔镜根治性前列腺切除术后尖部切缘阳性及生化复发的影响[J]. 中华外科杂志, 2019, 57(3): 200−205. DOI: 10.3760/cma.j.issn.0529-5815.2019.03.008.
Liang YC, Xu N, Wu YP, et al. Impact of diverse shapes of prostatic apex on positive apical margin rate and biochemical recurrence following laparoscopic radical prostatectomy[J]. Chin J Surg, 2019, 57(3): 200−205. DOI: 10.3760/cma.j.issn.0529-5815.2019.03.008.[11] 马帅军, 张景良, 苏醒, 等. 根治性前列腺切除术后生化复发的危险因素分析[J]. 中华泌尿外科杂志, 2022, 43(1): 35−39. DOI: 10.3760/cma.j.cn112330-20210722-00388.
Ma SJ, Zhang JL, Su X, et al. Risk factor analysis of patients with biochemical recurrence after radical prostatectomy[J]. Chin J Urol, 2022, 43(1): 35−39. DOI: 10.3760/cma.j.cn112330-20210722-00388.[12] Cao Y, Ma J. Body mass index, prostate cancer-specific mortality, and biochemical recurrence: a systematic review and meta-analysis[J]. Cancer Prev Res (Phila), 2011, 4(4): 486−501. DOI: 10.1158/1940-6207.CAPR-10-0229. [13] Maj-Hes AB, Mathieu R, Özsoy M, et al. Obesity is associated with biochemical recurrence after radical prostatectomy: A multi-institutional extended validation study[J]. Urol Oncol, 2017, 35(7): 460.e1−460.e8. DOI: 10.1016/j.urolonc.2017.01.022. [14] Yu YD, Byun SS, Lee SE, et al. Impact of body mass index on oncological outcomes of prostate cancer patients after radical prostatectomy[J/OL]. Sci Rep, 2018, 8(1): 11962[2021-12-06]. https://www.nature.com/articles/s41598-018-30473-y. DOI: 10.1038/s41598-018-30473-y. [15] Bai PD, Hu MB, Xu H, et al. Body mass index is associated with higher Gleason score and biochemical recurrence risk following radical prostatectomy in Chinese men: a retrospective cohort study and meta-analysis[J/OL]. World J Surg Oncol, 2015, 13: 311[2021-12-06]. https://wjso.biomedcentral.com/articles/10.1186/s12957-015-0725-0. DOI: 10.1186/s12957-015-0725-0. [16] Zhang YD, Wu CJ, Bao ML, et al. MR-based prognostic nomogram for prostate cancer after radical prostatectomy[J]. J Magn Reson Imaging, 2017, 45(2): 586−596. DOI: 10.1002/jmri.25441. [17] Ho R, Siddiqui MM, George AK, et al. Preoperative multiparametric magnetic resonance imaging predicts biochemical recurrence in prostate cancer after radical prostatectomy[J/OL]. PLoS One, 2016, 11(6): e0157313[2021-12-06]. https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0157313. DOI: 10.1371/journal.pone.0157313. [18] Jegadeesh N, Liu Y, Zhang C, et al. The role of adjuvant radiotherapy in pathologically lymph node-positive prostate cancer[J]. Cancer, 2017, 123(3): 512−520. DOI: 10.1002/cncr.30373. [19] Mottet N, van den Bergh RCN, Briers E, et al. EAU-EANM-ESTRO-ESUR-SIOG guidelines on prostate cancer-2020 update. Part 1: screening, diagnosis, and local treatment with curative intent[J]. Eur Urol, 2021, 79(2): 243−262. DOI: 10.1016/j.eururo.2020.09.042. -






 下载:
下载: