-
秀丽隐杆线虫(Caenorhabditis elegans,简称线虫)是一种独立生存的非寄生性土壤线虫。作为经典模式生物之一,线虫与其他模式生物相比具有独特的优势:(1)通体透明,其细胞和器官发育可通过体视显微镜观察;(2)体积小,且基因组序列完整,拥有83%的人类同源基因[1];(3)发育周期较短,20℃的培养条件下,从虫卵发育到成虫仅需3 d。基于以上优势,线虫已成为多个研究领域,如阿尔茨海默症、帕金森病、肥胖症及衰老等研究领域的模式生物。用于疾病研究的线虫模型已建立成熟,通过对突变体线虫各项指标进行检测,即可完成对相关药物的筛选,这是一种高通量的药物筛选方式。
此外,线虫在电离辐射研究领域同样应用广泛。电离辐射可以通过改变基因从而对受照者及其后代的健康产生影响。电离辐射可诱导生殖细胞凋亡、细胞周期阻滞和DNA损伤。1985年,Hartman[2]发现了多种线虫突变体,其中2个是辐射敏感性突变体rad-1和rad-2。线虫拥有敏感的神经系统,能够及时响应外界刺激,在响应DNA损伤方面与人类有相似之处,并已有大量辐射敏感性突变体可供使用[3]。线虫可耐受>1 kGy的γ射线[4],故适用于电离辐射研究。且线虫寿命较短,可以在很短的时间内观察其受到电离辐射后的生物学效应,如寿命和产卵率的变化、畸形的发生和行为学的改变。
-
线虫有雄性和雌雄同体2种类型,并以雌雄同体为主。雌雄同体线虫的自受精是非常高效的。一个未交配的雌雄同体线虫会利用其所有的精子来产生后代。长期的慢性辐照对成虫的繁殖有显著影响。线虫从胚胎发育到成虫的过程中,长期暴露于总剂量为6.7 Gy和14.0 Gy的电离辐射时,其产卵率分别下降43%、61%;当辐射剂量>50 Gy时,线虫的孵化率和繁殖力会受到显著影响[5]。γ射线可使线虫成虫的产卵率降低,其下降程度随辐射剂量的增加而增加:暴露于200 Gy辐照下的线虫均失去产卵能力,100 Gy的辐照使其平均产卵率下降了98%,50 Gy的辐照使其平均产卵率下降了67.9%[6]。同时,辐照可显著降低成虫的胚胎孵化能力,其下降程度也随辐射剂量的增加而增加,正常线虫的产卵器平整,经过辐照后可观察到其产卵器的2种变化:产卵器隆起和产卵器肿瘤[6]。产卵器畸形的发生率随辐射剂量的增加而升高。亲代线虫受到辐照对其胚胎体细胞的生长亦有显著影响。
-
电离辐射可显著促进线虫生殖细胞凋亡,且随着辐射剂量的增加,凋亡细胞数量也明显增加。低剂量(6 Gy)的急性电离辐射对L4期线虫的产卵率无显著影响,这表明线虫的辐射敏感性可能与其生命阶段或幼虫的发育过程有关[7]。急性和慢性的γ射线照射(6 Gy)不会对L4期线虫的生殖情况产生显著影响[7]。在线虫的发育过程中(从胚胎期到L4期),以类似的剂量(>4 Gy)对线虫进行慢性照射,不会影响其死亡率,但会产生显著的生殖毒性[7]。这表明L4期前的线虫对电离辐射更为敏感。当幼虫在发育早期受到辐照时,可观察到剂量依赖性的生殖毒性;而成虫受到辐照时,未观察到任何影响[7]。同时,与仅在幼虫期进行照射相比,将照射时段提前到胚胎期并不会增加其生殖毒性。在线虫发育过程中,胚胎期DNA修复能力最强。在相同的辐照剂量下,幼虫的体细胞比生殖细胞更能耐受DNA损伤[8]。γ射线照射野生型线虫后,cel-mir-237(一种微小RNA)表达下调,下调数小时后,jun-1(JUN转录因子同源物)的表达水平上升;在功能上,cel-mir-237过表达和jun-1功能缺失的突变体线虫对γ射线的敏感性相似,且均比未经辐照的野生型线虫的辐射敏感性高,从而导致生殖细胞加速衰老[9]。有研究结果表明,线虫暴露于2.9 Gy的电离辐射下即可出现生殖细胞凋亡,慢性辐照可减少精子数量,长期的电离辐射可引起精子缺陷,导致依赖性生殖毒性效应[7]。然而,无论是暴露于急性电离辐射还是慢性电离辐射,参与卵子发生的蛋白质均比参与精子发生的蛋白质受到的干扰更多[10]。
-
衰老是一个复杂的生理过程,涉及到多个分子途径和随机事件的调控。有研究结果表明,切除生殖腺的线虫寿命延长了60%[11],这使得一些线虫突变体适合用于衰老研究。由DNA甲基化和组蛋白修饰等多种翻译后修饰介导的表观遗传漂变会影响基因表达和生物分子的相互作用,进而影响衰老。
有关线虫衰老的遗传学研究主要关注衰老相关基因的表达及其调控机制。野生型线虫在20℃的培养条件下平均寿命为20 d。与野生型相比,长寿突变体线虫age-1的平均寿命会延长40%~60%,且其抗氧化应激能力增强,故成为线虫衰老研究的重要突变体[12]。其他长寿突变体,如daf-2、eat-2和clk-1也同样具有增强的抗应激能力,而短寿命突变体mev-1和daf-16的抗氧化酶水平较低。
胰高血糖素样肽1(glp-1)基因可调节线虫体细胞的生长和分化,glp-1不育突变体有助于研究电离辐射对不育线虫的影响,该突变体由于生殖系统突变而延长了寿命,其接受辐照后蛋白质损伤严重(即蛋白质羰基化),寿命显著缩短[13]。蛋白质羰基化是一种不可逆的翻译后修饰。现已证明羰基化是衰老的一种生物学标志,衰老线虫体内蛋白质羰基化的水平更高[13]。羰基化常发生在线粒体中,因此有学者认为,野生型线虫与glp-1不育突变体线虫之间的差异可能是由于野生型线虫体内的线粒体数量多于glp-1不育突变体[14]。此外,glp-1不育突变体线虫的脂质水平高于野生型线虫[15]。有实验结果表明,无论电离辐射的剂量或剂量率高或低,其均可诱导脂质分解代谢,这可能与线虫寿命的缩短有关[13]。解释接受辐照后线虫脂质分解代谢的一种说法是其对食物的摄取量较少,从而导致脂质摄取减少,但在正常衰老的线虫中不会观察到这一现象[16]。另一种说法是较高的甘油三酯降解速率会增加游离脂肪酸的释放和能量的产生。此外,蛋白质周转率的降低也是衰老的生物学标志之一,其与蛋白质丰度随时间的变化无关[16]。
氨基酸衍生物可提高线虫的抗氧化能力,并延长其寿命。Kim等[17]的研究结果表明,构成细胞膜的磷脂酰胆碱具有体内抗氧化活性,这为磷脂作为一种新型抗氧化剂和抗衰老生物分子的应用提供了科学基础[17]。2′-甲基丁酸可延长野生型线虫的寿命。但在glp-1不育突变体线虫中没有这一作用,这表明2′-甲基丁酸可作用于生殖腺信号通路[18]。
-
线虫的生殖系统DNA损伤可诱导细胞周期阻滞和凋亡,这2种反应在空间上是独立的。电离辐射诱导的生殖细胞凋亡不同于体细胞凋亡。细胞核是辐射损伤的敏感部位,DNA是辐射损伤的关键靶点。电离辐射可诱导线虫的生殖细胞发生多种反应,包括细胞凋亡、细胞周期阻滞以及DNA双链断裂修复,从而维持基因组的完整性等。雌雄同体线虫有2条生殖腺,呈U型,并在子宫近端连接在一起,且其在空间上可分为3个区域:有丝分裂区、过渡区、减数分裂区。最远端的生殖细胞以有丝分裂的方式增殖,并作为干细胞群;当通过过渡区时,生殖细胞停止分裂,进入减数分裂前期[19]。在减数分裂后期生殖细胞对辐射诱导的凋亡较敏感[20]。线虫暴露于电离辐射会导致其生殖腺远端细胞周期进程暂时停滞,有丝分裂的生殖细胞数量减少[21]。在成虫中,电离辐射诱导的生殖细胞凋亡仅发生在粗线期,且呈剂量依赖性,在凋亡形态上与生理性凋亡没有区别。凋亡细胞数量在线虫接受辐照后2~3 h显著增加,且可持续增加至辐照后24~36 h[20]。早前的研究结果表明,给予线虫急性电离辐射(>60 Gy)才能检测出生殖细胞凋亡[22]。而近几年研究者发现,给予L1~L4期线虫低至2.9 Gy的辐照便可有效增加凋亡细胞数量[7]。线虫的DNA修复能力在胚胎发育的早期非常强,幼虫的体细胞比生殖细胞对DNA损伤的耐受性更强[23]。神经酰胺重新合成途径和DNA损伤响应途径在辐射诱导的生殖细胞凋亡中可能具有协同作用[24]。最新的研究结果显示,神经酰胺可能通过调节DNA损伤检查点hus-1和细胞凋亡调控基因egl-1来介导辐射诱导的生殖细胞凋亡[25]。
-
辐射引起的旁观者效应已在生物体内得到证实,有研究者建立了一个自上而下布局的线虫共培养实验系统,其中顶部和底部线虫之间的交流以空气为传播介质,利用辐射适应性反应可评估顶部线虫的辐射反应,结果表明,对底部线虫进行γ射线辐照可降低顶部线虫的胚胎致死率,顶部线虫通过头部感觉神经元感知挥发性信号,刺激处于有丝分裂期的生殖细胞的DNA损伤修复,从而增强DNA损伤修复能力[26]。
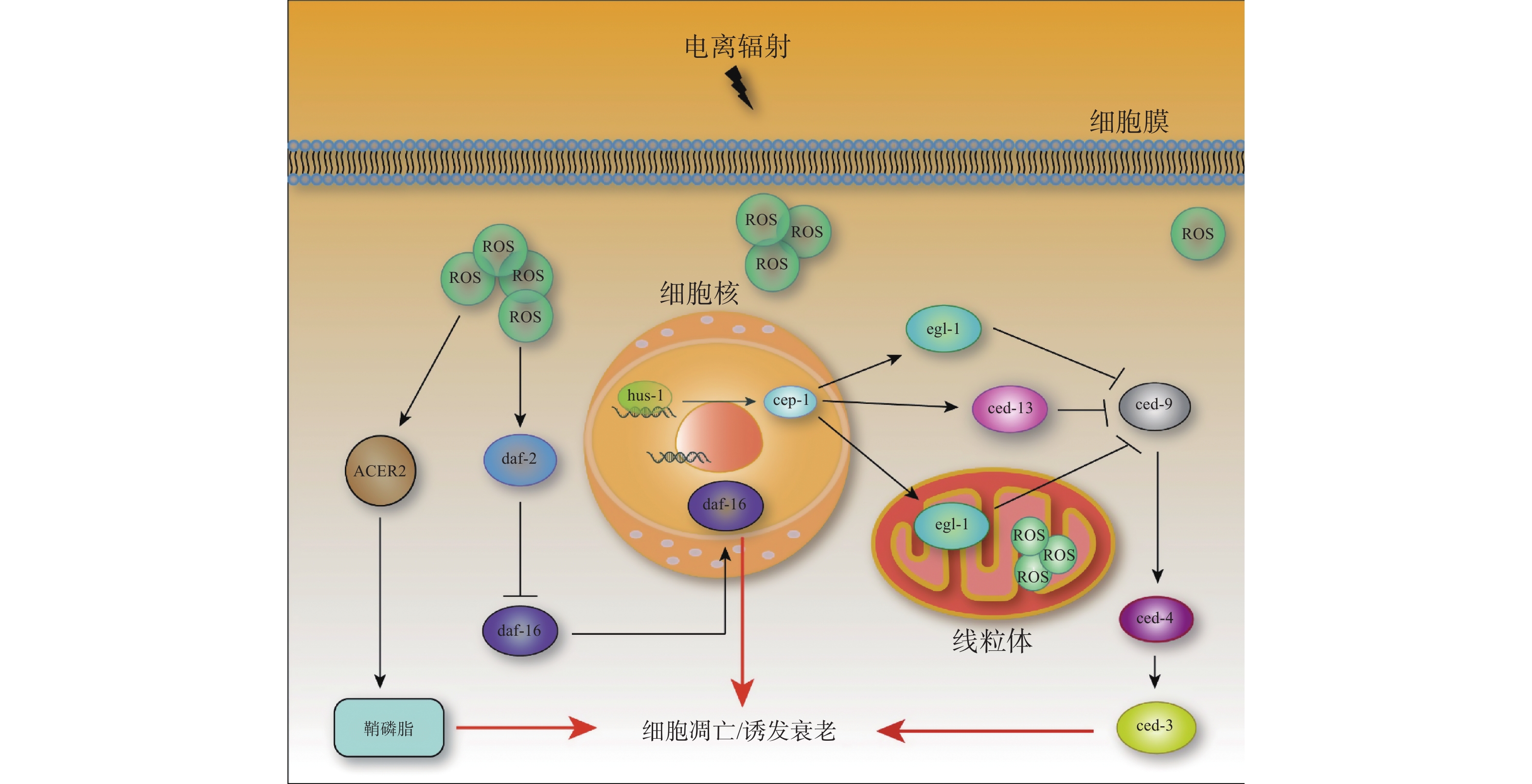
由细胞促凋亡基因(caspase同源物,ced-3)和凋亡蛋白酶激活因子1(apaf-1同源物,ced-4)调控的核心凋亡途径是电离辐射诱导的生理性细胞凋亡以及胚胎发育期间的生理性体细胞凋亡的主要途径[27]。ced-4活性受到ced-9的抑制[28]。egl-1和ced-13可从ced-4/ced-9异四聚体中解离出ced-4,ced-4可作为DNA损伤引起细胞凋亡的诱导剂[29]。当野生型线虫暴露于电离辐射后,efl-1和ced-13基因的转录水平上调,其方式依赖于p53同源基因cep-1的积累[30](图1)。通过对不同基因缺陷突变体进行遗传筛选,已发现3种在辐射诱导的细胞凋亡方面有缺陷的突变体:hus-1、mrt-2和rad-5,它们均可消除DNA损伤引起的细胞周期阻滞和凋亡,而不影响生殖细胞的发育或生理性死亡[31]。有研究结果表明,电离辐射通过激活神经酰胺合成途径,以DNA损伤依赖的方式诱导细胞凋亡[32]。同时,电离辐射诱导的DNA损伤可以激活DNA损伤检查点hus-1,进而激活p53同源物基因cep-1和细胞凋亡调控基因egl-1,从而诱导细胞凋亡。
-
电离辐射可通过2种方式引起生物体的毒性效应:一是直接将能量沉积在生物分子上,二是通过产生自由基造成间接损害。间接损害通过一系列物理和化学事件进行,从而导致自由基的产生。水的解离会产生剂量依赖性的ROS,电离辐射会造成线虫体内ROS水平上升。随着照射总剂量的增加,线虫体内的ROS水平逐步升高,并主要集中在肠道两端[33]。ROS的积累(线粒体呼吸链系统)和消除(抗氧化系统)之间的平衡决定了线虫的衰老速度和寿命。自由基衰老学说认为,线粒体中大分子氧化损伤的积累是衰老的原因之一。在较高强度的紫外线辐照下,线粒体DNA损伤水平显著升高,线虫的寿命缩短;然而,在中等剂量的紫外线辐照下,尽管线粒体DNA损伤水平也显著升高,但线虫的寿命并没有缩短[34]。
线虫细胞内的ROS平衡可通过胰岛素(Ins)/胰岛素样生长因子1(IGF-1)信号通路调节。该通路分泌的胰岛素样肽与胰岛素受体样基因daf-2受体结合,可激活daf-2信号通路。活化的daf-2信号抑制daf-16的核转位和活性[35](图1)。在该通路中,转录因子daf-16的突变会抑制age-1和daf-2突变体的长寿表型[36]。同时,胰岛素(Ins)/胰岛素样生长因子1(IGF-1)信号通路受损可促进线粒体L-脯氨酸分解代谢,进而诱导瞬时的ROS水平升高,延长线虫寿命[37](图1)。在应激条件下,线虫中控制抗氧化和线粒体呼吸链系统的daf-16的许多下游靶点被连续激活[38]。ROS还可以通过激活或抑制其他细胞内途径影响线虫的寿命[39]。暴露于低剂量应激源(如X射线、热应激或高氧)的线虫会产生一种刺激效应,从而延长其寿命。
线粒体是ROS的主要来源,线粒体功能障碍通常与ROS的增加有关。ROS是电离辐射诱导生殖细胞凋亡的核心因素。自由基清除剂二甲基亚砜(DMSO)可抑制电离辐射诱导的生殖细胞凋亡。DNA损伤诱导的ROS能上调碱性神经酰胺酶2(ACER2)的表达,使神经酰胺衍生物之一的细胞鞘磷脂水平升高,从而导致细胞凋亡[40](图1)。最新的研究结果表明,通过RNA抑制敲除人神经酰胺合成酶1同源基因lagr-1可以抑制电离辐射诱导的ROS积累[25]。外源性C16-神经酰胺能促进线虫体内ROS的积累,但不能拮抗体积浓度为5‰的二甲基亚砜(DMSO)对电离辐射诱导的生殖细胞凋亡的抑制作用。以上研究结果表明,神经酰胺可通过增加ROS的积累来介导电离辐射诱导的生殖细胞凋亡[25]。在幼虫的发育过程中,长期的电离辐射会显著提高线虫体内ROS水平,同时诱导抗氧化防御激活,该防御激活对接受慢性γ射线照射后的线虫维持体内氧化还原稳态至关重要[33]。常作为辐射损伤模型的线虫突变体总结于表1。
突变体 功能 参考文献 rad-1 辐射敏感基因,在DNA损伤反应和细胞存活信号中起关键作用 [41] rad-2 辐射敏感基因,参与辐射损伤的修复过程 [42] cep-1 p53家族唯一同源基因,通过激活egl-1和ced-13的转录来调节DNA损伤诱导的生殖细胞凋亡 [43] daf-16 编码转录调控因子中叉头(forkhoad)家族/肝细胞核心因子3的成员,叉头转基因子(FoxO1)的同源基因,是daf-2的作
用目标,突变能够抑制daf-2、age-1突变的全部表型[44] daf-2 胰岛素受体样基因,在线虫内调控长寿和滞育 [45] age-1 是线虫中第一个长寿突变体,在20℃的培养条件下,平均寿命延长40%,最长寿命平均增加60%,雌雄同体自交能力
降低75%[46] egl-1 细胞凋亡调控基因,与哺乳动物BH3-only蛋白类似,通过拮抗核心B淋巴细胞瘤2基因家族的抗凋亡成员来触发凋亡 [47] ced-9 能够抑制线虫正常发育过程中几乎所有细胞凋亡,ced-9可调控ced-3和ced-4基因的活性 [28] 注:DNA为脱氧核糖核酸;ced为细胞促凋亡基因;daf为胰岛素受体样基因;egl-1为细胞凋亡调控基因 表 1 常作为辐射损伤模型的线虫突变体
Table 1. Mutants of Caenorhabditis elegans commonly used as models in ionizing radiation damage research
-
随着人类基因组计划的完成和后基因组研究时代的到来,模式生物的研究受到了更多重视。通过对模式生物相关基因结构和功能进行研究,可对人类疾病发生发展的机制做出更好的诠释。辐射损伤研究常见的研究模型是小鼠或大鼠,但其繁殖速度慢、经济和时间成本较高,且筛选隐性突变体较困难。线虫的繁殖周期仅为3~4 d,其基因突变体易于构建和筛选。更重要的是,线虫的生殖系统对电离辐射敏感,相较于其他模式生物,其更易于进行生殖系统损伤相关研究。线虫全身透明,在体视显微镜下即可观察到其各个时期的细胞发育和形态,尤其是电离辐射造成的畸形、肿瘤等现象。线虫的神经系统发达,可非常好地模拟头部放疗造成的神经系统疾病。此外,线虫在毒理学研究中有着不可忽视的地位,通过对线虫的生殖系统、肠道系统等敏感系统进行检测,即可了解不同放疗方案背后的毒理学特性等,从而构建科学的辐射损伤评价体系。
辐射的生物学效应是由辐射能量积累引起的。为了系统地理解辐射剂量与生物学效应之间的关系,应将微剂量学与生物学效应有机结合起来。但细胞种类繁多,缺乏同一的评价标准。因此,线虫作为一种简单的动物模型,将其用来建立微剂量学和生物学效应的联合模型是最好的选择。线虫的头部摆动频率和产卵量可以反映线虫全身和生殖腺能量积累引起的辐射损伤程度。线虫全身的吸收剂量约为(99.9±57.8) Gy,生殖腺的吸收剂量为(19.8±5.1) Gy。与生长发育水平相比,线虫的行为和运动能力更容易受到辐射的影响[48]。线虫是一个研究辐射微剂量学和生物学效应的良好组合模型,然而,其仍有一些局限性。在未来的研究中,需要进一步精确地计算出神经、肠道和其他主要器官的剂量积累。研究者们利用线虫作为辐射损伤模型实现了很多科研突破,如在线虫中首次发现了衰老和氧化应激的细胞信号转导系统[49-50]。对于大多数生物来说,衰老是一个普遍的、本质上难以抵抗的现象,遗传和环境因素错综复杂地交织在一起,影响着衰老的进程。衰老在分子、细胞和组织水平上影响生物学功能,导致代谢过程减慢,最终增加对疾病的易感性。电离辐射引起的线虫衰老受多种基因控制,这些基因与哺乳动物相似,因此通过研究辐射引起线虫衰老的机制可以加强和补充对哺乳动物此方面的研究。生殖腺是线虫体内对辐射最敏感的组织之一,电离辐射引起的生殖细胞凋亡呈剂量依赖性。此外,线虫具有灵敏的嗅觉系统,可以通过嗅觉识别小鼠尿液,并对低至2 Gy剂量的辐照小鼠尿液具有趋向性[51],这表明线虫识别的气质物可作为未来临床诊断的无创性生物标志物。综上所述,利用线虫这种模式生物进行研究有望在未来更好地阐明高等生物的辐射损伤机制。
利益冲突 所有作者声明无利益冲突
作者贡献声明 王周旋负责文献的收集与整理、综述的撰写;朱彤负责综述的修订;樊赛军负责命题思路的提供与指导
以秀丽隐杆线虫为模型的电离辐射损伤研究进展
Research progress in ionizing radiation damage using Caenorhabditis elegans as a model
-
摘要: 秀丽隐杆线虫(简称线虫)作为一种经典模式生物,已被广泛应用于辐射损伤研究领域。电离辐射在线虫体内造成的损伤与脊椎动物相似,主要体现在DNA损伤、活性氧水平上升、衰老加速和生殖系统受损等。以线虫作为电离辐射动物模型的研究已经在辐射损伤领域中取得很多突破。电离辐射引起的线虫衰老受多种因素影响,包括错误的蛋白表达、脂质代谢的改变等。电离辐射可诱导线虫生殖细胞凋亡、细胞周期阻滞和DNA损伤。以线虫作为电离辐射动物模型的研究对高等生物的辐射效应研究有重要意义。笔者简要综述了以线虫为模型的辐射损伤研究进展。Abstract: Caenorhabditis elegans (C.elegans for short) has been widely used in researches on ionizing radiation as a classic model organism. Similar to vertebrates, the injury induced by radiation mainly include DNA damage, increase of reactive oxygen species level, accelerated aging, and the injury in reproductive system. As a model of ionizing radiation, C.elegans have made many breakthroughs in the field of radiation damage. The accelerated aging induced by ionizing radiation is controlled by multiple factors, like the incorrect expression of proteins and altered lipid metabolism. Ionizing radiation induces apoptosis, cell cycle arrest, and DNA damage in germ cells. C.elegans, as a well-established model of ionizing radiation, has significant implications for the study of radiation effects in higher organisms. The research progress in ionizing radiation damage using C.elegans as a model is reviewed in this paper.
-
Key words:
- Caenorhabditis elegans /
- Radiation, ionizing /
- Germ cells /
- Aging /
- Model organisms
-
表 1 常作为辐射损伤模型的线虫突变体
Table 1. Mutants of Caenorhabditis elegans commonly used as models in ionizing radiation damage research
突变体 功能 参考文献 rad-1 辐射敏感基因,在DNA损伤反应和细胞存活信号中起关键作用 [41] rad-2 辐射敏感基因,参与辐射损伤的修复过程 [42] cep-1 p53家族唯一同源基因,通过激活egl-1和ced-13的转录来调节DNA损伤诱导的生殖细胞凋亡 [43] daf-16 编码转录调控因子中叉头(forkhoad)家族/肝细胞核心因子3的成员,叉头转基因子(FoxO1)的同源基因,是daf-2的作
用目标,突变能够抑制daf-2、age-1突变的全部表型[44] daf-2 胰岛素受体样基因,在线虫内调控长寿和滞育 [45] age-1 是线虫中第一个长寿突变体,在20℃的培养条件下,平均寿命延长40%,最长寿命平均增加60%,雌雄同体自交能力
降低75%[46] egl-1 细胞凋亡调控基因,与哺乳动物BH3-only蛋白类似,通过拮抗核心B淋巴细胞瘤2基因家族的抗凋亡成员来触发凋亡 [47] ced-9 能够抑制线虫正常发育过程中几乎所有细胞凋亡,ced-9可调控ced-3和ced-4基因的活性 [28] 注:DNA为脱氧核糖核酸;ced为细胞促凋亡基因;daf为胰岛素受体样基因;egl-1为细胞凋亡调控基因 -
[1] Van Gilst MR, Hadjivassiliou H, Jolly A, et al. Nuclear hormone receptor NHR-49 controls fat consumption and fatty acid composition in C. elegans[J]. PLoS Biol, 2005, 3(2): e53. DOI: 10.1371/journal.pbio.0030053. [2] Hartman PS. Epistatic interactions of radiation-sensitive (rad) mutants of Caenorhabditis elegans[J]. Genetics, 1985, 109(1): 81−93. DOI: 10.1093/genetics/109.1.81. [3] Taubert S, Van Gilst MR, Hansen M, et al. A mediator subunit, MDT-15, integrates regulation of fatty acid metabolism by NHR-49-dependent and -independent pathways in C. elegans[J]. Genes Dev, 2006, 20(9): 1137−1149. DOI: 10.1101/gad.1395406. [4] Bailly A, Gartner A. Germ cell apoptosis and DNA damage responses[J]. Adv Exp Med Biol, 2013, 757: 249−276. DOI: 10.1007/978-1-4614-4015-4_9. [5] Dubois C, Lecomte C, Ruys SPD, et al. Precoce and opposite response of proteasome activity after acute or chronic exposure of C. elegans to γ-radiation[J/OL]. Sci Rep, 2018, 8(1): 11349[2021-12-06]. https://www.nature.com/articles/s41598-018-29033-1. DOI: 10.1038/s41598-018-29033-1. [6] Cui FM, Ma N, Han XJ, et al. Effects of 60Co γ irradiation on the reproductive function of Caenorhabditis elegans[J/OL]. Dose Response, 2019, 17(1): 1559325818820981[2021-12-06]. https://journals.sagepub.com/doi/10.1177/1559325818820981. DOI: 10.1177/1559325818820981. [7] Maremonti E, Eide DM, Oughton DH, et al. Gamma radiation induces life stage-dependent reprotoxicity in Caenorhabditis elegans via impairment of spermatogenesis[J]. Sci Total Environ, 2019, 695: 133835. DOI: 10.1016/j.scitotenv.2019.133835. [8] Lans H, Vermeulen W. Tissue specific response to DNA damage: C. elegans as role model[J]. DNA Repair (Amst), 2015, 32: 141−148. DOI: 10.1016/j.dnarep.2015.04.025. [9] Metheetrairut C, Adams BD, Nallur S, et al. cel-mir-237 and its homologue, hsa-miR-125b, modulate the cellular response to ionizing radiation[J]. Oncogene, 2017, 36(4): 512−524. DOI: 10.1038/onc.2016.222. [10] Dubois C, Pophillat M, Audebert S, et al. Differential modification of the C. elegans proteome in response to acute and chronic gamma radiation: link with reproduction decline[J]. Sci Total Environ, 2019, 676: 767−781. DOI: 10.1016/j.scitotenv.2019.04.039. [11] Berman JR, Kenyon C. Germ-cell loss extends C. elegans life span through regulation of DAF-16 by kri-1 and lipophilic-hormone signaling[J]. Cell, 2006, 124(5): 1055−1068. DOI: 10.1016/j.cell.2006.01.039. [12] Campisi J, Kapahi P, Lithgow GJ, et al. From discoveries in ageing research to therapeutics for healthy ageing[J]. Nature, 2019, 571(7764): 183−192. DOI: 10.1038/s41586-019-1365-2. [13] Kuzmic M, Galas S, Lecomte-Pradines C, et al. Interplay between ionizing radiation effects and aging in C. elegans[J]. Free Radic Biol Med, 2019, 134: 657−665. DOI: 10.1016/j.freeradbiomed.2019.02.002. [14] Aguilaniu H, Gustafsson L, Rigoulet M, et al. Asymmetric inheritance of oxidatively damaged proteins during cytokinesis[J]. Science, 2003, 299(5613): 1751−1753. DOI: 10.1126/science.1080418. [15] Lapierre LR, Silvestrini MJ, Nuñez L, et al. Autophagy genes are required for normal lipid levels in C. elegans[J]. Autophagy, 2013, 9(3): 278−286. DOI: 10.4161/auto.22930. [16] Dhondt I, Petyuk VA, Bauer S, et al. Changes of protein turnover in aging Caenorhabditis elegans[J]. Mol Cell Proteomics, 2017, 16(9): 1621−1633. DOI: 10.1074/mcp.RA117.000049. [17] Kim SH, Kim BK, Park S, et al. Phosphatidylcholine extends lifespan via DAF-16 and reduces amyloid-beta-induced toxicity in Caenorhabditis elegans[J]. Oxid Med Cell Longev, 2019, 2019: 2860642. DOI: 10.1155/2019/2860642. [18] 李云飞. 短链脂肪酸对秀丽隐杆线虫寿命的影响及分子机制的初步探究[D]. 长春: 长春理工大学, 2019.
Li YF. Effect of short-chain fatty acids on lifespan and its mechanism on C. elegans[D]. Changchun: Changchun University of Science and Technology, 2019.[19] Stergiou L, Hengartner MO. Death and more: DNA damage response pathways in the nematode C. elegans[J]. Cell Death Differ, 2004, 11(1): 21−28. DOI: 10.1038/sj.cdd.4401340. [20] Gartner A, Milstein S, Ahmed S, et al. A conserved checkpoint pathway mediates DNA damage-induced apoptosis and cell cycle arrest in C. elegans[J]. Mol Cell, 2000, 5(3): 435−443. DOI: 10.1016/s1097-2765(00)80438-4. [21] Guédon R, Maremonti E, Armant O, et al. A systems biology analysis of reproductive toxicity effects induced by multigenerational exposure to ionizing radiation in C. elegans[J]. Ecotoxicol Environ Saf, 2021, 225: 112793. DOI: 10.1016/j.ecoenv.2021.112793. [22] Schumacher B, Schertel C, Wittenburg N, et al. C. elegans ced-13 can promote apoptosis and is induced in response to DNA damage[J]. Cell Death Differ, 2005, 12(2): 153−161. DOI: 10.1038/sj.cdd.4401539. [23] Belan O, Anand R, Boulton SJ. Mechanism of mitotic recombination: insights from C. elegans[J]. Curr Opin Genet Dev, 2021, 71: 10−18. DOI: 10.1016/j.gde.2021.06.005. [24] 许光敏, 杨亚宁, 徐升敏, 等. 神经酰胺在辐射诱导的秀丽隐杆线虫生殖细胞旁效应中的机制研究[J]. 中华放射医学与防护杂志, 2019, 39(6): 408−414. DOI: 10.3760/cma.j.issn.0254-5098.2019.06.002.
Xu GM, Yang YN, Xu SM, et al. The role of ceramide in radiation-induced bystander effect on germ cells in Caenorhabditis elegans[J]. Chin J Radiol Med Prot, 2019, 39(6): 408−414. DOI: 10.3760/cma.j.issn.0254-5098.2019.06.002.[25] Yang YN, Xu GM, Xu Y, et al. Ceramide mediates radiation-induced germ cell apoptosis via regulating mitochondria function and MAPK factors in Caenorhabditis elegans[J]. Ecotoxicol Environ Saf, 2021, 208: 111579. DOI: 10.1016/j.ecoenv.2020.111579. [26] Tang HQ, Chen LW, Dai ZY, et al. Enhancement of DNA damage repair potential in germ cells of Caenorhabditis elegans by a volatile signal from their irradiated partners[J]. DNA Repair (Amst), 2020, 86: 102755. DOI: 10.1016/j.dnarep.2019.102755. [27] Lettre G, Hengartner MO. Developmental apoptosis in C. elegans: a complex CEDnario[J]. Nat Rev Mol Cell Biol, 2006, 7(2): 97−108. DOI: 10.1038/nrm1836. [28] Xue D, Horvitz HR. Caenorhabditis elegans CED-9 protein is a bifunctional cell-death inhibitor[J]. Nature, 1997, 390(6657): 305−308. DOI: 10.1038/36889. [29] Fairlie WD, Perugini MA, Kvansakul M, et al. CED-4 forms a 2: 2 heterotetrameric complex with CED-9 until specifically displaced by EGL-1 or CED-13[J]. Cell Death Differ, 2006, 13(3): 426−434. DOI: 10.1038/sj.cdd.4401762. [30] Schumacher B, Hofmann K, Boulton S, et al. The C. elegans homolog of the p53 tumor suppressor is required for DNA damage-induced apoptosis[J]. Curr Biol, 2001, 11(21): 1722−1727. DOI: 10.1016/s0960-9822(01)00534-6. [31] Ahmed S, Hodgkin J. MRT-2 checkpoint protein is required for germline immortality and telomere replication in C. elegans[J]. Nature, 2000, 403(6766): 159−164. DOI: 10.1038/35003120. [32] Kolesnick R, Fuks Z. Radiation and ceramide-induced apoptosis[J]. Oncogene, 2003, 22(37): 5897−5906. DOI: 10.1038/sj.onc.1206702. [33] Maremonti E, Eide DM, Rossbach LM, et al. In vivo assessment of reactive oxygen species production and oxidative stress effects induced by chronic exposure to gamma radiation in Caenorhabditis elegans[J]. Free Radic Biol Med, 2020, 152: 583−596. DOI: 10.1016/j.freeradbiomed.2019.11.037. [34] Ng LF, Ng LT, Van Breugel M, et al. Mitochondrial DNA damage does not determine C. elegans lifespan[J/OL]. Front Genet, 2019, 10: 311[2021-12-06]. https://www.frontiersin.org/articles/10.3389/fgene.2019.00311/full. DOI: 10.3389/fgene.2019.00311. [35] Mendelski MN, Keshet A, Hoffschroer N, et al. ROS-mediated relationships between metabolism and DAF-16 subcellular localization in Caenorhabditis elegans revealed by a novel fluorometric method[J]. Cell Signal, 2019, 62: 109330. DOI: 10.1016/j.cellsig.2019.05.015. [36] Lin K, Dorman JB, Rodan A, et al. daf-16: an HNF-3/forkhead family member that can function to double the life-span of Caenorhabditis elegans[J]. Science, 1997, 278(5341): 1319−1322. DOI: 10.1126/science.278.5341.1319. [37] Zarse K, Schmeisser S, Groth M, et al. Impaired insulin/IGF1 signaling extends life span by promoting mitochondrial L-proline catabolism to induce a transient ROS signal[J]. Cell Metab, 2012, 15(4): 451−465. DOI: 10.1016/j.cmet.2012.02.013. [38] Sakashita T, Takanami T, Yanase S, et al. Radiation biology of Caenorhabditis elegans: germ cell response, aging and behavior[J]. J Radiat Res, 2010, 51(2): 107−121. DOI: 10.1269/jrr.09100. [39] Gusarov I, Shamovsky I, Pani B, et al. Dietary thiols accelerate aging of C. elegans[J/OL]. Nat Commun, 2021, 12(1): 4336[2021-12-06]. https://www.nature.com/articles/s41467-021-24634-3. DOI: 10.1038/s41467-021-24634-3. [40] Xu RJ, Wang K, Mileva I, et al. Alkaline ceramidase 2 and its bioactive product sphingosine are novel regulators of the DNA damage response[J/OL]. Oncotarget, 2016, 7(14): 18440−18457[2021-12-06]. https://www.oncotarget.com/article/7825/text/. DOI: 10.18632/oncotarget.7825. [41] Greiss S, Schumacher B, Grandien K, et al. Transcriptional profiling in C. elegans suggests DNA damage dependent apoptosis as an ancient function of the p53 family[J/OL]. BMC Genomics, 2008, 9: 334[2021-12-06]. https://bmcgenomics.biomedcentral.com/articles/10.1186/1471-2164-9-334. DOI: 10.1186/1471-2164-9-334. [42] Criswell T, Leskov K, Miyamoto S, et al. Transcription factors activated in mammalian cells after clinically relevant doses of ionizing radiation[J]. Oncogene, 2003, 22(37): 5813−5827. DOI: 10.1038/sj.onc.1206680. [43] Hoffman S, Martin D, Meléndez A, et al. C. elegans CEP-1/p53 and BEC-1 are involved in DNA repair[J/OL]. PLoS One, 2014, 9(2): e88828[2021-12-06]. https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0088828. DOI: 10.1371/journal.pone.0088828. [44] Zečić A, Braeckman BP. DAF-16/FoxO in Caenorhabditis elegans and its role in metabolic remodeling[J/OL]. Cells, 2020, 9(1): 109[2021-12-06]. https://www.mdpi.com/2073-4409/9/1/109. DOI: 10.3390/cells9010109. [45] Zhao Y, Zhang B, Marcu I, et al. Mutation of daf-2 extends lifespan via tissue-specific effectors that suppress distinct life-limiting pathologies[J]. Aging Cell, 2021, 20(3): e13324. DOI: 10.1111/acel.13324. [46] Friedman DB, Johnson TE. A mutation in the age-1 gene in Caenorhabditis elegans lengthens life and reduces hermaphrodite fertility[J]. Genetics, 1988, 118(1): 75−86. DOI: 10.1093/genetics/118.1.75. [47] Nehme R, Conradt B. egl-1: a key activator of apoptotic cell death in C. elegans[J]. Oncogene, 2008, 27 Suppl 1: S30−S40. DOI: 10.1038/onc.2009.41. [48] Yu WT, Long HQ, Gao J, et al. Study on Caenorhabditis elegans as a combined model of microdosimetry and biology[J/OL]. Dose Response, 2021, 19(1): 1559325821990125[2021-12-06]. https://journals.sagepub.com/doi/10.1177/1559325821990125. DOI: 10.1177/1559325821990125. [49] Kimura KD, Tissenbaum HA, Liu Y, et al. daf-2, an insulin receptor-like gene that regulates longevity and diapause in Caenorhabditis elegans[J]. Science, 1997, 277(5328): 942−946. DOI: 10.1126/science.277.5328.942. [50] Johnson TE, Nelson GA. Caenorhabditis elegans: a model system for space biology studies[J]. Exp Gerontol, 1991, 26(2/3): 299−309. DOI: 10.1016/0531-5565(91)90024-g. [51] 张雪莹, 朱彤, 樊赛军. 秀丽隐杆线虫识别辐射损伤小鼠尿液的研究[J]. 国际放射医学核医学杂志, 2021, 45(4): 224−230. DOI: 10.3760/cma.j.cn121381-202103013-00049.
Zhang XY, Zhu T, Fan SJ. Identification of radiation injury mouse urine by Caenorhabditis elegans[J]. Int J Radiat Med Nucl Med, 2021, 45(4): 224−230. DOI: 10.3760/cma.j.cn121381-202103013-00049. -






 下载:
下载: