-
先天性中胚层肾瘤(congenital mesoblastic nephroma,CMN)是最常发生于6个月以下婴儿的肾脏肿瘤,但其常被误诊[1]。CMN分为3种病理学亚型:细胞型、经典型及混合型[2]。3种亚型的CMN预后各异,其中,经典型CMN及以经典型成分为主(>80%)的混合型CMN预后较好,仅需手术切除,无需放化疗,患者5年生存率达90%以上。细胞型CMN的恶性程度相对较高,患者除需接受单侧肾切除外,还需接受放化疗及新辅助化疗[3]。由于临床上对CMN的影像学特征认识不足,常将其误诊为其他常见的肾脏恶性肿瘤,如肾母细胞瘤或横纹肌肉瘤等,而这些恶性程度更高的肿瘤的治疗方式与CMN大相径庭[4]。故将CMN与其他儿童肾脏恶性肿瘤加以鉴别以及准确鉴别CMN的不同病理学亚型是CMN影像学诊断的关键。
据文献报道,CMN在超声检查中有低回声环的特异性征象[5-6]。而CT不仅具有较高的可重复性和组织对比度,还能完整显示肿瘤的全貌及其与周围组织的毗邻关系,因此CT在CMN的影像学诊断上有着不可替代的重要作用[7]。然而,目前还没有针对CMN,尤其是治疗手段有显著差异的含经典型成分的混合型CMN的CT影像学特征及其与超声、组织病理学特征对照的文献报道。本研究对CMN在CT平扫及增强扫描中的影像学特征作一总结,并将其与超声、组织病理学特征进行对照,以进一步明确CMN的CT影像学特征,为鉴别诊断提供参考。
-
回顾性分析2008年1月至2017年7月就诊于中山大学附属第一医院经组织病理学检查确诊的10例CMN患儿的临床资料和影像学资料,其中男患儿8例、女患儿2例,年龄1个月~7岁[(12.6±26.1)个月];细胞型CMN 2例、经典型CMN 6例、以经典型成分为主(>80%)的混合型CMN 2例。10例患儿中共有6例新生儿,包括1例细胞型CMN、3例经典型CMN、2例以经典型成分为主(>80%)的混合型CMN,均于产前行超声检查时发现肾脏肿物,患儿出生后暂未出现任何临床症状;另1例细胞型CMN患儿因腹痛就诊;另3例经典型CMN患儿中2例因血尿就诊、1例因腹部包块就诊。10例患儿均行术前实验室检查、患侧肾脏全肾根治性切除术,术后均行常规组织病理学、免疫组织化学检查。本研究符合《赫尔辛基宣言》的原则。手术前患儿家属均签署了知情同意书。
-
应用多层螺旋CT(日本东芝公司,Aquilion 64)进行扫描,遵循最小合理剂量原则,采集范围从肾上腺上缘至肾下缘,若肿瘤体积较大,则扫描范围需扩大至包含全部肿瘤组织。以碘普罗胺注射液(德国拜耳公司,300 mgI/ml)为对比剂,注射剂量为1.5 ml/kg,注射速率为1~2 ml/s。超声(法国声科医疗公司,Aixplorer)检查时取肿瘤的典型切面并标注方位。然后将超声图像与CMN的CT特异性征象进行对比。在不知晓组织病理学检查结果的情况下,由2名具有5年以上工作经验的放射科医师独立阅片,意见不同时商议决定,采集并记录CMN的 CT影像学特征,包括肿瘤的体积、形态、包膜情况、与正常肾组织的分界情况、密度特征、强化特点、肿瘤周围情况、肾门淋巴结有无增大等,其后对以上特征进行描述性统计。
-
对于CT、超声图像中的典型征象,在手术时用丝线在肿瘤上的相应位置进行标记,并进行取材。所有标本的病理切片均由2名具有5年以上工作经验的的病理科医师独立阅片。CMN的组织病理学检查诊断标准参照2016年世界卫生组织(WHO)泌尿与男性生殖系统肿瘤分类[2]。
-
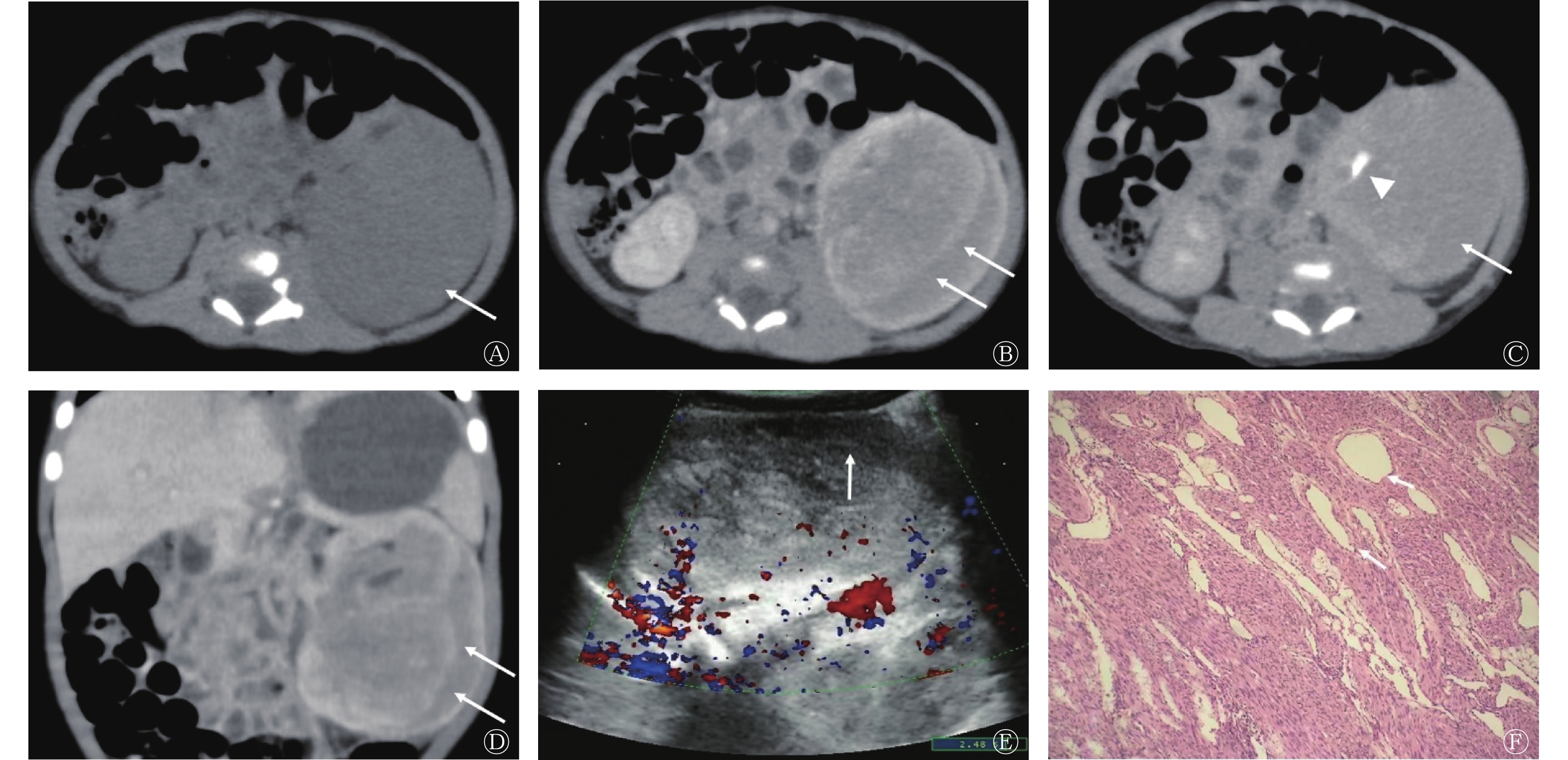
对6例经典型CMN和2例以经典型成分为主(>80%)的混合型CMN患儿的CT影像学特征进行重点分析。按照类似肾母细胞瘤的分期标准[8],8例肿瘤均属于Ⅰ~Ⅱ期,其长径为27~153(62.6±38.9) mm,8例肿瘤在CT图像中均表现为包膜不完整的类圆形肿物,与正常肾组织分界欠清,其中,3例肿瘤为实性密度、5例为囊实性密度且囊壁光整。仅有1例肿瘤含钙化成分,1例肿瘤出现肿瘤周围血肿。8例肿瘤均未见肾门淋巴结肿大。无论肿瘤是否为囊实性密度,CT增强扫描后其实性部分均表现为不均匀强化,且多数肿瘤(7/8)在实质期有特征性“双边征”的强化方式,表现为平扫时密度差异不明显,CT值约为40 HU,但增强扫描后肿瘤内部与肿瘤边缘出现条状强化,条状强化中间区域强化较弱,其强化程度较条状强化周边区域CT值少约20 HU;1例肿瘤则表现为“双边征”较均匀强化。同时,在8例肿瘤内均发现肾盂,即肾盂被肿瘤环绕包裹,延迟期可见对比剂浓聚。经典型CMN和以经典型成分为主(>80%)的混合型CMN的CT影像学特征如图1、2所示。而以上2个征象在2例细胞型CMN中均未发现。2例细胞型CMN的CT影像学特征与肾母细胞瘤较为类似,表现为边界较清晰的囊实性肿物,见假包膜形成,增强扫描后实性部分强化不均,部分未见明确强化,考虑为坏死。细胞型CMN的CT影像学特征如图3所示。

图 1 经典型先天性中胚层肾瘤患儿(男,1个月)的CT、超声和组织病理学检查图
Figure 1. CT, ultrasound and histopathological images of a patient with classic type congenital mesoblastic nephroma (male, 1 month old)
-
在8例含经典型成分的CMN患儿中,5例产前接受了超声检查,结果显示,肿瘤均在CT增强扫描所示的“双边征”部位表现出特征性的低回声环。彩色多普勒血流显像结果显示,在肿瘤的实性部分均可见血流信号,而在低回声环中未见血流信号,这表明低回声环所在区域为乏血供区或血流极其缓慢。其中1例经典型CMN患儿接受了超声造影检查,在注射对比剂后,其进入低回声环较为缓慢,出现与CT增强扫描中类似的特征性“双边征”,而后该区域逐渐强化,至延迟期,其强化程度与肿瘤实质成分相当。
-
6例经典型CMN和2例以经典型成分为主(>80%)的混合型CMN均位于肾实质内,且均未见明确的纤维包膜,肿瘤局部与肾实质分界欠清。组织病理学检查均可见肿瘤局部包裹肾盂。将CT增强扫描中的特征性“双边征”、超声中的低回声环所在区域与组织病理切片进行对照,发现该部位为肿瘤边缘特异性的富血窦区。
-
CMN是最常发生于6个月以下婴儿的肾脏肿瘤,成年人中极其罕见[9]。在所有的儿童肿瘤中,CMN约占5%,但在6个月以下婴儿的肾脏实性肿瘤中,CMN约占64%,CMN患儿中约90%为1岁以下的婴儿[2]。该比例与本研究中CMN患儿的年龄分布相当,本研究10例患儿中,8例<1岁,且其中5例患儿均为产前通过超声检查发现肾脏肿物。CMN在男患儿中更为多见,患儿的男女比例约为1.5∶1[10]。多数CMN患儿无临床症状,或只有轻微的临床症状,如腹胀、尿血[11]。据文献统计,CMN的3种亚型中,细胞型CMN的占比最高,为66%,经典型CMN次之,为24%,混合型CMN则仅占10%[12],但在中山大学附属第一医院的统计数据中,经典型CMN占比最高,这也可能是由于所收集的病例数偏少及患儿的年龄偏小所致。
本研究中,经典型CMN和以经典型成分为主(>80%)的混合型CMN倾向于表现为类圆形的实性或囊实性肿物,罕见钙化,肿物与肾实质分界欠清,增强扫描后实性部分不均匀强化,并出现特征性“双边征”,排泄期可见肿瘤内肾盂。这些CT影像学特征与其组织病理学及病理生理学特点密不可分。大体病理学上,CMN通常表现为累及单侧肾脏的孤立性肿物,其中的经典型成分可呈现出致密的、旋涡状的外观,且与正常肾组织分界不清[13-15]。显微镜下可见CMN经典型成分多数由成纤维细胞构成,排列成束状或旋涡状,而肿物边缘并没有明显包膜,与正常肾组织部分交错,甚至部分浸润正常肾组织,将正常的肾结构,如肾盂包裹[14]。这样的组织学结构造成了CMN在CT图像中表现为无包膜的、与肾组织分界不清的肿物,且出现肿瘤内肾盂的影像学特征。同时,作为胚胎性肿瘤,CMN的肿瘤组织有不同的分化类型,包括动静脉通路及血窦等,而血窦的分化又好发生于肿瘤边缘,在CT增强扫描后,对比剂进入血窦缓慢,在增强扫描的早中期,血窦的对比剂浓度低于邻近实质成分,从而造成了特征性“双边征”。而在超声图像中,血窦表现为低回声,且由于血流极度缓慢,可导致彩色多普勒血流显像上无彩色血流信号,从而造成特征性的低回声环,这一特殊的超声征象首次由Chan等[16]于1987年提出,其病理学解释也曾被Kelner等[17]证实。类似的CT征象在中文文献[18]中曾被提及,但因病例数较少未作出总结及解释。而本研究进一步提出了CMN经典型成分的特征性CT影像学征象,并证明其与超声图像中的低回声环来源相同,即均源于组织病理学上肿瘤周边的富血窦区。
虽然本研究最终只纳入了2例细胞型CMN患儿,但通过对这2例细胞型CMN的CT影像学特征进行分析,以及结合文献资料分析,发现细胞型CMN的CT影像学特征与经典型CMN有较大差异。总体来说,细胞型CMN通常表现为边界较清晰的囊实性肿物,可有假包膜形成,增强扫描后实性部分呈现出相较于经典型CMN更为不均的强化方式。肿瘤周围血肿及肾门淋巴结肿大也较经典型CMN更为常见。
CMN需要与其他婴幼儿常见的肾脏肿瘤相鉴别。肾母细胞瘤作为婴幼儿最常见的肾脏肿瘤,首先需被纳入鉴别诊断。事实上,在本研究纳入的10例CMN中,仅有4例于术前得到了正确诊断,其余6例均于术前被误诊为肾母细胞瘤。虽然肾母细胞瘤是婴幼儿最常见的肾脏肿瘤,但其在6个月以下婴儿中的发生率并不高,在胎儿期发生的概率则更低[19-20]。在CT影像学上,相较于CMN,肾母细胞瘤会表现出更多的恶性特征:肾母细胞瘤一般在发现时体积较大,且由于生长快速,通常会有假包膜形成,与正常肾实质分界清晰;此外,出血、坏死、肾盂侵犯、肾静脉癌栓及远处转移等征象在肾母细胞瘤上更常见[21-22]。但有时肾母细胞瘤与细胞型CMN在影像学上很难鉴别。其他需要鉴别诊断的肿瘤包括好发于婴幼儿的单发实性肾脏肿瘤,如透明细胞肉瘤、恶性肾脏横纹肌样瘤等。透明细胞肉瘤为囊实性肿瘤,具有较强的侵袭性,易局部复发及骨转移。通过其明显的囊性成分,不难将其与囊性成分较少的CMN区分开来[23]。而恶性肾脏横纹肌样瘤在CT影像上则多有肿瘤边缘新月形液性低密度影、肿瘤边缘坏死区等特征,且肾包膜下积血也更为常见[24]。然而,并没有特异性的影像学特征可明确区分肾母细胞瘤及恶性肾脏横纹肌样瘤。
作为一种低级别的成纤维肉瘤,CMN的预后与其组成成分密切相关。据文献报道,经典型CMN的总生存率可达82%~96%。手术完全切除是CMN最重要的治疗手段,且经典型CMN及含经典型成分的混合型CMN患者无需再接受术后化疗。但对于Ⅲ期的细胞型CMN患儿,除行单侧肾脏的切除术外,术后仍需接受新辅助化疗并密切随访[25]。本研究中的患儿在行单侧肾脏切除术后3年进行随访时,均未见复发征象。故术前通过影像学检查对CMN,尤其是对以经典型成分为主的混合型CMN进行正确诊断,对治疗和手术方式的选择非常关键。
利益冲突 所有作者声明无利益冲突
作者贡献声明 戴艳负责论文的撰写与修订;周路遥负责超声图像的采集与分析;廖娜波负责组织病理学标本的处理与分析;苏舒、范淼负责CT图像的分析;高鹏飞、刘钧澄负责手术、术后的治疗与随访;陈颖茜负责命题的提出、方法的设计与指导、CT图像的分析、论文的修订
先天性中胚层肾瘤的CT影像学特征及其与超声、组织病理学特征的对照分析
CT imaging characteristics of congenital mesoblastic nephroma and their comparison with ultrasound and histopathological features
-
摘要:
目的 探讨先天性中胚层肾瘤(CMN)的CT影像学特征,并将其与超声、组织病理学特征进行对照,探究其组织病理学基础。 方法 回顾性分析2008年1月至2017年7月就诊于中山大学附属第一医院经组织病理学检查确诊的10例CMN患儿的临床资料和影像学资料,其中男患儿8例、女患儿2例,年龄1个月~7岁[(12.6±26.1)个月];细胞型CMN 2例、经典型CMN 6例、以经典型成分为主(>80%)的混合型CMN 2例。分析CMN患儿CT平扫和增强扫描的影像学特点,并将经典型CMN及以经典型成分为主(>80%)的混合型CMN的CT影像学特征与超声、组织病理学特征进行对照。 结果 经典型CMN及以经典型成分为主(>80%)的混合型CMN的CT影像学特征多表现为类圆形的实性(3/8)或囊实性(5/8)肿物,且边界欠清(8/8);肿瘤实性部分密度不均(7/8),增强扫描后不均匀强化(8/8);与细胞型CMN相比,肿瘤内肾盂(8/8)及增强扫描后出现特征性“双边征”(7/8)是其特殊的影像学特征。组织病理学检查结果显示,CT影像学特征中的“双边征”与超声图像中的低回声环相对应,是由肿瘤周围扩张的血窦所致的特殊影像学征象。 结论 “双边征”及肿瘤内肾盂为经典型CMN及以经典型成分为主的混合型CMN的CT影像学特征。 -
关键词:
- 肾瘤,中胚叶 /
- 体层摄影术,X线计算机 /
- 超声检查 /
- 病理学
Abstract:Objective To investigate the CT imaging characteristics of congenital mesoblastic nephroma (CMN) and compare them with ultrasound and histopathological features to explore the histopathological basis of CMN. Methods Clinical and imaging data of 10 children with CMN confirmed by histopathology in the First Affiliated Hospital, Sun Yat-sen University from January 2008 to July 2017 were retrospectively analyzed. The cohort included 8 males and 2 females, aged from 1 month to 7 years ((12.6±26.1) months). Two cases of cellular CMN, 6 cases of typical CMN, and 2 cases of mixed CMN mainly with typical components (>80%) were evaluated. The characteristics of plain and contrast-enhanced CT scans of the children with CMN were summarized, and the CT characteristics of typical CMN and mixed CMN mainly with typical components (>80%) were compared with ultrasound and histopathological features. Results CT imaging characteristics of typical CMN and mixed CMN mainly with typical components (>80%) were as follows: mostly round solid (3/8) or cystic solid (5/8) masses with poorly defined boundaries (8/8); uneven density of the solid part of the tumor (7/8); and uneven enhancement (8/8). Compared with cellular CMN, intratumoral renal pelvis (8/8) and bilateral sign (7/8) after enhanced scan were the special imaging features. Histopathological results showed that the bilateral sign in the CT imaging characteristics corresponded to the hypoechoic ring signal in ultrasound images, which is a special imaging sign caused by the dilated blood sinus around the tumor. Conclusion Bilateral sign and intratumoral renal pelvis were the CT imaging characteristics of typical CMN and mixed CMN mainly with typical components. -
Key words:
- Nephroma, mesoblastic /
- Tomography, X-ray computed /
- Ultrasonography /
- Pathology
-
-
[1] Chen YX, Huang C, He QM, et al. Prenatal diagnosis and postnatal management of congenital mesoblastic nephroma: experience at a single center in China[J]. Prenat Diagn, 2021, 41(6): 766−771. DOI: 10.1002/pd.5942. [2] Moch H, Cubilla AL, Humphrey PA, et al. The 2016 WHO classification of tumours of the urinary system and male genital organs-part a: renal, penile, and testicular tumours[J]. Eur Urol, 2016, 70(1): 93−105. DOI: 10.1016/j.eururo.2016.02.029. [3] Isaacs H Jr. Fetal and neonatal renal tumors[J]. J Pediatr Surg, 2008, 43(9): 1587−1595. DOI: 10.1016/j.jpedsurg.2008.03.052. [4] 胡晓儒, 李勇, 李晓晗, 等. 小儿先天性中胚层肾瘤临床特点分析[J]. 中国小儿急救医学, 2018, 25(11): 870−874. DOI: 10.3760/cma.j.issn.1673-4912.2018.11.015.
Hu XR, Li Y, Li XH, et al. Clinical characteristics of congenital mesoblastic nephroma in children[J]. Chin Pediatr Emerg Med, 2018, 25(11): 870−874. DOI: 10.3760/cma.j.issn.1673-4912.2018.11.015.[5] Chung EM, Graeber AR, Conran RM. Renal tumors of childhood: radiologic-pathologic correlation part 1. The 1st decade: from the radiologic pathology archives[J]. Radiographics, 2016, 36(2): 499−522. DOI: 10.1148/rg.2016150230. [6] 张静漪, 林玲, 陈红艳. 先天性中胚层肾瘤超声表现1例[J]. 中国医学影像技术, 2017, 33(2): 166. DOI: 10.13929/j.1003-3289.201608120.
Zhang JY, Lin L, Chen HY. Ultrasonography of congenital mesoblastic nephroma: case report[J]. Chin J Med Imaging Technol, 2017, 33(2): 166. DOI: 10.13929/j.1003-3289.201608120.[7] 徐化凤, 姚琼, 梁琼鹤, 等. 小儿先天性中胚层肾瘤的CT表现[J]. 临床放射学杂志, 2019, 38(2): 322−325. DOI: 10.13437/j.cnki.jcr.2019.02.035.
Xu HF, Yao Q, Liang QH, et al. CT diagnosis of congenital mesoblastic nephroma[J]. J Clin Radiol, 2019, 38(2): 322−325. DOI: 10.13437/j.cnki.jcr.2019.02.035.[8] Martínez CH, Dave S, Izawa J. Wilms' tumor[J]. Adv Exp Med Biol, 2010, 685: 196−209. [9] 高亚枫, 诸伟, 胡春洪, 等. 肾脏少见原发肿瘤的影像诊断[J]. 实用放射学杂志, 2018, 34(3): 392−394, 483. DOI: 10.3969/j.issn.1002-1671.2018.03.017.
Gao YF, Zhu W, Hu CH, et al. Imaging manifestations of rare primary renal tumors[J]. J Pract Radiol, 2018, 34(3): 392−394, 483. DOI: 10.3969/j.issn.1002-1671.2018.03.017.[10] Gooskens SL, Houwing ME, Vujanic GM, et al. Congenital mesoblastic nephroma 50 years after its recognition: a narrative review[J]. Pediatr Blood Cancer, 2017, 64(7): e26437. DOI: 10.1002/pbc.26437. [11] 王作鹏, 李凯, 董岿然, 等. 八例小儿先天性中胚层肾瘤的临床分析[J]. 中华小儿外科杂志, 2013, 34(10): 754−756. DOI: 10.3760/cma.j.issn.0253-3006.2013.10.009.
Wang ZP, Li K, Dong KR, et al. Eight cases of congenital mesoblastic nephroma: clinical analysis and literature review[J]. Chin J Pediatr Surg, 2013, 34(10): 754−756. DOI: 10.3760/cma.j.issn.0253-3006.2013.10.009.[12] 余天平, 尹晓雪, 陈敏, 等. 先天性中胚层肾瘤临床病理和分子遗传学分析[J]. 临床与实验病理学杂志, 2017, 33(6): 645−648. DOI: 10.13315/j.cnki.cjcep.2017.06.011.
Yu TP, Yin XX, Chen M, et al. Congenital mesoblastic nephroma: clinicopathological features and molecular genetic analyses[J]. Chin J Clin Exp Pathol, 2017, 33(6): 645−648. DOI: 10.13315/j.cnki.cjcep.2017.06.011.[13] 王晗, 马阳阳, 张大文, 等. 先天性中胚层肾瘤的临床病理分析[J]. 中华病理学杂志, 2016, 45(9): 646−647. DOI: 10.3760/cma.j.issn.0529-5807.2016.09.013.
Wang H, Ma YY, Zhang DW, et al. Congenital mesoblastic nephroma: a clinicopathologic analysis of 17 cases[J]. Chin J Pathol, 2016, 45(9): 646−647. DOI: 10.3760/cma.j.issn.0529-5807.2016.09.013.[14] Kamaraj S, Arbuckle S, Warner D, et al. Congenital mesoblastic nephroma presenting with hematuria in a neonate: a case report[J]. Urology, 2016, 88: 189−191. DOI: 10.1016/j.urology.2015.10.026. [15] Gruver AM, Hansel DE, Luthringer DJ, et al. Congenital mesoblastic nephroma[J]. J Urol, 2010, 183(3): 1188−1189. DOI: 10.1016/j.juro.2009.12.055. [16] Chan HS, Cheng MY, Mancer K, et al. Congenital mesoblastic nephroma: a clinicoradiologic study of 17 cases representing the pathologic spectrum of the disease[J]. J Pediatr, 1987, 111(1): 64−70. DOI: 10.1016/s0022-3476(87)80343-8. [17] Kelner M, Droullé P, Didier F, et al. The vascular "ring" sign in mesoblastic nephroma: report of two cases[J]. Pediatr Radiol, 2003, 33(2): 123−128. DOI: 10.1007/s00247-002-0821-5. [18] 鄂天娇, 李玉华, 郑慧, 等. 婴幼儿肾脏肿瘤的CT诊断价值[J]. 中国医学计算机成像杂志, 2016, 22(2): 157−161. DOI: 10.19627/j.cnki.cn31-1700/th.2016.02.012.
E TJ, Li YH, Zheng H, et al. Diagnosis of renal tumor in infants by CT[J]. Chin Comput Med Imaging, 2016, 22(2): 157−161. DOI: 10.19627/j.cnki.cn31-1700/th.2016.02.012.[19] Glick RD, Hicks MJ, Nuchtern JG, et al. Renal tumors in infants less than 6 months of age[J]. J Pediatr Surg, 2004, 39(4): 522−525. DOI: 10.1016/j.jpedsurg.2003.12.007. [20] Montaruli E, Fouquet V. Prenatal diagnosis of congenital mesoblastic nephroma[J]. Fetal Diagn Ther, 2013, 33(1): 79−80. DOI: 10.1159/000336464. [21] Emir S. Wilms tumor with intravascular tumor thrombus[J/OL]. Transl Pediatr, 2014, 3(1): 29−33[2021-10-16]. https://tp.amegroups.com/article/view/3218. DOI: 10.3978/j.issn.2224-4336.2014.01.03. [22] 王秋艳, 高煜, 金彪, 等. 儿童肾母细胞瘤的CT诊断和鉴别诊断[J]. 实用放射学杂志, 2001, 17(5): 333−335. DOI: 10.3969/j.issn.1002-1671.2001.05.004.
Wang QY, Gao Y, Jin B, et al. CT diagnosis and differential diagnosis of wilms' tumors of children[J]. J Pract Radiol, 2001, 17(5): 333−335. DOI: 10.3969/j.issn.1002-1671.2001.05.004.[23] Walke VA, Shende NY, Kumbhalkar DT. Renal clear cell sarcoma−anaplastic variant: a rare entity[J]. J Clin Diagn Res, 2017, 11(1): ED10−ED11. DOI: 10.7860/JCDR/2017/23138.9214. [24] 薛潋滟, 朱铭, 钟玉敏, 等. 儿童肾恶性横纹肌样瘤的影像特征及病理学对照[J]. 实用放射学杂志, 2015, 31(3): 454−457. DOI: 10.3969/j.issn.1002-1671.2015.03.028.
Xue LY, Zhu M, Zhong YM, et al. Correlation of radiological charicteristics of renal malignant rhabdoid tumor in children with pathology[J]. J Pract Radiol, 2015, 31(3): 454−457. DOI: 10.3969/j.issn.1002-1671.2015.03.028.[25] Pachl M, Arul GS, Jester I, et al. Congenital mesoblastic nephroma: a single-centre series[J]. Ann R Coll Surg Engl, 2020, 102(1): 67−70. DOI: 10.1308/rcsann.2019.0111. -





 下载:
下载: