-
DTC患者术后首次接受131I治疗时,需在服用治疗活度131I(1.11~9.25 GBq)后第3~7天行全身前、后位平面显像,这对探测术后残留转移性淋巴结和远处转移具有重要价值[1]。有研究结果显示,治疗活度131I平面显像使9%~23%的DTC患者的疾病分期和诊疗决策发生改变[2]。Zhang等[3]有关治疗活度131I平面显像预后价值的研究结果进一步显示,72%仅有残留甲状腺的DTC患者获得痊愈;然而,存在术后残留转移性淋巴结和远处转移的DTC患者的累计痊愈率分别为45%和25%。治疗活度131I 平面显像缺乏精细的解剖学信息且组织器官前、后位显像重叠,这在一定程度上影响了其在病灶诊断中的准确性。Xue等[4]发现,在治疗活度 131I平面显像显示的所有摄碘灶中,6%~58%的摄碘灶在定性诊断上存在困难。SPECT/CT提高了131I平面显像的影像质量和诊断准确性,并以其方便可行、易于推广和医疗运行成本低廉的特点,在肿瘤学、心血管学和呼吸学等多个领域发挥着重要的临床诊断增益价值[4-5]。然而,目前有关DTC患者SPECT/CT显像诊断增益价值的研究,多为对比清甲后、随访期的诊断活度131I(74~185 MBq)平面显像[4, 6-7]。受131I用量、显像时间和残甲等因素的影响,使得治疗活度与诊断活度131I平面显像提供的诊断信息存在显著差异[1, 3, 8]。我们探讨了DTC患者术后首次行131I治疗时,治疗活度131I SPECT/CT显像对DTC患者的诊断增益价值及其对患者临床诊疗决策的影响。
-
回顾性分析2017年1月至2020年5月于四川大学华西医院核医学科接受131I治疗的404例DTC患者的临床资料,其中男性89例、女性315例,年龄21~69(46.3 ± 5.9)岁。纳入标准:(1)经组织病理学检查结果确诊为DTC,已行甲状腺全切,且术后首次行131I治疗的DTC患者;(2)131I治疗后第5天行全身前、后位平面显像,同时对131I平面显像探测到的摄碘灶加做SPECT/CT显像的患者;(3)年龄>20周岁。排除标准:(1)既往接受过放疗的DTC患者;(2)首次行131I治疗前停用左旋甲状腺素3~4周,TSH仍未升至30 mU/L以上的患者[9]。本研究符合《赫尔辛基宣言》的原则。
-
所有DTC患者在131I治疗前,低碘饮食2周,停用左旋甲状腺素3~4周[10-11]。依据美国癌症联合委员会与国际抗癌联盟联合制定的第8版TNM分期[12]和2015年美国甲状腺协会指南[13],对患者进行疾病分期和初始危险度分层,并结合131I治疗前的刺激性甲状腺球蛋白水平[14-15],确定患者服用131I的剂量。术后单纯清甲、合并残留淋巴结转移、肺转移和合并骨转移患者的131I剂量分别为1.11~3.70 GBq、3.70~5.55 GBq、7.40 GBq和9.25 GBq[13]。
-
使用美国GE公司Discovery NM/670型双探头SPECT/CT仪,配高能通用型准直器。131I由成都中核高通公司提供。DTC患者行全身前、后位平面显像的采集参数:矩阵1024×512、放大倍数1.0、能峰364 keV、窗宽20%、扫描速度20 cm/min。平面显像结束后,依据病灶部位及范围,加做头颈部、胸部、腹部和(或)四肢的SPECT/CT融合显像。为了合理化地降低CT辐射剂量,CT扫描范围仅限定于病灶所在的解剖学区域。SPECT采集参数:2个配高能平行孔准直器的探头成90°夹角,采用步进式模式,每个探头各旋转180°,6°/帧,每帧采集30 s,共采集32帧;矩阵64×64、能峰364 keV、窗宽20%、放大倍数1.0。CT采集参数:管电压130 kV,管电流时间积60~80 mAs,X线管旋转时间0.6 s/圈,准直扫描2.0 mm×2.5 mm。SPECT和CT 图像采集期间,患者仰卧于检查床,体位保持不变。使用美国GE公司的Volumetrix MI同机融合软件实现SPECT和CT图像的同机融合。
-
在隐蔽患者疾病分期、初始危险度分层等特征的情况下,由2位高年资核医学科主任或副主任医师独立阅片,意见不一致时商议后做出诊断,阅片标准如下。131I平面显像[1, 3]:(1)131I浓聚于甲状腺床区,视为残甲;131I浓聚于甲状腺床区之上,但仍位于颈前正中,视为甲状腺椎状叶或甲状腺舌管残留,上述影像学表现统称为残甲;(2)131I浓聚于颈侧区,视为颈部淋巴结转移;(3)肺、骨骼出现131I浓聚,视为远处转移;(4)不能明确定性的131I摄取病灶,视为不确定性病灶。
依据CT的解剖定位信息,计算SPECT/CT显像对131I平面显像显示的摄碘灶的原始诊断的修正比例。SPECT/CT显像将131I平面显像显示的摄碘灶诊断为:(1)残甲;(2)颈部淋巴结转移;(3)远处转移;(4)鼻咽、唾液腺和肠道等造成的131I生理性摄取、滞留;(5)皮肤表面污染。
-
应用SPSS 10.0软件对数据进行统计学分析。符合正态分布的计量资料以
$ {{\bar x}} \pm s$ 表示。计数资料以例数(%)表示。131I平面显像与SPECT/CT显像结果之间的分布差异采用McNemar检验和McNemar-Bowker检验进行评估。P<0.05为差异有统计学意义。 -
所有患者的肿瘤原发病灶长径为(1.9±0.8) cm。颈部淋巴结转移占89.4%(361/404)、中央区淋巴结转移占26.0%(105/404)、中央区合并颈侧区淋巴结转移占63.4%(256/404)、远处淋巴结转移占7.9%(32/404)。初始危险度分层:低危占6.9%(28/404)、中危占53.0%(214/404)、高危占40.1%(162/404)。所有患者的131I治疗剂量为(4.2±0.9) GBq。患者其他特征见表1。
患者特征 例数(%) 病理类型 乳头状癌 385(95.3) 滤泡癌 19(4.7) T分期 T1 99(24.5) T2 77(19.1) T3 93(23.0) T4 78(19.3) Tx 57(14.1) N分期 N0 34(8.4) N1a 105(26.0) N1a+N1b 256(63.4) Nx 9(2.2) M分期 M0 372(92.1) M1 32(7.9) 表 1 404例接受131I治疗的分化型甲状腺癌患者的一般特征
Table 1. General characteristics of 404 differentiated thyroid carcinoma patients treated with 131I
-
404例DTC患者的131I平面显像共探测到了927个摄碘灶,其中头颈部841个、胸部29个、腹部24个、四肢33个。McNemar检验结果显示,SPECT/CT显像显示的头颈部淋巴结转移灶(52个)多于131I平面显像(35个)(P<0.05)。对131I平面显像及SPECT/CT显像显示的927个摄碘灶的转移、残甲和不确定性病灶3类进行McNemar-Bowker检验,结果显示,2种显像方法在摄碘灶的定性诊断中存在差异(χ2=101.69,P<0.001)。SPECT/CT对131I平面显像显示的摄碘灶的定性分析见表2。
部位 131I 平面显像 SPECT/CT显像 摄碘灶数量
(n= 927)头颈部 残留甲状腺 残留甲状腺 684 淋巴结转移 23a 淋巴结转移 淋巴结转移 15 残留甲状腺 5a 颌下腺生理性摄取 15a 不确定性病灶 残留甲状腺 85a 淋巴结转移 14a 胸部 肺转移 肺转移 10 肺部炎症灶摄取 3a 纵膈淋巴结转移 纵膈淋巴结转移 10 胸腺及食管生理性摄取 6a 腹部 肝转移 胆管生理性滞留 2a 骨转移 骨转移 3 不确定性病灶 肠道生理性滞留 15a 经期子宫的生理性滞留 1a 骨转移 3a 四肢 骨转移 骨转移 26 外伤骨折病灶摄取 1a 局部皮肤污染 6a 注:a表示SPECT/CT显像对131I平面显像显示的摄碘灶具有诊断增益价值,合计19.3%(179/927)。SPECT为单光子发射计算机体层摄影术;CT为计算机体层摄影术 表 2 SPECT/CT对131I平面显像显示的927个摄碘灶的定性分析
Table 2. Qualitative analysis of SPECT/CT imaging to 927 iodine uptake foci shown by 131I planar scans
SPECT/CT排除了131I平面显像假阳性诊断(图1A、B),定性了131I平面显像不确定性摄碘灶(图1C~F),更好地提供了病灶的解剖学部位并纠正了131I平面显像诊断错误的摄碘灶(图1G、H),11.9%(48/404)的DTC患者的SPECT/CT显像具有诊断增益价值。
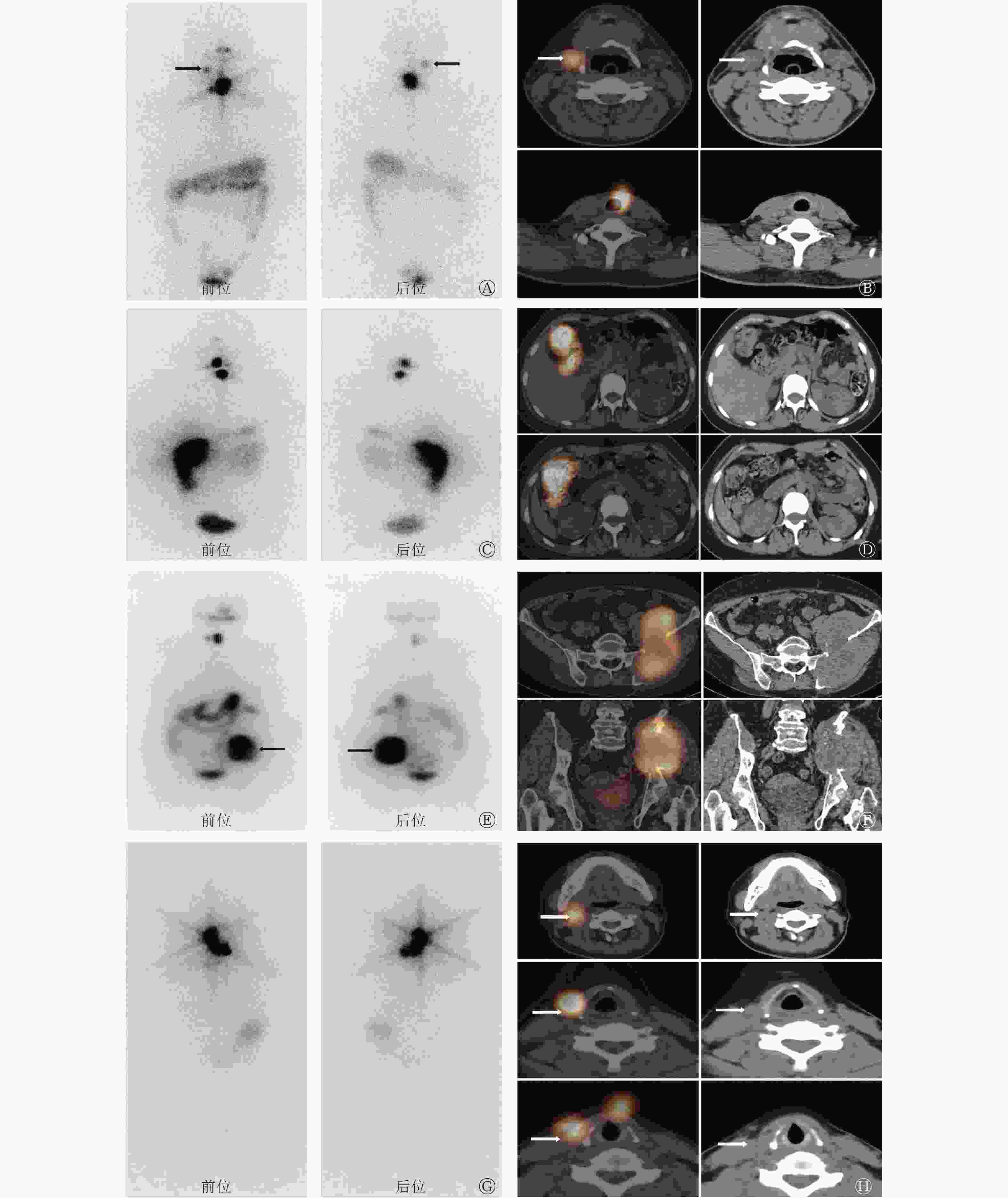
图 1 术后分期为T3bN1bM0、T4aN1bM0、T4aN0M1、T3bN1bM0的甲状腺乳头状癌患者(A~B:男性,47岁;C~D:女性,58岁;E~F:女性,62岁;G~H:女性,34岁)的131I平面显像图、SPECT/CT融合显像图和CT图
Figure 1. images of 131I planar scans, SPECT/CT fusion imaging and CT imaging of papillary thyroid carcinoma carcinoma patients (A–B: male, 47 years old; C–D: female, 58 years old; E–F: female, 62 years old; G–H: female, 34 years old) with postoperative staging of T3bN1bM0, T4aN1bM0, T4aN0M1 and T3bN1bM0 respectively
-
1.7%(7/404)患者的诊疗决策发生了变化,详见表3。
年龄 性别 131I平面显像 SPECT/CT显像 影像诊断 诊疗决策 影像诊断 诊疗决策 36 女 右侧股骨转移 上调分期为M1 外伤骨折病灶摄取 维持M0分期 55 女 肝脏转移 上调分期为M1 肝总管生理性滞留 维持M0分期 66 女 右侧肱骨转移 上调分期为M1 局部皮肤污染 维持M0分期 23 女 残留甲状腺 随访监测 多发残留淋巴结转移 再次手术 34 女 残留甲状腺 随访监测 多发残留淋巴结转移 再次手术 35 男 残留甲状腺 随访监测 多发残留淋巴结转移 再次手术 39 男 残留甲状腺 随访监测 多发残留淋巴结转移 再次手术 注:SPECT为单光子发射计算机体层摄影术;CT为计算机体层摄影术 表 3 SPECT/CT显像对分化型甲状腺癌患者诊疗决策的影响
Table 3. Effect of SPECT/CT imaging on diagnosis and treatment decision of patients with differentiated thyroid carcinoma
-
本研究结果显示,与131I平面显像相比,SPECT/CT显像具有诊断增益价值,主要体现在鉴别诊断:(1)残甲与颈部淋巴结转移灶;(2)131I在唾液腺、肠道等的生理性滞留及非特异性聚集炎症病灶而造成的假阳性。SPECT/CT显像排除了131I平面显像的假阳性诊断,定性了131I平面显像的不确定性病灶,更好地确定了病灶的解剖学部位,进而纠正了131I平面显像诊断错误的病灶。SEPCT/CT显像对11.9%的DTC患者的131I平面显像具有诊断性增益价值,并由此改变了1.7%的DTC患者的诊疗决策。
是否常规行中央区淋巴结的预防性清扫,以治疗为目的行中央区和(或)颈侧区淋巴结清扫,清扫范围和程度在临床中仍存在较大差异,加上DTC患者颈部淋巴结跳跃性转移可能,这些因素均可造成淋巴结清扫不彻底[16]。对已知有淋巴结转移的DTC患者而言,术后有无残留转移性淋巴结不影响患者的分期和初始危险度分层,若转移性淋巴结的长径大于1 cm,即使其摄取131I,但单纯依赖131I治疗很难达到彻底根除的目的,对于此类患者应考虑再次手术清扫残留淋巴结[17]。因此,探测术后有无残留转移性淋巴结,对DTC患者有一定的预后价值。残甲摄131I能力较强,而131I平面显像具有缺乏精细解剖学信息且组织器官前、后位重叠显像等特点,这导致其难以准确鉴别残甲与残留转移性淋巴结。本研究结果显示,在131I平面显像显示的头颈部841个摄碘灶中,16.9%的摄碘灶定性诊断存在困难,SPECT/CT对此具有诊断增益价值。
放射性药物在体内代谢的过程中,不可避免地造成一些放射性药物生理性分布区域产生本底信号。正常组织器官的解剖结构及代谢功能存在个体化差异,因此个体间放射性药物生理性分布的器官影像亦存在一定差异[18]。部分放射性药物生理性分布呈现孤立、结节状形态时,缺乏精细解剖学信息的平面显像,将难以对其定性。131I在唾液腺、肠道、胆管[19]、经期子宫[20]的生理性滞留若表现为局灶性的聚集,131I平面显像将难以定性,易误诊为转移灶。此外,131I可非特异性聚集在肺部炎症灶、植入钢板的骨折病灶[21]等中,局部皮肤的污染[22]亦可以造成假阳性诊断。依赖CT提供的精细解剖学信息,SPECT/CT显像排除了上述原因所致的假阳性病灶,提高了定位、定性诊断的准确性。
SPECT/CT显像给DTC患者带来的诊断增益价值和其对诊疗决策的影响,远超过了CT引发的额外辐射风险。个体化地制定诊疗方案,对DTC患者的预后具有重要意义。本研究结果显示,SPECT/CT显像因定性了131I平面显像不确定的病灶,排除了假阳性病灶,使1.7%的DTC患者的诊疗决策得以改变。
Zilioli等[8]分析了365 例DTC患者SPECT/CT显像的诊断价值,与131I平面显像相比,22.5%DTC患者的SPECT/CT显像具有增益价值,由此改变了3.6%DTC患者的诊疗决策。Kohlfuerst等[23]对比了41例DTC患者131I平面显像与SPECT/CT显像结果:73.7%的患者得以获益,24.4%的患者诊疗决策得以改变,该结果显著优于本研究和Zilioli等[8]的研究结果,这可能与样本量有关。此外,不同研究纳入标准间的差异也需引起注意。
SPECT/CT在临床肿瘤学中的应用可分为“选择性”和“常规性”2种。“选择性”应用指由于缺乏解剖学信息,131I平面显像不能准确做出诊断,需选用SPECT/CT进一步定位及定性诊断。“常规性”应用指在131I平面显像的基础上,进一步行SPECT/CT显像。当“选择性”应用时,SPECT/CT的诊断增益价值理论上可达到100%。但对于131I平面显像已“确诊”的患者是否有必要进一步行SPECT/CT检查,目前尚无统一定论。Kohlfuerst等[23]纳入的多是131I平面显像不能确诊的DTC患者,结果显示,SPECT/CT显像具有较高的诊断增益价值。
既往探讨SPECT/CT显像诊断增益价值的相关研究存在一定异质性。其同时纳入了诊断活度131I平面显像和治疗活度131I平面显像、DTC清甲患者和清甲后随访的患者[4] 。由于131I使用剂量的差异,治疗活度131I平面显像探测病灶的能力及提供的诊断信息优于诊断活度131I平面显像。残甲的存在,使得平面显像区分、定性颈部摄碘灶的难度增大。清甲后随访期DTC患者的颈部淋巴结转移灶显示更加清晰。这些因素均会影响对SPECT/CT显像诊断增益价值的判断。本研究纳入的样本量相对较大,研究对象均为清甲治疗的DTC患者,这是目前在核素治疗病房最常见到的DTC患者群;清甲后的治疗活度显像也是清甲治疗的重要环节,我们据此探讨SPECT/CT显像的诊断增益价值,更具临床实用性。
本研究存在一定不足:(1)回顾性研究;(2)评价SPECT/CT显像的诊断增益价值时,均先分析131I平面显像,随后分析SPECT/CT显像,这可能造成解释性(记忆性)偏倚,但符合临床实际阅片习惯;(3)摄碘性病灶的性质缺乏确切的组织病理学资料或未经临床随访证实。对完成甲状腺全切和颈部淋巴结清扫的DTC患者来说,穿刺活检或手术切除颈部摄碘性病灶缺乏一定的必要性和可行性。因病灶已摄取了131I,131I的内照射损伤效应难以通过随访判定病灶性质[24]。
利益冲突 所有作者声明无利益冲突
作者贡献声明 王钰负责数据的收集与分析、论文的撰写;向镛兆负责图像的采集、数据的分析;刘斌负责命题的构思与设计、论文最终版本的修订
治疗活度131I SPECT/CT显像对分化型甲状腺癌患者诊断增益价值的研究
Value of post-therapeutic of 131 I SPECT/CT imaging in diagnosing patients with differentiated thyroid carcinoma
-
摘要:
目的 探讨治疗活度131I SPECT/CT显像对分化型甲状腺癌(DTC)患者的诊断增益价值和其对临床诊疗决策的影响。 方法 回顾性分析2017年1月至2020年5月于四川大学华西医院接受131I治疗的404例DTC患者的临床资料,其中男性89例、女性315例,年龄21~69(46.3 ± 5.9)岁。所有患者均首次行131I治疗,剂量为1.11~9.25 GBq,治疗后第5天行全身前、后位131I平面显像,同时对其探测到的摄碘灶加做SPECT/CT显像,单独依据131I平面显像和SPECT/CT显像将摄碘灶定性为残甲、颈部淋巴结转移、远处转移和不确定性病灶。依据CT的解剖定位信息,计算SPECT/CT显像对131I平面显像显示的摄碘灶的原始诊断的修正比例,从而评估SPECT/CT显像对DTC患者临床诊疗决策的影响。131I平面显像与SPECT/CT显像之间的分布差异采用McNemar和McNemar-Bowker检验进行评估。 结果 404例DTC患者的131I平面显像共检测出927个摄碘灶。SPECT/CT显像对131I平面显像显示的927个摄碘灶中的179个摄碘灶具有诊断增益价值,准确解释了131I平面显像不能定性的118个摄碘灶。SPECT/CT显像对11.9%(48/404)的DTC患者具有诊断增益价值,1.7%(7/404)患者的诊疗决策发生了改变。131I平面显像与SPECT/CT显像结果在摄碘灶定性诊断中的差异有统计学意义(χ2=101.69,P<0.001),SPECT/CT显像对颈部淋巴结转移灶的显示明显优于131I平面显像(McNemar检验,P<0.05)。 结论 治疗活度131I SPECT/CT显像对DTC患者具有诊断增益价值,并对其临床诊疗决策具有积极意义。 -
关键词:
- 碘放射性同位素 /
- 分化型甲状腺癌 /
- 体层摄影术,发射型计算机,单光子 /
- 体层摄影术,X线计算机
Abstract:Objective To investigate the diagnostic gain value and its effect on clinical diagnosis and treatment of post-therapeutic 131I SPECT/CT imagings in patients with differentiated thyroid carcinoma (DTC). Methods This retrospective study enrolled 404 DTC patients composed of 89 males and 315 females and aged 21 to 69 (46.3±5.9) years old. The patients took their first 131I therapy at the West China Hospital of Sichuan University between January 2017 and May 2020. All patients were evaluated using SPECT/CT imagings and whole-body anteroposterior position 131I planar scans five days after receiving a dose of 1.11–9.25 GBq. The 131I planar scans and the SPECT/CT imagings were evaluated independently for iodine uptake foci, which were categorized as residual thyroid, lymph node, distant metastasis and the equivocal foci. According to the anatomical location information of CT, the correction ratio of SPECT/CT imagings to the original diagnosis of iodine uptake foci shown by 131I planar scans was calculated. Then, the influence of SPECT/CT imagings on the clinical diagnosis and management of DTC patients was further assessed. McNemar test and McNemar–Bowker test were both used to assess the distribution differences between 131I planar scans and SPECT/CT imagings. Results A total of 927 iodine uptake foci were detected in the 131I planar scans of 404 DTC patients. According to the images of 131I planar scans, SPECT/CT imagings led to a revision of the original diagnosis in 179 of 927 iodine uptake foci, and 118 iodine uptake foci considered to be indeterminate based solely on the planar images were accurately classified. SPECT/CT imagings has diagnostic gain value for 11.9% (48/404) of DTC patients, and 1.7% (7/404) patients' diagnosis and treatment decisions have changed. The difference between 131I planar scans and SPECT/CT imagings in the qualitative diagnosis of iodine uptake foci was statistically significant (χ2=101.69, P<0.001). Regarding the detection of metastatic cervical lymph nodes, the characterization of the 131I uptake by SPECT/CT was significantly better than that by planar scans (McNemar test, P<0.05). Conclusion Post-therapeutic 131I SPECT/CT imagings is of positive significance in the diagnostic gain value and diagnosis and treatment of patients with DTC. -
图 1 术后分期为T3bN1bM0、T4aN1bM0、T4aN0M1、T3bN1bM0的甲状腺乳头状癌患者(A~B:男性,47岁;C~D:女性,58岁;E~F:女性,62岁;G~H:女性,34岁)的131I平面显像图、SPECT/CT融合显像图和CT图
Figure 1. images of 131I planar scans, SPECT/CT fusion imaging and CT imaging of papillary thyroid carcinoma carcinoma patients (A–B: male, 47 years old; C–D: female, 58 years old; E–F: female, 62 years old; G–H: female, 34 years old) with postoperative staging of T3bN1bM0, T4aN1bM0, T4aN0M1 and T3bN1bM0 respectively
表 1 404例接受131I治疗的分化型甲状腺癌患者的一般特征
Table 1. General characteristics of 404 differentiated thyroid carcinoma patients treated with 131I
患者特征 例数(%) 病理类型 乳头状癌 385(95.3) 滤泡癌 19(4.7) T分期 T1 99(24.5) T2 77(19.1) T3 93(23.0) T4 78(19.3) Tx 57(14.1) N分期 N0 34(8.4) N1a 105(26.0) N1a+N1b 256(63.4) Nx 9(2.2) M分期 M0 372(92.1) M1 32(7.9) 表 2 SPECT/CT对131I平面显像显示的927个摄碘灶的定性分析
Table 2. Qualitative analysis of SPECT/CT imaging to 927 iodine uptake foci shown by 131I planar scans
部位 131I 平面显像 SPECT/CT显像 摄碘灶数量
(n= 927)头颈部 残留甲状腺 残留甲状腺 684 淋巴结转移 23a 淋巴结转移 淋巴结转移 15 残留甲状腺 5a 颌下腺生理性摄取 15a 不确定性病灶 残留甲状腺 85a 淋巴结转移 14a 胸部 肺转移 肺转移 10 肺部炎症灶摄取 3a 纵膈淋巴结转移 纵膈淋巴结转移 10 胸腺及食管生理性摄取 6a 腹部 肝转移 胆管生理性滞留 2a 骨转移 骨转移 3 不确定性病灶 肠道生理性滞留 15a 经期子宫的生理性滞留 1a 骨转移 3a 四肢 骨转移 骨转移 26 外伤骨折病灶摄取 1a 局部皮肤污染 6a 注:a表示SPECT/CT显像对131I平面显像显示的摄碘灶具有诊断增益价值,合计19.3%(179/927)。SPECT为单光子发射计算机体层摄影术;CT为计算机体层摄影术 表 3 SPECT/CT显像对分化型甲状腺癌患者诊疗决策的影响
Table 3. Effect of SPECT/CT imaging on diagnosis and treatment decision of patients with differentiated thyroid carcinoma
年龄 性别 131I平面显像 SPECT/CT显像 影像诊断 诊疗决策 影像诊断 诊疗决策 36 女 右侧股骨转移 上调分期为M1 外伤骨折病灶摄取 维持M0分期 55 女 肝脏转移 上调分期为M1 肝总管生理性滞留 维持M0分期 66 女 右侧肱骨转移 上调分期为M1 局部皮肤污染 维持M0分期 23 女 残留甲状腺 随访监测 多发残留淋巴结转移 再次手术 34 女 残留甲状腺 随访监测 多发残留淋巴结转移 再次手术 35 男 残留甲状腺 随访监测 多发残留淋巴结转移 再次手术 39 男 残留甲状腺 随访监测 多发残留淋巴结转移 再次手术 注:SPECT为单光子发射计算机体层摄影术;CT为计算机体层摄影术 -
[1] Liu B, Chen Y, Jiang LS, et al. Is postablation whole-body 131I scintigraphy still necessary in intermediate-risk papillary thyroid cancer patients with pre-ablation stimulated thyroglobulin <1 ng/mL?[J]. Clin Endocrinol (Oxf), 2017, 86(1): 134−140. DOI: 10.1111/cen.13158. [2] Malamitsi JV, Koutsikos JT, Giourgouli SI, et al. I-131 postablation SPECT/CT predicts relapse of papillary thyroid carcinoma more accurately than whole body scan[J]. In Vivo, 2019, 33(6): 2255−2263. DOI: 10.21873/invivo.11731. [3] Zhang XY, Liu LN, Chen Y, et al. Prognostic value of post-ablation 131I scintigraphy in children with thyroid cancer[J]. Head Neck, 2020, 42(8): 1738−1745. DOI: 10.1002/hed.26088. [4] Xue YL, Qiu ZL, Song HJ, et al. Value of 131I SPECT/CT for the evaluation of differentiated thyroid cancer: a systematic review of the literature[J]. Eur J Nucl Med Mol Imaging, 2013, 40(5): 768−778. DOI: 10.1007/s00259-012-2310-x. [5] Israel O, Pellet O, Biassoni L, et al. Two decades of SPECT/CT—the coming of age of a technology: an updated review of literature evidence[J]. Eur J Nucl Med Mol Imaging, 2019, 46(10): 1990−2012. DOI: 10.1007/s00259-019-04404-6. [6] Spanu A, Nuvoli S, Gelo I, et al. Role of diagnostic 131I SPECT/CT in long-term follow-up of patients with papillary thyroid microcarcinoma[J]. J Nucl Med, 2018, 59(10): 1510−1515. DOI: 10.2967/jnumed.117.204636. [7] Spanu A, Nuvoli S, Marongiu A, et al. Neck lymph node metastasis detection in patients with differentiated thyroid carcinoma (DTC) in long-term follow-up: a 131I-SPECT/CT study[J/OL]. BMC Cancer, 2020, 20(1): 239[2021-10-01]. https://bmccancer.biomedcentral.com/articles/10.1186/s12885-020-06744-1. DOI: 10.1186/s12885-020-06744-1. [8] Zilioli V, Peli A, Panarotto MB, et al. Differentiated thyroid carcinoma: incremental diagnostic value of 131I SPECT/CT over planar whole body scan after radioiodine therapy[J]. Endocrine, 2017, 56(3): 551−559. DOI: 10.1007/s12020-016-1086-3. [9] 刘斌, 匡安仁. 重组人促甲状腺激素在分化型甲状腺癌诊治中的应用[J]. 生物医学工程学杂志, 2012, 29(3): 588−592.
Liu B, Kuang AR. Clinical application of recombinant human thyroid-stimulating hormone in management of differentiated thyroid carcinoma[J]. J Biomed Eng, 2012, 29(3): 588−592.[10] 刘斌, 曾宇, 王建涛, 等. 131I治疗分化型甲状腺癌肺转移吸收剂量学评价肺安全性[J]. 生物医学工程学杂志, 2010, 27(4): 852−854.
Liu B, Zeng Y, Wang JT, et al. Lungs absorbed dose in radioiodine therapy of differentiated thyroid carcinoma with diffuse pulmonary metastases[J]. J Biomed Eng, 2010, 27(4): 852−854.[11] 刘丽娜, 张歆玥, 刘斌, 等. 首次131I治疗前刺激性Tg对儿童及青少年分化型甲状腺癌疗效的预测价值[J]. 中华核医学与分子影像杂志, 2020, 40(6): 324−328. DOI: 10.3760/cma.j.cn321828-20200219-00054.
Liu LN, Zhang XY, Liu B, et al. Predictive value of stimulated thyroglobulin before the first 131I therapy for children and adolescents with differentiated thyroid carcinoma[J]. Chin J Nucl Med Mol Imaging, 2020, 40(6): 324−328. DOI: 10.3760/cma.j.cn321828-20200219-00054.[12] Amin MB, Edge SB, Greene FL, et al. AJCC cancer staging manual[M]. 8th ed. Switzerland: Springer, 2017. [13] Haugen BR, Alexander EK, Bible KC, et al. 2015 American thyroid association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer: the American thyroid association guidelines task force on thyroid nodules and differentiated thyroid cancer[J]. Thyroid, 2016, 26(1): 1−133. DOI: 10.1089/thy.2015.0020. [14] Liu LN, Zhang XY, Tian T, et al. Prognostic value of pre-ablation stimulated thyroglobulin in children and adolescents with differentiated thyroid cancer[J]. Thyroid, 2020, 30(7): 1017−1024. DOI: 10.1089/thy.2019.0585. [15] Tian T, Jiang LS, Zhang XY, et al. Association between clinical and tumor features with postoperative thyroglobulin in pediatric papillary thyroid cancer[J]. Surgery, 2020, 168(6): 1095−1100. DOI: 10.1016/j.surg.2020.07.058. [16] Robinson TJ, Thomas S, Dinan MA, et al. How many lymph nodes are enough? Assessing the adequacy of lymph node yield for papillary thyroid cancer[J]. J Clin Oncol, 2016, 34(28): 3434−3439. DOI: 10.1200/JCO.2016.67.6437. [17] Hung ML, Wu JX, Li N, et al. Association of radioactive iodine administration after reoperation with outcomes among patients with recurrent or persistent papillary thyroid cancer[J]. JAMA Surg, 2018, 153(12): 1098−1104. DOI: 10.1001/jamasurg.2018.2659. [18] Liu B, Servaes S, Zhuang HM. SPECT/CT MIBG imaging is crucial in the follow-up of the patients with high-risk neuroblastoma[J]. Clin Nucl Med, 2018, 43(4): 232−238. DOI: 10.1097/RLU.0000000000001984. [19] Dai HY, Huang R. Radioiodine retention within dilated common biliary duct mimicking metastatic thyroid cancer diagnosed by the combination of SPECT/CT and MRI[J]. Clin Nucl Med, 2020, 45(10): 787−788. DOI: 10.1097/RLU.0000000000003054. [20] Liu LN, Chen Y, Tian T, et al. Physiologic uterine uptake of radioiodine during menstruation demonstrated by SPECT/CT[J]. Clin Nucl Med, 2019, 44(12): 975−977. DOI: 10.1097/RLU.0000000000002754. [21] Liu LN, Chen Y, Tian T, et al. An unusual false-positive uptake of radioiodine caused by metallic implants[J]. Clin Nucl Med, 2019, 44(8): e495−e496. DOI: 10.1097/RLU.0000000000002587. [22] Liu B, Tilak G, Edwards K, et al. Intense iodine activity caused by mosquito bite[J]. Clin Nucl Med, 2013, 38(11): e414−e416. DOI: 10.1097/RLU.0b013e31827a0020. [23] Kohlfuerst S, Igerc I, Lobnig M, et al. Posttherapeutic 131I SPECT-CT offers high diagnostic accuracy when the findings on conventional planar imaging are inconclusive and allows a tailored patient treatment regimen[J]. Eur J Nucl Med Mol Imaging, 2009, 36(6): 886−893. DOI: 10.1007/s00259-008-1044-2. [24] Tian T, Chen Y, Xiang YZ, et al. Remarkable response of pulmonary metastases rather than remnant thyroid in 131I therapy of follicular thyroid cancer[J]. Clin Nucl Med, 2019, 44(4): 327−329. DOI: 10.1097/RLU.0000000000002477. -





 下载:
下载:


