-
99Tcm-MDP全身骨显像(whole-body bone scan,WBS)是最常用的核医学检查方法之一。在临床上,除骨骼、肾脏和膀胱可见显影外,心肌、肌肉等骨外软组织也可见异常显影。慢性肾功能不全、甲状旁腺功能亢进症等均可引起全身或局部软组织内钙盐沉积,继而引发转移性钙化或钙化防御,99Tcm-MDP可通过化学吸附方式定位于钙盐表面而显影[1]。我们报道了1例慢性肾功能不全长期腹膜透析的钙化防御伴左心室转移性钙化99Tcm-MDP SPECT/CT显像的病例,在排除显像剂质量及采集技术问题后,结合患者临床症状及实验室检查结果,针对特定部位行99Tcm-MDP SPECT/CT显像,在缺少组织病理学检查结果的情况下充分发挥其诊断效能,以期为临床医师提供参考。
-
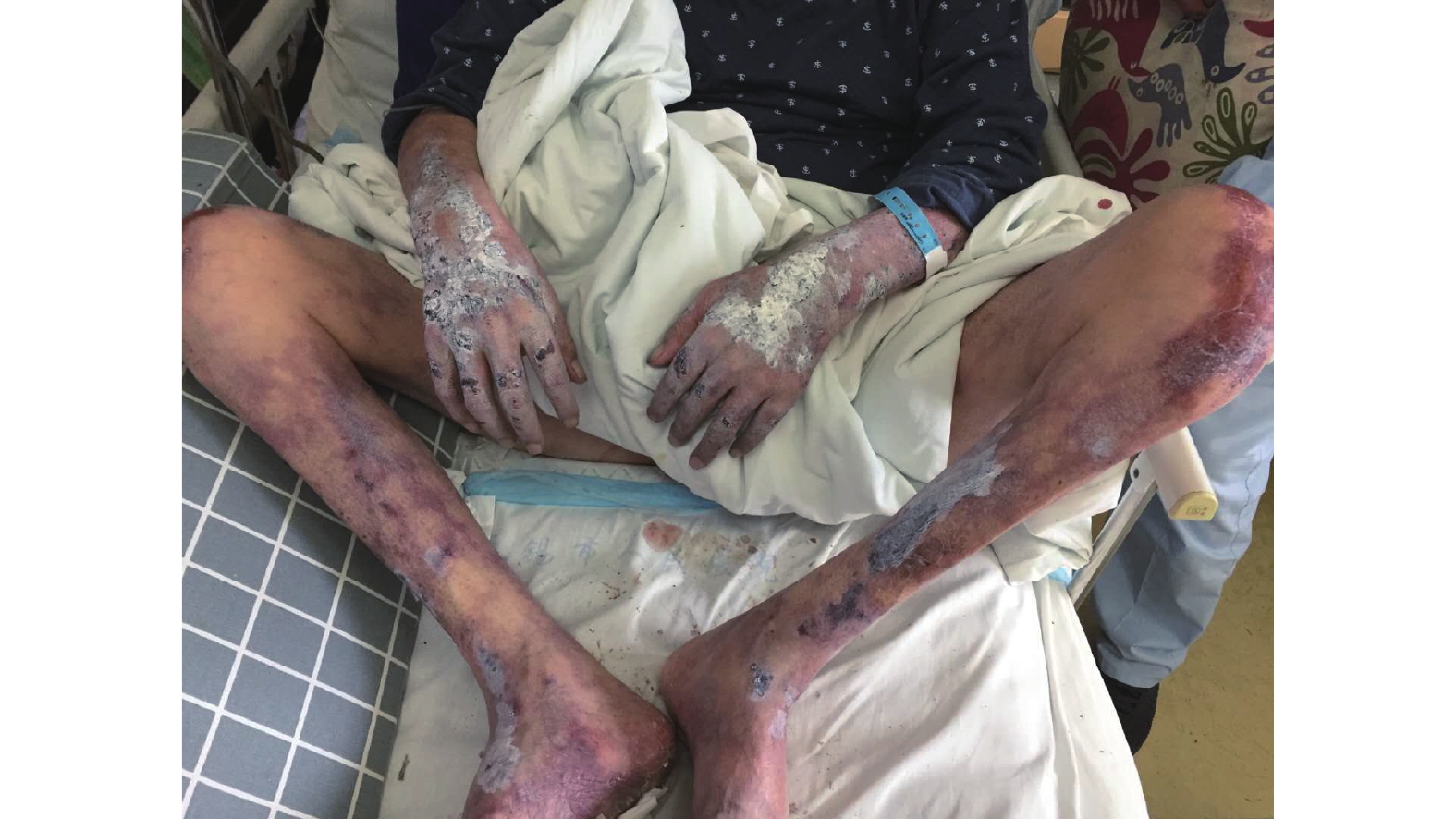
患者男性,65岁,因“维持性腹膜透析2年,双下肢疼痛伴皮损2周”于2019年1月25日至南京医科大学附属无锡人民医院就诊。患者被临床确诊为慢性肾功能不全(慢性肾脏病5期),进行维持性肾脏替代治疗腹膜透析2年。入院前2周,患者双下肢疼痛,以腓肠肌处较为明显,伴局部出现水泡,破溃后结痂形成硬结(图1)。病程中,患者有明显胸闷、气喘及心悸症状。既往史:5个月前,患者被诊断为慢性炎症性脱髓鞘性多发性神经病,口服强的松60 mg/日,治疗后1个月出现血糖升高,诊断为类固醇性糖尿病,行胰岛素降血糖治疗并减少口服强的松剂量至30 mg/日;无明确严重心绞痛及心肌梗死病史。实验室检查结果(括号内为正常参考范围):WBC 11.2(4.0~10.0)×109/L、中性粒细胞百分比84%(50%~75%)、肌酐771.3(57.0~111.0) mmol/L、尿素31.3(3.6~9.5) mmol/L、血钙2.15(2.20~2.70) mmol/L、血磷3.40(0.85~1.51) mmol/L、甲状旁腺激素203.40(12.00~88.00) pg/ml。辅助检查结果:(1)双下肢B超检查结果显示,双下肢动脉硬化伴斑块形成;(2)心电图检查结果显示,心房扑动,ST-T段改变;(3)心脏超声检查结果显示,左心室前壁收缩功能减弱,左心室壁明显增厚,左心室射血分数为38%,左心房增大;(4)胸部CT检查结果显示,左心室壁密度增高(CT值均数为65 HU)。临床考虑患者出现转移性钙化和钙化防御,行99Tcm-MDP WBS进一步评估其钙化病变的累及范围,并根据WBS前位、后位图像加做局部SPECT/CT显像,显示双下肢骨外软组织、心脏异常放射性浓聚,局部骨骼不清晰,双肾显影较小,其余骨骼未见明显异常放射性浓聚(图2)。胸部99Tcm-MDP SPECT/CT显示,心影增大,左心室壁心肌密度异常增高伴明显放射性浓聚(图2A)。右下肢横断面和冠状面的99Tcm-MDP SPECT/CT显示,骨外软组织内多发沙砾状、条状钙化影,小血管广泛钙化,右下肢骨外软组织摄取增加,胫腓骨摄取明显减少(图2B、C)。临床医师诊断其为双下肢软组织钙化防御伴左心室转移性钙化。半个月后,患者因多脏器功能衰竭病死,因此未能进一步行组织病理学检查。
-
正常情况下,99Tcm-MDP WBS仅骨骼、肾脏及膀胱可见显影,但在临床上也常发现骨外软组织异常摄取的病例,且以恶性肿瘤病变引起为主,良性肿瘤病变引起的转移性钙化或钙化防御也占一定比例[2]。慢性肾功能不全患者常出现一系列骨内或骨外病变,临床主要表现为纤维性骨炎、骨质疏松和转移性钙化等,其发生的原因主要与肾脏功能及透析治疗有关,因而统称为肾性骨营养不良,简称肾性骨病。肾性骨病患者的临床症状与体征不典型,对骨或骨外软组织行活体组织病理学检查可诊断早期肾性骨病,且可进行组织病理学分类,但其为有创检查不易被患者接受,因此,临床应用受到一定限制。WBS作为一种无创检查方法和定量诊断工具,可帮助临床医师早期、灵敏地发现患者全身骨骼和软组织的异常放射性浓聚,有助于肾性骨病的早期诊断及定位。SPECT/CT能对骨外软组织显影且能同时提供精准的解剖定位与功能显像。本例患者的99Tcm-MDP WBS显示,心脏及双下肢有异常放射性浓聚;99Tcm-MDP SPECT/CT显示,左心室壁密度异常增高伴明显放射性浓聚,双下肢软组织内钙化沉积、小血管壁钙化伴放射性浓聚明显增加,因此将SPECT功能显像与CT解剖结构进行融合成像,可提高诊断的灵敏度、特异度和准确率。
99Tcm-MDP WBS出现心脏放射性浓聚比较罕见,可能原因如下:(1)心肌炎、电击伤、挫伤等引起的心脏摄取,以及WBS前行放射性核素心肌显像所导致的放射性示踪剂在心脏残留,本例患者无相关病史,可以排除;(2)心肌梗死有时会导致心肌摄取骨显像剂,其可能机制主要是营养不良性钙化,本例患者心电图无特征性心肌梗死表现,且既往无明确严重的心绞痛或心肌梗死病史,故可能性较低;(3)心脏淀粉样变性,其可累及心肌,导致心肌肥厚、限制性心肌病、充血性心力衰竭及心律失常等,特征性心电图、超声心动图和心脏磁共振表现是目前影像学诊断心肌心脏淀粉样变性的主要依据,CT表现通常没有特异性。核医学显像中99Tcm-PYP(焦磷酸盐)显像对转甲状腺素蛋白淀粉样变心肌病有良好的辅助诊断价值。Ross等[3]也报道了心肌99Tcm-MDP摄取的病例,但最终确诊还必须依据心内膜心肌活体组织病理学检查或基因检测结果;(4)转移性钙化,是指各种原因引起的机体钙磷代谢紊乱导致钙盐异常沉积在除骨骼及牙齿以外的正常软组织内。
转移性钙化的可能发病原因如下:高钙、高磷或钙磷沉积超过60~75 mg2/dl2;继发性甲状旁腺功能亢进;低转化性肾性骨病;过度使用含钙或磷的药物;维生素D的不恰当使用等。转移性钙化的男女发病率无明显差异,常累及血管、关节周围软组织、胃黏膜、肾脏、肺和心脏等,可表现为系统性钙化或局部钙化,患者常无明显症状,仅在X射线或超声心动图等检查时偶然发现。心脏受累时常见心内膜、心瓣膜、心包或局部心肌钙化,大范围的心肌钙化可导致心室壁顺应性降低,心肌细胞收缩功能减退,进一步加重心力衰竭。若钙化累及心脏传导系统则可导致局灶性心肌运动异常,并且可能发生危及生命的心律失常[4]。本例患者有慢性肾功能不全腹膜透析病史,CT显示左心室壁心肌密度异常增高伴99Tcm-MDP放射性浓聚,因此考虑其为左心室转移性钙化所致。
钙化防御是一种以系统性小动脉钙化和组织缺血为特征的罕见且病死率极高的疾病,主要表现为动脉血管钙化、皮肤溃疡和周围组织缺血性坏死,严重者可表现为坏疽。在临床上,本病多见于慢性肾功能不全尿毒症期患者,故又被称为钙性尿毒症性小动脉病。McCarthy等[5]发现,钙性尿毒症性小动脉病在肾透析患者中的发病率约为1/10 000,患者一旦确诊,其预后极差,生存期<1年。钙化防御的主要危险因素有长期透析、高龄、女性、白种人、肥胖、糖尿病、高磷、高钙(或钙磷沉积升高)以及低蛋白血症;有华法林、糖皮质激素、钙剂以及维生素D治疗史等[6]。目前钙化防御的诊断主要依靠典型的临床表现,终末期肾病患者尤其是长期接受透析的患者,表现为皮肤及皮下软组织硬化斑块的形成或坏死,并伴有明显疼痛。皮肤活体组织病理学检查是诊断钙化防御的“金标准”,但会导致新的不愈合溃疡和皮肤感染,因此,其临床实用价值仍存在一定争议[7]。常用的影像学检查方法(如X射线、放射性核素骨扫描等)对异位钙化较为敏感,尤其在无法进行活体组织病理学检查或该检查无法确诊时,其诊断价值较高。综合本例患者的临床资料、实验室检查结果及影像学表现,可诊断其为钙化防御。
综上所述,当WBS出现骨外软组织放射性浓聚时,应当充分利用SPECT/CT的解剖和功能显像的诊断效能,结合患者的临床资料,在不能进行组织病理学检查的情况下,SPECT/CT在转移性钙化和钙化防御的诊断中可为临床医师提供更多参考信息,有助于预后判断和治疗方案的合理制定。
利益冲突 所有作者声明无利益冲突
作者贡献声明 胡伟负责论文的撰写;浦晓佳负责临床数据的收集与整理;朱宝负责方法的建立、论文的审阅
钙化防御伴左心室转移性钙化99Tcm-MDP SPECT/CT显像一例
99Tcm-MDP SPECT/CT imaging of calciphylaxis and left ventricular metastatic calcification: a case report
-
摘要: 笔者报道了1例慢性肾功能不全长期腹膜透析的钙化防御伴左心室转移性钙化99Tcm-亚甲基二膦酸盐(MDP)SPECT/CT显像的病例,显像结果示左心室转移性钙化及双下肢钙化防御骨外软组织异常放射性浓聚。笔者分别从临床症状、实验室检查及影像学表现等方面分析了该病的特点,并通过文献复习加深了对钙化防御伴转移性钙化发病机制的认识。Abstract: The authors reported a case of chronic renal insufficiency with long-term peritoneal dialysis calciphylaxis and left ventricular metastatic calcification with 99Tcm-medronate (MDP) SPECT/CT imaging. The imaging results showed left ventricle metastatic calcification and lower limb calciphylaxis abnormal radioactive concentration of ertraosseous soft tissue. The authors analyzed the characteristics of the disease from the aspects of clinical symptoms, laboratory examinations and imaging findings, and deepened the understanding of the pathogenesis of calciphylaxis and metastatic calcification through literature review.
-
Key words:
-
-
[1] 邹珍, 常娅妮, 武志芳. 常见的99Tcm-MDP骨扫描骨外摄取研究进展[J]. 国际放射医学核医学杂志, 2017, 41(2): 137−142, 155. DOI: 10.3760/cma.j.issn.1673-4114.2017.02.011.
Zou Z, Chang YN, Wu ZF. Extraosseous findings on bone scintigraphy and research progress of its mechanism[J]. Inter J Radiati Med Nucl Med, 2017, 41(2): 137−142, 155. DOI: 10.3760/cma.j.issn.1673-4114.2017.02.011.[2] 解敬慧, 张延军, 张欣, 等. 骨外组织摄取骨显像剂的所见及临床意义探讨(附497例报告)[J]. 中国临床医学影像杂志, 2006, 17(10): 588−591. DOI: 10.3969/j.issn.1008-1062.2006.10.016.
Xie JH, Zhang YJ, Zhang X, et al. The appearances and evaluation of 99Tcm-MDP accumulation in non-osseous tissue: report of 497 cases[J]. J China Clin Med Imaging, 2006, 17(10): 588−591. DOI: 10.3969/j.issn.1008-1062.2006.10.016.[3] Ross JC, Hutt DF, Burniston M, et al. Quantitation of 99mTc-DPD uptake in patients with transthyretin-related cardiac amyloidosis[J]. Amyloid, 2018, 25(3): 203−210. DOI: 10.1080/13506129.2018.1520087. [4] Belkin MN, Cruz MD, Nadeem U, et al. Massive Myocardial Calcium Deposition: Hardened Heart[J/OL]. JACC Case Rep, 2020, 17, 2(7): 996−1003[2021-07-26]. https://www.ncbi.nlm.nih.gov/pmc/journals/4067. DOI: 10.1016/j.jaccas.2020.03.034. [5] McCarthy JT, El-Azhary RA, Patzelt MT, et al. Survival, risk factors, and effect of treatment in 101 patients with calciphylaxis[J]. Mayo Clin Proc, 2016, 91(10): 1384−1394. DOI: 10.1016/j.mayocp.2016.06.025. [6] Baby D, Upadhyay M, Joseph MD, et al. Calciphylaxis and its diagnosis: a review[J]. J Family Med Prim Care, 2019, 8(9): 2763−2767. DOI: 10.4103/jfmpc.jfmpc_588_19. [7] Rotondi S, De Martini N, Tartaglione L, et al. On the role of skin biopsy in the diagnosis of calcific uremic arteriolopathy: a case-based discussion[J]. J Nephrol, 2020, 33(4): 859−865. DOI: 10.1007/s40620-019-00678-z. -






 下载:
下载: