-
PET/CT融合了结构和功能显像,在肿瘤患者的诊断、分期及预后评估中的应用越来越广泛[1]。18F-FDG的分子结构与葡萄糖类似,可被代谢旺盛的肿瘤组织摄取并显像,但患者血糖水平升高时,肿瘤摄取18F-FDG减少[2],病灶与本底的对比度降低,影响肿瘤病灶的检出率。目前,糖尿病患者在行PET/CT检查前,需使用降糖药物将空腹血糖水平控制在11.1 mmol/L以下。
二甲双胍是临床指南推荐的Ⅱ型糖尿病一线治疗药物,近年来还作为辅助化疗药物应用于肿瘤患者[3]。既往研究结果表明,使用二甲双胍的糖尿病患者肠道18F-FDG摄取呈弥漫性、连续性增高[4],影响肠道肿瘤病灶的诊断。有指南建议糖尿病患者18F-FDG检查前48 h停用二甲双胍[4],但停药导致的血糖水平升高也会降低病灶的检出率。胰岛素是糖尿病患者常用的另一种降血糖药物[5],胰岛素的使用会导致肌肉组织对18F-FDG的高摄取。目前,有关胰岛素对肠道18F-FDG摄取的影响的临床研究较少。我们回顾性分析服用二甲双胍和胰岛素治疗的糖尿病患者的18F-FDG PET/CT影像学资料,对比分析2种降血糖药物在糖尿病患者行18F-FDG PET/CT检查时肠道摄取18F-FDG的差异。
-
回顾性分析2017年1月至2019年1月于西安交通大学第一附属医院行18F-FDG PET/CT检查且确诊为Ⅱ型糖尿病的70例患者的临床资料和影像学资料,其中男性41例、女性29例,年龄38~86(62.9±12.4)岁。纳入标准:(1)行18F-FDG PET/CT检查;(2)确诊为Ⅱ型糖尿病。排除标准:(1)有肠道肿瘤和(或)腹腔肿瘤转移;(2)近期有急慢性肠炎病史;(3)既往有胃肠道手术史;(4)服用影响胃肠道动力功能的药物,如抗胆碱能药物、平滑肌钙离子拮抗剂等;(5)既往已确诊肝炎、肝癌。根据降血糖药物的服用情况进一步剔除以下患者:(1)仅饮食控制,不服用降血糖药物;(2)联合服用2种及以上降血糖药物;(3)服用二甲双胍和胰岛素以外的降血糖药物。将纳入的患者按所服药物分为二甲双胍治疗组和胰岛素治疗组。
收集非糖尿病受检者38名作为对照组,其中男性22名、女性16名,年龄16~82(55.0±13.0)岁。纳入标准:(1)既往未确诊糖尿病;(2)以健康体检或肿瘤筛查为检查目的。排除标准:(1)空腹血糖水平>6.1 mmol/L;(2)既往已确诊慢性肝炎;(3)既往有胃肠道手术史、炎症病史;(4)有结直肠息肉。本研究经西安交通大学第一附属医院伦理委员会批准[批准号:2020伦审科字第(085)号],所有受检者均已签署知情同意书。
-
18F-FDG使用美国GE公司MINItrace小型回旋加速器及18F-FDG合成模块在西安交通大学第一附属医院医学影像科自行制备,放射化学纯度> 99%。使用荷兰PHLIPS公司Gemini TF 64 PET/CT对受检者进行扫描,检查前禁食6 h以上,空腹血糖水平控制在11.1 mmol/L以下。服用胰岛素及二甲双胍的患者在检查前1天规律用药,检查当天早晨停药,停药时间>8 h。受检者经静脉注射3.7~4.5 MBq/kg 18F-FDG后,安静休息40~60 min,扫描前饮用300~500 ml纯净水并排空膀胱。CT扫描范围自颅底至股骨中段,管电压120 kV、管电流50 mA、层厚5 mm、层间距5 mm。PET扫描自颅底至股骨中段,根据患者的身高,共采集7~10个床位,1.5 min/床位。PET扫描数据经CT衰减校正、迭代法重建后传送至荷兰PHILIPS公司EBW工作站进行图像的分析判读。
-
由2名从事PET/CT诊断工作10年以上的副主任医师独立盲法阅片,在EBW工作站配置的PET/CT图像融合软件上进行肠道摄取程度的视觉分级。采用18F-FDG PET/CT 最大密度投影图(MIP)对肠道的18F-FDG摄取程度进行评级,以肝脏18F-FDG摄取本底作为对照[4],对小肠和结肠的18F-FDG摄取量进行目测评估,根据18F-FDG摄取程度分为4级。1级:肠道摄取18F-FDG程度低于肝脏本底;2级:肠道摄取18F-FDG程度与肝脏本底基本相当;3级:肠道摄取18F-FDG程度高于肝脏本底;4级:肠道摄取18F-FDG显著且呈弥漫性增高。意见存在分歧时,由2名医师协商决定。
-
由1名从事PET/CT诊断工作10年以上的副主任医师在PHILIPS EBW工作站配置的PET/CT图像融合软件上手动勾画ROI。主动脉18F-FDG摄取程度的测量选取升主动脉根部横断面上的最大层面,避开动脉管壁后勾画直径为2 cm的同心圆作为ROI,计算SUVmax。肝脏18F-FDG摄取程度的测量选取肝脏右叶的最大水平层面,在肝包膜1 cm以下的区域内避开肝血管后,勾画直径为2 cm的同心圆,计算肝脏的SUVmax。十二指肠、空肠、回肠、升结肠、横结肠、降结肠、乙状结肠、直肠的测量分别选取各段肠道摄取最明显的部位,避开肾脏、肝脏、脾脏等高摄取脏器,勾画直径为2 cm的同心圆,计算各段肠道的SUVmax。右侧股直肌18F-FDG摄取程度的测量选取右侧大腿上1/3段的股直肌部分,勾画直径为2 cm的同心圆作为ROI,并计算相应的SUVmax。
-
应用SPSS 22.0软件进行统计学分析。符合正态分布的计量资料以
$\bar x $ ±s表示。采用卡方检验比较3组受检者性别的差异;采用非参数Kruskal-Wallis秩和检验对3组受检者肠道18F-FDG摄取程度的视觉评级进行比较并进行成对分析;采用单因素方差分析比较3组受检者临床指标和不同部位SUVmax的差异,并采用 LSD-t 检验进一步行组间两两比较(方差齐)。P<0.05为差异有统计学意义。 -
共纳入受检者108名,其中二甲双胍治疗组38例(男性22例、女性16例)、胰岛素治疗组32例(男性19例、女性13例)、对照组38名(男性22名,女性16名)。3组受检者在性别间的差异无统计学意义(χ2=0.020,P=0.990)。由表1可知,3组受检者的身高、体重、体重指数、显像剂注射剂量、主动脉SUVmax和肝脏SUVmax间的差异均无统计学意义(均P>0.05)。二甲双胍治疗组和胰岛素治疗组患者的空腹血糖高于对照组(均P<0.05),其中胰岛素治疗组患者的空腹血糖水平略高于二甲双胍治疗组,且差异有统计学意义(P<0.05);与对照组比较,二甲双胍治疗组和胰岛素治疗组的患者年龄更大,且差异均有统计学意义(均P<0.01)。
组别 年龄
(岁)身高
(m)体重
(kg)体重指数
(kg/m2)空腹血糖
(mmol/L)显像剂注射剂量
(MBq)主动脉
SUVmax肝脏
SUVmax二甲双胍治疗组
(n=38)62.82±10.46a 1.67±0.08 68.67±12.69 24.43±3.41 7.09±1.35a 221.82±47.10 2.62±0.42a 3.62±0.51 胰岛素治疗组
(n=32)63.13±9.99a 1.69±0.08 64.11±11.82 22.43±2.99b 7.86±1.88a,b 206.81±41.97 2.62±0.33a 3.55±0.42 对照组(n=38) 55.00±12.98 1.67±0.07 66.15±12.92 23.51±3.71 5.17±0.50 221.25±45.58 2.43±0.44 3.42±0.63 F值 6.885 0.354 1.178 3.306 44.608 1.227 3.063 1.526 P值 0.002 0.702 0.312 0.052 <0.001 0.297 0.051 0.222 注:a表示与对照组比较,差异均有统计学意义(F=3.083、2.978、8.796、9.119、1.995、2.133,P=0.003、0.004、0.001、0.001、0.049、0.036);b表示与二甲双胍治疗组比较,差异均有统计学意义(F=2.612、2.015, P=0.011、0.048)。SUVmax为最大标准化摄取值 表 1 二甲双胍治疗组、胰岛素治疗组糖尿病患者和对照组受检者临床资料和SUVmax的比较(
$\bar x $ Table 1. Comparison of clinical data and maximum standardized uptake value of patients with diabetes mellitus in metformin treatment group, insulin treatment group and the subjects in control group (
$\bar x $ -
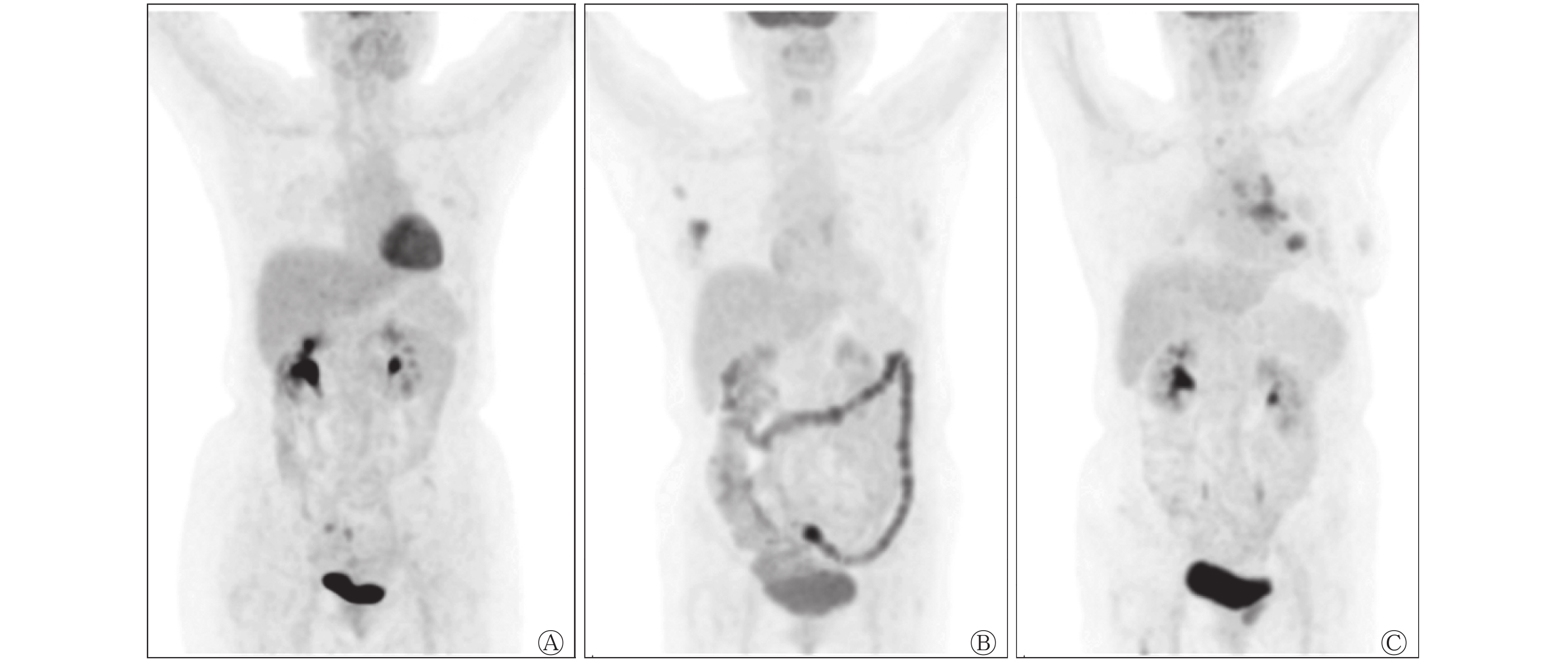
二甲双胍治疗组、胰岛素治疗组和对照组受检者肠道的18F-FDG摄取程度视觉评级结果显示,3组间的差异有统计学意义(H=17.412,P=0.001)。两两分析结果显示,二甲双胍治疗组18F-FDG PET/CT肠道图像的视觉评级与对照组和胰岛素治疗组间的差异均有统计学意义(H=25.988、21.548,P=0.001、P=0.015),而对照组与胰岛素治疗组间视觉评级的差异无统计学意义(H=4.440,P=1.000)。典型病例的18F-FDG PET/CT显像图见图1。
-
由图2可见,肠道的SUVmax分段测量结果显示,与对照组比较,二甲双胍治疗组除十二指肠外,空肠(2.23±0.51对2.60±0.57)、回肠(2.19±0.66对2.95±1.66)、升结肠(2.65±1.03对4.56±3.09)、横结肠(2.09±0.83对3.37±2.15) 、降结肠(2.37±1.06对4.72±3.51)、乙状结肠(2.74±1.12对5.26±3.34)、直肠(3.40±1.06对5.74±3.27)的SUVmax均明显增高,且差异均有统计学意义(均 P<0.01);胰岛素治疗组的横结肠(2.09±0.83对2.71±1.65)、降结肠(2.37±1.06对3.35±2.72)、乙状结肠(2.74±1.12对3.79±2.68)的SUVmax均明显增高,且差异均有统计学意义(均P<0.05)。与胰岛素治疗组比较,二甲双胍治疗组的空肠(2.26±0.41对2.60±0.57)、回肠(2.13±0.58对2.95±1.66)、升结肠(2.84±1.15对4.56±3.09)、乙状结肠(3.79±2.68对5.26±3.34)、直肠(3.89±2.34对5.74±3.27)的SUVmax均明显增高,且差异均有统计学意义(均 P<0.05)。二甲双胍治疗组、胰岛素治疗组、对照组的右侧股直肌SUVmax的差异无统计学意义(F=0.240,P=0.787)。

图 2 二甲双胍治疗组、胰岛素治疗组糖尿病患者和对照组受检者各段肠道及右侧股直肌18F-FDG摄取值SUVmax的比较
Figure 2. Comparison of maximum standardized uptake value of 18F-FDG uptake value of each segment of bowel and right rectus femoris muscle of diabetes patients in metformin treatment group, insulin treatment group and the subjects in control group
-
本研究视觉评级的结果显示,二甲双胍治疗组糖尿病患者肠道18F-FDG PET/CT图像评级与胰岛素治疗组患者和对照组之间的差异均有统计学意义。为进一步探究二甲双胍对肠道不同分段摄取18F-FDG的影响,我们测量了各段肠道的SUVmax,结果显示,除十二指肠外,二甲双胍治疗组患者各段肠道摄取的18F-FDG均高于对照组;在空肠、回肠、升结肠、横结肠、降结肠、乙状结肠和直肠段,二甲双胍治疗组摄取的18F-FDG均高于胰岛素治疗组。
二甲双胍主要通过降低肝糖原的产生和输出,改善肝脏、肌肉和脂肪等外周组织对胰岛素的敏感性,增加葡萄糖的摄取和利用[5]。二甲双胍因耐受性好且安全性高,通常不伴有低血糖症、贫血、乳酸性酸中毒等而被视为糖尿病临床治疗的一线用药。本研究结果显示,口服二甲双胍的糖尿病患者各段肠道对18F-FDG的摄取均较高,这与既往的研究结果[4, 6-8]一致。正常情况下,由于肠道的分泌作用、胃肠道内容物以及胃肠道本身持续蠕动的影响,正常胃肠道可能有部分节段对18F-FDG有生理性摄取,通过充分的肠道准备,抑制胃肠道蠕动,可以明显降低该生理性摄取。有研究者使用PET/MRI比较二甲双胍治疗组与正常对照组肠道的18F-FDG摄取程度视觉评级和SUVmax,结果也显示二甲双胍有18F-FDG肠道摄取增高效应[9]。一项随机对照试验比较了18F-FDG PET/CT检查前未停用、停用24 h和停用48 h二甲双胍的情况下各段肠道的18F-FDG摄取程度,结果表明,停用二甲双胍后,大肠的SUVmax降低最明显,但停药48 h和24 h的SUVmax无差异,这说明PET/CT检查前停用二甲双胍可以降低肠道对18F-FDG的摄取程度,但停药时间还存在争议[6]。二甲双胍影响肠道摄取葡萄糖的机制目前仍不清楚,有学者认为,二甲双胍通过磷酸腺苷(AMP)激活的蛋白激酶(AMPK)诱导葡萄糖转运蛋白-2至肠道上皮细胞表面,导致肠道对葡萄糖的摄取增加[9]。二甲双胍可使肠道对葡萄糖的利用率提高60%以上[10],并降低葡萄糖从肠上皮细胞到血液的转运[11]。消化道通过活跃的平滑肌、淋巴组织、黏膜细胞摄取葡萄糖,结肠和乙状结肠的淋巴组织更丰富,且微生物数量更多,因此导致了该部分肠段的18F-FDG摄取增高更为明显[12-13]。
本研究结果还显示,胰岛素对肠道摄取葡萄糖的影响低于二甲双胍,胰岛素治疗组18F-FDG PET/CT视觉评级与正常对照组无明显差异,SUVmax也具有类似的结果。胰岛素主要作用于肝脏、肌肉和脂肪组织,通过一系列化学反应促进糖原和脂肪酸的合成,使葡萄糖转变为糖原储存起来,以备肌肉活动利用。临床18F-FDG PET/CT检查前,停用胰岛素的主要目的是减少18F-FDG在肌肉组织中的摄取。本研究中我们测量右侧股直肌的SUVmax,主要是将对照组与胰岛素治疗组进行比较,结果显示,胰岛素治疗组患者右侧股直肌的18F-FDG摄取较对照组略低,但两者的差异无统计学意义。既往研究结果表明,使用短效胰岛素的糖尿病患者在行PET/CT检查前4 h注射胰岛素对肌肉摄取18F-FDG的影响最小[14]。本研究结果显示,与对照组相比,胰岛素治疗组患者的右侧股直肌SUVmax没有升高。因此,合理使用和停用胰岛素,既能有效控制血糖水平,减少其对PET/CT检查肠道图像的影响,也能降低肌肉组织对18F-FDG的异常摄取。
本研究仍存在不足之处:本研究是回顾性研究,样本量较少;降血糖药物的停药时间相对不足。有研究结果表明,降血糖药物在PET/CT检查前的停药时间应在48~72 h,但部分患者结肠摄取的抑制效果仍不理想[15-16]。目前国际上对糖尿病患者在PET/CT检查前停用降血糖药物的时间还没有统一的标准[17-18]。另外,停用降血糖药物超过2 d的患者的血糖水平往往过高,甚至超过PET/CT检查的血糖水平限值,以致难以满足这部分患者PET/CT临床检查的需求。
糖尿病患者在18F-FDG PET/CT检查前服用二甲双胍降低血糖水平,会导致肠道对18F-FDG的摄取增加,干扰影像学结果的判读,降低肠道肿瘤的检出率,而胰岛素的使用对肠道的影响较小。在临床工作中,在保证糖尿病患者的血糖水平符合18F-FDG PET/CT检查需求的同时,为了减少肠道摄取18F-FDG,可考虑使用胰岛素代替二甲双胍作为降血糖药物。
利益冲突 所有作者声明无利益冲突
作者贡献声明 李阳负责研究的实施、数据的采集与统计分析、论文的撰写;沈聪负责数据的统计分析、论文的撰写;袁网、丁晖、李艳负责数据的采集与统计分析、研究的实施;段小艺、杨健、张卫善负责试验的设计、论文的审阅
服用二甲双胍与胰岛素的糖尿病患者肠道摄取18F-FDG的比较
Comparison of the effects of metformin and insulin on intestinal 18F-FDG uptake in diabetic patients
-
摘要:
目的 对比分析二甲双胍与胰岛素的使用对糖尿病患者行PET/CT检查时肠道摄取18F-氟脱氧葡萄糖(FDG)的影响。 方法 回顾性分析2017年1月至2019年1月于西安交通大学第一附属医院行18F-FDG PET/CT检查的70例Ⅱ型糖尿病患者的临床资料和影像学资料,其中男性41例、女性29例,年龄38~86(62.9±12.4)岁。根据使用的降血糖药物将患者分为二甲双胍治疗组和胰岛素治疗组。收集同期以健康体检或肿瘤筛查为检查目的的非糖尿病患者作为对照组(38名),其中男性22名、女性16名,年龄16~82(55.0±13.0)岁。对肠道 PET/CT图像的 18F-FDG摄取程度进行视觉评级,并测量各段肠道的最大标准化摄取值(SUVmax)。采用卡方检验比较3组受检者性别的差异;采用非参数Kruskal-Wallis秩和检验比较3组间肠道摄取程度的视觉评级并进行成对分析。采用单因素方差分析比较3组间一般临床资料及肠道各段和右侧股直肌SUVmax的差异,并采用LSD-t检验进一步行组间比较。 结果 二甲双胍治疗组患者肠道的18F-FDG摄取程度视觉评级与对照组和胰岛素治疗组之间的差异均有统计学意义(H=25.988、21.548,均P<0.05)。与对照组比较,二甲双胍治疗组除十二指肠外,空肠(2.23±0.51对2.60±0.57)、回肠(2.19±0.66对2.95±1.66)、升结肠(2.65±1.03对4.56±3.09)、横结肠(2.09±0.83对3.37±2.15) 、降结肠(2.37±1.06对4.72±3.51)、乙状结肠(2.74±1.12对5.26±3.34)、直肠(3.40±1.06对5.74±3.27)的SUVmax均明显增高,且差异均有统计学意义(t=2.133~4.699,均 P<0.01)。与胰岛素治疗组比较,二甲双胍治疗组的空肠(2.26±0.41对2.60±0.57)、回肠(2.13±0.58对2.95±1.66)、升结肠(2.84±1.15对4.56±3.09)、乙状结肠(3.79±2.68对5.26±3.34)、直肠(3.89±2.34对5.74±3.27)的SUVmax均明显增高,且差异均有统计学意义(t=2.002~2.977,均 P<0.05)。 结论 二甲双胍可导致糖尿病患者肠道摄取18F-FDG增加,而胰岛素对肠道摄取18F-FDG的影响较小。 -
关键词:
- 正电子发射断层显像术 /
- 体层摄影术,X线计算机 /
- 氟脱氧葡萄糖 /
- 糖尿病 /
- 二甲双胍 /
- 胰岛素
Abstract:Objective To compare the effects of metformin and insulin on the intestinal uptake of 18F-fluorodeoxyglucose (18F-FDG) in patients with diabetes mellitus undergoing PET/CT. Methods The clinical and imaging data of 70 diabetic patients (41 males and 29 females, aged between 38 and 86 (62.9±12.4) years old) who underwent 18F-FDG PET/CT examination in the First Affiliated Hospital of Xi'an Jiaotong University from January 2017 to January 2019 were retrospectively analyzed. The patients were divided into the metformin treatment group and insulin treatment group according to the hypoglycemic drugs used. Non-diabetic patients undergoing physical examination or tumor screening (38 cases, including 22 males and 16 females, aged between 16 and 82 (55.0±13.0) years old) were collected as the control group. The PET/CT images of the intestine were visually rated, and the 18F-FDG maximum standardized uptake value (SUVmax) of each segment of the intestine was measured. The Chi-square test was used to compare the gender differences of the subjects in the three groups. The nonparametric Kruskal–Wallis rank sum test was used to compare the visual rating of the extent of intestinal uptake in the three groups, and paired analysis was conducted. One-way analysis of variance was used to compare the general data and the differences in the SUVmax of each segment of the intestine and the right rectus femoris muscle among the three groups. Further comparisons were made between the groups by LSD-t test. Results Statistically significant differences were observed in the image visual score of the intestinal tract in the metformin treatment group and between the insulin treatment group and the control group (H=25.988, 21.548; both P<0.05). Compared with the control group, except for the duodenum, SUVmax of jejunum (2.23±0.51 vs. 2.60±0.57), ileum (2.19±0.66 vs. 2.95±1.66), ascending colon (2.65±1.03 vs. 4.56±3.09 ), transverse colon (2.09±0.83 vs. 3.37±2.15 ), descending colon (2.37±1.06 vs. 4.72±3.51), sigmoid colon (2.74±1.12 vs. 5.26±3.34), rectum (3.40±1.06 vs. 5.74±3.27) in metformin treatment group were significantly higher, and all differences were statistically significant (t=2.133–4.699, all P<0.05). Compared with the insulin treatment group, the SUVmax values of the jejunum (2.26±0.41 vs. 2.60±0.57), ileum (2.13±0.58 vs. 2.95±1.66), ascending colon (2.84±1.15 vs. 4.56±3.09), sigmoid colon (3.79±2.68 vs. 5.26±3.34), and rectum (3.89±2.34 vs. 5.74±3.27) in the metformin treatment group were significantly higher than those in the insulin treatment group, and all differences were statistically significant (t=2.002–2.977, all P<0.05). Conclusion Metformin can increase the intestinal uptake of 18F-FDG in diabetic patients, whereas insulin has less effect on the intestinal uptake of 18F-FDG. -
图 2 二甲双胍治疗组、胰岛素治疗组糖尿病患者和对照组受检者各段肠道及右侧股直肌18F-FDG摄取值SUVmax的比较
Figure 2. Comparison of maximum standardized uptake value of 18F-FDG uptake value of each segment of bowel and right rectus femoris muscle of diabetes patients in metformin treatment group, insulin treatment group and the subjects in control group
表 1 二甲双胍治疗组、胰岛素治疗组糖尿病患者和对照组受检者临床资料和SUVmax的比较(
$\bar x $ Table 1. Comparison of clinical data and maximum standardized uptake value of patients with diabetes mellitus in metformin treatment group, insulin treatment group and the subjects in control group (
$\bar x $ 组别 年龄
(岁)身高
(m)体重
(kg)体重指数
(kg/m2)空腹血糖
(mmol/L)显像剂注射剂量
(MBq)主动脉
SUVmax肝脏
SUVmax二甲双胍治疗组
(n=38)62.82±10.46a 1.67±0.08 68.67±12.69 24.43±3.41 7.09±1.35a 221.82±47.10 2.62±0.42a 3.62±0.51 胰岛素治疗组
(n=32)63.13±9.99a 1.69±0.08 64.11±11.82 22.43±2.99b 7.86±1.88a,b 206.81±41.97 2.62±0.33a 3.55±0.42 对照组(n=38) 55.00±12.98 1.67±0.07 66.15±12.92 23.51±3.71 5.17±0.50 221.25±45.58 2.43±0.44 3.42±0.63 F值 6.885 0.354 1.178 3.306 44.608 1.227 3.063 1.526 P值 0.002 0.702 0.312 0.052 <0.001 0.297 0.051 0.222 注:a表示与对照组比较,差异均有统计学意义(F=3.083、2.978、8.796、9.119、1.995、2.133,P=0.003、0.004、0.001、0.001、0.049、0.036);b表示与二甲双胍治疗组比较,差异均有统计学意义(F=2.612、2.015, P=0.011、0.048)。SUVmax为最大标准化摄取值 -
[1] Wareham NE, Lundgren JD, Da Cunha-Bang C, et al. The clinical utility of FDG PET/CT among solid organ transplant recipients suspected of malignancy or infection[J]. Eur J Nucl Med Mol Imaging, 2017, 44(3): 421−431. DOI: 10.1007/s00259-016-3564-5. [2] Finessi M, Bisi G, Deandreis D. Hyperglycemia and 18F-FDG PET/CT, issues and problem solving: a literature review[J]. Acta Diabetol, 2020, 57(3): 253−262. DOI: 10.1007/s00592-019-01385-8. [3] Coyle C, Cafferty FH, Vale C, et al. Metformin as an adjuvant treatment for cancer: a systematic review and meta-analysis[J]. Ann Oncol, 2016, 27(12): 2184−2195. DOI: 10.1093/annonc/mdw410. [4] Ozülker T, Ozülker F, Mert M, et al. Clearance of the high intestinal 18F-FDG uptake associated with metformin after stopping the drug[J]. Eur J Nucl Med Mol Imaging, 2010, 37(5): 1011−1017. DOI: 10.1007/s00259-009-1330-7. [5] Grammatiki M, Sagar R, Ajjan RA. Metformin: is it still the first line in type 2 diabetes management algorithm?[J]. Curr Pharm Des, 2021, 27(8): 1061−1067. DOI: 10.2174/1381612826666201222154616. [6] Koffert JP, Mikkola K, Virtanen KA, et al. Metformin treatment significantly enhances intestinal glucose uptake in patients with type 2 diabetes: results from a randomized clinical trial[J]. Diabetes Res Clin Pract, 2017, 131: 208−216. DOI: 10.1016/j.diabres.2017.07.015. [7] Franquet E, Watts G, Kolodny GM, et al. PET-CT reveals increased intestinal glucose uptake after gastric surgery[J]. Surg Obes Relat Dis, 2019, 15(4): 643−649. DOI: 10.1016/j.soard.2019.01.018. [8] Morris M, Saboury B, Chen WE, et al. Finding the sweet spot for metformin in 18F-FDG-PET[J]. Nucl Med Commun, 2017, 38(10): 875−880. DOI: 10.1097/MNM.0000000000000728. [9] Morita Y, Nogami M, Sakaguchi K, et al. Enhanced release of glucose into the intraluminal space of the intestine associated with metformin treatment as revealed by [18F]fluorodeoxyglucose PET-MRI[J]. Diabetes Care, 2020, 43(8): 1796−1802. DOI: 10.2337/dc20-0093. [10] Ikeda T, Iwata K, Murakami H. Inhibitory effect of metformin on intestinal glucose absorption in the perfused rat intestine[J]. Biochem Pharmacol, 2000, 59(7): 887−890. DOI: 10.1016/s0006-2952(99)00396-2. [11] Horakova O, Kroupova P, Bardova K, et al. Metformin acutely lowers blood glucose levels by inhibition of intestinal glucose transport[J/OL]. Sci Rep, 2019, 9(1): 6156[2021-06-06]. https://www.nature.com/articles/s41598-019-42531-0. DOI: 10.1038/s41598-019-42531-0. [12] Ito J, Nogami M, Morita Y, et al. Dose-dependent accumulation of glucose in the intestinal wall and lumen induced by metformin as revealed by 18F-labelled fluorodeoxyglucose positron emission tomography-MRI[J]. Diabetes Obes Metab, 2021, 23(3): 692−699. DOI: 10.1111/dom.14262. [13] Chang HS, Kim SJ, Kim YH. Association between colonic 18F-FDG uptake and glycemic control in patients with diabetes mellitus[J]. Nucl Med Mol Imaging, 2020, 54(4): 168−174. DOI: 10.1007/s13139-020-00647-6. [14] Petrella LI, Maggi LE, Souza RM, et al. Influence of subcutaneous fat in surface heating of ultrasonic diagnostic transducers[J]. Ultrasonics, 2014, 54(6): 1476−1479. DOI: 10.1016/j.ultras.2014.04.018. [15] Lee SH, Jin S, Lee HS, et al. Metformin discontinuation less than 72 h is suboptimal for F-18 FDG PET/CT interpretation of the bowel[J]. Ann Nucl Med, 2016, 30(9): 629−636. DOI: 10.1007/s12149-016-1106-7. [16] Sheikh A, Anolik J, Maurer AH. Update on serum glucose and metabolic management of clinical nuclear medicine studies: current status and proposed future directions[J]. Semin Nucl Med, 2019, 49(5): 411−421. DOI: 10.1053/j.semnuclmed.2019.06.001. [17] Kaiser A, Davenport MS, Frey KA, et al. Management of diabetes mellitus before 18F-fluorodeoxyglucose PET/CT: a nationwide patient-centered assessment of approaches to examination preparation[J]. J Am Coll Radiol, 2019, 16(6): 804−809. DOI: 10.1016/j.jacr.2018.09.006. [18] Hamidizadeh R, Eftekhar A, Wiley EA, et al. FDG PET/CT显像前停服二甲双胍: 比较停服二甲双胍24 h和48 h肠道活动的一项随机对照试验[J]. 国际医学放射学杂志, 2019, 42(1): 105−106. DOI: 10.19300/j.2019.r1109.
Hamidizadeh R, Eftekhar A, Wiley EA, et al. Metformin discontinuation prior to FDG PET/CT: a randomized controlled study to compare 24-and 48-hour bowel activity[J]. Int J Med Radiol, 2019, 42(1): 105−106. DOI: 10.19300/j.2019.r1109. -





 下载:
下载: