-
18F-FDG PET/CT是肿瘤无创性诊断和分期的重要方法[1-4]。基于全身扫描模式,PET/CT可为非小细胞肺癌(non-small cell lung cancer,NSCLC)患者提供可靠的T分期和M分期信息。然而,炎症或其他肉芽组织增生性病变也能非特异性地摄取18F-FDG,且淋巴结长径>10 mm时,葡萄糖的代谢水平也随之增高[5]。一项国际循证医学研究结果表明,18F-FDG PET/CT的诊断效能不足以对NSCLC患者进行N分期[6]。但是,有研究结果表明,ⅢA期NSCLC患者肿瘤的葡萄糖代谢参数与ⅡB及ⅢB期患者存在差异,并且肿瘤本身的异质性以及淋巴结SUVmax与纵隔血池平均标准化摄取值(mean standardized uptake value, SUVmean)的比值(称为LMV)等参数在有无淋巴结转移的患者中不同[7]。此外,Gao等[8]认为,淋巴结转移阳性的NSCLC患者的血清D-二聚体水平显著高于阴性的患者。本研究回顾性分析了NSCLC患者的临床资料和18F-FDG PET/CT的影像学信息,筛选出淋巴结转移的高危因素,为适合行超声内镜引导下的经支气管针吸活检(EBUS-TBNA)的患者提供无创性的诊断信息。
-
回顾性分析2018年1月至2021年3月因肺部疾病于安徽省阜阳市人民医院核医学科行18F-FDG PET/CT显像诊断和分期的NSCLC患者的临床资料。纳入标准:经组织病理学检查确诊为NSCLC。排除标准:(1)病历资料不全;(2)行18F-FDG PET/CT发现有远处转移;(3)行18F-FDG PET/CT前已接受放疗、化疗、靶向治疗、免疫治疗及中药治疗等;(4)既往确诊有其他类型的恶性肿瘤。最终纳入NSCLC患者102例,其中男性59例、女性43例,年龄33~90(66.0±11.2)岁;行手术的患者64例、行纵隔淋巴结穿刺的患者38例。按照美国癌症联合委员会第8版肺癌分期标准[9]对所有患者进行T分期和N分期。本研究经安徽省阜阳市人民医院伦理委员会批准[批准号:2019(92)号],所有患者均知悉检查流程及注意事项,并签署了知情同意书。
-
患者行检查前需至少禁食6 h,且24 h内无剧烈运动。注射18F-FDG(由南京森科有限公司提供,放射化学纯度≥90%)前测定患者的身高、体重及指尖血糖水平,血糖水平<11.0 mmol/L视为符合注射要求。按照5.18 MBq/kg的剂量静脉注射显像剂,待其代谢(60±10)min后,患者采取仰卧位,行体部(范围为颅底至股骨中上段)和脑部PET/CT图像采集,使用荷兰皇家飞利浦公司Gemini TF 64 PET/CT仪。1.5 min/床位,共采集8~9个床位。CT扫描参数:管电压120~140 kV,管电流采用自动调制方式,层厚3.0 mm;PET图像按照有序子集最大期望值法重建。
-
应用麦迪克斯(MedEx)V8.0软件,由2位高年资的核医学科主治医师进行图像分析,意见不一致时由另1位核医学科主任医师进行诊断。在三维模式下显示原发灶及纵隔淋巴结最大截面的长径和短径,以勾画ROI的方式计算其SUVmax和SUVmean。病灶葡萄糖酵解总量(total lesion glycolysis,TLG)为肿瘤代谢体积(metabolic tumor volume,MTV)与SUVmean的乘积;病灶CV为病灶SUVmax的标准差(standard deviation,SD)与SUVmax的比值。纵隔淋巴结选择SUVmax最高者进行参数测量。绘制ROC曲线,确定预测淋巴结转移的最佳临界值,并计算灵敏度和特异度。
-
应用SPSS 26.0软件进行统计学分析。计数资料采用χ2检验或Fisher确切概率法进行分析。连续性计量资料符合正态分布的以
$\bar x $ ±s表示,在方差齐的条件下采用独立样本t检验进行分析。采用单因素及多因素Logistic回归分析筛选淋巴结转移的预测因素。P<0.05为差异有统计学意义。 -
102例NSCLC患者中,血清D-二聚体水平异常增高(>0.8 mg/L)的患者41例,血清癌胚抗原(carcinoembryonic antigen,CEA)水平异常增高(>5.0 ng/mL)的患者48例;原发肿瘤位于右肺上叶的患者46例、位于右肺中叶的患者4例、位于右肺下叶的患者13例、位于左肺上叶的患者32例、位于左肺下叶的患者7例;病理类型为腺癌的患者66例、鳞癌的患者31例、大细胞型的患者3例、腺鳞癌的患者2例;T分期为T1期的患者57例、T2期的患者25例、T3期的患者14例、T4期的患者6例;N分期为N0期的患者60例、N1期的患者25例、N2期的患者17例;纵隔淋巴结转移阳性的患者42例(转移组),阴性的患者60例(未转移组)。
-
由表1可知,肺部原发肿瘤长径>30.0 mm的患者更易发生淋巴结转移(61.9%对38.1%,P<0.01);转移组患者中淋巴结短径>10.0 mm的患者明显较淋巴结短径≤10.0 mm的患者多(59.5%对40.5%,P<0.05);且转移组患者原发肿瘤葡萄糖代谢的异质性(以CV衡量)、淋巴结SUVmax和LMV亦明显高于未转移组患者(46.7±6.1对29.4±6.0、5.9±1.9对2.8±1.6、2.2±0.6对1.4±0.3,均P<0.01)。患者的年龄、性别、吸烟状态、原发肿瘤的位置、MTV、TLG、血清CEA和D-二聚体的水平在2组间的差异均无统计学意义(均P>0.05)。
参数 转移组
(n=42)未转移组
(n=60)检验值 P值 年龄(岁) 66.6±12.3 65.0±15.1 t=0.82 0.37 性别[例 (%)] χ2=0.87 0.64 男 22(52.4) 37(61.7) 女 20(47.6) 23(38.3) 吸烟状态[例(%)] χ2=0.40 0.53 吸烟或既往吸烟 18(42.9) 22(36.7) 不吸烟 24(57.1) 38(63.3) 原发肿瘤的位置[例 (%)] χ2=1.48 0.22 右肺 23(54.8) 40(66.7) 左肺 19(45.2) 20(33.3) 肿瘤长径[例(%)] χ2=9.16 <0.01 ≤30.0 mm 16(38.1) 41(68.3) >30.0 mm 26(61.9) 19(31.7) MTV(cm3) 56.5±15.8 48.7±17.6 t=0.81 0.51 TLG(g) 242.0±55.3 168.5±46.7 t=0.84 0.36 原发肿瘤CV 46.7±6.1 29.4±6.0 t=13.81 <0.01 淋巴结短径[例(%)] χ2=5.20 0.02 >10.0 mm 25(59.5) 22(36.7) ≤10.0 mm 17(40.5) 38(63.3) 淋巴结SUVmax 5.9±1.9 2.8±1.6 t=8.60 <0.01 LMV 2.2±0.6 1.4±0.3 t=3.97 <0.01 血清癌胚抗原水平[例(%)] χ2=0.81 0.37 >5.0 ng/mL 22(52.4) 26(43.3) ≤5.0 ng/mL 20(47.6) 34(56.7) 血清D-二聚体水平[例(%)] χ2=0.13 0.72 >0.8 mg/L 16(38.1) 25(41.7) ≤0.8 mg/L 26(61.9) 35(58.3) 注:MTV为肿瘤代谢体积;TLG为病灶葡萄糖酵解总量;CV为变异系数;SUVmax为最大标准化摄取值;LMV为淋巴结SUVmax与纵隔血池平均标准化摄取值的比值 表 1 102例非小细胞肺癌患者淋巴结转移影响因素的单因 素Logistic回归分析结果
Table 1. Results of univariable Logistic regression analysis of factors for lymph node metastasis in 102 patients with non-small cell lung cancer
将淋巴结短径、肿瘤长径、淋巴结SUVmax、LMV和原发肿瘤CV纳入多因素Logistic回归分析的结果表明,淋巴结SUVmax(OR=2.2,95%CI:1.30~3.80,P<0.05)以及原发肿瘤CV(OR=1.5,95%CI:1.20~1.80,P<0.01)是影响淋巴结转移的危险因素(表2)。
因素 标准差 P值 OR 95%CI 淋巴结短径(>10.0 mm) 1.22 0.50 − − 肿瘤长径(>30.0 mm) 1.22 0.10 − − 淋巴结SUVmax 0.30 0.04 2.2 1.30~3.80 LMV 1.77 0.20 − − 原发肿瘤CV 0.10 <0.01 1.5 1.20~1.80 注:SUVmax为最大标准化摄取值;LMV为淋巴结SUVmax与纵隔血池平均标准化摄取值的比值;CV为变异系数;CI为可变区间。−表示无此项数据 表 2 102例非小细胞肺癌患者淋巴结转移影响因素的多因 素Logistic回归分析结果
Table 2. Results of multivariable Logistic regression analysis of factors for lymph node metastasis in 102 patients with non- small cell lung cancer
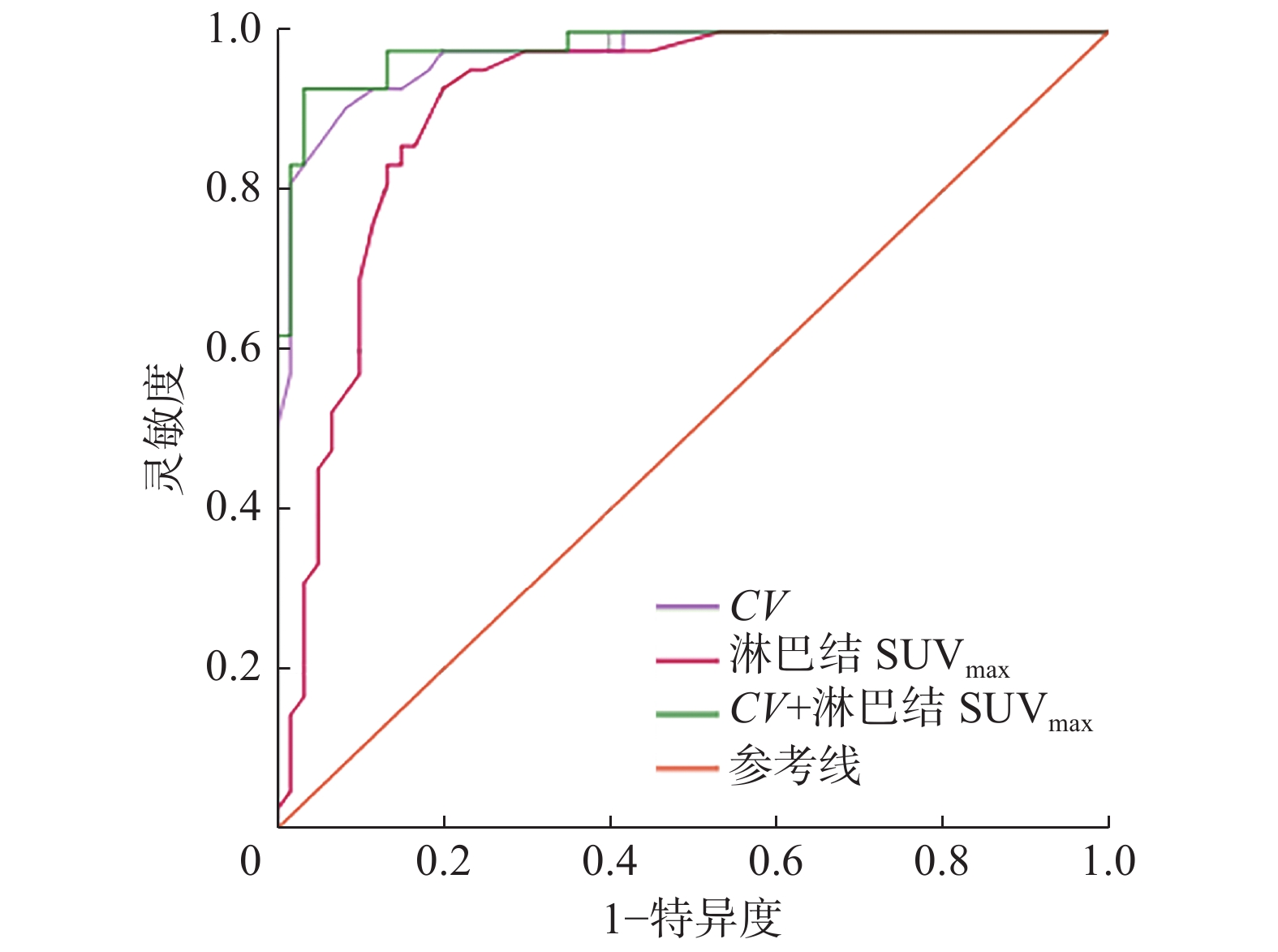
如图1所示,ROC曲线分析结果表明,原发肿瘤CV的AUC=0.97(SD=0.02,95%CI:0.94~0.99,P<0.01),当CV>30.5时,其诊断淋巴结转移的灵敏度为97.5%、特异度为41.7%;淋巴结SUVmax的AUC=0.91(SD=0.30,95%CI:0.85~0.97,P<0.01),当淋巴结SUVmax>3.1时,其诊断淋巴结转移的灵敏度和特异度分别为95.2%和23.3%。将以上2个危险因素进行联合诊断,得出的AUC=0.98(SD=0.01,95%CI:0.96~1.00,P<0.01),高于两者独立预测淋巴结转移的AUC。

图 1 原发肿瘤CV、淋巴结SUVmax以及两者联合对102例非小细胞肺癌患者淋巴结转移的预测效能的受试者工作特征曲线
Figure 1. Receiver operator characteristic curve of the coefficient of variation of primary tumor, the maximum standardized uptake value of lymph nodes, and the combination of the two in predicting lymph node metastasis in 102 patients with non-small cell lung cancer
-
本研究结果表明,NSCLC患者的葡萄糖代谢参数对淋巴结转移具有较高的诊断效能。尽管转移组患者的MTV和TLG均高于未转移组患者,但其差异并无统计学意义。2020年中国临床肿瘤学会指南工作委员会发布的NSCLC诊疗指南建议对经CT或PET/CT高度怀疑淋巴结转移的患者在术前行淋巴结穿刺活检[10]。淋巴结穿刺作为一种侵入性手段,会导致部分患者出现出血、感染等不良事件,也存在未穿刺到病灶的可能。因此,在临床治疗方案的制定过程中,18F-FDG PET/CT可提供重要的淋巴结转移信息,为患者淋巴结穿刺提供依据,尤其是在N2期淋巴结转移的判断上,其发挥了至关重要的作用。原发肿瘤CV虽然在诊断淋巴结转移中具有较高的灵敏度,但其特异度欠佳,导致其对NSCLC患者淋巴结转移的检出率较高,但是在鉴别淋巴结的良恶性方面仍需结合淋巴结的形态学信息。
Pahk等[11]认为,CV对N2期淋巴结转移具有较高的诊断灵敏度和特异度,考虑到样本量应足够大以及患者病理类型的差异,本研究纳入的患者数为前者研究的2倍,且鳞癌患者数明显较前者报道中的多。鳞癌患者较多与吸烟相关,且纵隔内非特异性淋巴结炎的发病率也较高,这导致CV对葡萄糖代谢增高的淋巴结转移的诊断特异度较低。而Budiawan等[12]的研究结果表明,淋巴结转移阳性的患者的肿瘤CV明显高于阴性的患者,且其诊断效能优于其他代谢参数。Fortuny等[13]认为,肿瘤SUVmax无法鉴别淋巴结转移。但Park等 [14]认为,淋巴结转移的风险随淋巴结SUVmax的增加而升高(OR=1.469,95%CI:1.175~1.836,P=0.001),即当原发肿瘤SUVmax=7时,患者发生淋巴结转移的比例高达50%;当原发肿瘤SUVmax=12时,患者发生淋巴结转移的比例高达70%。
本研究结果显示,淋巴结SUVmax>3.1时,患者更易发生淋巴结转移,且其诊断淋巴结转移的灵敏度和特异度分别为95.2%和23.3%。因此,我们认为SUVmax较高的可疑淋巴结更适合进行穿刺活检。其他研究者认为淋巴结SUVmax>3.32、3.6或4.0均可获得较高的诊断效能[15-16]。除了淋巴结SUVmax,本研究的单因素Logistic回归分析结果表明,淋巴结LMV在转移组患者中显著增高,但多因素Logistic回归分析结果显示2组间的差异无统计学意义。Simsek等[17]认为,当LMV>1.4时,淋巴结转移的概率增高,但是其诊断淋巴结转移的灵敏度和特异度均较低,分别为69.4%和64.7%。此外,本研究将淋巴结SUVmax和肺部肿瘤CV进行联合诊断,发现其诊断灵敏度和特异度均较两者单独诊断高。因此,我们认为当淋巴结SUVmax>3.1且肺部肿瘤CV>30.5时,推荐进行淋巴结穿刺活检。本研究中,血清CEA和D-二聚体的水平在2组患者中的差异均无统计学意义,且淋巴结转移与患者的年龄、性别、吸烟状态和肿瘤的位置等均无关。
本研究尚存在不足之处。首先,本研究为单中心回顾性分析,且未纳入远处转移的患者。其次,本研究选择的淋巴结代谢参数仅为临床常用且简便的SUVmax和SUVmean,更多代谢参数尚待进一步研究。我们认为18F-FDG PET/CT代谢参数中原发肿瘤CV和淋巴结SUVmax与纵隔淋巴结转移密切相关,有助于筛选出适合行淋巴结穿刺的患者,但尚无前瞻性的研究结果支持此结论。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明 许颍负责研究过程的实施、数据的采集与统计、论文的撰写;李广利、张申负责命题的完善、数据的分析、论文的修订;蔡二锋、关永珍负责数据的采集与统计;黄成奇负责命题的提出、论文的审阅。
18F-FDG PET/CT代谢参数在预测非小细胞肺癌患者纵隔淋巴结转移中的临床价值
Clinical value of 18F-FDG PET/CT metabolic parameters in the prediction of mediastinal lymph node metastasis in patients with non-small cell lung cancer
-
摘要:
目的 探讨18F-氟脱氧葡萄糖(FDG) PET/CT代谢参数在预测非小细胞肺癌(NSCLC)患者纵隔淋巴结转移中的临床价值。 方法 回顾性分析2018年1月至2021年3月于安徽省阜阳市人民医院经组织病理学检查确诊为NSCLC的102例患者的临床资料,其中男性59例、女性43例,年龄33~90(66.0±11.2)岁。所有患者术前均行18F-FDG PET/CT显像,分析并计算代谢参数,变异系数(CV)为病灶最大标准化摄取值(SUVmax)的标准差(SD)与SUVmax的比值;LMV为淋巴结SUVmax与纵隔血池平均标准化摄取值(SUVmean)的比值;病灶葡萄糖酵解总量(TLG)为肿瘤代谢体积(MTV)与SUVmean的乘积。绘制受试者工作特征(ROC)曲线,确定预测淋巴结转移的最佳临界值,并计算灵敏度和特异度。计数资料采用χ2检验或Fisher确切概率法进行比较;连续性计量资料采用独立样本t检验进行比较。采用单因素及多因素Logistic回归分析筛选淋巴结转移的预测因素。 结果 单因素Logistic回归分析结果显示,当患者肺部原发肿瘤的长径>30.0 mm或淋巴结的短径>10.0 mm时易发生淋巴结转移(61.9%对38.1%、59.5%对40.5%,χ2=9.16、5.20,均P<0.05);转移组患者的原发肿瘤CV、淋巴结SUVmax和LMV均高于未转移组患者(46.7±6.1对29.4±6.0、5.9±1.9对2.8±1.6、2.2±0.6对1.4±0.3,t=13.81、8.60、3.97,均P<0.05)。多因素Logistic回归分析结果显示,淋巴结SUVmax[OR=2.2,95%可信区间(CI):1.30~3.80,P<0.05]和原发肿瘤CV(OR=1.5,95%CI:1.20~1.80,P<0.01)是影响淋巴结转移状态的独立危险因素。ROC曲线分析结果显示,原发肿瘤CV的曲线下面积(AUC)=0.97(SD=0.02,95%CI:0.94~0.99,P<0.01),当CV>30.5时,其诊断淋巴结转移的灵敏度为97.5%、特异度为41.7%;淋巴结SUVmax的AUC=0.91(SD=0.30,95%CI:0.85~0.97,P<0.01),当淋巴结SUVmax>3.1时,其诊断淋巴结转移的灵敏度和特异度分别为95.2%和23.3%。将2种危险因素进行联合诊断,得出的AUC=0.98(SD=0.01,95%CI:0.96~1.00,P<0.01)。 结论 18F-FDG PET/CT代谢参数中原发肿瘤CV和淋巴结SUVmax是预测NSCLC患者纵隔淋巴结转移状态的独立危险因素,可为患者诊疗方案的制定提供重要参考依据。 -
关键词:
- 氟脱氧葡萄糖F18 /
- 正电子发射断层显像术 /
- 体层摄影术,X线计算机 /
- 癌,非小细胞肺 /
- 淋巴转移 /
- 最大标准化摄取值
Abstract:Objective To explore the clinical value of 18F-fluorodeoxyglucose (FDG) PET/CT metabolic parameters in the prediction of mediastinal lymph node metastasis in patients with non-small cell lung cancer (NSCLC). Methods A total of 102 patients with NSCLC histopathologically confirmed from January 2018 to March 2021 in Fuyang People's Hospital were restrospectively analyzed in this study. The patients consisted of 59 males and 43 females aged 33–90 (66.0±11.2) years. All patients underwent 18F-FDG PET/CT imaging before operation to analyze and calculate the metabolic parameters. The coefficient of variation (CV) is the ratio of the standard deviation (SD) of the maximum standardized uptake value (SUVmax) to SUVmax of the lesion; LMV is the ratio of the SUVmax of the lymph node to the mean standardized uptake value (SUVmean) of the mediastinal blood pool; the total lesion glycolysis (TLG) is the product of metabolic tumor volume (MTV) and SUVmean. The receiver operator characteristic (ROC) curve was drawn to determine the optimal cut-off value for predicting lymph node metastasis and calculate the sensitivity and specificity. Enumeration data were evaluated using χ2 test or Fisher's exact probability method, and continuous measurement data were compared using independent-sample t test. Univariate and multivariate Logistic regression analysis were used in screening the predictors of lymph node metastasis. Results The univariate Logistic regression analysis results showed that when the long diameter of the lung primary tumor was over 30.0 mm or the short diameter of the lymph nodes was over 10.0 mm, lymph node metastasis was likely to occur (61.9% vs. 38.1%, 59.5% vs. 40.5%; χ2=9.16, 5.20; both P<0.05); the CV of the primary tumor and the SUVmax and LMV of lymph nodes of patients with lymph node metastasis were higher than those of patients without lymph node metastasis (46.7±6.1 vs. 29.4±6.0, 5.9±1.9 vs. 2.8±1.6, 2.2±0.6 vs. 1.4±0.3; t=13.81, 8.60, 3.97; all P<0.05). The multivariate Logistic regression analysis results suggested that the SUVmax of lymph nodes (OR=2.2, 95% confidence interval (CI): 1.30–3.80, P<0.05) and the CV of the primary tumor (OR=1.5, 95%CI: 1.20–1.80, P<0.01) were independent risk factors affecting the status of lymph node metastasis. The ROC curve analysis results showed that the area under the CV curve of the primary tumor was 0.97 (SD=0.02, 95%CI: 0.94–0.99, P<0.01). When CV>30.5, the sensitivity of diagnosis of lymph node metastasis was 97.5%, and the specificity was 41.7%. The area under the curve of lymph node SUVmax was 0.91 (SD=0.30, 95%CI: 0.85–0.97, P<0.01). When the lymph node SUVmax>3.1, the sensitivity and specificity of the diagnosis of lymph node metastasis were 95.2% and 23.3%, respectively. The combined diagnosis of the two risk factors resulted in an area under the curve of 0.98 (SD=0.01, 95%CI: 0.96–1.00, P<0.01). Conclusion Among the metabolic parameters of 18F-FDG PET/CT, the CV of the primary tumor and the SUVmax of lymph nodes are independent risk factors for predicting mediastinal lymph node metastasis in patients with NSCLC and can provide useful information for treatment. -
图 1 原发肿瘤CV、淋巴结SUVmax以及两者联合对102例非小细胞肺癌患者淋巴结转移的预测效能的受试者工作特征曲线
Figure 1. Receiver operator characteristic curve of the coefficient of variation of primary tumor, the maximum standardized uptake value of lymph nodes, and the combination of the two in predicting lymph node metastasis in 102 patients with non-small cell lung cancer
表 1 102例非小细胞肺癌患者淋巴结转移影响因素的单因 素Logistic回归分析结果
Table 1. Results of univariable Logistic regression analysis of factors for lymph node metastasis in 102 patients with non-small cell lung cancer
参数 转移组
(n=42)未转移组
(n=60)检验值 P值 年龄(岁) 66.6±12.3 65.0±15.1 t=0.82 0.37 性别[例 (%)] χ2=0.87 0.64 男 22(52.4) 37(61.7) 女 20(47.6) 23(38.3) 吸烟状态[例(%)] χ2=0.40 0.53 吸烟或既往吸烟 18(42.9) 22(36.7) 不吸烟 24(57.1) 38(63.3) 原发肿瘤的位置[例 (%)] χ2=1.48 0.22 右肺 23(54.8) 40(66.7) 左肺 19(45.2) 20(33.3) 肿瘤长径[例(%)] χ2=9.16 <0.01 ≤30.0 mm 16(38.1) 41(68.3) >30.0 mm 26(61.9) 19(31.7) MTV(cm3) 56.5±15.8 48.7±17.6 t=0.81 0.51 TLG(g) 242.0±55.3 168.5±46.7 t=0.84 0.36 原发肿瘤CV 46.7±6.1 29.4±6.0 t=13.81 <0.01 淋巴结短径[例(%)] χ2=5.20 0.02 >10.0 mm 25(59.5) 22(36.7) ≤10.0 mm 17(40.5) 38(63.3) 淋巴结SUVmax 5.9±1.9 2.8±1.6 t=8.60 <0.01 LMV 2.2±0.6 1.4±0.3 t=3.97 <0.01 血清癌胚抗原水平[例(%)] χ2=0.81 0.37 >5.0 ng/mL 22(52.4) 26(43.3) ≤5.0 ng/mL 20(47.6) 34(56.7) 血清D-二聚体水平[例(%)] χ2=0.13 0.72 >0.8 mg/L 16(38.1) 25(41.7) ≤0.8 mg/L 26(61.9) 35(58.3) 注:MTV为肿瘤代谢体积;TLG为病灶葡萄糖酵解总量;CV为变异系数;SUVmax为最大标准化摄取值;LMV为淋巴结SUVmax与纵隔血池平均标准化摄取值的比值 表 2 102例非小细胞肺癌患者淋巴结转移影响因素的多因 素Logistic回归分析结果
Table 2. Results of multivariable Logistic regression analysis of factors for lymph node metastasis in 102 patients with non- small cell lung cancer
因素 标准差 P值 OR 95%CI 淋巴结短径(>10.0 mm) 1.22 0.50 − − 肿瘤长径(>30.0 mm) 1.22 0.10 − − 淋巴结SUVmax 0.30 0.04 2.2 1.30~3.80 LMV 1.77 0.20 − − 原发肿瘤CV 0.10 <0.01 1.5 1.20~1.80 注:SUVmax为最大标准化摄取值;LMV为淋巴结SUVmax与纵隔血池平均标准化摄取值的比值;CV为变异系数;CI为可变区间。−表示无此项数据 -
[1] Siegel RL, Miller KD, Jemal A. Cancer statistics, 2020[J]. CA: Cancer J Clin, 2020, 70(1): 7−30. DOI: 10.3322/caac.21590. [2] 许莉, 李素平. 18F-FDG PET/CT代谢参数与非小细胞肺癌EGFR、ALK、KRAS突变的相关性研究进展[J]. 国际放射医学核医学杂志, 2020, 44(8): 515−521. DOI: 10.3760/cma.j.cn121381-201906035-00066.
Xu L, Li SP. Research progress on the correlation between 18F-FDG PET/CT metabolic parameters and mutations of EGFR, ALK and KRAS in non-small cell lung cancer[J]. Int J Radiat Med Nucl Med, 2020, 44(8): 515−521. DOI: 10.3760/cma.j.cn121381-201906035-00066.[3] Kandathil A, Kay FU, Butt YM, et al. Role of FDG PET/CT in the eighth edition of TNM staging of non-small cell lung cancer[J]. Radiographics, 2018, 38(7): 2134−2149. DOI: 10.1148/rg.2018180060. [4] 林小敏, 潘雪艳, 唐明灯. 18F-FDG PET/CT 显像在直肠癌术前分期中的价值及与临床病理特征关系的研究[J]. 国际放射医学核医学杂志, 2020, 44(10): 641−648. DOI: 10.3760/cma.j.cn121381-201909027-00089.
Lin XM, Pan XY, Tang MD. Preoperative staging of rectal cancer with 18F-FDG PET/CT and its relationship with clinicopathological features[J]. Int J Radiat Med Nucl Med, 2020, 44(10): 641−648. DOI: 10.3760/cma.j.cn121381-201909027-00089.[5] Sivrikoz CM, Ak I, Simsek FS, et al. Is mediastinoscopy still the gold standard to evaluate mediastinal lymph nodes in patients with non-small cell lung carcinoma?[J]. Thorac Cardiovasc Surg, 2012, 60(2): 116−121. DOI: 10.1055/s-0030-1271148. [6] Schmidt-Hansen M, Baldwin DR, Hasler E, et al. PET-CT for assessing mediastinal lymph node involvement in patients with suspected resectable non-small cell lung cancer[J/OL]. Cochrane Database Syst Rev, 2014, 2014(11): CD009519[2021-05-26]. https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD009519.pub2/full. DOI: 10.1002/14651858.CD009519.pub2. [7] Ohno Y, Fujisawa Y, Sugihara N, et al. Dynamic contrast-enhanced perfusion area-detector CT: preliminary comparison of diagnostic performance for N stage assessment with FDG PET/CT in non-small cell lung cancer[J]. AJR Am J Roentgenol, 2017, 209(5): W253−W262. DOI: 10.2214/AJR.17.17959. [8] Gao XL, Wang SS, Cao DB, et al. The role of plasma D-dimer levels for predicting lymph node and mediastinal lymph node involvement in non-small cell lung cancer[J]. Clin Respir J, 2018, 12(6): 2151−2156. DOI: 10.1111/crj.12786. [9] Rami-Porta R, Bolejack V, Crowley J, et al. The IASLC lung cancer staging project: proposals for the revisions of the T descriptors in the forthcoming eighth edition of the TNM classification for lung cancer[J]. J Thorac Oncol, 2015, 10(7): 990−1003. DOI: 10.1097/JTO.0000000000000559. [10] 中国临床肿瘤学会指南工作委员会. 中国临床肿瘤学会(CSCO)非小细胞肺癌诊疗指南-2020[M]. 北京: 人民卫生出版社, 2020.
Guidelines Working Committee of Chinese Society of Clinical Oncology. Guidelines of Chinese Society of Clinical Oncology (CSCO): non-small cell lung cancer-2020[M]. Beijing: People's Medical Publishing House, 2020.[11] Pahk K, Chung JH, Yi E, et al. Metabolic tumor heterogeneity analysis by F-18 FDG PET/CT predicts mediastinal lymph node metastasis in non-small cell lung cancer patients with clinically suspected N2[J]. Eur J Radiol, 2018, 106: 145−149. DOI: 10.1016/j.ejrad.2018.07.028. [12] Budiawan H, Cheon GJ, Im HJ, et al. Heterogeneity analysis of 18F-FDG uptake in differentiating between metastatic and inflammatory lymph nodes in adenocarcinoma of the lung: comparison with other parameters and its application in a clinical setting[J]. Nucl Med Mol Imaging, 2013, 47(4): 232−241. DOI: 10.1007/s13139-013-0216-6. [13] Fortuny MS, Gallego M, Berna L, et al. FDG-PET parameters predicting mediastinal malignancy in lung cancer[J/OL]. BMC Pulm Med, 2016, 16: 177[2021-05-26]. https://link.springer.com/article/10.1186/s12890-016-0338-6. DOI: 10.1186/s12890-016-0338-6. [14] Park SY, Yoon JK, Park KJ, et al. Prediction of occult lymph node metastasis using volume-based PET parameters in small-sized peripheral non-small cell lung cancer[J]. Cancer Imaging, 2015, 15: 21. DOI: 10.1186/s40644-015-0058-9. [15] Moloney F, Ryan D, McCarthy L, et al. Increasing the accuracy of 18F-FDG PET/CT interpretation of "mildly positive" mediastinal nodes in the staging of non-small cell lung cancer[J]. Eur J Radiol, 2014, 83(5): 843−847. DOI: 10.1016/j.ejrad.2014.01.016. [16] Shinya T, Rai K, Okumura Y, et al. Dual-time-point F-18 FDG PET/CT for evaluation of intrathoracic lymph nodes in patients with non-small cell lung cancer[J]. Clin Nucl Med, 2009, 34(4): 216−221. DOI: 10.1097/RLU.0b013e31819a1f3d. [17] Simsek FS, Comak A, Asik M, et al. Is FDG-PET/CT used correctly in the combined approach for nodal staging in NSCLC patients?[J/OL]. Niger J Clin Pract, 2020, 23(6): 842−847[2021-05-26]. https://www.njcponline.com/article.asp?issn=1119-3077;year=2020;volume=23;issue=6;spage=842;epage=847;aulast=Simsek. DOI: 10.4103/njcp.njcp_2_19. -





 下载:
下载: