-
弥漫性大B细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)是非霍奇金淋巴瘤最常见的类型之一,近年来,利妥昔单抗的使用在一定程度上改善了患者的预后。但是,由于DLBCL具有较高的异质性,部分患者预后较差,目前仍有30%~40%的患者在治疗过程中出现疾病进展或复发[1]。18F-FDG PET/CT 具有分子影像和解剖结构显像的双重优势,广泛应用于淋巴瘤的诊断、分期、疗效监测和预后评估。已有不少研究结果证实,PET/CT Deauville评分对化疗中期DLBCL患者的生存有预测价值[2-4]。 PET/CT代谢参数中, SUVmax、全身所有病灶总的代谢肿瘤体积(total metabolic tumor volume, TMTV)、总的糖酵解总量(total of total lesion glycolysis, TTLG)对DLBCL患者预后的预测价值一直是研究的热点,但是,对于化疗中期的评估结果仍存在争议[5]。本研究通过分析18F-FDG PET/CT 参数及临床相关因素与化疗中期DLBCL患者无进展生存(progress-free survival, PFS)期和总生存(overall survival, OS)期的关系,探讨临床因素和18F-FDG PET/CT代谢参数及解剖测量参数对DLBCL患者预后判断的价值。
-
回顾性分析2011年1月至2020年1月于河北医科大学第四医院经组织病理学检查确诊的112例DLBCL患者的临床资料和影像学资料,其中男性60例、女性52例,年龄16~79(49.5±16.6)岁。所有患者均进行了3~4个周期化疗,其中采用利妥昔单抗+环磷酰胺+多柔比星+长春新碱+泼尼松(R-CHOP)方案治疗29例、利妥昔单抗+依托泊苷+强的松+长春新碱+环磷酰胺+表柔霉素(R-EPOCH)方案治疗22例、利妥昔单抗+环磷酰胺+脂质体阿霉素+长春新碱+强的松(R-CDOP)方案治疗40例、其他方案治疗21例。纳入标准:(1)经组织病理学检查确诊为DLBCL;(2)经3~4周期化疗后(中期)行18F-FDG PET/CT检查;(3)临床数据和影像学资料完整。排除标准:(1)转化型DLBCL或组织病理学不能分型者;(2)伴有其他恶性肿瘤或严重慢性疾病;(3)中期PET/CT检查前行手术切除病灶者。
所有患者均签署了知情同意书。本研究已获得河北医科大学第四医院伦理委员会的批准(批准号:2022KY228)。
-
应用荷兰Philips 公司GEMINI GXL16 PET/CT显像仪,18F-FDG由河北安迪科正电子技术有限公司提供,放射化学纯度>95%。患者检查前禁食禁水6 h以上,测量身高(cm)、体重(kg),空腹血糖水平控制在8 mmol/l以下。按体重经静脉注射18F-FDG,剂量为3.70~5.55 MBq/kg(0.10~0.15 mCi/kg)。患者安静休息60 min后,排空膀胱上机检查。扫描期间患者取仰卧位,双臂上举,扫描范围自颅底至双侧股骨上段。先进行螺旋CT扫描,采集条件:管电流160 mA、管电压120 kV、矩阵512×512、螺距0.813、层厚5 mm、球管单圈旋转时间0.5 s;CT图像采用标准重建法,重建层厚为5 mm。PET采集条件: 三维模式采集,共采集8~10个床位, 2.5 min/床位。应用CT数据进行衰减校正,校正后的PET图像与CT图像融合,最终得到横断面、矢状面和冠状面的PET、CT及PET/CT融合图像。PET图像处理应用荷兰Philips公司的Extended Brilliance TM workspace软件以及Medex工作站,并将图像导入LEFX软件进行代谢参数的相关测量。
-
由3位具有5年以上工作经验的核医学科医师进行图像处理分析。先经最大密度投影图(MIP)初步判断显像剂在全身的分布情况,然后从横断面、冠状面和矢状面观察病灶位置、形态、大小及代谢情况。以SUVmax的40%(40%SUVmax)为阈值勾画ROI,获得病灶的SUVmax、TMTV和TTLG;在CT图像上测量6个靶病灶最大垂直径乘积之和(sum of products of greatest diameters, SPD)。依据Deauville评分[6]:病灶18F-FDG摄取不超过背景放射性分布为1分;残留病灶18F-FDG摄取≤纵隔血池摄取为2分;纵隔血池残留病灶18F-FDG摄取≤肝血池摄取为3分;任何部位病灶18F-FDG摄取相对于肝血池摄取有轻度或中度增高为4分;任何部位的残留病灶18F-FDG摄取相对于肝血池摄取有显著增高(SUVmax>2倍肝血池摄取或出现新发病灶)为5分;新发病灶有18F-FDG摄取,但与淋巴瘤无关的记为X。1~3分为PET/CT阴性(阴性组),4~5分及X为PET/CT阳性(阳性组)。
-
随访起始时间为患者第一次行PET/CT显像日期,截止时间为2020年12月31日。以PFS期和OS期为研究终点。PFS期定义为从疾病确诊日期到出现疾病进展、复发、疾病相关死亡或至随访截止日期。OS期定义为从疾病确诊日期至患者死亡或随访截止日期。通过面谈、电话以及查阅患者在本院诊治信息等方式进行随访,随访内容主要包括患者的症状、体征、影像学检查、实验室检查以及组织病理学检查、免疫学检查等。
-
应用IBM SPSS Statistics 21软件进行统计学分析。将所有连续变量均转化为二分类变量。以出现疾病进展和死亡为阳性事件,根据ROC曲线计算PET/CT代谢参数和解剖测量参数SUVmax、TMTV、TTLG和SPD预测预后的最佳临界值,AUC>0.5且P<0.05的参数对患者预后有意义。采用Kaplan-Meier法对患者的PFS期和OS期进行生存分析。单因素分析采用Log-rank检验;多因素分析采用Cox比例风险模型。P<0.05为差异有统计学意义。
-
112例DLBCL患者中,Ⅰ期和Ⅱ期50例,Ⅲ期和Ⅳ期62例;乳酸脱氧酶(lactate dehydrogenase,LDH)水平升高者55例,LDH水平正常者57例。其他临床特征见表1。患者无失访,中位随访时间为36(6~93)个月。112例DLBCL患者中,25例(22.3%)出现疾病进展、14例(12.5%)死亡。
临床因素 例数 死亡数 疾病进展数 Kaplan-Meier分析 中位PFS期(个月) χ2值 P值 中位OS期(个月) χ2值 P值 年龄 5.152 0.023 4.735 0.030 ≥60岁 39 8 13 25.0 29.0 <60岁 73 6 12 29.0 35.0 LDH水平 2.223 0.136 4.154 0.042 升高 55 10 15 27.0 29.0 正常 57 4 10 31.0 32.0 ECOG评分 17.810 <0.001 11.414 0.001 ≥2 32 9 15 27.5 30.5 <2 80 5 10 29.0 31.5 分期 6.136 0.105 6.824 0.078 Ⅰ 19 1 3 29.0 31.0 Ⅱ 31 1 3 32.0 33.0 Ⅲ 19 2 5 29.0 30.0 Ⅳ 43 10 14 25.0 26.0 IPI评分 13.298 0.004 17.473 0.001 低危 47 2 5 29.0 31.0 低中危 19 0 3 40.0 43.0 高中危 29 6 9 22.0 25.0 高危 17 6 8 24.0 33.0 NCCN-IPI评分 22.998 <0.001 19.687 <0.001 低危 27 1 3 29.0 29.0 低中危 48 2 6 32.5 35.0 高中危 30 8 11 23.0 24.0 高危 7 3 5 15.0 24.0 化疗方案 2.312 0.774 1.753 0.839 R-CDOP 40 6 11 21.0 26.5 R-CHOP 29 3 5 36.0 36.0 R-EPOCH 22 1 2 28.5 28.5 其他 21 4 7 35.0 41.0 注:DLBCL为弥漫性大B细胞淋巴瘤;PFS为无进展生存;OS为总生存;LDH为乳酸脱氢酶;ECOG为美国东部肿瘤协作组; IPI 为国际预后指数;NCCN-IPI为美国国家综合癌症网络-国际预后指数;R-CDOP为利妥昔单抗+环磷酰胺+脂质体阿霉素+长春新碱+强的松;R-CHOP为利妥昔单抗+环磷酰胺+多柔比星+长春新碱+泼尼松;R-EPOCH为利妥昔单抗+依托泊苷+强的松+长春新碱+环磷酰胺+表柔霉素 表 1 112例化疗中期DLBCL患者PFS期和OS期的临床特征分析
Table 1. Analysis of clinical characteristics of progress-free survival and overall survival in 112 patients with diffuse large B-cell lymphoma in the middle stage of chemotherapy
-
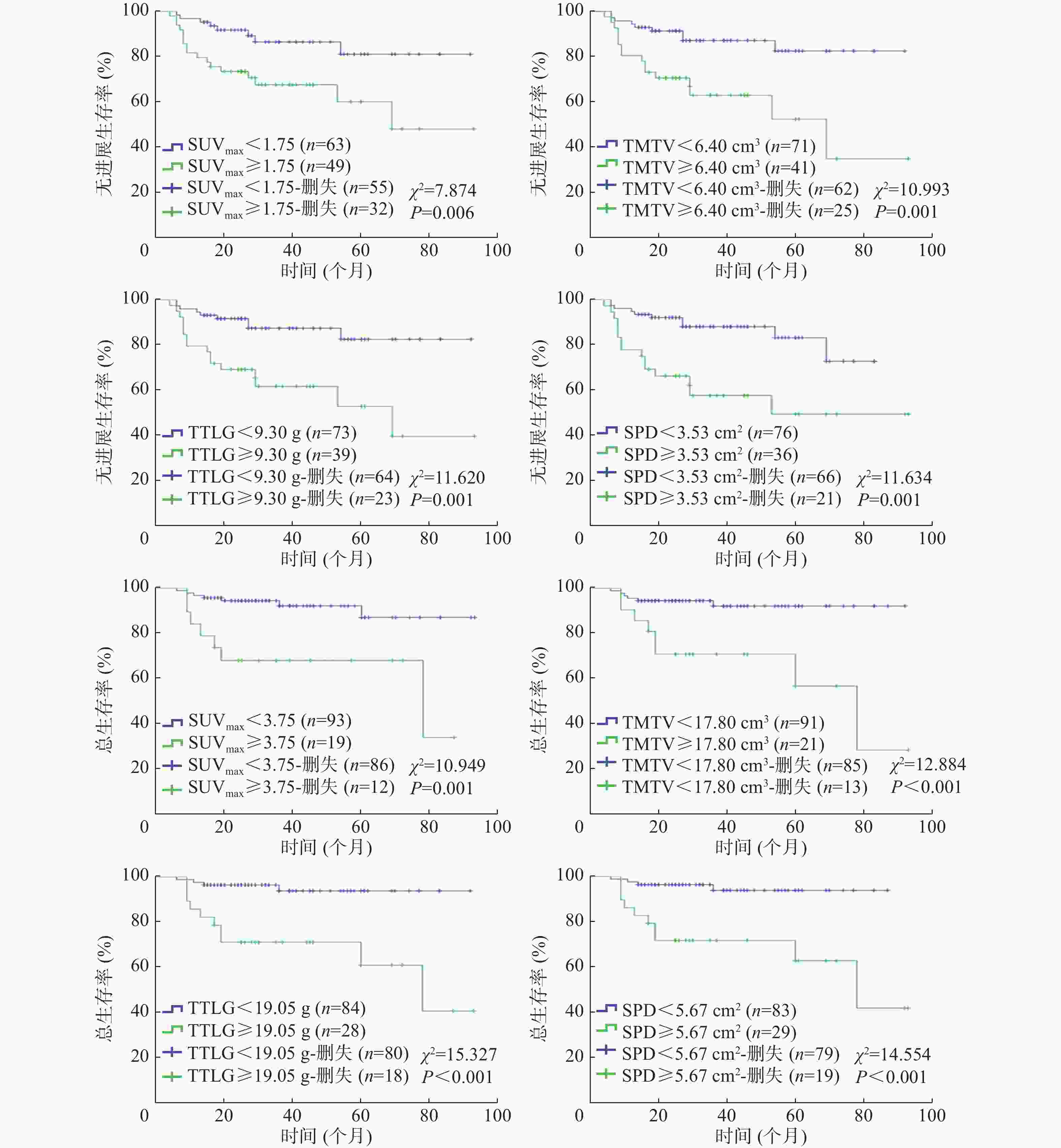
由表2可知,18F-FDG PET/CT参数SUVmax、TMTV、TTLG、SPD预测DLBCL患者PFS期的最佳界值分别为1.75、6.40 cm3、9.30 g和3.53 cm2,AUC分别为0.712、0.652、0.680、0.728(95%CI:0.596~0.829、0.518~0.787、0.549~0.811、0.619~0.837,均P<0.05)。由表3可知,18F-FDG PET/CT参数SUVmax、TMTV、TTLG、SPD预测OS期的最佳临界值分别为3.75、17.80 cm3、19.05 g和5.67 cm2,AUC分别为0.727、0.686、0.727、0.757(95%CI:0.578~0.877、0.512~0.861、0.559~0.896、0.622~0.891,均P<0.05)。
参数 临界值 灵敏度(%) 特异度(%) AUC(95%CI) P值 SUVmax 1.75 68.0 63.2 0.712(0.596~0.829) 0.001 TMTV(cm3) 6.40 64.0 71.3 0.652(0.518~0.787) 0.021 TTLG(g) 9.30 64.0 73.6 0.680(0.549~0.811) 0.006 SPD(cm2) 3.53 64.0 75.9 0.728(0.619~0.837) 0.001 注:FDG为氟脱氧葡萄糖;PET为正电子发射断层显像术;CT为计算机体层摄影术;DLBCL为弥漫性大B细胞淋巴瘤;PFS为无进展生存;AUC为曲线下面积;CI为置信区间;SUVmax为最大标准化摄取值;TMTV为总的代谢肿瘤体积;TTLG为总的糖酵解总量;SPD为最大垂直径乘积之和 表 2 18F-FDG PET/CT参数预测112例化疗中期DLBCL患者PFS期的临界值
Table 2. Cut-off values of 18F-FDG PET/CT parameters for predicting progress-free survival in 112 patients with diffuse large B-cell lymphoma in the middle stage of chemotherapy
参数 临界值 灵敏度(%) 特异度 (%) AUC(95%CI) P值 SUVmax 3.75 50.0 87.8 0.727(0.578~0.877) 0.006 TMTV(cm3) 17.80 57.1 86.7 0.686(0.512~0.861) 0.025 TTLG(g) 19.05 71.4 81.6 0.727(0.559~0.896) 0.006 SPD(cm2) 5.67 71.4 80.6 0.757(0.622~0.891) 0.002 注: FDG为氟脱氧葡萄糖;PET为正电子发射断层显像术;CT为计算机体层摄影术;DLBCL为弥漫性大B细胞淋巴瘤;OS为总生存;AUC为曲线下面积;CI为置信区间;SUVmax为最大标准化摄取值;TMTV为总的代谢肿瘤体积;TTLG为总的糖酵解总量;SPD为最大垂直径乘积之和 表 3 18F-FDG PET/CT参数预测112例化疗中期DLBCL患者OS期的临界值
Table 3. Cut-off values of 18F-FDG PET/CT parameters for predicting overall survival in 112 patients with diffuse large B-cell lymphoma in the middle stage of chemotherapy
-
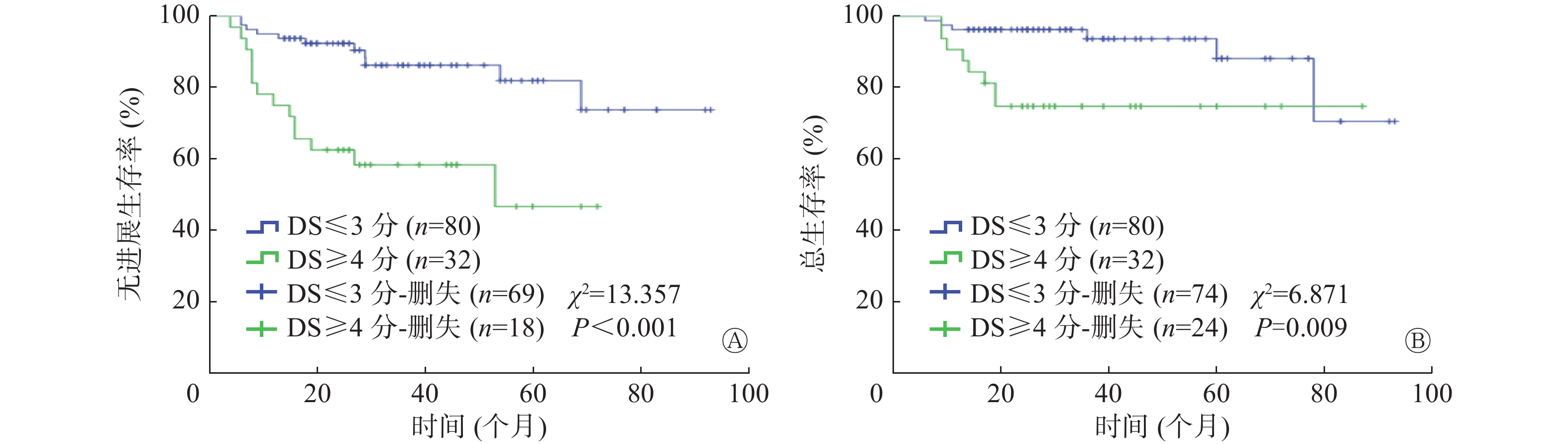
Deauville评分结果显示,112例DLBCL患者中,4~5分阳性组32例,1~3分阴性组80例(其中1分63例、2分7例、3分10例),评分X的患者0例。如图1所示,以PFS期为研究终点,阳性组患者的PFS期与阴性组患者PFS期比较,差异有统计学意义(P<0.001);以OS期为研究终点,2组OS期的差异有统计学意义(P=0.009)。
图 1 18F-FDG PET/CT Deauville评分对112例化疗中期DLBCL患者PFS期和OS期预后分析的Kaplan-Meier生存曲线
Figure 1. Kaplan-Meier survival curves of prognosis of progress-free survival (A) and overall survival (B) in 112 patients with diffuse large B-cell lymphoma in the middle stage of chemotherapy using Deauville criteria for 18F-FDG PET/CT
-
单因素分析结果显示,年龄、美国东部肿瘤协作组(Eastern Cooperative Oncology Group, ECOG)评分、国际预后指数(International Prognostic Index,IPI)评分、美国国家综合癌症网络-国际预后指数(NCCN-IPI)评分是DLBCL患者PFS期和OS期的预后影响因素(均P<0.05);LDH水平是OS期的预后影响因素(P=0.042),但不是PFS期的预后影响因素(P=0.136) (表1)。
-
将18F-FDG PET/CT代谢参数SUVmax、TMTV、TTLG和解剖测量参数SPD纳入单因素生存分析,结果显示,4个参数均是DLBCL患者PFS期和OS期的预后影响因素(均 P<0.01,图2)。
-
将单因素分析中对DLBCL患者预后有统计学意义的临床因素和化疗中期 18F-FDG PET/CT参数进行多因素分析,结果显示:年龄、ECOG评分、TTLG是影响DLBCL患者PFS期的独立危险因素(均P<0.01,表4) ;SPD、LDH水平是影响DLBCL患者OS期的独立危险因素(均P<0.05,表5)。
因素 β值 Wald值 HR值 95%CI P值 年龄 −1.107 6.952 0.331 0.145~0.753 0.008 ECOG评分 −1.339 9.827 0.262 0.113~0.605 0.002 Deauville评分 −0.537 0.980 0.585 0.202~1.693 0.322 IPI评分 −0.418 0.147 0.658 0.078~5.566 0.701 NCCN-IPI评分 −0.183 0.074 1.200 0.321~4.489 0.786 SUVmax −0.342 0.280 0.711 0.201~2.517 0.596 TMTV −0.462 0.104 0.630 0.038~10.482 0.747 TTLG −1.269 8.320 0.281 0.119~0.666 0.004 SPD 0.062 0.007 1.064 0.256~4.422 0.932 注:DLBCL为弥漫性大B细胞淋巴瘤;PFS为无进展生存;CI 为置信区间;ECOG为美国东部肿瘤协作组;IPI为国际预后指数;NCCN-IPI为美国国家综合癌症网络-国际预后指数; SUVmax为最大标准化摄取值;TMTV为总的代谢肿瘤体积;TTLG为总的糖酵解总量;SPD为最大垂直径乘积之和 表 4 影响112例化疗中期DLBCL患者PFS期的多因素分析
Table 4. Multivariate analysis of progression-free survival of 112 patients with diffuse large B-cell lymphoma in the middle stage of chemotherapy
因素 β值 Wald值 HR值 95%CI P值 年龄 −0.237 0.795 0.789 0.469~1.328 0.372 ECOG评分 −0.364 1.580 0.695 0.394~1.226 0.209 Deauville评分 −0.312 0.918 0.732 0.387~1.385 0.338 IPI评分 −0.033 0.007 0.967 0.437~2.138 0.094 NCCN-IPI评分 −0.015 0.001 0.985 0.310~3.129 0.980 SUVmax 0.427 1.565 1.532 0.785~2.990 0.211 TMTV −0.748 1.386 0.437 0.136~1.644 0.239 TTLG 0.502 1.336 1.652 0.705~3.872 0.248 SPD 0.654 5.686 1.992 1.123~3.290 0.017 LDH水平 −0.521 4.174 0.594 0.360~0.979 0.041 注:DLBCL为弥漫性大B细胞淋巴瘤;OS为总生存;CI为置信区间;ECOG为美国东部肿瘤协作组;IPI为国际预后指数;NCCN-IPI为美国国家综合癌症网络-国际预后指数; SUVmax为最大标准化摄取值;TMTV为总的代谢肿瘤体积;TTLG为总的糖酵解总量;SPD为最大垂直径乘积之和;LDH为乳酸脱氢酶 表 5 影响112例化疗中期DLBCL患者OS期的多因素分析
Table 5. Multivariate analysis of overall survival of 112 patients with diffuse large B-cell lymphoma in the middle stage of chemotherapy
-
DLBCL是非霍奇金淋巴瘤最常见的类型之一,具有较高的异质性和较强的侵袭性,不同生物学特征对化疗反应的敏感性不同,部分化疗中期PET/CT显像结果阳性的患者出现疾病进展或死亡,故需要结合临床、影像学、组织病理学特征及分子生物学特征等相关预后因素,对患者进行准确的危险分层和预后评估,帮助改善患者预后。目前,Deauville评分和化疗中期PET/CT多个代谢参数常被用于DLBCL的预后评估[7-9]。Yim等[7]的研究结果显示,Deauville评分为5分的患者较1~4分的患者预后差,以Deauville评分4分为临界值,可以提高对患者的危险分层。本研究中,Deauville评分阳性组中位PFS期和OS期均低于阴性组。Zucca等[9]研究基线和化疗中期PET/CT代谢参数与DLBCL患者预后的关系,结果显示,化疗中期PET/CT参数SUVmax、代谢肿瘤体积(metabolic tumor volume, MTV)和糖酵解总量高临界值组患者预后较差;多因素分析结果显示,ΔSUVmax和基线MTV为独立预后因素。Islam等[10]评估化疗中期和治疗后PET/CT代谢参数与DLBCL患者预后的关系,Kaplan-Meier生存分析结果显示,全身所有病灶的TMTV和TTLG均与患者的PFS期密切相关;研究结果还表明,化疗中期PET/CT代谢参数MTV对治疗后MTV有一定的预测价值。本研究单因素分析结果显示, SUVmax、TMTV、 TTLG、SPD对 DLBCL 患者 PFS期和 OS 期均具有很好的预测价值,以最佳临界值为界,高 SUVmax、TMTV、 TTLG 、SPD组患者的预后较差。有研究结果表明,治疗前18F-FDG PET/CT代谢参数糖酵解总量是影响Ⅱ~Ⅲ期DLBCL患者PFS期和OS期的独立预后因素[11]。本研究多因素分析结果显示,年龄、ECOG评分、TTLG是影响DLBCL患者PFS期的独立危险因素,LDH水平和SPD是影响OS期的独立危险因素。本研究中不同化疗方案的DLBCL患者预后差异无统计学意义,分析原因在于:(1)纳入研究的病例多数都采用了联合化疗方案,缺乏单纯环磷酰胺+脂质体阿霉素+长春新碱+强的松(CHOP)方案与利妥昔单抗+环磷酰胺+脂质体阿霉素+长春新碱+强的松(R-CHOP)等方案之间的对比;(2)不同方案组的样本量较少;(3)本研究局限于化疗3~4周期的中期患者的PET/CT,未研究化疗1~2周期和5~8周期的患者,可能导致患者之间的疗效差异较小。
Yim等[7]将化疗3周期后DLBCL患者的中期PET/CT Deauville评分与基线IPI评分结合,将患者分为3组:低风险组(Deauville评分1~3分和低/中低IPI评分)、中风险组(Deauville评分1~3分和高/中高IPI评分或Deauville评分4~5分和低/中低IPI评分)和高风险组(Deauville评分4~5分和高/中高IPI评分),结果显示,低风险组、中风险组、高风险组的5年PFS率分别为84.5%、58.7%、14.3%,这些结果提示结合化疗中期PET/CT中的Deauville评分和IPI评分进行早期风险分层可以预测DLBCL患者的疾病进展或死亡风险。我们单独分析了各因素对DLBCL患者预后的判断价值,并未将不同因素两两结合研究对患者危险分层的判断价值,且纳入研究的PET/CT参数较为局限,SUV峰值(SUVpeak)、病灶代谢率随时间变化率等与DLBCL患者预后的关系将成为今后研究的重点。本研究为回顾性、小样本研究,随访时间较短,导致某些参数的高于最佳临界值组患者的PFS期或OS期与低于最佳临界值组患者的PFS期和OS期的差值较小,但差异均有统计学意义。本研究中,我们仅分析了PET/CT代谢参数对化疗中期DLBCL患者预后的影响,未能分析治疗前后各参数的变化率与预后的关系,且未能对不同化疗周期(3周期或4周期)患者进一步分组,经过不同治疗周期的患者,化疗中期PET/CT影像学表现不同,这可能是本研究中部分PET/CT代谢参数预测患者预后灵敏度和特异度较低的原因。新的预后因素如分子生物学特征、B细胞淋巴瘤2(BCL-2)基因、B细胞淋巴瘤6(BCL-6)基因、细胞增殖核抗原Ki-67表达和C-MYC基因重排、免疫治疗相关的预后程序性死亡受体-1(PD-1)、程序性死亡配体-1(PD-L1)以及肿瘤微环境等与PET/CT参数结合对DLBCL患者预后的影响越来越成为研究的热点。国外研究者认为,趋化因子受体4(CXCR4)表达是DLBCL患者预后不良的标志[12]。也有研究者发现,循环肿瘤DNA水平与IPI评分和TMTV呈高度相关,此外,预处理循环肿瘤DNA是DLBCL患者的独立预后因素[13]。
综上所述,化疗中期DLBCL患者的18F-FDG PET/CT代谢参数SUVmax、TMTV、TTLG和解剖测量参数SPD对其预后具有一定的预测价值,年龄、ECOG评分、TTLG是影响DLBCL患者PFS期的独立危险因素;SPD、LDH水平是影响DLBCL患者OS期的独立危险因素。
利益冲突 所有作者声明无利益冲突
作者贡献声明 刘文静负责研究命题的提出与设计、数据的收集、统计与分析、病例的随访、论文的撰写与修改;赵新明负责研究命题的提出与设计、论文的审阅与最终版本的修订;吴冯春负责数据的收集、统计与分析、论文的修订
18F-FDG PET/CT对化疗中期弥漫性大B细胞淋巴瘤患者预后判断的价值
The value of 18F-FDG PET/CT in predicting the prognosis of patients with diffuse large B-cell lymphoma in the middle stage of chemotherapy
-
摘要:
目的 探讨18F-氟脱氧葡萄糖(FDG)PET/CT参数对化疗中期弥漫性大B细胞淋巴瘤(DLBCL)患者预后判断的价值。 方法 回顾性分析2011年1月至2020年1月河北医科大学第四医院112例DLBCL患者的临床资料和化疗3~4周期后(中期)18F-FDG PET/CT显像资料,其中男性60例、女性52例,年龄16~79(49.5±16.6)岁。以最大标准化摄取值(SUVmax)的40%为阈值勾画感兴趣区(ROI),获得病灶的SUVmax、全身所有病灶总的代谢肿瘤体积(TMTV)、总的糖酵解总量(TTLG),在CT图像上测量6个靶病灶的最大垂直径乘积之和(SPD)。采用受试者工作特性(ROC)曲线计算各代谢参数和解剖测量参数预测患者无进展生存(PFS)期和总生存(OS)期的最佳临界值。采用Kaplan-Meier法进行生存分析,采用Log-rank检验进行单因素分析,采用Cox比例风险回归模型对单因素分析有统计学意义的预后影响因素进行多因素分析。 结果 112例DLBCL患者中,在随访期间25例(22.3%)出现疾病进展、14例(12.5%)死亡。18F-FDG PET/CT 参数SUVmax、TMTV、TTLG和SPD预测DLBCL患者PFS期的最佳临界值分别为1.75、6.40 cm3、9.30 g和3.53 cm2,曲线下面积(AUC)分别为0.712、0.652、0.680、0.728(95%CI:0.596~0.829、0.518~0.787、0.549~0.811、0.619~0.837,均P<0.05);预测OS期的最佳临界值分别为3.75、17.80 cm3、19.05 g和5.67 cm2,AUC分别为0.727、0.686、0.727、0.757(95%CI:0.578~0.877、0.512~0.861、0.559~0.896、0.622~0.891,均P<0.05)。单因素分析结果显示,年龄、美国东部肿瘤协作组(ECOG)评分、国际预后指数评分、美国国家综合癌症网络-国际预后指数评分、Deauville评分以及SUVmax、TMTV、TTLG、SPD均是DLBCL患者PFS期(χ2=5.152~22.998,均P<0.05)和OS期的影响因素(χ2=4.735~19.687,均P<0.05);乳酸脱氢酶(LDH)水平是OS期的影响因素(χ2=4.154,P<0.05),但不是PFS期的影响因素(χ2=2.223,P>0.05)。多因素分析结果显示,年龄、ECOG评分、TTLG是影响DLBCL患者PFS期的独立危险因素(HR=0.331、0.262、0.281,95%CI:0.145~0.753、0.113~0.605、0.119~0.666,均P<0.01);LDH水平、SPD是影响DLBCL患者OS期的独立危险因素(HR=0.594、1.922,95%CI:0.360~0.979、1.123~3.290,均P<0.05)。 结论 18F-FDG PET/CT参数 SUVmax、TMTV、TTLG、SPD对化疗中期DLBCL患者预后有较好的判断价值。 -
关键词:
- 淋巴瘤,大B细胞,弥漫性 /
- 正电子发射断层显像术 /
- 体层摄影术,X线计算机 /
- 氟脱氧葡萄糖F18 /
- 药物疗法 /
- 预后
Abstract:Objective To investigate the prognostic value of 18F-fluorodeoxyglucose (FDG) PET/CT parameters in patients with diffuse large B-cell lymphoma (DLBCL) in their middle stage of chemotherapy. Methods Clinical data and PET/CT imaging data of 112 DLBCL patients in the Fourth Hospital of Hebei Medical University from January 2011 to January 2020 after 3–4 cycles of chemotherapy were retrospectively analyzed, patients included 60 males and 52 females aged 16–79 (49.5±16.6) years. Then, 40% of the maximum standardized uptake value (SUVmax) was taken as the threshold to outline the region of interest (ROI) and subsequently obtain the SUVmax of lesion, total metabolic tumor volume (TMTV), and total of total lesion glycolysis (TTLG) of all lesions in the body. The sum of products of greatest diameter (SPD) of six target lesions were measured on a CT image. The optimal cut-off values of predicting the progress-free survival (PFS) and overall survival (OS) of the metabolic parameters and anatomical measurement parameters were calculated using the receiver operating characteristic (ROC) curve. The Log-rank test was used for univariate analysis. Kaplan-Meier method was used for the survival analysis. Cox proportional hazards regression model was used for the multivariate analysis of statistically significant prognostic factors obtained from the univariate analysis. Results Among 112 patients, 25 (22.3%) disease developed DLBCL and 14 (12.5%) died from DLBCL during the follow-up period. The optimal cut-off values of the 18F-FDG PET/CT parameters for SUVmax, TMTV, TTLG, and SPD for predicting the PFS of patients with DLBCL were 1.75, 6.40 cm3, 9.30 g, and 3.53 cm2, respectively, with corresponding area under curve (AUC) of 0.712, 0.652, 0.680 and 0.728 (95% CI: 0.596–0.829, 0.518–0.787, 0.549–0.811 and 0.619–0.837; all P<0.05). Meanwhile, the optimal cut-off values for predicting OS were 3.75, 17.80 cm3, 19.05 g, and 5.67 cm2, respectively, with corresponding AUC of 0.727, 0.686, 0.727 and 0.757 (95% CI: 0.578–0.877, 0.512–0.861, 0.559–0.896 and 0.622–0.891; all P<0.05). The results of univariate analysis indicate that age, Eastern Cooperative Oncology Group (ECOG) score, International Prognostic Index (IPI) score, National Comprehensive Cancer Network-IPI score, Deauville score, SUVmax, TMTV, TTLG, and SPD were the influencing factors of PFS (χ2=5.152–22.998, all P<0.05) and OS (χ2=4.735–19.687, all P<0.05). Meanwhile, lactate dehydrogenase (LDH) level only influences OS (χ2=4.154, P<0.05) but not PFS (χ2=2.223, P>0.05). Then, the results of multivariate analysis indicate that age, ECOG score, and TTLG were the independent risk factors affecting the PFS of patients with DLBCL (HR=0.331, 0.262, and 0.281; 95% CI: 0.145–0.753, 0.113–0.605 and 0.119–0.666; all P<0.01), whereas LDH level and SPD were the independent risk factors affecting the OS patients with DLBCL (HR=0.594, 1.922; 95% CI: 0.360–0.979 and 1.123–3.290; all P<0.05). Conclusions The 18F-FDG PET/CT parameters of SUVmax, TMTV, TTLG, and SPD have a good prognostic value for DLBCL patients in their middle stage of chemotherapy. -
图 1 18F-FDG PET/CT Deauville评分对112例化疗中期DLBCL患者PFS期和OS期预后分析的Kaplan-Meier生存曲线
Figure 1. Kaplan-Meier survival curves of prognosis of progress-free survival (A) and overall survival (B) in 112 patients with diffuse large B-cell lymphoma in the middle stage of chemotherapy using Deauville criteria for 18F-FDG PET/CT
表 1 112例化疗中期DLBCL患者PFS期和OS期的临床特征分析
Table 1. Analysis of clinical characteristics of progress-free survival and overall survival in 112 patients with diffuse large B-cell lymphoma in the middle stage of chemotherapy
临床因素 例数 死亡数 疾病进展数 Kaplan-Meier分析 中位PFS期(个月) χ2值 P值 中位OS期(个月) χ2值 P值 年龄 5.152 0.023 4.735 0.030 ≥60岁 39 8 13 25.0 29.0 <60岁 73 6 12 29.0 35.0 LDH水平 2.223 0.136 4.154 0.042 升高 55 10 15 27.0 29.0 正常 57 4 10 31.0 32.0 ECOG评分 17.810 <0.001 11.414 0.001 ≥2 32 9 15 27.5 30.5 <2 80 5 10 29.0 31.5 分期 6.136 0.105 6.824 0.078 Ⅰ 19 1 3 29.0 31.0 Ⅱ 31 1 3 32.0 33.0 Ⅲ 19 2 5 29.0 30.0 Ⅳ 43 10 14 25.0 26.0 IPI评分 13.298 0.004 17.473 0.001 低危 47 2 5 29.0 31.0 低中危 19 0 3 40.0 43.0 高中危 29 6 9 22.0 25.0 高危 17 6 8 24.0 33.0 NCCN-IPI评分 22.998 <0.001 19.687 <0.001 低危 27 1 3 29.0 29.0 低中危 48 2 6 32.5 35.0 高中危 30 8 11 23.0 24.0 高危 7 3 5 15.0 24.0 化疗方案 2.312 0.774 1.753 0.839 R-CDOP 40 6 11 21.0 26.5 R-CHOP 29 3 5 36.0 36.0 R-EPOCH 22 1 2 28.5 28.5 其他 21 4 7 35.0 41.0 注:DLBCL为弥漫性大B细胞淋巴瘤;PFS为无进展生存;OS为总生存;LDH为乳酸脱氢酶;ECOG为美国东部肿瘤协作组; IPI 为国际预后指数;NCCN-IPI为美国国家综合癌症网络-国际预后指数;R-CDOP为利妥昔单抗+环磷酰胺+脂质体阿霉素+长春新碱+强的松;R-CHOP为利妥昔单抗+环磷酰胺+多柔比星+长春新碱+泼尼松;R-EPOCH为利妥昔单抗+依托泊苷+强的松+长春新碱+环磷酰胺+表柔霉素 表 2 18F-FDG PET/CT参数预测112例化疗中期DLBCL患者PFS期的临界值
Table 2. Cut-off values of 18F-FDG PET/CT parameters for predicting progress-free survival in 112 patients with diffuse large B-cell lymphoma in the middle stage of chemotherapy
参数 临界值 灵敏度(%) 特异度(%) AUC(95%CI) P值 SUVmax 1.75 68.0 63.2 0.712(0.596~0.829) 0.001 TMTV(cm3) 6.40 64.0 71.3 0.652(0.518~0.787) 0.021 TTLG(g) 9.30 64.0 73.6 0.680(0.549~0.811) 0.006 SPD(cm2) 3.53 64.0 75.9 0.728(0.619~0.837) 0.001 注:FDG为氟脱氧葡萄糖;PET为正电子发射断层显像术;CT为计算机体层摄影术;DLBCL为弥漫性大B细胞淋巴瘤;PFS为无进展生存;AUC为曲线下面积;CI为置信区间;SUVmax为最大标准化摄取值;TMTV为总的代谢肿瘤体积;TTLG为总的糖酵解总量;SPD为最大垂直径乘积之和 表 3 18F-FDG PET/CT参数预测112例化疗中期DLBCL患者OS期的临界值
Table 3. Cut-off values of 18F-FDG PET/CT parameters for predicting overall survival in 112 patients with diffuse large B-cell lymphoma in the middle stage of chemotherapy
参数 临界值 灵敏度(%) 特异度 (%) AUC(95%CI) P值 SUVmax 3.75 50.0 87.8 0.727(0.578~0.877) 0.006 TMTV(cm3) 17.80 57.1 86.7 0.686(0.512~0.861) 0.025 TTLG(g) 19.05 71.4 81.6 0.727(0.559~0.896) 0.006 SPD(cm2) 5.67 71.4 80.6 0.757(0.622~0.891) 0.002 注: FDG为氟脱氧葡萄糖;PET为正电子发射断层显像术;CT为计算机体层摄影术;DLBCL为弥漫性大B细胞淋巴瘤;OS为总生存;AUC为曲线下面积;CI为置信区间;SUVmax为最大标准化摄取值;TMTV为总的代谢肿瘤体积;TTLG为总的糖酵解总量;SPD为最大垂直径乘积之和 表 4 影响112例化疗中期DLBCL患者PFS期的多因素分析
Table 4. Multivariate analysis of progression-free survival of 112 patients with diffuse large B-cell lymphoma in the middle stage of chemotherapy
因素 β值 Wald值 HR值 95%CI P值 年龄 −1.107 6.952 0.331 0.145~0.753 0.008 ECOG评分 −1.339 9.827 0.262 0.113~0.605 0.002 Deauville评分 −0.537 0.980 0.585 0.202~1.693 0.322 IPI评分 −0.418 0.147 0.658 0.078~5.566 0.701 NCCN-IPI评分 −0.183 0.074 1.200 0.321~4.489 0.786 SUVmax −0.342 0.280 0.711 0.201~2.517 0.596 TMTV −0.462 0.104 0.630 0.038~10.482 0.747 TTLG −1.269 8.320 0.281 0.119~0.666 0.004 SPD 0.062 0.007 1.064 0.256~4.422 0.932 注:DLBCL为弥漫性大B细胞淋巴瘤;PFS为无进展生存;CI 为置信区间;ECOG为美国东部肿瘤协作组;IPI为国际预后指数;NCCN-IPI为美国国家综合癌症网络-国际预后指数; SUVmax为最大标准化摄取值;TMTV为总的代谢肿瘤体积;TTLG为总的糖酵解总量;SPD为最大垂直径乘积之和 表 5 影响112例化疗中期DLBCL患者OS期的多因素分析
Table 5. Multivariate analysis of overall survival of 112 patients with diffuse large B-cell lymphoma in the middle stage of chemotherapy
因素 β值 Wald值 HR值 95%CI P值 年龄 −0.237 0.795 0.789 0.469~1.328 0.372 ECOG评分 −0.364 1.580 0.695 0.394~1.226 0.209 Deauville评分 −0.312 0.918 0.732 0.387~1.385 0.338 IPI评分 −0.033 0.007 0.967 0.437~2.138 0.094 NCCN-IPI评分 −0.015 0.001 0.985 0.310~3.129 0.980 SUVmax 0.427 1.565 1.532 0.785~2.990 0.211 TMTV −0.748 1.386 0.437 0.136~1.644 0.239 TTLG 0.502 1.336 1.652 0.705~3.872 0.248 SPD 0.654 5.686 1.992 1.123~3.290 0.017 LDH水平 −0.521 4.174 0.594 0.360~0.979 0.041 注:DLBCL为弥漫性大B细胞淋巴瘤;OS为总生存;CI为置信区间;ECOG为美国东部肿瘤协作组;IPI为国际预后指数;NCCN-IPI为美国国家综合癌症网络-国际预后指数; SUVmax为最大标准化摄取值;TMTV为总的代谢肿瘤体积;TTLG为总的糖酵解总量;SPD为最大垂直径乘积之和;LDH为乳酸脱氢酶 -
[1] Tilly H, Gomes da Silva M, Vitolo U, et al. Diffuse large B-cell lymphoma (DLBCL): ESMO Clinical Practice Guidelines for Diagnosis, Treatment and Follow-up[J]. Ann Oncol, 2015, 26 Suppl 5: v116−v125. DOI: 10.1093/annonc/mdv304. [2] 高艳, 赵晋华, 宋建华, 等. ∆SUV法和Deauville五分法在弥漫性大B细胞淋巴瘤预后中的作用[J]. 中华核医学与分子影像杂志, 2016, 36(5): 420−425. DOI: 10.3760/cma.j.issn.2095-2848.2016.05.009.
Gao Y, Zhao JH, Song JH, et al. Prognostic value of △SUV and Deauville 5-point scoring in patients with diffuse large B-cell lymphoma[J]. Chin J Nucl Med Mol Imaging, 2016, 36(5): 420−425. DOI: 10.3760/cma.j.issn.2095-2848.2016.05.009.[3] 江茂情, 陈萍, 阮新忠, 等. 化疗中期18F–FDG PET/CT显像对弥漫性大B细胞淋巴瘤的预后评估效能[J]. 中华核医学与分子影像杂志, 2018, 38(6): 395−398. DOI: 10.3760/cma.j.issn.2095-2848.2018.06.004.
Jiang MQ, Chen P, Ruan XZ, et al. Prognostic efficiency of interim 18F-FDG PET/CT in patients with diffuse large B-cell lymphoma[J]. Chin J Nucl Med Mol Imaging, 2018, 38(6): 395−398. DOI: 10.3760/cma.j.issn.2095-2848.2018.06.004.[4] 陈虞梅, 周明舸, 刘建军, 等. 化疗中期及化疗后18F-FDG PET/CT对弥漫性大B细胞淋巴瘤患者预后判断的价值[J]. 中华核医学与分子影像杂志, 2018, 38(9): 598−601. DOI: 10.3760/cma.j.issn.2095-2848.2018.09.004.
Chen YM, Zhou MG, Liu JJ, et al. Prognostic value of interim and end-of-treatment 18F-FDG PET/CT in patients with diffuse large B-cell lymphoma[J]. Chin J Nucl Med Mol Imaging, 2018, 38(9): 598−601. DOI: 10.3760/cma.j.issn.2095-2848.2018.09.004.[5] Burggraaff CN, de Jong A, Hoekstra OS, et al. Predictive value of interim positron emission tomography in diffuse large B-cell lymphoma: a systematic review and meta-analysis[J]. Eur J Nucl Med Mol Imaging, 2019, 46(1): 65−79. DOI: 10.1007/s00259-018-4103-3. [6] 中国临床肿瘤学会指南工作委员会. 中国临床肿瘤学会(CSCO)淋巴瘤诊疗指南-2020[M]. 北京: 人民卫生出版社, 2020.
Guidelines Working Committee of Chinese Society of Clinical Oncology (CSCO). Guidelines of Chinese Society of Clinical Oncology (CSCO) Lymphoid Malignancies 2020[M]. Beijing: People's Medical Publishing House, 2020.[7] Yim SK, Yhim HY, Han YH, et al. Early risk stratification for diffuse large B-cell lymphoma integrating interim Deauville score and International Prognostic Index[J]. Ann Hematol, 2019, 98(12): 2739−2748. DOI: 10.1007/s00277-019-03834-4. [8] Zhang YY, Song L, Zhao MX, et al. A better prediction of progression-free survival in diffuse large B-cell lymphoma by a prognostic model consisting of baseline TLG and %ΔSUVmax[J/OL]. Cancer Med, 2019, 8(11): 5137−5147[2021-04-19]. https://onlinelibrary.wiley.com/doi/10.1002/cam4.2284. DOI: 10.1002/cam4.2284. [9] Zucca E, Cascione L, Ruberto T, et al. Prognostic models integrating quantitative parameters from baseline and interim positron emission computed tomography in patients with diffuse large B-cell lymphoma: post-hoc analysis from the SAKK38/07 clinical trial[J]. Hematol Oncol, 2020, 38(5): 715−725. DOI: 10.1002/hon.2805. [10] Islam P, Goldstein J, Flowers CR. PET-derived tumor metrics predict DLBCL response and progression-free survival[J]. Leuk Lymphoma, 2019, 60(8): 1965−1971. DOI: 10.1080/10428194.2018.1562181. [11] 丁重阳, 李天女, 唐立钧, 等. 18F-FDG PET/CT代谢参数判断Ⅱ~Ⅲ期弥漫大B细胞淋巴瘤的预后价值[J]. 国际放射医学核医学杂志, 2019, 43(3): 203−209. DOI: 10.3760/cma.j.issn.1673-4114.2019.03.002.
Ding CY, Li TN, Tang LJ, et al. Prognostic value of metabolic parameters for 18F-FDG PET/CT in patients with diffuse large B-cell lymphoma of stageⅡ~Ⅲ[J]. Int J Radiat Med Nucl Med, 2019, 43(3): 203−209. DOI: 10.3760/cma.j.issn.1673-4114.2019.03.002.[12] Laursen MB, Reinholdtz L, Schönherz AA, et al. High CXCR4 expression impairs rituximab response and the prognosis of R-CHOP-treated diffuse large B-cell lymphoma patients[J/OL]. Oncotarget, 2019, 10(7): 717−731[2021-04-19]. https://www.oncotarget.com/article/26588/text/. DOI: 10.18632/oncotarget.26588. [13] Kurtz DM, Scherer F, Jin MC, et al. Circulating tumor DNA measurements as early outcome predictors in diffuse large B-cell lymphoma[J]. J Clin Oncol, 2018, 36(28): 2845−2853. DOI: 10.1200/JCO.2018.78.5246. -





 下载:
下载: