-
造血系统包括造血细胞、造血微环境(又称为造血干细胞龛)和造血刺激因子,其对电离辐射非常敏感。电离辐射主要破坏或抑制造血细胞的增殖能力,而骨髓抑制是造血系统辐射损伤的主要表现。造血干细胞(hematopoietic stem cell,HSC)具有自我更新、增殖和分化生成全血细胞的功能,其受损伤后将引起骨髓持久性抑制,甚至造成个体死亡[1]。大量研究结果表明,HSC储存在造血干细胞龛中[2]。哺乳动物HSC在骨髓乏氧区骨内膜龛中保持静止状态[3]。正常HSC能够保持细胞内低氧浓度并稳定表达低氧诱导因子(hypoxia-inducible factor,HIF)。在缺少HIF-1α的小鼠中,HSC退出细胞循环的静止期,在骨髓移植、骨髓抑制等情况下HSC数量明显降低[4-5]。提高HIF-1α的表达水平,可以提高HSC的归巢和移植再生能力[6-7]。
HIF是一种在低氧浓度下被激活的转录因子,由α亚基和β亚基构成。HIF-1α的转录活性受环境氧浓度的调节。低氧诱导因子抑制因子(factor inhibiting hypoxia-inducible factor,FIH)又名天冬酰胺酰羟化酶,是体内调节HIF-1α转录活性的主要因子。在正常氧浓度下,FIH通过使HIF-1α的C末端反式激活结构域内第803位的天冬氨酸残基羟基化,阻止HIF-1α与转录辅助激活因子CBP/P300结合,从而抑制HIF-1α的转录激活;在低氧浓度下,FIH的活性降低,激活HIF-1α的转录活性,启动低氧应激调控网络[4-6]。研究结果表明,提高HIF-1α蛋白的稳定性,可以缓解辐射引起的造血系统损伤和胃肠功能障碍,减轻放射性胃肠损伤[5, 8-9]。
N-草酰基-D-苯丙氨酸(N-oxalyl-D-phenylalanine,NOFD)是FIH的特异性抑制剂[10],能提高HIF-1α的转录活性。我们的前期研究结果表明,NOFD能够降低辐射后人结肠癌细胞(HCT116)和仓鼠卵巢细胞(CHO-K1)的细胞内活性氧(reactive oxygen species,ROS)水平,减轻辐射引起的DNA损伤和细胞凋亡;NOFD能够促进HCT116细胞中HIF-1α调控的下游基因的表达,包括促红细胞生成素(EPO)、血红素氧合酶1(HO-1)、葡萄糖转运蛋白1(Glut-1)、血管内皮生长因子(VEGF)、Notch2和Notch1;体内实验结果表明,以5 mg/kg的剂量腹腔给予NOFD,可以明显提高辐射损伤小鼠的存活率[11]。本研究旨在系统评价NOFD对小鼠造血系统辐射损伤的防护作用,以期为FIH抑制剂作为新型辐射防护药的研发提供实验依据。
-
抗小鼠Sca-1-PE、CD117(c-kit)APC、CD3-APC抗体购自美国eBioscience公司;Streptavidin-PerCP抗体,抗小鼠 CD11b-PerCP、Gr1-PerCP、B220-PE、Ter119抗体,抗小鼠B220、Gr1、CD11b、CD4、CD8、CD11b抗体均购自美国Biolegend公司;荧光染料MitoSOX(10 µmol/L)购自美国Life Technologies公司;FACSTM 裂解溶液、anti-γ-H2AX抗体(γ-H2AX为磷酸化组蛋白H2AX)购自美国BD公司;乙二胺四乙酸二钾(EDTA)购自美国Sigma公司。NOFD由中国医学科学院北京协和医学院放射医学研究所辐射防护与药物室合成。
Gammacell®40 Exactor 137Cs γ射线照射源购自加拿大Best Theratronics公司,剂量率为0.99 Gy/min;MEK-7222K全自动血液分析仪购自日本光电工业株式会社;Accuri C6流式细胞仪购自美国BD公司。
-
18只C57BL/6雄性小鼠,体重20~22 g,6~8周龄,由北京维通利华实验动物中心提供[许可证号为SCXK(京)2016-0011],饲养在中国医学科学院北京协和医学院放射医学研究所动物中心,在标准条件[温度(22±2)℃,12 h光明、12 h黑暗交替,湿度(50±10)%]下自由饮用无菌水和进食无特定病原体级鼠繁殖饲料。动物实验开展前获得了中国医学科学院北京协和医学院放射医学研究所动物伦理委员会的批准(批准号:IRM-DWLL-2017109)。所有小鼠饲养1周适应环境后,按照区组随机法分为3组:对照组、4 Gy γ射线全身照射组(简称照射组)和4 Gy γ射线全身照射+ 5 mg/kg NOFD组(简称照射给药组),每组6只。照射给药组于照射前2、16 h及照射后3 d分别腹腔给予5 mg/kg NOFD,对照组和照射组给予等量生理盐水,给药时间和次数与照射给药组相同。
-
照射后第9天脱颈处死小鼠,采集外周血和双侧股骨。股骨用PBS冲洗并收集骨髓细胞,分别置于事先加入乙二胺四乙酸二钾溶液作抗凝处理的1.5 mL离心管中,经全自动血液分析仪测定并计数小鼠外周血血细胞和BMNC。
-
取0.5 mL外周血加入乙二胺四乙酸二钾抗凝剂后,在室温下用B220、CD3-APC、Gr1、CD11b的混合液孵育30 min。用FACSTM裂解溶液除去红细胞。用流式细胞仪检测并计数B细胞、T细胞和髓系细胞,并应用Accuri C6软件对数据进行采集和分析。
-
用PBS将小鼠骨髓中的骨髓细胞冲出,过滤并计数后将5×106个骨髓细胞与CD11b-PerCP、Gr1-PerCP、B220-PE、Ter119、CD4、CD8抗体的混合液孵育30 min,用PBS清洗1次后弃上清,加入Sca-1-PE、CD117(c-kit)APC、Streptavidin-PerCP与PBS的混合液4 μL,室温避光染色20 min,加入1 mL含2%胎牛血清的PBS,1000 r/min离心(离心半径35 cm)5 min后弃上清,加入300 μL PBS重悬细胞,用流式细胞仪计数HPC和HSC,并应用美国BD公司Accuri C6软件对数据进行采集和分析。
-
将骨髓细胞与0.5 μmol/L MitoSOX在37℃水浴中孵育10 min后,用流式细胞仪分析各组细胞内线粒体ROS自由基(MitoSOX)的平均荧光强度(median fluorescence intensity,MFI), 并应用Accuri C6软件对数据进行采集和分析。
-
在室温下用anti-γ-H2AX抗体对骨髓细胞进行染色孵育1 h,用流式细胞仪分析各组细胞的γ-H2AX MFI, 并应用Accuri C6软件对数据进行采集和分析。
-
分离小鼠骨髓细胞,取对照组1×104个细胞,照射组、照射给药组5×104个细胞于M3534培养基中培养5 d后进行集落形成单位分析,以细胞数≥30个为阳性集落进行计数。
-
照射后第9天脱颈处死小鼠并取脾脏,用Bouin液(饱和苦味酸溶液15 mL、甲醛5 mL、冰醋酸1 mL,混匀即得)固定24 h后,取肉眼可见的集落进行计数。
-
应用GraphPad prism 8软件进行统计学分析。符合正态分布的数据以
$\bar x \pm s $ 表示;在方差齐的条件下,组间两两比较采用Student t 检验。P<0.05为差异有统计学意义。 -
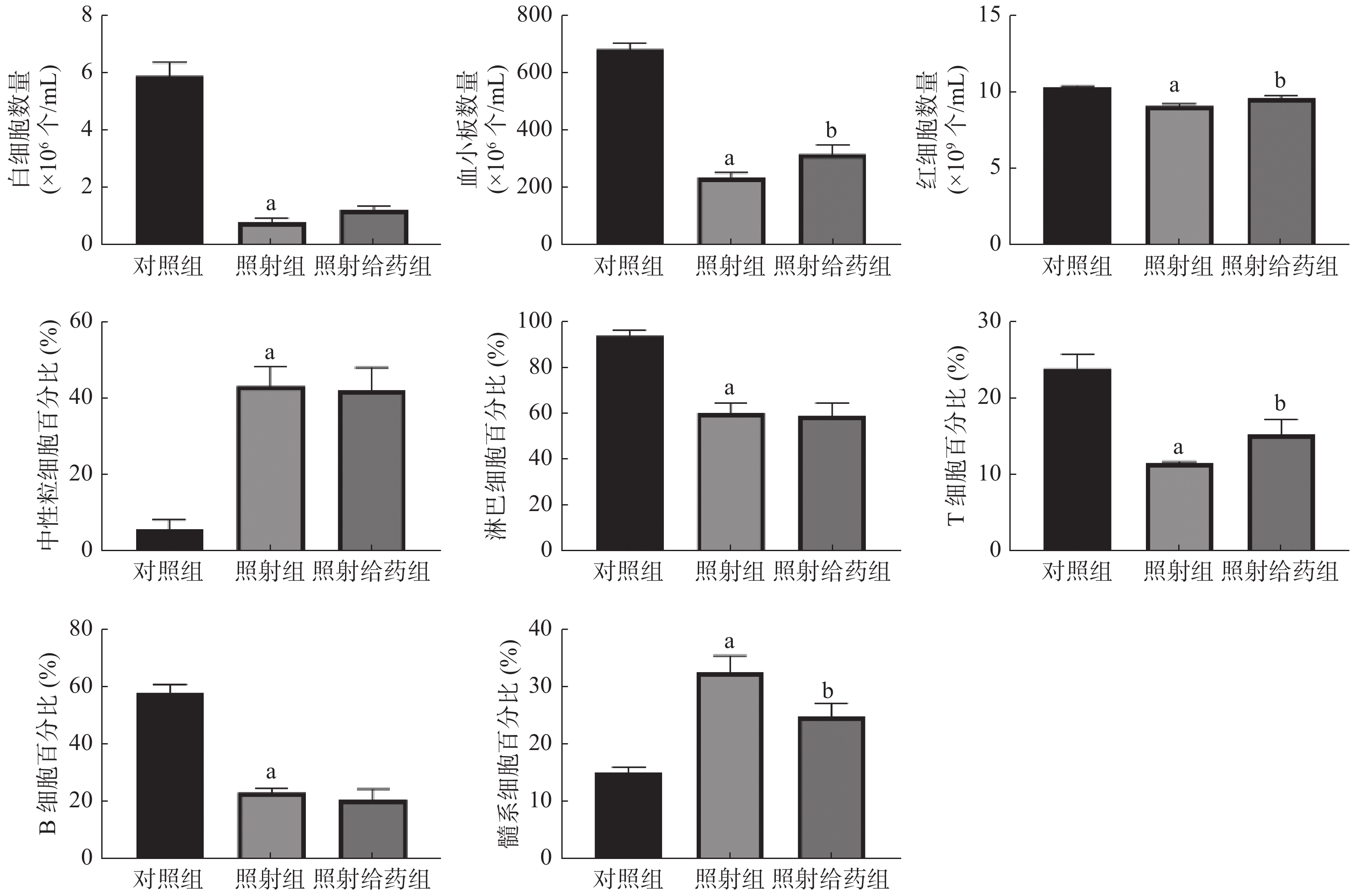
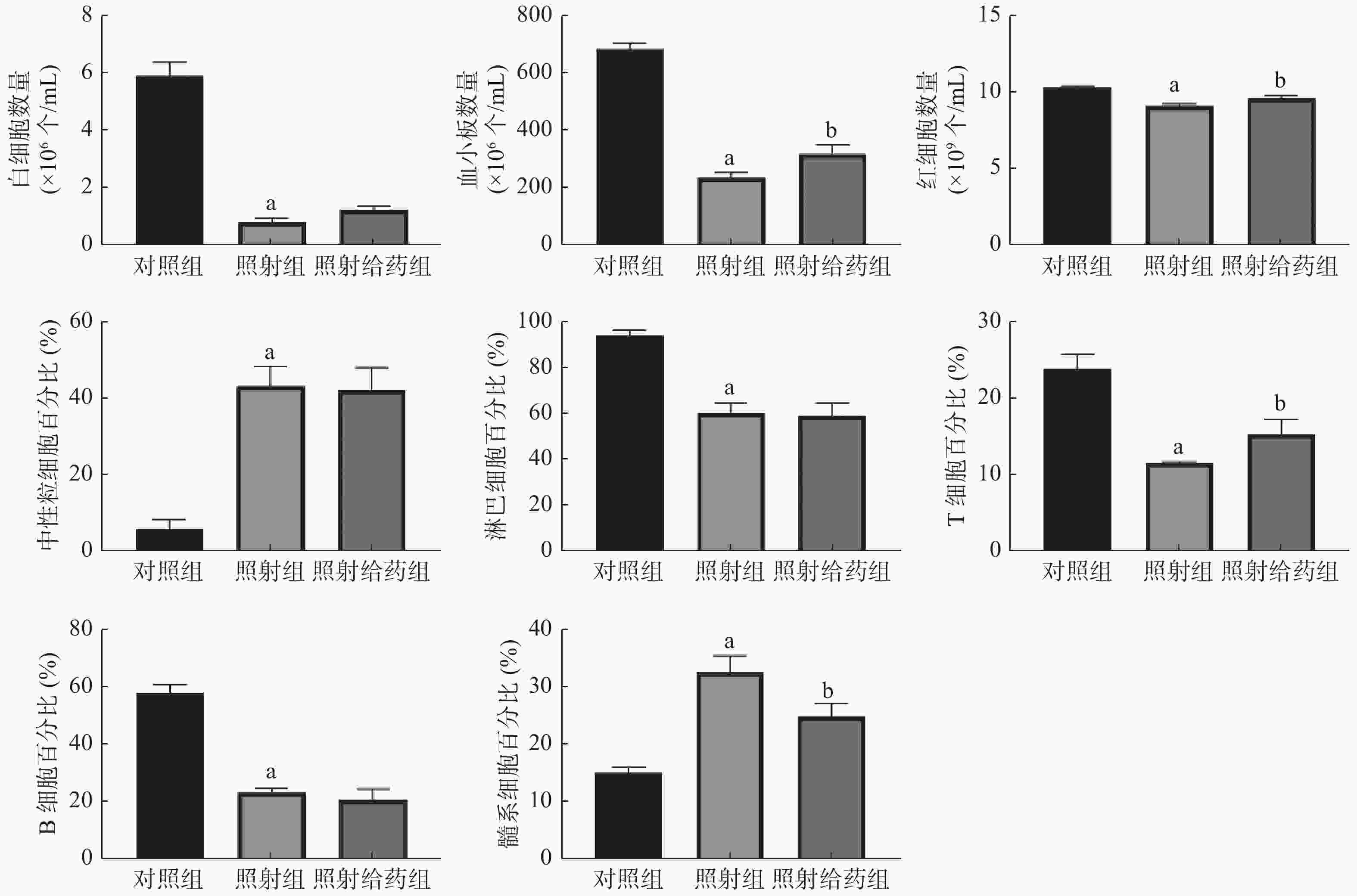
由图1可见,与对照组相比,照射组小鼠外周血中WBC、血小板和RBC数量均明显减少,且差异均有统计学意义(均P<0.05);与照射组相比,照射给药组小鼠外周血中血小板[(234.7±15.81)×106个/mL 对(315.5±32.57)×106个/mL]和RBC数量 [(9.05±0.16)×109个/mL对(9.57±0.15)×109个/mL] 明显增加,且差异均有统计学意义(均P<0.05);与对照组相比,照射组小鼠淋巴细胞、T细胞和B细胞的百分比均明显下降,中性粒细胞和髓系细胞的百分比均明显上升,且差异均有统计学意义(均P<0.05);与照射组相比,照射给药组小鼠T细胞的百分比[(11.54±0.20)%对(15.31±1.88)%]明显升高,髓系细胞的百分比[(32.67±2.87)%对(24.90±2.19)%]明显降低,且差异均有统计学意义(均P<0.05)。以上结果表明,NOFD改善了小鼠辐射所致的髓系-淋巴系分化失衡,并使外周血细胞的数量得到部分恢复。
-
由图2可见,与对照组相比,照射组小鼠的BMNC数量、HPC数量及百分比、HSC数量及百分比均明显降低,且差异均有统计学意义(均P<0.05);与照射组相比,照射给药组小鼠的HSC数量及百分比[(2.24±0.54)×103个/股骨对(6.77±1.67)×103个/股骨;(0.09±0.02)%对(0.59±0.13)%]、HPC百分比[(0.62±0.14)%对(1.82±0.43)%]均明显升高,且差异均有统计学意义(均P<0.05)。以上结果表明,NOFD能够缓解电离辐射对小鼠骨髓中HSC和HPC的损伤,提高HSC的数量,使HSC和HPC在骨髓细胞中的百分比得到恢复,维持照射后造血系统的平衡。
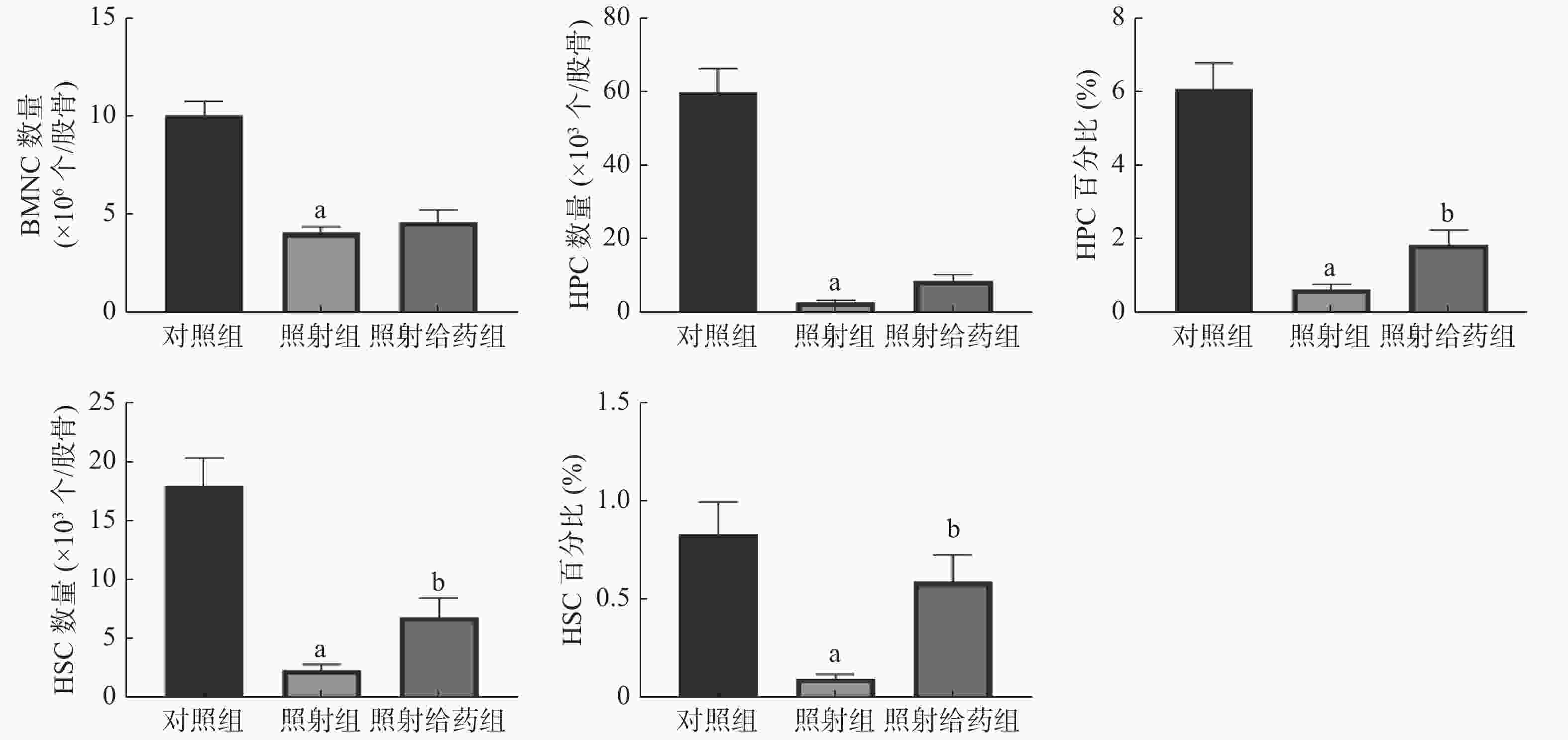
图 2 N-草酰基-D-苯丙氨酸对辐射损伤小鼠骨髓细胞的影响 a表示与对照组比较,差异均有统计学意义(t=4.503~8.770,均P<0.05);b表示与照射组比较,差异均有统计学意义(t= 2.683、2.581、3.633,均P<0.05)。对照组为未照射且不给药;照射组为4 Gy γ射线全身照射;照射给药组为4 Gy γ射线全身照射+ 5 mg/kg N-草酰基-D-苯丙氨酸。BMNC为骨髓有核细胞;HSC为造血干细胞;HPC为造血祖细胞
Figure 2. Effects of N-oxalyl-D-phenylalanine on bone marrow cells in irradiated mice
-
由图3可见,与对照组相比,照射组小鼠的BMNC、HPC中线粒体ROS自由基(MitoSOX)的MFI明显升高,且差异均有统计学意义(均P<0.05);与照射组相比,照射给药组小鼠的BMNC和HPC中线粒体ROS自由基(MitoSOX)的MFI 明显降低[(6.66±0.56)×103对(3.19±0.25)×103;(2.51±0.46)×103对(1.20±0.35)×103],且差异均有统计学意义(均P<0.05)。以上结果表明,NOFD能清除骨髓细胞中线粒体的ROS,减轻辐射所致的损伤。
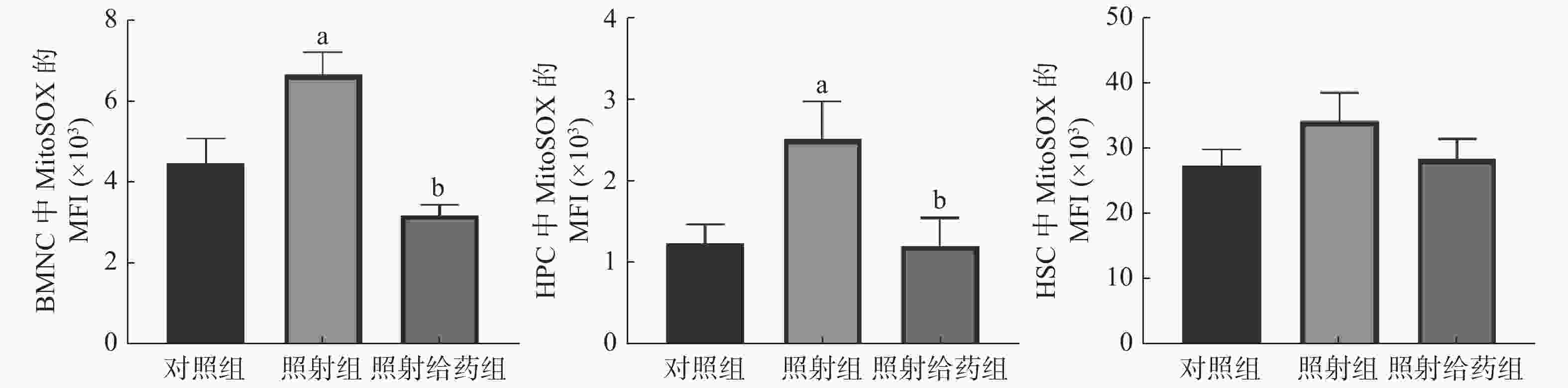
图 3 N-草酰基-D-苯丙氨酸对辐射损伤小鼠骨髓细胞中线粒体活性氧水平的影响 a表示与对照组比较,差异均有统计学意义(t=2.538、2.331,均 P<0.05);b表示与照射组比较,差异均有统计学意义(t=6.350、2.282,均 P<0.05)。对照组为未照射且不给药;照射组为4 Gy γ射线全身照射;照射给药组为4 Gy γ射线全身照射+ 5 mg/kg N-草酰基-D-苯丙氨酸。BMNC为骨髓有核细胞;MitoSOX为一种荧光染料;MFI为平均荧光强度;HPC为造血祖细胞;HSC为造血干细胞
Figure 3. Effects of N-oxalyl-D-phenylalanine on the level of mitochondrial reactive oxygen species in bone marrow cells of irradiated mice
-
由图4 可见,与对照组相比,照射组小鼠的BMNC、HPC和HSC中γ-H2AX的MFI明显增加,且差异均有统计学意义(均P<0.05),这表明4 Gy的电离辐射对小鼠骨髓细胞DNA的损伤较为严重;与照射组相比,照射给药组小鼠的BMNC、HPC和HSC中γ-H2AX的MFI明显降低[(10.25±0.77)×103对(7.22±0.15)×103;(18.37±2.52)×103对(12.44±0.34)×103;(26.05±2.64)×103对(17.16±1.20)×103],且差异均有统计学意义(均P<0.05)。以上结果表明,NOFD可以减轻辐射损伤小鼠骨髓细胞中DNA的双链断裂。
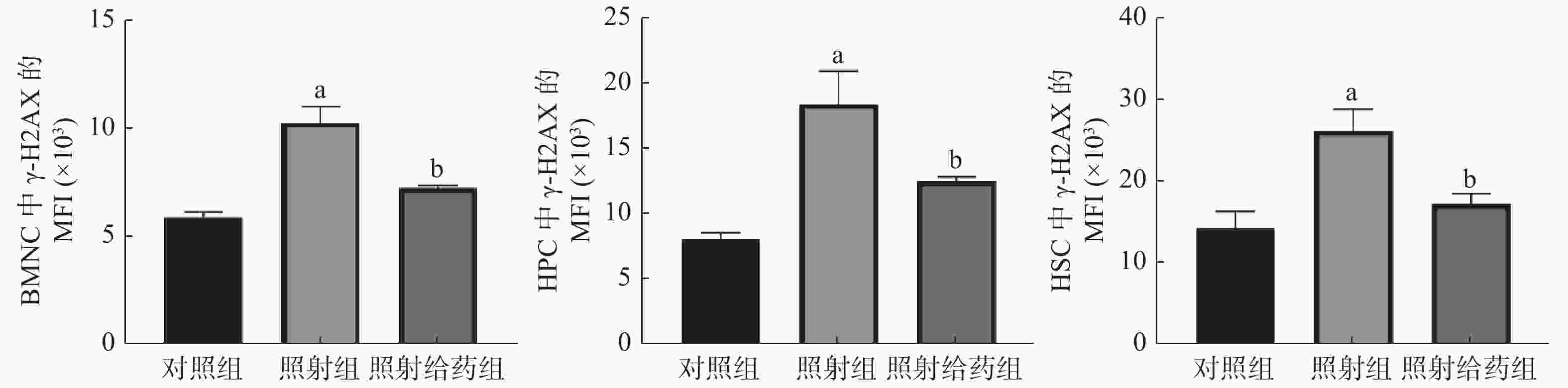
图 4 N-草酰基-D-苯丙氨酸对辐射损伤小鼠骨髓细胞DNA损伤的影响 a表示与对照组比较,差异均有统计学意义(t=5.964、4.029、3.465,均 P<0.05);b表示与照射组比较,差异均有统计学意义(t=4.356、2.577、3.070,均 P<0.05)。对照组为未照射且不给药;照射组为4 Gy γ射线全身照射;照射给药组为4 Gy γ射线全身照射+ 5 mg/kg N-草酰基-D-苯丙氨酸。BMNC为骨髓有核细胞;γ-H2AX为磷酸化组蛋白H2AX;MFI:平均荧光强度;HPC为造血祖细胞;HSC为造血干细胞
Figure 4. Effects of N-oxalyl-D-phenylalanine on DNA damage of bone marrow cells in irradiated mice
-
由图5可见,与对照组相比,照射组小鼠的骨髓细胞的CFU-GM明显减少,且差异有统计学意义(P<0.05),这表明4 Gy照射能明显降低骨髓细胞的增殖能力;与照射组相比,照射给药组小鼠骨髓细胞的CFU-GM明显增多(12.33±1.48对24.00±3.92),且差异有统计学意义(P<0.05)。与对照组相比,照射组小鼠的骨髓细胞的CFU-S增加,且差异有统计学意义(P<0.05);与照射组相比,照射给药组小鼠CFU-S明显增加(6.00±1.07对10.83±1.01),且差异有统计学意义(P<0.05)。以上结果表明,NOFD可增强辐射损伤小鼠骨髓细胞的增殖能力。
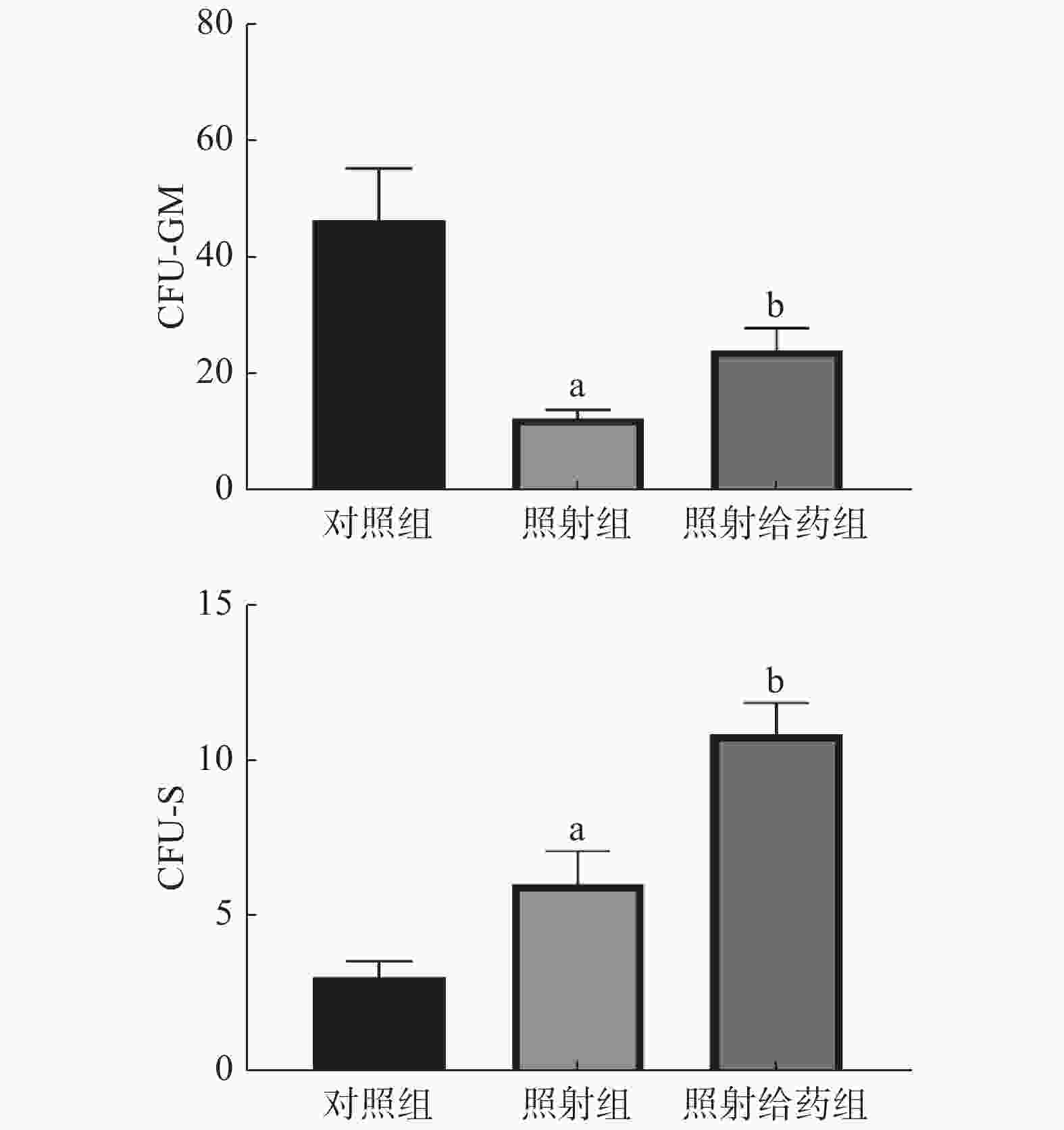
图 5 N-草酰基-D-苯丙氨酸对辐射损伤小鼠骨髓细胞的CFU-GM和CFU-S的影响 a表示与对照组比较,差异均有统计学意义(t=4.193、2.350,均 P<0.05);b表示与照射组比较,差异均有统计学意义(t=2.788、3.288,均 P<0.05)。对照组为未照射且不给药;照射组为4 Gy γ射线全身照射;照射给药组为4 Gy γ射线全身照射+ 5 mg/kg N-草酰基-D-苯丙氨酸。CFU-GM为粒细胞-巨噬细胞集落形成单位;CFU-S为脾集落形成单位
Figure 5. Effects of N-oxalyl-D-phenylalanine on colony-forming units-granulocyte-macrophage and colony-forming units-spleen in irradiated mice
-
随着我国核能应用的不断发展,放射性同位素和射线检测技术的广泛应用,以及核恐怖威胁的持续存在,人们暴露在辐射下的风险不断升高。中高剂量照射引起的骨髓抑制成为辐射致死的主要原因。在肿瘤的临床治疗中,放疗的不良反应之一即为引起骨髓抑制,进而影响患者的治疗效果和生活质量。因此,临床上迫切需要使用辐射防护剂,特别是辐射损伤后的治疗药物,以提高患者辐射损伤的治疗效果,满足辐射损伤人群救治的需要。
HIF是由Semenza[12]发现的一类氧敏感性异二聚体蛋白,其对机体在低氧浓度下发生的一系列生理学改变起着关键性的调控作用。研究结果显示,在组织贫(缺)血和炎症疾病中,HIF蛋白的稳定表达对缓解病情具有重要作用[13]。对辐射损伤的研究结果显示,通过稳定HIF-1α可以改善辐射造成的造血系统损伤[2]和胃肠功能障碍[8]。
研究结果显示,电离辐射可导致造血系统损伤[14-15],HSC和HPC的再生和分化能力受到影响,引起造血细胞数量减少及其在骨髓细胞中的百分比降低,导致外周血中髓系-淋巴系分化的失衡[16],表现为外周血细胞及淋巴细胞减少,髓系细胞增多。电离辐射还能够直接导致DNA损伤或介导ROS间接损伤DNA,γ-H2AX是评估DNA双链断裂损伤的一种重要标志物。细胞在受到照射后,ROS水平会显著升高[17]。受到辐射损伤的线粒体的通透性会发生改变,并将这一损伤通过Ca2+传递给邻近的线粒体,导致线粒体内ROS水平升高[18],因此,线粒体内ROS自由基的清除能力是评价辐射防护效果的重要指标。
在本研究中,我们探讨了调控HIF-1α转录活性的FIH抑制剂NOFD在小鼠辐射损伤中的作用,评价其对辐射诱导的造血系统损伤的防护效果。结果显示,NOFD能缓解辐射损伤小鼠的骨髓抑制,保护HSC和HPC,刺激HSC增殖,通过降低骨髓细胞线粒体中ROS水平来减轻DNA损伤。
然而,目前关于NOFD的生物活性及作用机制的研究报道并不多见。我们的研究团队首次发现了NOFD具有较好的辐射防护作用,其作用机制可能与其促进HIF-1α的转录活性和HIF下游基因,如促红细胞生成素(EPO)、血管内皮生长因子(VEGF)等的表达有关[19]。因为重组促红细胞生成素(EPO)被报道具有明显的辐射防护作用[20-22],而血管内皮生长因子(VEGF)可以促进缺氧环境下的血管生成[23]。
FIH在蛋白-蛋白相互作用过程中能识别多个蛋白底物,FIH除了调控HIF-1通路转录活性外,FIH蛋白底物还可富集至核因子κB、Notch等信号通路中。FIH对Notch有很高的亲和力,可以羟化Notch的天冬酰胺残基,影响Notch途径的下游靶基因。HIF-1α和Notch信号通路在FIH处相互联系,敲除FIH可激活Notch信号通路。Notch作为一条高度保守的信号通路,在细胞增殖、分化和凋亡过程中发挥着重要作用[24]。研究结果表明,Notch受体和配体在哺乳动物造血系统中广泛表达[25]。其中,Notch1和Notch2在HSC中高表达,Notch配体在造血微环境中高表达。Notch信号通路能够促进HSC的“干性”维持,其靶基因发状分裂相关增强子在HSC中高表达[26]。在造血微环境中高表达的Notch配体与HSC上的Notch受体直接接触,激活Notch信号通路,平衡HSC的自我更新和分化,避免HSC耗竭,促进造血重建[27]。我们之前的研究结果也证实了NOFD能够显著促进Notch mRNA的表达[11]。因此,NOFD发挥辐射防护作用的机制可能与其抑制FIH激活Notch信号通路有关。
近些年,HIF-1α与HSC的辐射损伤、修复之间的关系逐渐引起了研究者的广泛兴趣。研究结果表明,辐射可以导致机体内产生大量ROS,异常增多的ROS可抑制HSC的自我更新,诱导HSC衰老,同时又可影响HIF-1α的转录活性[28-29];而上调HIF-1α可以降低细胞中的ROS水平[30]。由此可见,ROS与HIF-1α之间可以相互影响。清除照射产生的ROS一直是辐射损伤防护的重要策略。本研究结果表明,NOFD能够降低BMNC和HPC中线粒体ROS水平,减轻HSC的DNA损伤,增强HSC的增殖能力,调节髓系-淋巴系分化失衡。
综上,本研究结果证实,NOFD促进了辐射损伤小鼠造血系统的恢复,改善了细胞内的氧化应激,发挥了辐射防护作用。然而,关于NOFD的作用机制仍有待深入地研究。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明 唐海康负责数据的统计、图表的制作、论文的撰写与修改;孟媛媛、孟鑫负责现场的实验;龙伟、周晓靓负责数据的统计与分析;徐文清负责论文的审阅与修改。
N-草酰基-D-苯丙氨酸对小鼠造血系统辐射损伤的防护作用
Protective effects of N-oxalyl-D-phenylalanine on hematopoietic system injury induced by ionizing radiation in mice
-
摘要:
目的 研究N-草酰基-D-苯丙氨酸(NOFD)对小鼠造血系统辐射损伤的防护作用。 方法 将18只6 ~ 8周龄的健康C57BL/6J雄性小鼠按区组随机法分为3组:对照组、4 Gy γ射线全身照射组(简称照射组)和4 Gy γ射线全身照射 + 5 mg/kg NOFD组(简称照射给药组),每组6只。照射给药组于照射前2、16 h及照射后3 d分别腹腔给予5 mg/kg NOFD,对照组和照射组给予等量生理盐水,给药时间和次数与照射给药组相同。采用血细胞计数仪分析各组小鼠外周血血细胞数量;采用流式细胞仪检测外周血中B细胞、T细胞、髓系细胞的百分比,骨髓细胞中造血干细胞(HSC)和造血祖细胞(HPC)的数量及百分比,骨髓细胞中磷酸化组蛋白H2AX(γ-H2AX)和线粒体活性氧(ROS)水平;采用粒细胞-巨噬细胞集落形成单位(CFU-GM)实验和脾集落形成单位(CFU-S)实验检测骨髓细胞的增殖能力。组间两两比较采用Student t 检验。 结果 与照射组相比,照射给药组小鼠外周血中红细胞数量明显增加[(9.05±0.16)×109个/mL对(9.57±0.15)×109个/mL],T细胞的百分比升高[(11.54±0.20)%对(15.31±1.88)%],髓系细胞的百分比降低[(32.67±2.87)%对(24.90±2.19)%],HSC的数量增加[(2.24±0.54)×103个/股骨对(6.77±1.67)×103个/股骨],同时HSC和HPC在骨髓细胞中的百分比[(0.09±0.02)%对(0.59±0.13)%;(0.62±0.14)%对(1.82±0.43)%]升高,且差异均有统计学意义(t=1.998~3.633,均P<0.05)。流式细胞仪检测结果显示,与照射组相比,照射给药组小鼠的骨髓有核细胞(BMNC)和HPC中线粒体ROS自由基(MitoSOX)的平均荧光强度(MFI)明显降低[(6.66±0.56)×103对(3.19±0.25)×103;(2.51±0.46)×103对(1.20±0.35)×103],且差异均有统计学意义(t=6.350、2.282,均P<0.05);同时照射给药组小鼠BMNC、HPC和HSC中γ-H2AX的MFI明显降低[(10.25±0.77)×103对(7.22±0.15)×103;(18.37±2.52)×103对(12.44±0.34)×103;(26.05±2.64)×103对(17.16±1.20)×103],且差异均有统计学意义(t=4.356、2.577、3.070,均P<0.05)。集落形成单位实验结果显示,与照射组相比,照射给药组CFU-GM(12.33±1.48对24.00±3.92)和CFU-S(6.00±1.07对10.83±1.01)明显增加,且差异均有统计学意义(t=2.788、3.288,均P<0.05)。 结论 NOFD对小鼠造血系统辐射损伤有明显的保护作用。 -
关键词:
- 辐射损伤 /
- 造血系统 /
- 活性氧 /
- 辐射防护剂 /
- N-草酰基-D-苯丙氨酸
Abstract:Objective To study the protective effects of N-oxalyl-D-phenylalanine (NOFD) on the radiation injury of hematopoietic system in mice. Methods Eighteen healthy C57BL/6J male mice aged 6−8 weeks were divided into three groups with six mice each according to randomized block design: a control group, a 4 Gy γ ray whole body irradiation group (TBI group), and a 4 Gy γ ray whole body irradiation + 5 mg/kg NOFD group (TBI+NOFD group). The mice in the TBI+NOFD group were intraperitoneally given with 5 mg/kg NOFD at 2, 16 h before irradiation, and 3 d after irradiation, respectively, while the control group and TBI group were intraperitoneally given with the same amount of normal saline at the same time as that in the TBI+NOFD group. The number of peripheral blood cells in each group of mice were analyzed using a blood cell counter. The percentage of B cells, T cells, and myeloid cells in peripheral blood were detected via flow cytometry. The number and percentage of hematopoietic stem cell (HSC) and hematopoietic progenitor cell (HPC) in bone marrow cells were detected via flow cytometry. Levels of phosphorylated histone H2AX (γ-H2AX) and mitochondrial reactive oxygen species in bone marrow cells were detected via flow cytometry. The proliferation ability of bone marrow cells was evaluated by counting colony-forming units-granulocyte-macrophage (CFU-GM) and colony-forming units-spleen(CFU-S). Student's t test was used for comparison between two groups. Results Compared with that in the TBI group, the number of peripheral blood erythrocytes in the TBI+NOFD group substantially increased ((9.05±0.16)×109/mL vs. (9.57±0.15)×109/mL). The percentage of T cells increased ((11.54±0.20)% vs. (15.31±1.88)%), whereas the percentage of myeloid cells decreased ((32.67±2.87)% vs. (24.90±2.19)%). The number of HSC increased ((2.24±0.54)×103/femur vs. (6.77±1.67)×103/femur), whereas the percentage of HSC and HPC in bone marrow cells significantly increased ((0.09±0.02)% vs. (0.59±0.13)%, (0.62±0.14)% vs. (1.82±0.43)%; t=1.998−3.633, all P<0.05). The median fluorescence intensity (MFI) of mitochondrial reactive oxygen species (MitoSOX) in bone marrow nucleated cells (BMNC) and HPC in the TBI+NOFD group was significantly lower than that in the TBI group ((6.66±0.56)×103 vs. (3.19±0.25)×103, (2.51±0.46)×103 vs. (1.20±0.35)×103; t=6.350, 2.282, both P<0.05). Moreover, the MFI of γ-H2AX in BMNC, HPC, and HSC in the TBI+NOFD group was significantly lower than that in the TBI group ((10.25±0.77)×103 vs. (7.22±0.15)×103, (18.37±2.52)×103 vs. (12.44±0.34)×103, (26.05±2.64)×103 vs. (17.16±1.20)×103; t=4.356, 2.577, 3.070, all P<0.05). Compared with those in the TBI group, CFU-GM (12.33±1.48 vs. 24.00±3.92) and CFU-S (6.00±1.07 vs. 10.83±1.01) in the TBI+NOFD group significantly increased (t=2.788, 3.288; both P<0.05). Conclusion NOFD exerts an obvious protective effect on the radiation injury of hematopoietic system in mice. -
图 2 N-草酰基-D-苯丙氨酸对辐射损伤小鼠骨髓细胞的影响 a表示与对照组比较,差异均有统计学意义(t=4.503~8.770,均P<0.05);b表示与照射组比较,差异均有统计学意义(t= 2.683、2.581、3.633,均P<0.05)。对照组为未照射且不给药;照射组为4 Gy γ射线全身照射;照射给药组为4 Gy γ射线全身照射+ 5 mg/kg N-草酰基-D-苯丙氨酸。BMNC为骨髓有核细胞;HSC为造血干细胞;HPC为造血祖细胞
Figure 2. Effects of N-oxalyl-D-phenylalanine on bone marrow cells in irradiated mice
图 3 N-草酰基-D-苯丙氨酸对辐射损伤小鼠骨髓细胞中线粒体活性氧水平的影响 a表示与对照组比较,差异均有统计学意义(t=2.538、2.331,均 P<0.05);b表示与照射组比较,差异均有统计学意义(t=6.350、2.282,均 P<0.05)。对照组为未照射且不给药;照射组为4 Gy γ射线全身照射;照射给药组为4 Gy γ射线全身照射+ 5 mg/kg N-草酰基-D-苯丙氨酸。BMNC为骨髓有核细胞;MitoSOX为一种荧光染料;MFI为平均荧光强度;HPC为造血祖细胞;HSC为造血干细胞
Figure 3. Effects of N-oxalyl-D-phenylalanine on the level of mitochondrial reactive oxygen species in bone marrow cells of irradiated mice
图 4 N-草酰基-D-苯丙氨酸对辐射损伤小鼠骨髓细胞DNA损伤的影响 a表示与对照组比较,差异均有统计学意义(t=5.964、4.029、3.465,均 P<0.05);b表示与照射组比较,差异均有统计学意义(t=4.356、2.577、3.070,均 P<0.05)。对照组为未照射且不给药;照射组为4 Gy γ射线全身照射;照射给药组为4 Gy γ射线全身照射+ 5 mg/kg N-草酰基-D-苯丙氨酸。BMNC为骨髓有核细胞;γ-H2AX为磷酸化组蛋白H2AX;MFI:平均荧光强度;HPC为造血祖细胞;HSC为造血干细胞
Figure 4. Effects of N-oxalyl-D-phenylalanine on DNA damage of bone marrow cells in irradiated mice
图 5 N-草酰基-D-苯丙氨酸对辐射损伤小鼠骨髓细胞的CFU-GM和CFU-S的影响 a表示与对照组比较,差异均有统计学意义(t=4.193、2.350,均 P<0.05);b表示与照射组比较,差异均有统计学意义(t=2.788、3.288,均 P<0.05)。对照组为未照射且不给药;照射组为4 Gy γ射线全身照射;照射给药组为4 Gy γ射线全身照射+ 5 mg/kg N-草酰基-D-苯丙氨酸。CFU-GM为粒细胞-巨噬细胞集落形成单位;CFU-S为脾集落形成单位
Figure 5. Effects of N-oxalyl-D-phenylalanine on colony-forming units-granulocyte-macrophage and colony-forming units-spleen in irradiated mice
-
[1] Shao LJ, Luo Y, Zhou DH. Hematopoietic stem cell injury induced by ionizing radiation[J]. Antioxid Redox Signal, 2014, 20(9): 1447−1462. DOI: 10.1089/ars.2013.5635. [2] Forristal CE, Winkler IG, Nowlan B, et al. Pharmacologic stabilization of HIF-1α increases hematopoietic stem cell quiescence in vivo and accelerates blood recovery after severe irradiation[J]. Blood, 2013, 121(5): 759−769. DOI: 10.1182/blood-2012-02-408419. [3] Morikawa T, Takubo K. Hypoxia regulates the hematopoietic stem cell niche[J]. Pflugers Arch, 2016, 468(1): 13−22. DOI: 10.1007/s00424-015-1743-z. [4] Takubo K, Goda N, Yamada W, et al. Regulation of the HIF-1α level is essential for hematopoietic stem cells[J]. Cell Stem Cell, 2010, 7(3): 391−402. DOI: 10.1016/j.stem.2010.06.020. [5] Vukovic M, Sepulveda C, Subramani C, et al. Adult hematopoietic stem cells lacking Hif-1α self-renew normally[J]. Blood, 2016, 127(23): 2841−2846. DOI: 10.1182/blood-2015-10-677138. [6] Speth JM, Hoggatt J, Singh P, et al. Pharmacologic increase in HIF1α enhances hematopoietic stem and progenitor homing and engraftment[J]. Blood, 2014, 123(2): 203−207. DOI: 10.1182/blood-2013-07-516336. [7] Ratajczak MZ, Suszynska M. Emerging strategies to enhance homing and engraftment of hematopoietic stem cells[J]. Stem Cell Rev Rep, 2016, 12(1): 121−128. DOI: 10.1007/s12015-015-9625-5. [8] Taniguchi CM, Miao YR, Diep AN, et al. PHD inhibition mitigates and protects against radiation-induced gastrointestinal toxicity via HIF2[J]. Sci Transl Med, 2014, 6(236): 236ra64. DOI: 10.1126/scitranslmed.3008523. [9] Zhang P, Du JC, Zhao HN, et al. Radioprotective effects of roxadustat (FG-4592) in haematopoietic system[J]. J Cell Mol Med, 2019, 23(1): 349−356. DOI: 10.1111/jcmm.13937. [10] McDonough MA, McNeill LA, Tilliet M, et al. Selective inhibition of factor inhibiting hypoxia-inducible factor[J]. J Am Chem Soc, 2005, 127(21): 7680−7681. DOI: 10.1021/ja050841b. [11] 孟媛媛, 徐文清. N-草酰化-D-苯丙氨酸对小鼠的辐射防护作用[J]. 辐射研究与辐射工艺学报, 2019, 37(3): 030302. DOI: 10.11889/j.1000-3436.2019.rrj.37.030302.
Meng YY, Xu WQ. Protective effect of N-oxalyl-D-phenylalanine on radiation injury in mice[J]. J Radiat Res Radiat Process, 2019, 37(3): 030302. DOI: 10.11889/j.1000-3436.2019.rrj.37.030302.[12] Semenza GL. Involvement of hypoxia-inducible factor 1 in human cancer[J]. Intern Med, 2002, 41(2): 79−83. DOI: 10.2169/internalmedicine.41.79. [13] Chan MC, Holt-Martyn JP, Schofield CJ, et al. Pharmacological targeting of the HIF hydroxylases — a new field in medicine development[J]. Mol Aspects Med, 2016, 47/48: 54−75. DOI: 10.1016/j.mam.2016.01.001. [14] Xue XL, Han XD, Li Y, et al. Astaxanthin attenuates total body irradiation-induced hematopoietic system injury in mice via inhibition of oxidative stress and apoptosis[J/OL]. Stem Cell Res Ther, 2017, 8(1): 7[2021-03-22]. DOI: 10.1186/s13287-016-0464-3. [15] Han XD, Xue XL, Zhao Y, et al. Rutin-enriched extract from Coriandrum sativum L. ameliorates ionizing radiation-induced hematopoietic injury[J/OL]. Int J Mol Sci, 2017, 18(5): 942[2021-03-22]. https://www.mdpi.com/1422-0067/18/5/942. DOI: 10.3390/ijms18050942. [16] Wang JW, Sun Q, Morita Y, et al. A differentiation checkpoint limits hematopoietic stem cell self-renewal in response to DNA damage[J]. Cell, 2012, 148(5): 1001−1014. DOI: 10.1016/j.cell.2012.01.040. [17] Scialò F, Fernández-Ayala DJ, Sanz A. Role of mitochondrial reverse electron transport in ROS signaling: potential roles in health and disease[J/OL]. Front Physiol, 2017, 8: 428[2021-03-22]. https://www.frontiersin.org/articles/10.3389/fphys.2017.00428/full. DOI: 10.3389/fphys.2017.00428. [18] Sanz A, Pamplona R, Barja G. Is the mitochondrial free radical theory of aging intact?[J]. Antioxid Redox Signal, 2006, 8(3/4): 582−599. DOI: 10.1089/ars.2006.8.582. [19] Meng YY, Yang FJ, Long W, et al. Radioprotective activity and preliminary mechanisms of N-oxalyl-D-phenylalanine (NOFD) in vitro[J/OL]. Int J Mol Sci, 2019, 20(1): 37[2021-03-22]. https://www.mdpi.com/1422-0067/20/1/37. DOI: 10.3390/ijms20010037. [20] Peslak SA, Wenger J, Bemis JC, et al. EPO-mediated expansion of late-stage erythroid progenitors in the bone marrow initiates recovery from sublethal radiation stress[J]. Blood, 2012, 120(12): 2501−2511. DOI: 10.1182/blood-2011-11-394304. [21] Galal SM, Abdel-Rafei MK, Hasan HF. Cholinergic and cytoprotective signaling cascades mediate the mitigative effect of erythropoietin on acute radiation syndrome[J]. Can J Physiol Pharmacol, 2018, 96(5): 442−458. DOI: 10.1139/cjpp-2017-0578. [22] Ugurluer G, Cebi A, Mert H, et al. Neuroprotective effects of erythropoietin against oxidant injury following brain irradiation: an experimental study[J]. Arch Med Sci, 2016, 12(6): 1348−1353. DOI: 10.5114/aoms.2016.58622. [23] Chen Q, Liu Y, Jeong HW, et al. Apelin+ endothelial niche cells control hematopoiesis and mediate vascular regeneration after myeloablative injury[J]. Cell Stem Cell, 2019, 25(6): 768−783. DOI: 10.1016/j.stem.2019.10.006. [24] Kiriakidis S, Henze AT, Kruszynska-Ziaja I, et al. Factor-inhibiting HIF-1 (FIH-1) is required for human vascular endothelial cell survival[J]. FASEB J, 2015, 29(7): 2814−2827. DOI: 10.1096/fj.14-252379. [25] Kim A, Shim S, Kim MJ, et al. Mesenchymal stem cell-mediated Notch2 activation overcomes radiation-induced injury of the hematopoietic system[J/OL]. Sci Rep, 2018, 8(1): 9277[2021-03-22]. DOI: 10.1038/s41598-018-27666-w. [26] Denkinger MD, Leins H, Schirmbeck R, et al. HSC aging and senescent immune remodeling[J]. Trends Immunol, 2015, 36(12): 815−824. DOI: 10.1016/j.it.2015.10.008. [27] Janghorban M, Xin L, Rosen JM, et al. Notch signaling as a regulator of the tumor immune response: to target or not to target?[J/OL]. Front Immunol, 2018, 9: 1649[2021-03-22]. DOI: 10.3389/fimmu.2018.01649. [28] Semenza GL. Regulation of oxygen homeostasis by hypoxia-inducible factor 1[J]. Physiology (Bethesda), 2009, 24: 97−106. DOI: 10.1152/physiol.00045.2008. [29] Gerić M, Gajski G, Garaj-Vrhovac V. γ-H2AX as a biomarker for DNA double-strand breaks in ecotoxicology[J]. Ecotoxicol Environ Saf, 2014, 105: 13−21. DOI: 10.1016/j.ecoenv.2014.03.035. [30] Chen CX, Hao XH, Geng ZR, et al. ITRAQ-based quantitative proteomic analysis of MG63 in response to HIF-1α inducers[J]. J Proteomics, 2020, 211: 103558. DOI: 10.1016/j.jprot.2019.103558. -





 下载:
下载: