-
随着核技术的发展和核能应用的增多,核泄漏或核战争发生的可能性增加,一旦事故发生,人们将受到电离辐射造成的不可逆损伤。核工业的从业人员也存在潜在风险,若意外暴露于电离辐射下,轻者可导致机体发生病理变化,重者会损伤其组织和器官[1-2]。核在医疗中的应用越来越多,比如放疗是癌症患者常用的治疗方法。其射线产生的不良反应包括急性胃肠道反应、皮肤反应,程度从轻微皮疹、水肿、腹泻、呕吐到严重溃疡、组织器官的坏死、瘘及其他并发症的发生[3]。约85%接受放疗的患者会出现中度至重度的不良反应,但是临床上没有用于评价放射性不良反应严重程度及预后的有效指标。早期准确诊断辐射损伤是目前临床上急需的。然而,利用稳定的染色体畸变进行辐射损伤诊断的生物剂量法费时费力,且有许多局限性,不适合对受照个体进行快速地判断和分类[4-5]。
秀丽隐杆线虫(Caenorhabditis elegans,简称线虫)是第一个基因组被完全测序的多细胞生物[6]。目前的研究数据表明,38%以上的线虫蛋白表达基因与人类同源,60%~80%的人类基因都可在线虫基因组中找到同源基因,其中包括40%的人类疾病相关基因[7]。因此,线虫作为一种模式生物已被广泛应用于人类疾病的研究。线虫独特的神经元结构决定了它具有灵敏的嗅觉[8-10]。有研究结果表明,野生型线虫对人类肿瘤细胞的分泌物、肿瘤组织以及肿瘤患者的尿液具有趋向性,但对健康者的尿液没有趋向性,同时也发现,线虫能通过嗅觉神经元“感觉”到尿液中的气味[11-12]。这种趋向性已在乳腺癌、宫颈癌和黑色素瘤等多种类型肿瘤中得到证实[13]。由此可见,通过嗅觉灵敏的线虫对患者的体液气味进行分析,可以更好地观察和预测疾病的发生发展[14-18]。
本研究通过全身照射建立小鼠辐射损伤模型,利用线虫的嗅觉,研究其对照射后小鼠和未照射小鼠的尿液是否表现出不同的趋向性、照射剂量和照射后不同时间的关系、照射后小鼠的尿液中是否有吸引线虫的代谢性物质等,为临床辐射损伤的诊断和治疗提供新思路,为辐射损伤代谢标志物的研究打基础,以期开发出一种用于临床的放射性核素造成不良反应的评估体系。
-
清洁级C57/BL6品系雄性小鼠168只,6~7周龄,体重(20±2)g,购自北京华阜康生物科技有限公司[许可证号:SCXK(京)2020-0004]。均饲养于无特定病原体级动物房,控制室内温度25℃左右,相对湿度(60±5)%,保持12 h/12 h的明暗循环,小鼠随意采食全价鼠饲料及清洁水。
-
使用加拿大Best Theratronics公司Gammacell®40 Exactor照射仪,137Cs γ射线对小鼠进行全身照射,剂量率为0.84 Gy/min。按照区组随机法分为对照组和照射组,其中对照组为未照射小鼠,照射组为不同剂量、不同时间点照射后的小鼠。
-
将小鼠固定,轻柔按压小鼠腹部,待有尿液流出,用1.5 mL离心管分别收集每只小鼠的尿液(50~100 μL),放入台式高速离心机(美国Thermo公司Micro21R型),12 000 r/min离心(离心半径8 cm)10 min,将上清液转移至另一离心管中,立刻加到培养皿上进行后续实验。
-
线虫均为N2品系野生型(军事医学科学院张成岗研究员馈赠),使用固体NGM培养基(3 g/L NaCl、2.5 g/L细菌蛋白胨、5 mg/L胆固醇和1.5%琼脂高温高压灭菌后,加入至已过滤除菌的1 mol/L PBS 25 mL、1 mol/L MgSO4 1 mL和1 mol/L CaCl2 1 mL溶液中)及OP50大肠杆菌进行培养。涂布适量菌液(约1 mL)至固体NGM培养基(90 mm平皿)中后风干表面液体,将线虫挑至培养基上,20℃培养箱(RQX-250型,青岛名博环保科技有限公司)中倒置培养。
-
培养线虫至L4产卵期,在体视显微镜(日本尼康公司SMZ1270型)下观察到有大部分线虫已产卵。用M9缓冲液(6 g/L Na2HPO4、3 g/L KH2PO4和5 g/L NaCl)将线虫清洗下来,收集到1.5 mL离心管中,2000 r/min离心(离心半径8 cm)2 min后弃上清。加入1 mL卵回收裂解液(0.5 mol/L NaOH和0.5% NaClO溶于M9缓冲液)后剧烈震荡15~30 s,2000 r/min离心(离心半径8 cm)2 min后弃上清。加入1 mL M9缓冲液清洗裂解体系,重复清洗2次,随后用100 μL的M9缓冲液重悬,加入到无OP50大肠杆菌的NGM培养基(35 mm平皿)上,置于20℃培养箱中孵化24 h。待所有卵在培养基上孵化至L1幼虫期后,将幼虫转移至含OP50大肠杆菌的NGM培养基(90 mm平皿)上继续培养,培养至L3幼虫期用于后续实验。
-
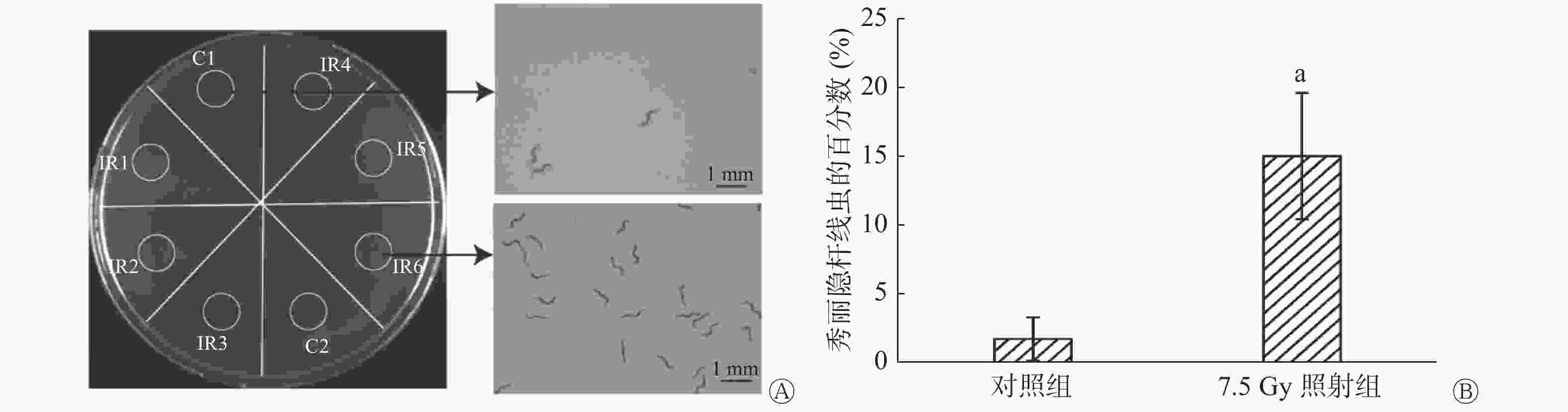
将小鼠分为7.5 Gy照射组和对照组,每组12只,于照射后24 h收集每只小鼠尿液。将90 mm平皿NGM培养基平均划分为8个扇形,于每个扇形靠培养皿边缘画一个直径为10 mm的圆形区域,将照射组和对照组小鼠的尿液分别间隔滴于同一培养皿的8个圆形区域中,含有线虫约700条的M9缓冲液滴至中心区域,静置30 min,拍照记录,而后置于体视显微镜下观察并统计每个圆形区域中线虫的数量,计数统计3次,取平均值,然后分别计算不同区域内线虫的百分数。
-
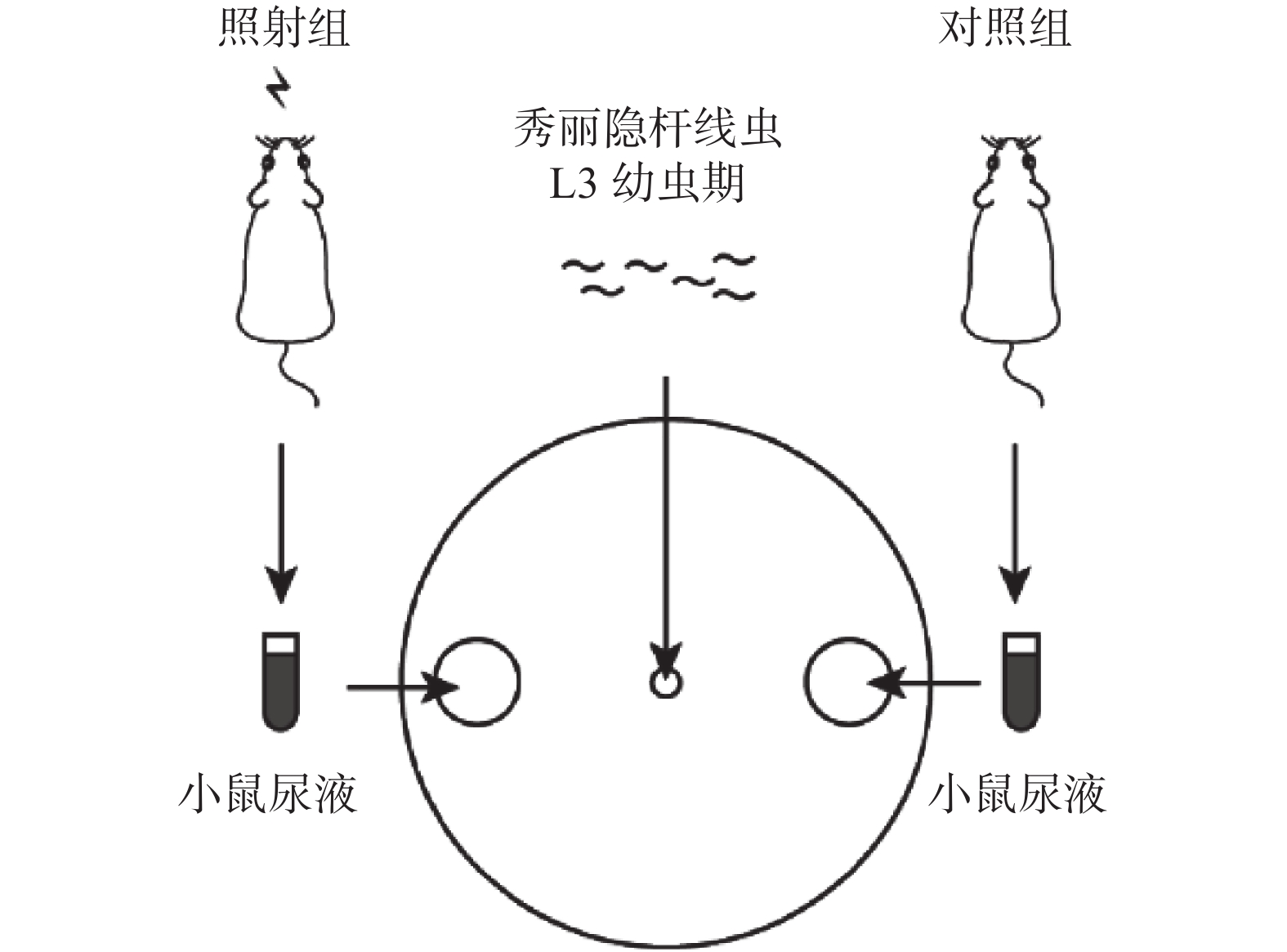
如图1所示,使用90 mm平皿NGM培养基,在距培养皿中心40 mm的两端各划出以该点为圆心的直径为10 mm的圆形区域,将下述实验对照组和照射组小鼠的尿液分别滴至两侧圆形区域中心,水平放置确保液滴不会外溢或扩散,将有约100条线虫的M9缓冲液滴于培养皿中心,静置30 min,置于体视显微镜下观察并统计每个圆形区域中线虫的数量。计数统计3次,取平均值,然后分别计算不同区域内线虫的百分数。

图 1 秀丽隐杆线虫爬行实验方法的示意图
Figure 1. Schematic diagram of experimental method of Caenorhabditis elegans crawling
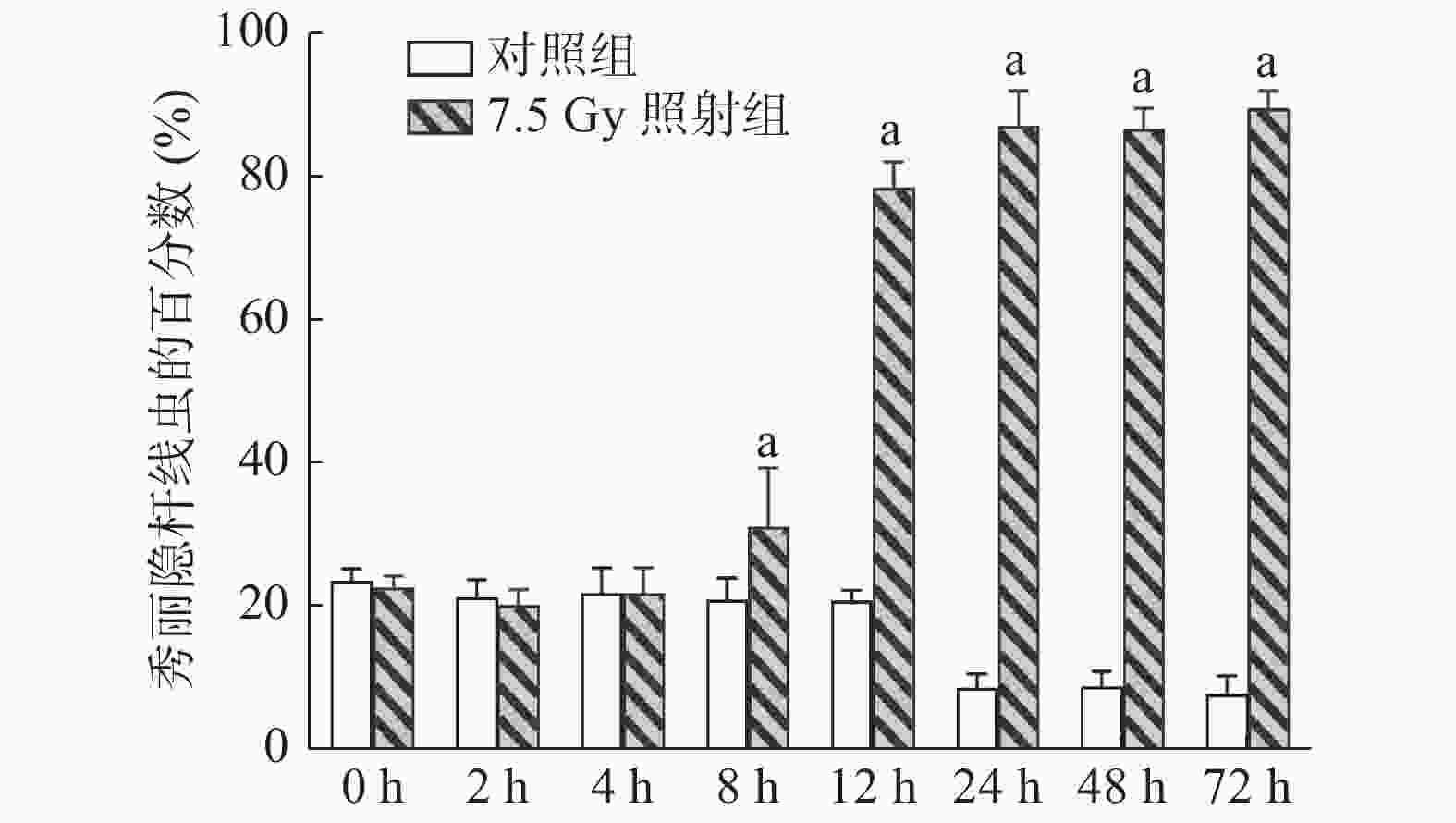
(1)照射后不同时间点的爬行实验:将小鼠分为7.5 Gy照射组和对照组,每组12只,于照射后0、2、4、8、12、24、48、72 h收集每只小鼠的尿液。
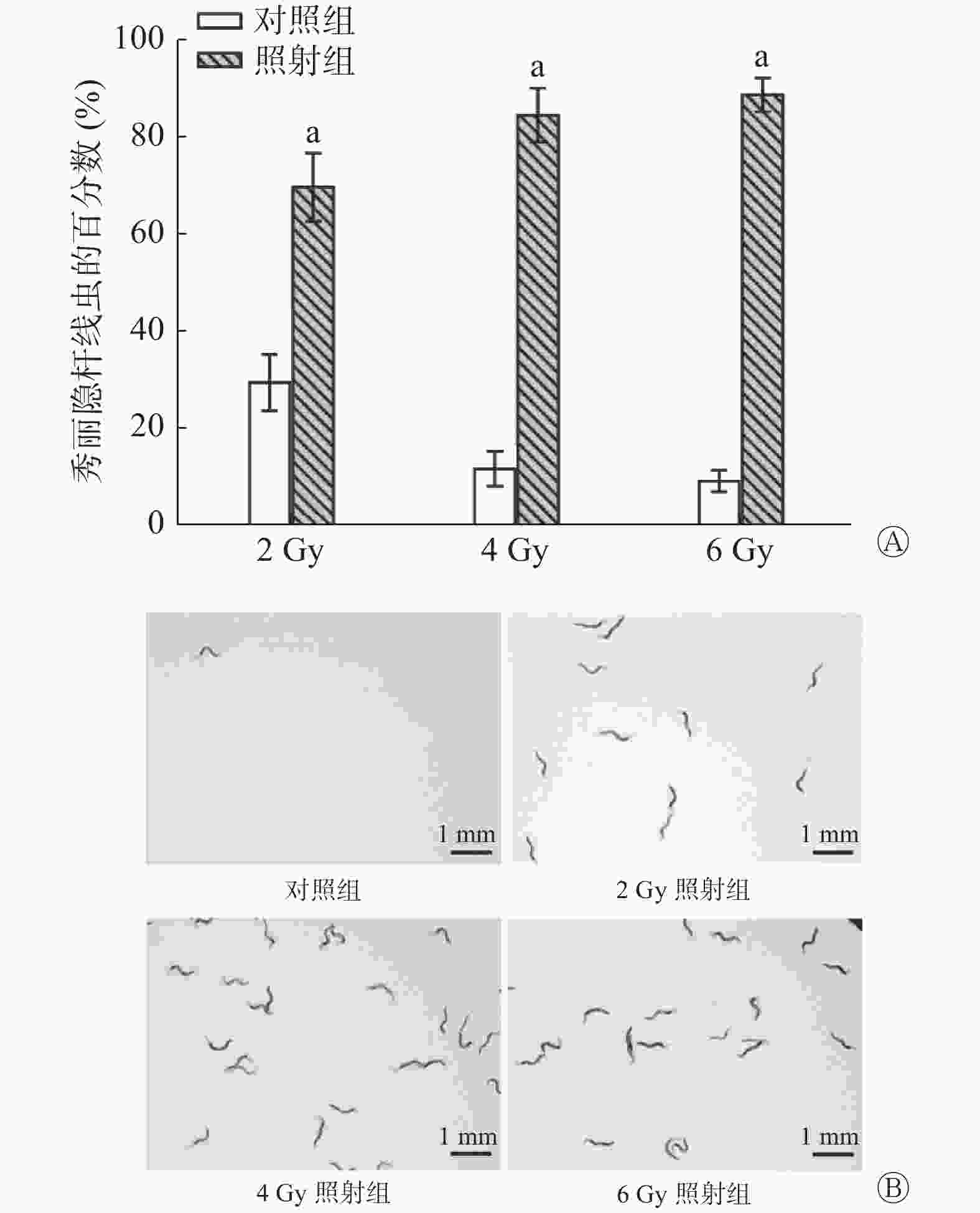
(2)不同剂量照射后的爬行实验:将小鼠分为2、4、6 Gy照射组和对照组,每组12只,于照射后24 h收集每只小鼠的尿液。
(3)时间与剂量之间的正交实验:将小鼠分为2、4、6 Gy照射组和对照组,每组12只,于照射后4、8、24 h收集每只小鼠的尿液。
(4)风扇实验和加热实验:将小鼠分为7.5 Gy照射组和对照组,每组12只,于照射后24 h收集每只小鼠的尿液。在滴加小鼠的尿液后进行风扇实验,即在培养皿一侧打开小风扇进行吹风,使培养皿表面气体流动,吹风30 min后进行爬行实验。在加热实验中,分别取每只小鼠的尿液后称重,放在干浴锅中98℃高温加热5 min,将小鼠尿液中可挥发物质尽量蒸发,再次称重,比较尿液蒸发前后的重量差异,待30 min尿液冷却后进行爬行实验。
-
应用SPSS 25.0软件对数据进行统计学分析。符合正态分布的数据用
$\bar x $ ±s表示,在方差齐的条件下,2组间的比较采用独立样本t检验;小鼠尿液加热前后的比较采用配对t检验。P<0.05为差异有统计学意义。 -
趋化实验结果见图2A,结果显示线虫对照射后小鼠的尿液有明显趋向性,与对照组相比,照射组区域内聚集了更多的线虫。0.5 h后,对照组有约(1.83±0.17)%的线虫,而照射组线虫达(14.17±1.01)%,二者的差异有统计学意义(P=0.002,图2B)。
-
如图3所示,7.5 Gy照射后8 h时线虫开始出现聚集,这说明此时小鼠尿液中产生了相关代谢物,且该代谢物在照射后72 h并未消失,同样可吸引线虫在尿液区域内聚集。与对照组线虫的百分数相比,照射组在照射后8、12、24、48、72 h时的差异均有统计学意义(t=4.073、42.947、53.333、67.518、61.250,均P<0.01)。
-
如图4所示,2 Gy照射后小鼠的尿液可吸引线虫聚集,照射组区域的线虫百分数为(69.58±7.00)%、对照组为(29.33±5.79)%。同样,4、6 Gy照射组也有线虫聚集[照射组线虫的百分数分别为(84.42±5.55)%和(88.58±3.45)%、对照组分别为(11.58±3.60)%和(9.08±2.19)%],与对照组相比,经不同剂量照射后小鼠的尿液中线虫的百分数均增加,且差异均有统计学意义(均P<0.001)。由此可知,线虫灵敏的嗅觉可识别2 Gy及以上剂量照射后小鼠的尿液。
-
由表1可知,在2、4、6 Gy不同剂量照射4 h后,小鼠尿液中无相关代谢物,其线虫的百分数与对照组相比,差异无统计学意义(t=2.152、−1.012、−0.087,均P>0.05);在照射后8 h,不同剂量照射组小鼠尿液的线虫百分数与对照组相比,差异均有统计学意义(均P<0.001)。这表明在照射后8 h时,不论照射剂量多少,该代谢途径已经产生。
组别 4 h 8 h 24 h 对照组(n=12) 20.00±2.04 21.00±1.41 20.17±1.75 2 Gy照射组(n=12) 22.25±2.99 63.25±7.55a 83.92±4.27a 4 Gy照射组(n=12) 18.58±3.26 77.33±8.77a 88.50±3.34a 6 Gy照射组(n=12) 19.92±1.97 72.58±6.14a 88.75±1.76a 注:a表示与对照组相比,差异均有统计学意义(t=17.628~133.349,均P<0.001) 表 1 不同剂量照射后不同时间点小鼠尿液中秀丽隐杆 线虫的百分数(
$\bar x $ Table 1. Percentage of Caenorhabditis elegans in urine of mice at different time points after different doses of irradiation (
$\bar x $ -
风扇实验结果显示,照射组和对照组的线虫百分数均增多,但二者的差异无统计学意义[(3.17±1.37)%对(2.38±1.26)%,t=1.250,P>0.05],即风扇实验后线虫不能识别照射后小鼠的尿液而产生聚集。加热实验结果显示,小鼠尿液加热前后整体重量差异有统计学意义[(1.060±0.028)g对(1.051±0.026)g,t=−11.814,P<0.001],这表示有大量组分挥发;蒸发后尿液的线虫爬行结果显示,照射组和对照组的线虫百分数均增多,但二者的差异无统计学意义[(17.46±11.00)%对(12.70±9.91)%,t=0.585,P>0.05],即经加热后的小鼠尿液并不能被线虫识别出是否经过照射。因此,我们认为照射后小鼠尿液中能被线虫特异性识别的物质为挥发性代谢物。
-
由于核污染等意外照射引起的电离辐射暴露可造成人体多处组织和器官损伤,同时在体内诱导一系列氧化应激反应,从而导致机体功能障碍[19],因此,当意外发生时,对受照人群的快速辨别成为临床上急需解决的问题之一。然而,由于个体差异,临床上现有的诊断方法仅能从表观症状对暴露于电离辐射的人群进行区分,经常导致进一步的临床指导和治疗出现拖延。因此,我们需要一种可用于快速评估个人辐射剂量的生物标志物,已有研究者利用定量蛋白质组学技术定量分析辐射诱导的蛋白质表达,筛选出了一些特异度高、灵敏度好的辐射标志物[20-21],但这些方法所用到的组织样本需要活检,并不适用于大规模的辐射暴露。目前已知与肿瘤预后相关的挥发性化合物存在于尿液中[22-23],且国外已有研究者尝试使用嗅觉灵敏的生物,如猪、狗、线虫等,以及电子气味识别系统对患者的体液气味进行分辨,以此获得更好的疾病预测和临床指导[23-25],但是关于辐射剂量生物标志物的研究仍以蛋白质组学技术为主,尚未有关于尿液挥发性代谢物和辐照暴露的报道。故人群意外暴露于电离辐射后,识别尿液中的挥发性代谢物有待成为早期评估个人辐射剂量和辐射损伤程度的方法之一,此法快速、样本采集方便且无创,可更好地帮助辐照后区域剂量重建、评估患者预后情况、指导早期用药和手术,从而制定最佳的治疗策略。
在本研究中,尿液均经离心后使用,前期发现线虫对不离心的尿液同样具有趋向性,因此尿液中的沉淀物质对线虫趋向性无影响,但为了便于实验统一,本研究一律采用离心法。在照射后不同时间点的爬行实验中,对于受照射后小鼠尿液产生代谢物的时间,我们展开了以时间为轴的取样方式,结果发现,当小鼠受照8 h后,线虫可通过其尿液识别受照个体。由于线虫对未照射小鼠尿液并无排斥性,因此,对照组小鼠尿液中线虫百分数在8 h后明显低于8 h前,这是由于线虫在未照射小鼠尿液中属于随机分散分布,并无规律,同样在其他结果中也出现此情况,并未明显聚集。在剂量与时间的关系实验中,我们发现照射剂量在2 Gy时,照射组小鼠尿液仍吸引线虫聚集,且不论剂量高低,均在8 h时出现差异,且有统计学意义;而低于2 Gy剂量照射时,小鼠尿液中挥发性代谢物是否依然可以吸引线虫,有待进一步验证。风扇实验结果显示,线虫是通过气味辨别照射后小鼠尿液的。加热实验中,照射组与对照组无明显差异,这表明加热后照射组小鼠的尿液中不再具有特异性代谢物,因而判断小鼠尿液中吸引线虫的代谢物为挥发性物质。考虑到进一步临床应用将脱离线虫模式,未来我们的工作中将不再使用线虫进行更低剂量的检测,而是使用气相色谱-质谱分析直接对该气质代谢物进行鉴定和定量。已有研究对血吸虫感染的小鼠尿液进行气质代谢物分析,其中马尿酸盐被指出与感染有关[26]。在未来的工作中,我们也将对照射后小鼠的尿液进行气质代谢物分析,由于物种差异,当凭借该代谢物进行临床早期诊断时,人类受到射线照射后该代谢物在尿液中的出现时间有待更多考证。
在本研究中,小鼠辐射损伤模型是通过2、4、6 Gy或7.5 Gy全身照射建成的,因此不同剂量照射对小鼠身体造成的损伤有所不同。其中2 Gy或4 Gy照射可能造成小鼠造血系统的损伤,而7.5 Gy则可能造成小鼠全身不同器官不同程度的损伤。其中包括肾脏,肾脏的损伤对尿液质量及成分有所影响,因此,本实验结果不排除肾脏损伤造成对小鼠尿液质量的影响。基于以上原因,对尿液中气质标志物的筛选至关重要。在未来工作中,可采用不同动物模型,使用气相色谱-质谱分析代谢组学方法从尿液中筛选表达代谢产物,并分析生物标志物与辐射剂量的关系,为探索一种新的方便可行的诊断方法提供依据。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明 张雪莹负责实验的实施、数据的处理、论文的撰写;朱彤负责实验思路的提供与设计、论文的修订;樊赛军负责实验思路的提供与设计。
秀丽隐杆线虫识别辐射损伤小鼠尿液的研究
Identification of radiation injury mouse urine by Caenorhabditis elegans
-
摘要:
目的 研究秀丽隐杆线虫(简称线虫)对照射后小鼠尿液的趋向性及与照射剂量和时间的关系。 方法 按照区组随机法将168只C57/BL6小鼠分为对照组和照射组,对照组为未照射的小鼠;照射组为使用137Cs γ射线进行全身照射后的小鼠,剂量率为0.84 Gy/min。(1)照射后不同时间点的爬行实验:将小鼠分为7.5 Gy照射组和对照组,每组12只,于照射后0、2、4、8、12、24、48、72 h收集尿液;(2)不同剂量照射后的爬行实验:将小鼠分为2、4、6 Gy照射组和对照组,每组12只,于照射后24 h收集尿液。(3)时间与剂量之间的正交实验:将小鼠分为2、4、6 Gy照射组和对照组,每组12只,于照射后4、8、24 h收集尿液。(4)风扇实验和加热实验:将小鼠分为7.5 Gy照射组和对照组,每组12只,于照射后24 h收集尿液,分别将尿液用风扇吹风和加热后进行爬行实验。线虫培养至L3幼虫期,将其分别和每组小鼠的尿液滴至培养皿的不同区域,于体视显微镜下观察并计算每个区域中线虫的百分数。2组间的比较采用独立样本t检验和配对t检验。 结果 (1)照射后不同时间点的爬行实验:7.5 Gy照射后8 h时线虫开始出现聚集,与对照组相比,照射组在照射后8、12、24、48、72 h时线虫的百分数差异均有统计学意义(t=4.073~67.518,均P<0.01)。(2)不同剂量照射后的爬行实验:与对照组相比,2、4、6 Gy照射组区域线虫的百分数均增加[(29.33±5.79)%对(69.58±7.00)%、(11.58±3.60)%对(84.42±5.55)%、(9.08±2.19)%对(88.58±3.45)%],且差异均有统计学意义(t=11.955、30.320、51.463,均P<0.001)。(3)时间与剂量之间的正交实验:在照射后8、24 h,2、4、6 Gy照射组小鼠尿液的线虫百分数与对照组相比,差异均有统计学意义(t=17.628~133.349,均P<0.001)。(4)风扇实验和加热实验:风扇实验结果显示,照射组和对照组的线虫百分数均增多,但二者的差异无统计学意义(t=1.250,P>0.05);加热实验结果显示,小鼠尿液加热前后整体重量的差异有统计学意义[(1.060±0.028) g对(1.051±0.026) g,t=11.814,P<0.001],照射组和对照组的线虫百分数均增多,但二者的差异无统计学意义(t=0.585,P>0.05)。 结论 线虫对照射后小鼠尿液中挥发性代谢物具有趋向性,且可辨别低剂量照射。 Abstract:Objective To study the relationship between urine tendency of Caenorhabditis elegans (C. elegans) to irradiated mice and administration dose and time of radiation. Methods A total of 168 C57/BL6 mice were divided into control group and irradiation group by randomized block design. The irradiation group was treated with 137Cs γ total body irradiation with 0.84 Gy/min. Mice and wild-type C. elegans were used to perform experiments with the following treatments: (1) crawling test at different time points after irradiation; the mice were divided into 7.5 Gy irradiation group and control group (n=12). After 7.5 Gy total body irradiation, urine samples were collected at 0, 2, 4, 8, 24, 48, and 72 h. (2) Crawling test after different doses of irradiation; the mice were divided into 2, 4, and 6 Gy irradiation groups and control groups (n=12). Urine samples were collected at 24 h after irradiation. (3) Orthogonal experiment between irradiation time and dose; the mice was divided into 2, 4, and 6 Gy irradiation groups and control groups (n=12), and urine samples were collected at 4, 8, and 24 h after irradiation. (4) Fan test and heating test; the urine samples were collected from 7.5 Gy total body irradiation mice after 24 h, accompanied by a blow on one side of the petri dish or heating of the urine prior to crawling test. C. elegans were cultured to L3 larval stage, and the urine of each group was dripped to different areas of the culture dish. The percentage of C.elegans in each area was observed and calculated under stereomicroscope. Independent-sample t test and paired t test were used for comparison between groups. Results (1) Crawling test at different time points after irradiation: C. elegans began to gather at 8 h after 7.5 Gy irradiation. Compared with the control group, significant differences in the percentage of C. elegans were observed at 8, 12, 24, 48, and 72 h after irradiation in the irradiation group (t=4.073−67.518, all P<0.01). (2) Crawling test after different doses of irradiation: compared with the control group, the percentages of C. elegans in the urine area of the 2, 4, and 6 Gy irradiation groups were increased ((69.58±7.00)%, (84.42±5.55)%, and (88.58±3.45)%, respectively, and (29.33±5.79)%, (11.58±3.60)%, and (9.08±2.19)% in the control group), and the differences were statistically significant (t=11.955, 30.320, 51.463; all P<0.001). (3) Orthogonal experiment between irradiation time and dose: compared with the control group, the percentages of C. elegans in the urine of mice showed significant differences at 8, 24 h after 2, 4, and 6 Gy irradiation (t=17.628−133.349, all P<0.001). (4) After the fan test, approximately (3.17±1.37)% C. elegans were distributed in the irradiation group and (2.38±1.26)% in the control group, without significant difference (t=1.250, P>0.05). The results of heating test showed a significant difference in the overall weight of urine before and after heating ((1.060±0.028) g vs. (1.051±0.026) g, t=11.814, P<0.001). Approximately (17.46±11.00)% C. elegans were distributed in the irradiation group and (12.70±9.91)% in the control group, but no significant difference was found between the two groups (t=0.585, P>0.05). Conclusion C. elegans have a tendency of volatile metabolites in urine of irradiated mice and can distinguish low-dose irradiation. -
Key words:
- Caenorhabditis elegans /
- Radiation injuries /
- Unrine tendency /
- Volatile metabolite
-
表 1 不同剂量照射后不同时间点小鼠尿液中秀丽隐杆 线虫的百分数(
$\bar x $ Table 1. Percentage of Caenorhabditis elegans in urine of mice at different time points after different doses of irradiation (
$\bar x $ 组别 4 h 8 h 24 h 对照组(n=12) 20.00±2.04 21.00±1.41 20.17±1.75 2 Gy照射组(n=12) 22.25±2.99 63.25±7.55a 83.92±4.27a 4 Gy照射组(n=12) 18.58±3.26 77.33±8.77a 88.50±3.34a 6 Gy照射组(n=12) 19.92±1.97 72.58±6.14a 88.75±1.76a 注:a表示与对照组相比,差异均有统计学意义(t=17.628~133.349,均P<0.001) -
[1] Cui M, Xiao HW, Li Y, et al. Faecal microbiota transplantation protects against radiation-induced toxicity[J]. EMBO Mol Med, 2017, 9(4): 448−461. DOI: 10.15252/emmm.201606932. [2] Tomasik B, Chałubińska-Fendler J, Chowdhury D, et al. Potential of serum microRNAs as biomarkers of radiation injury and tools for individualization of radiotherapy[J]. Transl Res, 2018, 201: 71−83. DOI: 10.1016/j.trsl.2018.06.001. [3] Choi C, Lee C. Comparison of proton and photon beam irradiation in radiation-induced intestinal injury using a mouse model[J/OL]. Int J Mol Sci, 2019, 20(8): 1894[2021-03-12]. https://www.mdpi.com/1422-0067/20/8/1894. DOI: 10.3390/ijms20081894. [4] Song M, Xie DF, Gao SS, et al. A biomarker panel of radiation-upregulated miRNA as signature for ionizing radiation exposure[J/OL]. Life (Basel), 2020, 10(12): 361[2021-03-12]. https://www.mdpi.com/2075-1729/10/12/361. DOI: 10.3390/life10120361. [5] Gramatyka M, Sokół M. Radiation metabolomics in the quest of cardiotoxicity biomarkers: the review[J]. Int J Radiat Biol, 2020, 96(3): 349−359. DOI: 10.1080/09553002.2020.1704299. [6] Poole RJ, Hobert O. Early embryonic programming of neuronal left/right asymmetry in C. elegans[J]. Curr Biol, 2006, 16(23): 2279−2292. DOI: 10.1016/j.cub.2006.09.041. [7] Shaye DD, Greenwald I. OrthoList: a compendium of C. elegans genes with human orthologs[J/OL]. PloS One, 2011, 6(5): e20085[2021-03-12]. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3102077. DOI: 10.1371/journal.pone.0020085. [8] Kaplan HS, Zimmer M. Sensorimotor integration for decision making: how the worm steers[J]. Neuron, 2018, 97(2): 258−260. DOI: 10.1016/j.neuron.2017.12.042. [9] Jin X, Pokala N, Bargmann C. Distinct circuits for the formation and retrieval of an imprinted olfactory memory[J]. Cell, 2016, 164(4): 632−643. DOI: 10.1016/j.cell.2016.01.007. [10] Worthy SE, Rojas GL, Taylor CJ, et al. Identification of odor blend used by Caenorhabditis elegans for pathogen recognition[J]. Chem Senses, 2018, 43(3): 169−180. DOI: 10.1093/chemse/bjy001. [11] Kusumoto H, Tashiro K, Shimaoka S, et al. Efficiency of gastrointestinal cancer detection by nematode-NOSE (N-NOSE)[J]. In Vivo, 2020, 34(1): 73−80. DOI: 10.21873/invivo.11747. [12] Hirotsu T, Sonoda H, Uozumi T, et al. A highly accurate inclusive cancer screening test using Caenorhabditis elegans scent detection[J/OL]. PloS One, 2015, 10(3): e0118699[2021-03-12]. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4356513. DOI: 10.1371/journal.pone.0118699. [13] Yoshida K, Hirotsu T, Tagawa T, et al. Odour concentration-dependent olfactory preference change in C. elegans[J/OL]. Nat Commun, 2012, 3: 739[2021-03-12]. https://www.nature.com/articles/ncomms1750. DOI: 10.1038/ncomms1750. [14] Li Z, Suslick KS. The optoelectronic nose[J]. Acc Chem Res, 2021, 54(4): 950−960. DOI: 10.1021/acs.accounts.0c00671. [15] de Meij TG, Larbi IB, van der Schee MP, et al. Electronic nose can discriminate colorectal carcinoma and advanced adenomas by fecal volatile biomarker analysis: proof of principle study[J]. Int J Cancer, 2014, 134(5): 1132−1138. DOI: 10.1002/ijc.28446. [16] Haque S, Md S, Sahni JK, et al. Development and evaluation of brain targeted intranasal alginate nanoparticles for treatment of depression[J]. J Psychiatr Res, 2014, 48(1): 1−12. DOI: 10.1016/j.jpsychires.2013.10.011. [17] Scheffler L, Sharapa C, Buettner A. Quantification of volatile metabolites derived from garlic in human breast milk[J]. Food Chem, 2019, 274: 603−610. DOI: 10.1016/j.foodchem.2018.09.039. [18] Inaba S, Shimozono N, Yabuki H, et al. Accuracy evaluation of the C. elegans cancer test (N-NOSE) using a new combined method[J/OL]. Cancer Treat Res Commun, 2021, 27: 100370[2021-03-12]. https://linkinghub.elsevier.com/retrieve/pii/S2468-2942(21)00068-X. DOI: 10.1016/j.ctarc.2021.100370. [19] Zhang JL, Han XD, Zhao Y, et al. Mouse serum protects against total body irradiation-induced hematopoietic system injury by improving the systemic environment after radiation[J]. Free Radic Biol Med, 2019, 131: 382−392. DOI: 10.1016/j.freeradbiomed.2018.12.021. [20] Obrador E, Salvador R, Villaescusa JI, et al. Radioprotection and radiomitigation: from the bench to clinical practice[J/OL]. Biomedicines, 2020, 8(11): 461[2021-03-12]. https://www.mdpi.com/2227-9059/8/11/461. DOI: 10.3390/biomedicines8110461. [21] Mu HX, Sun J, Li LW, et al. Ionizing radiation exposure: hazards, prevention, and biomarker screening[J]. Environ Sci Pollut Res Int, 2018, 25(16): 15294−15306. DOI: 10.1007/s11356-018-2097-9. [22] Cho CE, Brueggemann C, L'Etoile ND, et al. Parallel encoding of sensory history and behavioral preference during Caenorhabditis elegans olfactory learning[J/OL]. Elife, 2016, 5: e14000[2021-03-12]. https://elifesciences.org/articles/14000. DOI: 10.7554/eLife.14000. [23] Willis CM, Church SM, Guest CM, et al. Olfactory detection of human bladder cancer by dogs: proof of principle study[J]. BMJ, 2004, 329(7468): 712. DOI: 10.1136/bmj.329.7468.712. [24] Husson SJ, Mertens I, Janssen T, et al. Neuropeptidergic signaling in the nematode Caenorhabditis elegans[J]. Prog Neurobiol, 2007, 82(1): 33−55. DOI: 10.1016/j.pneurobio.2007.01.006. [25] Scheffler L, Sharapa C, Buettner A. quantification of volatile metabolites derived from garlic (Allium sativum) in human urine[J/OL]. Front Nutr, 2019, 6: 43[2012-03-12]. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6499206. DOI: 10.3389/fnut.2019.00043. [26] Loyo RM, Zarate E, Barbosa CS, et al. Gas chromatography-mass spectrometry (GC/MS) reveals urine metabolites associated to light and heavy infections by Schistosoma mansoni in mice[J]. Parasitol Int, 2021, 80: 102239. DOI: 10.1016/j.parint.2020.102239. -





 下载:
下载: