-
长链非编码RNA(long non-coding RNA, lncRNA)是一组转录本长度大于200个核苷酸的RNA分子,存在于细胞核内或胞浆内,能够通过多种机制影响肿瘤细胞的信号通路,并在染色质水平、转录水平和转录后水平影响靶基因的表达[1]。LncRNA具有特异性细胞类型表达、定位于特定亚细胞区室、与人类疾病相关联等特点[2]。在细胞内,多数lncRNA定位于细胞核,与核质蛋白结合,以促进核保留,并以顺式(in cis)或反式(in trans)方式结合在其调控基因附近,通过募集转录因子、组蛋白修饰因子或染色质修饰因子调控其靶基因的表达。胞质lncRNA在调控基因表达的过程中最常作为竞争性内源性RNA(ceRNA),竞争性内源性RNA通过与微小RNA(microRNA,miRNA)反应原件(MRE)竞争相同的miRNA调节靶基因转录本的表达[3]。此外,在空间分布上,肿瘤细胞与正常细胞、辐射或药物敏感细胞与辐射抵抗细胞中lncRNA的表达量也存在差异[4-5]。
放疗是多种恶性肿瘤的有效治疗方法之一,约半数的恶性肿瘤患者在治疗过程中需要使用放疗。然而,肿瘤细胞的辐射抵抗是导致放疗失败的主要原因[6],因此,提高肿瘤细胞的放疗敏感性是治疗成功的关键。电离辐射可直接作用于细胞核DNA,导致DNA双螺旋结构断裂,破坏遗传物质;同时,电离辐射能够诱导细胞内的水分子发生电离,产生大量的自由基分子,其与蛋白质等有机大分子发生反应,可直接破坏细胞结构,产生不可逆的损伤,最终导致细胞死亡[7]。
-
LncRNA能够通过多种方式调控基因的表达。LncRNA能够通过与DNA、RNA和蛋白质的相互作用调节染色质的结构和功能以及邻近和远处基因的转录,并影响RNA的剪接、稳定性和翻译过程,部分lncRNA还参与细胞器的形成和功能调节。
有研究者通过全基因组RNA-染色质关联分析,结合染色质构象捕获技术,揭示了部分lncRNA调节染色质结构和基因表达的过程[8]。从机制上看,顺式作用和反式作用的核lncRNA都能与DNA相互作用,改变染色质的结构,部分情况下其通过调控转录因子间接作用[8],其他情况下以特异序列直接结合DNA, 介导基因沉默或激活。
部分lncRNA通过协同作用、转录依赖和非转录依赖机制调控蛋白编码基因的表达,并能够通过剂量补偿效应介导基因沉默。增强子相关lncRNA(elncRNA)的剪接与其相关增强子的活性和邻近蛋白编码基因的丰度相关[9],并且可以与染色质调节蛋白共同调节染色质结构。
除了在转录调控和调节染色质结构中的作用外,lncRNA还控制着基因表达的其他几个方面。部分lncRNA能够被翻译成具有功能的肽段,部分lncRNA能够通过RNA基序或结构域结合蛋白质,形成特定的lncRNA-蛋白质复合物(lncRNP),参与转录后调控,改变mRNA的剪接过程,进而实现对信号通路的调节。一些lncRNA可以直接与mRNA进行碱基配对并招募mRNA降解相关蛋白质。此外,大量lncRNA携带miRNA的互补位点,可以作为竞争性的内源性RNA或miRNA的“海绵”来调节基因的表达。
部分lncRNA定位于外泌体和线粒体等特定细胞器。由于外泌体会定期释放到细胞外环境中,因此定位于外泌体的lncRNA可以最终进入受体细胞,参与表观遗传的调控、细胞类型的重编程等过程,定位于线粒体的lncRNA可以由核DNA和线粒体DNA编码,并且通常与线粒体的代谢和细胞凋亡等过程关联[10]。
-
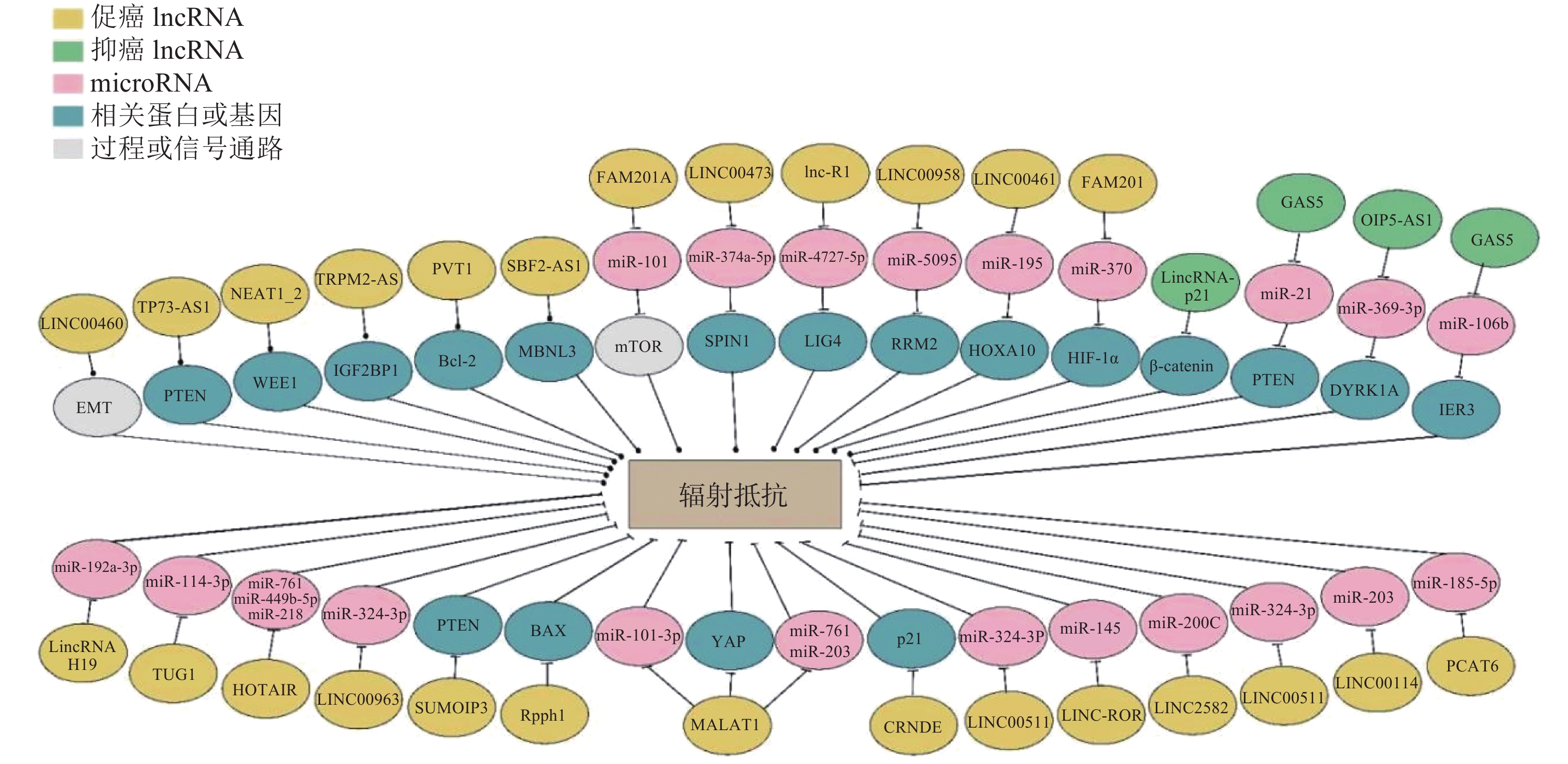
通过高通量转录组学分析发现,肿瘤患者组和健康对照组中lncRNA的表达量存在显著差异[11]。LncRNA能够通过多种分子机制影响细胞的放射敏感性(图1),调节DNA损伤修复、逆转细胞周期阻滞、细胞凋亡、上皮-间充质转化(epithelial-to-mesenchymal transition,EMT)和自噬等[12]过程,在肿瘤的治疗和预后过程中具有潜在价值。根据部分lncRNA在不同类型肿瘤放射敏感性调节等方面的作用对其进行归纳(表1)。
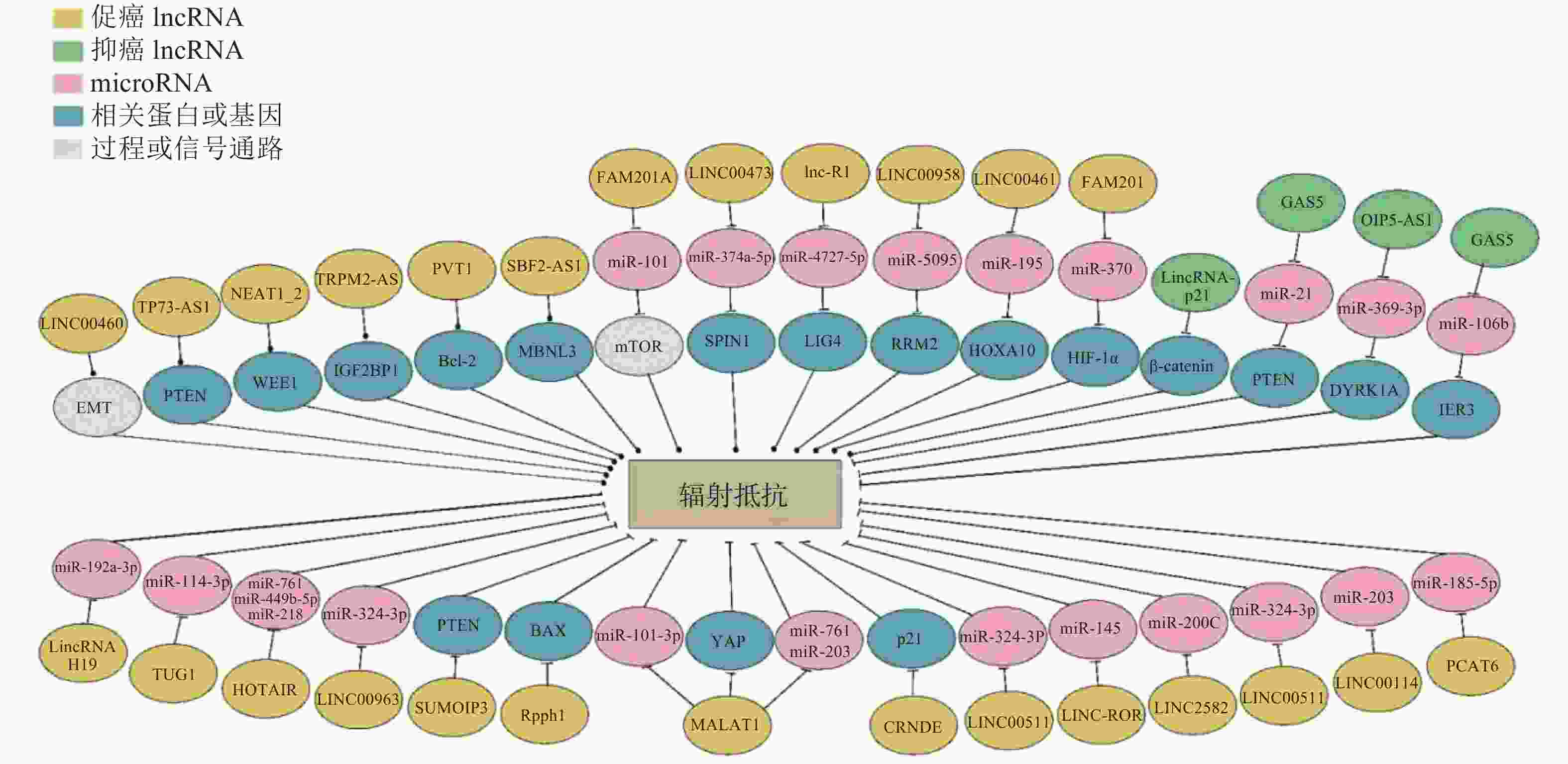
图 1 LncRNA介导肿瘤细胞辐射抵抗的多种机制
Figure 1. LncRNA mediates tumor cell radioresistance through multiple mechanisms
肿瘤
类型LncRNA 靶点/生物学过程· 调控放射
敏感性参考
文献肿瘤
类型LncRNA 靶点/生物学过程· 调控放射
敏感性参考
文献结直肠癌 MALAT1 MiR-101-3p 抵抗 [13] 鼻咽癌 linc00114 ERK/JNK信号通路
与MiR-203抵抗 [34] lnc-RI MiR-4727-5p 抵抗 [14] MALAT1 MiR-1 抵抗 [35] OIP5-AS1 MiR-369-3p 抵抗 [15] TUG1 EMT 抵抗 [36] ROR MiR-145 抵抗 [16] 胃癌 MALAT1 SOX2 抵抗 [37] linc00460 EMT 抵抗 [17] TRPM2-AS MiR-612 抵抗 [38] 食管癌 linc00473 MiR-374a-5p 抵抗 [18] lincRNA p21 β-catenin信号通路 增敏 [39] MALAT1 YAP 抵抗 [19] 肺癌 PVT1 MiR-424-5p 抵抗 [40] FAM201A MiR-101 抵抗 [20] SBF2-AS1 MBNL3 抵抗 [41] Rpph1 Bax/caspase-3 抵抗 [21] FAM201A MiR-370 抵抗 [42] TUG1 MiR-144-3p 抵抗 [22] GAS5 MiR-21 增敏 [43] 肝癌 NEAT1_2 MiR-101-3p 抵抗 [23] linc00461 MiR-195 抵抗 [44] TP73-AS1 PTEN 抵抗 [24] CRNDE G1/S期 抵抗 [45] TUG1 PRC2 抵抗 [25-26] 宫颈癌 MALAT1 MiR-145 抵抗 [46] SUMO1P3 − 抵抗 [27] linc00958 MiR-5095 抵抗 [47] 乳腺癌 HOTAIR MiR-218 抵抗 [28] GAS5 MiR-106b 增敏 [48] MiR-449b-5p 抵抗 [29] HOTAIR Wntv信号通路 抵抗 [49] linc00963 DNA损伤修复 抵抗 [30] linc02582 miR-200C 抵抗 [31] linc00511 miR-324-3p 抵抗 [32] PCAT6 MiR-185-5p 抵抗 [33] 注:lncRNA为长链非编码RNA;MALAT1为肺腺癌转录本1;OIP5-AS1为Opa相互作用蛋白5反义转录本1;ROR为重编程调控因子;FAM201A为序列相似性家族201-成员A;Rpph1为核糖核酸酶P RNA组份H1;TUG1为牛磺酸上调基因1;NEAT1_2为核富集转录本1;TP73-AS1为p53依赖性凋亡调节物;SUMO1P3为小泛素样修饰蛋白1假基因3;HOTAIR为人类同源异型盒基因转录反义RNA;PCAT6为前列腺相关转录本6;EMT为上皮-间充质转化;YAP为Yes相关蛋白;Bax为Bcl-2相关X蛋白质;PTEN为人第10号染色体缺失的磷酸酶及张力蛋白同源的基因;PRC2为多梳蛋白抑制复合体 2;DNA为脱氧核糖核酸;TRPM2-AS为瞬时受体电位M2反义RNA;PVT1为浆细胞瘤变异易位1;SBF2-AS1为SBF2反义RNA1;GAS5为生长阻滞特异性转录物5;CRNDE为结直肠肿瘤差异表达基因;ERK为细胞外调节蛋白激酶;JNK为c-Jun氨基末端激酶;SOX2为Y染色体性别决定区相关的高迁移率族盒蛋白2;MBNL3为Muscleblind样蛋白3;−表示文献中无此内容 表 1 不同类型肿瘤中对放射敏感性具有调节作用的lncRNA
Table 1. LncRNA with regulatory effects on radiosensitivity in different tumor types
-
结直肠癌居全球常见恶性肿瘤第3位,其高发病率和高病死率严重影响着人类健康。由于临床上结直肠癌对放疗的敏感性较低,因此其治疗效果受到很大影响。LncRNA的异常表达与结直肠癌的发生、发展、侵袭和转移等过程密切相关。有研究结果表明,部分lncRNA能够通过海绵化miRNA实现对放射敏感性的调控,lncRNA肺腺癌转录本1(metastasis-associated lung adenocarcinoma transcript 1,MALAT1)[13]、长链非编码RNA RI(lncRNA radiation induced,lnc-RI)[14]、Opa相互作用蛋白5反义转录本1(OIP5-AS1)[15]和lncRNA重编程调控因子(regulator of reprogramming,ROR)[16]可以通过竞争性结合miR-101-3p、miR-4727-5p、miR-369-3p和miR-145调节结直肠癌的辐射抗性。DNA双链断裂的修复效率是影响肿瘤放射敏感性的重要因素之一,lnc-RI能够通过lnc-RI/miR-4727-5p/DNA连接酶Ⅳ(LIG4)轴调节DNA连接酶Ⅳ的表达,提高非同源末端连接的修复效率,促进DNA双链断裂的修复,降低肿瘤细胞的辐射敏感性[14]。与lnc-RI参与的耐辐射机制不同的是,lncRNA Opa相互作用蛋白5反义转录本1(OIP5-AS1)能够抑制miR-369-3p的表达,从而上调miR-369-3p下游基因双底物特异性酪氨酸磷酸化调节激酶1A(DYRK1A)的表达,最终抑制细胞克隆存活,促进细胞凋亡,提高结直肠癌细胞的放射敏感性[15],且有研究结果发现,Opa相互作用蛋白5反义转录本1(OIP5-AS1)在抗辐射肿瘤组织中高表达。LncRNA ROR则通过负调控p53/miR-145降低结直肠癌细胞系的放射敏感性[16]。此外,linc00460在人结直肠腺癌(HCT)116细胞中的表达明显高于其他类型的细胞,辐射能够激活位于linc00460启动子上的c-Jun转录因子结合元件,从而诱导linc00460的表达,促进细胞EMT并产生辐射抗性[17]。
-
食管癌是常见的消化道肿瘤,居全球最常见的恶性肿瘤第7位,病死率居第6位。食管癌的病理类型主要有鳞癌和腺癌,我国以鳞癌为主。Linc00473在几种人类恶性肿瘤中异常表达,Chen等[18]发现linc00473和miR-374a-5p之间存在相互抑制的作用,甲基赖氨酸读写蛋白spindlin1(spindlin1,SPIN1)是miR-374a-5p的下游靶点,linc00473可以通过负调控miR-374a-5p的表达上调SPIN1的表达,从而增强食管鳞状癌(ESCC)细胞的辐射抗性。此外,lncRNA MALAT1在多种恶性肿瘤中具有促进肿瘤发生发展的作用,Yao等[19]发现敲除MALAT1能够降低食管鳞状癌细胞的干性与迁移能力,增强细胞的放射敏感性,同时MALAT1还可直接与Yes相关蛋白(Yes related protein 1,YAP)结合,促进YAP蛋白的表达并提高YAP的转录活性,从而逆转MALAT1敲除对食管鳞状癌细胞的干性和放射敏感性的影响。LncRNA序列相似性家族201-成员A(family with sequence similarity 201-member A,FAM201A)在辐射抵抗的食管鳞状癌(ESCC)肿瘤组织中表达上调,FAM201A敲除可以通过负调控miR-101的表达水平,调控雷帕霉素靶蛋白(mTOR)信号通路,从而增强人食管癌细胞ECA109和(或)ECA109R的放射敏感性[20]。LncRNA核糖核酸酶P RNA组份H1(ribonuclease P RNA component H1,Rpph1)在食管癌中高表达,降低Rpph1的表达水平可增加凋亡相关蛋白Bax和caspase-3的表达,同时B淋巴细胞瘤2基因(Bcl-2)表达水平降低。此外,干扰Rpph1能够减轻辐射诱导的G2/M期阻滞,进而显著抑制食管癌细胞中与细胞增殖、迁移和EMP调控相关蛋白的表达[21]。LncRNA牛磺酸上调基因1(taurine upregulation gene 1,TUG1)在食管鳞状癌细胞和组织中的表达上调,抑制LncRNA TUG1能够抑制食管癌细胞的增殖和集落的形成,同时诱导细胞凋亡,体内和体外实验均已证明敲除lncRNA TUG1可以上调miR-144-3p的表达水平,通过间质-表皮转化因子(cellular-mesenchymal epithelial transition factor,c-Met))/表皮生长因子受体(epithelial growth factor receptor,EGFR)/丝氨酸-苏氨酸激酶(Akt)轴提高食管鳞癌的辐射抗性[22]。
-
肝癌是人类第二大致死性恶性肿瘤,lncRNA的异常表达被认为与肝癌辐射抵抗的发生和治疗预后密切相关。其中,lncRNA核富集转录本1(NEAT1_2)[23]能够通过竞争性结合miR-101-3p调节肝癌的放射抗性。下调lncRNA核富集转录本1(NEAT1_2)可以通过调节miR-101-3p/丝氨酸/苏氨酸G2检查点激酶 1(WEE1)轴使肝癌细胞的放射敏感性增强。已有研究结果证实,lncRNA p53依赖性凋亡调节物(tumor protein P73 antisense RNA 1,TP73-AS1)在肝癌中高表达,并通过人第10号染色体缺失的磷酸酶及张力蛋白同源的基因(phosphate and tension homology deleted on chromsome ten,PTEN)/丝氨酸-苏氨酸激酶(Akt)信号通路参与肝癌的放射抵抗[24]。核转录因子特异性蛋白1(specificity protein,SP1)能够诱导lncRNA TUG1过表达,TUG1可与多梳蛋白抑制复合体 2(PRC2)结合并招募至Krüppel样因子2(KLF2) 的启动子区域,从而抑制Krüppel样因子2的转录,TUG1可作为肝癌的生物靶标,增强其放疗敏感性[25-26]。此外,lncRNA 小泛素样修饰蛋白1假基因3(SUMO1P3)的敲除可以显著抑制肝癌的生长、侵袭、促进细胞凋亡并增强细胞的放射敏感性,为小泛素样修饰蛋白1假基因3(SUMO1P3)可能成为一种潜在的生物标志物和肝癌的治疗靶点提供了可靠证据[27]。
-
近年来,乳腺癌的发病率呈逐年上升的趋势,其发病率排在女性恶性肿瘤的首位。术前和术后放疗在乳腺癌的治疗中起着举足轻重的作用,但经常因肿瘤细胞产生辐射抵抗,最终导致患者预后不良。LncRNA人类同源异型盒基因转录反义RNA(homeotic genes transcript antisense RNA,HOTAIR)在乳腺癌细胞和组织中表达上调,最近的研究结果表明,HOTAIR的表达随照射时间的延长而增加,且HOTAIR基因的敲除抑制了细胞的存活,增强了细胞对电离辐射的敏感性,这一放射增敏作用与HOTAIR的竞争性内源RNA miR-218上调有关[28]。此外,Zhang等[29]的研究结果证实,lncRNA HOTAIR可与miR-449b-5p竞争性结合,诱导休克蛋白A1A(HSPA1A)的表达,导致乳腺癌细胞的辐射抗性显著增强。有研究结果证实,沉默linc00963可以抑制乳腺癌细胞的增殖和成瘤,敲除linc00963会促进DNA损伤和氧化应激,并使乳腺癌细胞的放射敏感性增强[30]。Linc02582能够将miR-200C与其靶蛋白细胞周期检测点激酶1(Chk1)连接到一起,通过miR-200C下调检测点激酶1的表达水平,从而提高乳腺癌细胞的辐射敏感性[31]。此外,有研究结果表明,linc00511在乳腺癌组织中的表达水平显著升高,并与保乳手术后行放疗患者的复发和生存不良密切相关。体外小干扰RNA敲除实验结果证实,linc00511能够抑制细胞增殖,诱导凋亡加快,最终增强细胞的放射敏感性;同时,敲除linc00511在体内实验中表现为肿瘤的生长受到抑制,辐射的敏感性增强[32]。最近的研究结果表明,lncRNA前列腺相关转录本6(prostate cancer associated transcript 6,PCAT6)在三阴性乳腺癌(TNBC)的组织和细胞中高表达,PCAT6可以通过与miR-185-5p的竞争性结合调节肿瘤蛋白D52(tumor protein D52,TPD52)的表达,从而调节三阴性乳腺癌细胞的放射敏感性,抑制PCAT6能够通过调节miR-185-5p/肿瘤蛋白D52轴增强三阴性乳腺癌细胞的放射敏感性[33]。
-
鼻咽癌是一种起源于鼻咽上皮的恶性肿瘤,易发生远处转移和放射抵抗,lncRNA的异常表达与鼻咽癌的发生发展、侵袭转移和治疗敏感性等方面密切相关。LncRNA linc00114在鼻咽癌患者的血清、鼻咽癌组织和鼻咽癌细胞系中表达上调,且通过调节细胞外调节蛋白激酶(ERK)/ c-Jun氨基末端激酶(JNK)信号通路和miR-203诱导鼻咽癌的发生发展和辐射抵抗,这提示linc00114是一种很有前景的与鼻咽癌发生发展和辐射抵抗相关的生物标志物[34]。此外,lncRNA MALAT1在鼻咽癌细胞系和组织中显著上调,体内外实验结果均证实,敲除MALAT1基因可提高鼻咽癌细胞的辐射敏感性,其分子机制为MALAT1能够通过调节肿瘤干细胞的活性介导辐射抵抗,因此,MALAT1有望成为鼻咽癌患者治疗的靶点[35]。LncRNA TUG1在鼻咽癌组织和鼻咽癌细胞系中的表达水平高于正常鼻咽上皮组织和正常鼻咽细胞系,TUG1水平较高的鼻咽癌患者的总存活率较低,TUG1下调可以抑制EMT,降低鼻咽癌细胞的增殖、迁移和侵袭能力,而过表达TUG1则显著促进鼻咽癌细胞的增殖、迁移和侵袭[36]。
-
胃癌是全球最常见的恶性肿瘤之一,是恶性肿瘤第三大病死原因。近些年的研究结果证实,lncRNA在胃癌的诊断和预后中或可扮演重要角色。既往研究结果证实,lncRNA MALAT1能够促进结直肠癌的EMT和血管生成,过表达MALAT1能增强胃癌悬浮细胞的干性,MALAT1敲降后,胃癌悬浮细胞的放射敏感性和化疗敏感性均增强[37]。其机制为通过MALAT1直接与Y染色体性别决定区相关的高迁移率族盒蛋白2(Sox2)结合,增强Y染色体性别决定区相关的高迁移率族盒蛋白2(Sox2)的稳定性并促进其表达,Y染色体性别决定区相关的高迁移率族盒蛋白2(Sox2)敲降可以部分逆转MALAT1过表达对胃癌细胞干性的促进作用。也有研究通过筛选胃癌的肿瘤基因组(TCGA)数据库,确定了在胃癌组织中异常表达的关键lncRNA瞬时受体电位M2反义RNA(TRPM2-AS)[38],其可作为miRNA的“海绵”或竞争性内源RNA抑制肿瘤与miR-612结合,从而调节胰岛素样生长因子2 mRNA结合蛋白1(IGF2BP1)和叉头框蛋白M1(FOXM1)的表达,胰岛素样生长因子2 mRNA结合蛋白1上调后提高c-Myc的表达,最终促进癌细胞的发生发展。此外,lincRNA p21也能够通过靶向β-catenin信号通路提高胃癌细胞的放疗敏感性[39]。
-
LncRNA参与了包括非小细胞肺癌(non-small cell lung cancer,NSCLC)在内的多种肿瘤的发展。Wang和Hu[40]研究发现,浆细胞瘤变异易位 1(plasmacytoma variant translocation 1,PVT1)是NSCLC中上调最显著的lncRNA,NSCLC组织中的PVT1、共激活因子相关的精氨酸甲基转移酶 1(coactivator associated arginine methyltransferase 1,CARM1)、基质金属蛋白酶(matrix metalloprotein,MMP )-2、MMP-9和B淋巴细胞瘤2基因表达量升高,miR-424-5p和Bax表达量降低。PVT1敲降或过表达miR-424-5p后,PVT1、CARM1、MMP-2、MMP-9和B淋巴细胞瘤2基因下调,细胞增殖、迁移和浸润受阻;miR-424-5p、Bax上调,细胞凋亡增加,NSCLC细胞的辐射敏感性增强。Yu等[41]的研究结果表明,lncRNA SBF2反义RNA1(SBF2-AS1)敲降后,Muscleblind样蛋白3(MBNL3)下调,NSCLC细胞的辐射敏感性增强,细胞凋亡显著增加。LncRNA FAM201A能够通过竞争性靶向miR-370提高EGFR和缺氧诱导因子1α(hypoxia inducible factor-1α,HIF-1α)的水平;FAM201A敲降后,EGFR和HIF-1α的水平降低,细胞的放射敏感性增强[42]。电离辐射能有效促进lncRNA 生长阻滞特异性转录物5(growth arrest-specific transcript 5,GAS5)与miR-21/PTEN/Akt轴之间的相互作用,lncRNA GAS5对NSCLC具有放射增敏作用[43]。有研究结果表明,linc00461和人类同源异型盒基因A10(HOXA10)在原发性和转移性肺腺癌中高表达;同时linc00461可与miR-195结合,通过人类同源异型盒基因A10促进肺腺癌细胞的迁移和侵袭,并降低癌细胞的放射敏感性,为肺腺癌的靶向治疗提供了新的依据[44]。LncRNA结直肠肿瘤差异表达基因(colorectal neoplasia differentially expressed,CRNDE)在肺腺癌(lung adenocarcinoma,LAD)组织和辐射抵抗的LAD细胞系中显著上调,CRNDE的高表达与NSCLC的低分化、TNM分期、淋巴结转移、放疗疗效和总生存期显著缩短均密切相关。功能获得和功能丧失实验结果表明,CRNDE敲降可以通过影响体外培养的LAD细胞的G1/S期转换和诱导细胞凋亡影响LAD细胞的放射敏感性[45]。
-
宫颈癌是最常见的妇科恶性肿瘤之一,是一种世界范围内病死率较高的妇科疾病,目前包括放化疗在内的针对宫颈癌的治疗有效率均偏低。MALAT1是一种在包括宫颈癌在内的多种肿瘤中发挥致癌作用的lncRNA,MALAT1在放射抵抗的肿瘤组织中的表达水平明显高于放射敏感的肿瘤组织。有研究结果证实,在高危型人乳头状瘤病毒(HR-HPV)阳性患者的宫颈癌细胞中,MALAT1和miR-145的表达呈负相关,敲除MALAT1基因的人宫颈癌肠转移CaSki和人宫颈癌Hela细胞受到辐射后的集落形成率明显降低,G2/M期阻滞比例明显升高,细胞凋亡率明显升高,辐射敏感性提高[46]。放疗联合linc00958沉默、下调人核糖核苷酸还原酶M2(RRM2)或过表达miR-5095在体内外均能抑制宫颈癌细胞的增殖和肿瘤生长,同时促进细胞凋亡。Linc00958可通过海绵化miR-5095提高人核糖核苷酸还原酶M2水平,从而调节宫颈癌细胞对放疗的敏感性[47]。LncRNA GAS5过表达可通过miR-106b上调人早期应答基因3(IER3),增强宫颈癌细胞对放疗的敏感性[48]。放疗可降低肿瘤组织、Hela细胞和C33A细胞中HOTAIR和HIF-1α的表达,而HOTAIR过表达可阻断辐射对宫颈癌Hela和宫颈癌C33A的细胞活力和细胞凋亡的影响[49]。因此,阐明宫颈癌中lncRNA介导肿瘤细胞放射敏感性的分子机制,或可为今后宫颈癌的治疗提供潜在的诊断和治疗靶点[50]。
-
放疗是一种重要的肿瘤治疗方法,但其有效性受肿瘤细胞辐射抗性的影响。目前,肿瘤耐辐射的潜在机制尚未完全阐明,降低肿瘤细胞的辐射抗性、增强其辐射敏感性是恶性肿瘤研究领域的重要内容之一。
LncRNA已经被证明可参与多种生物过程,如转录调控、蛋白修饰、翻译及RNA-蛋白和(或)蛋白-蛋白复合物的形成,通过靶向蛋白或miRNA调控细胞凋亡、EMT、DNA损伤修复等多个过程,最终影响肿瘤对辐射的敏感性。就分子机制来说,lncRNA可通过miRNA、蛋白和相关信号通路介导肿瘤细胞的辐射抵抗,其中,miRNA参与多种lncRNA介导的辐射抵抗过程。研究结果显示,miRNA在肿瘤细胞的进展以及耐药性方面也发挥关键作用[51],且部分lncRNA可调节多种肿瘤的放射敏感性,如,MALAT1在结直肠癌、食管癌和鼻咽癌中都有促进辐射抵抗的作用,这为非编码RNA诱导的肿瘤的辐射抵抗和耐药性的治疗提供了一些新思路。此外,近年来有关lncRNA在肿瘤中表达的研究进展提示了其作为生物标志物在患者诊断和预后中的潜在作用,但还没有研究揭示放疗疗效与lncRNA作为放疗患者的生物标志物之间的关系,因此有必要对临床放疗敏感性与lncRNA的相关性进行研究,进而直接证明lncRNA与肿瘤细胞放疗敏感性的关系,也将为今后lncRNA放疗相关靶向分子制剂的临床研究提供可能。同时,这一领域还需要进行更多的基础和临床研究对lncRNA和信号分子如何协同作用进行探讨,从而调节肿瘤细胞的放射敏感性,研究和阐明lncRNA在放疗中的应用价值,为肿瘤治疗带来新的突破。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明 赵舒雅负责文献的收集与整理、 综述的撰写;李航、樊赛军负责综述的修改与审阅。
LncRNA调控肿瘤细胞辐射敏感性作用的研究进展
Research progress in the role of lncRNA in regulating radiationsensitivity of cancer cells
-
摘要: 放疗是治疗恶性肿瘤的主要方法之一,但放疗的效果在不同类型的肿瘤及个体间都存在差异,解决这一问题的重要手段之一是提高肿瘤的放射敏感性。长链非编码RNA(lncRNA)通过多种机制影响肿瘤细胞的放射敏感性,未来有望成为放疗的辅助治疗靶点。笔者综述了lncRNA参与肿瘤放疗抵抗过程的作用模式及其相关的分子机制。Abstract: Radiotherapy is one of the main modalities of cancer treatment, but the benefits from radiotherapy varies among different types of tumors and individuals. One of the important means to solve this problem is to improve the radiosensitivity of tumor tissues. Recent studies have shown that long non-coding RNA (lncRNA) influences the radiosensitivity of tumor cells through multiple mechanisms, and is expected to be an adjuvant therapeutic target for radiotherapy in the near future. In this paper, the authors review the action of lncRNA involved in the process of tumor radiotherapy resistance and its related molecular mechanisms.
-
Key words:
- Radiation tolerance /
- Radiotherapy /
- RNA, long non-coding
-
表 1 不同类型肿瘤中对放射敏感性具有调节作用的lncRNA
Table 1. LncRNA with regulatory effects on radiosensitivity in different tumor types
肿瘤
类型LncRNA 靶点/生物学过程· 调控放射
敏感性参考
文献肿瘤
类型LncRNA 靶点/生物学过程· 调控放射
敏感性参考
文献结直肠癌 MALAT1 MiR-101-3p 抵抗 [13] 鼻咽癌 linc00114 ERK/JNK信号通路
与MiR-203抵抗 [34] lnc-RI MiR-4727-5p 抵抗 [14] MALAT1 MiR-1 抵抗 [35] OIP5-AS1 MiR-369-3p 抵抗 [15] TUG1 EMT 抵抗 [36] ROR MiR-145 抵抗 [16] 胃癌 MALAT1 SOX2 抵抗 [37] linc00460 EMT 抵抗 [17] TRPM2-AS MiR-612 抵抗 [38] 食管癌 linc00473 MiR-374a-5p 抵抗 [18] lincRNA p21 β-catenin信号通路 增敏 [39] MALAT1 YAP 抵抗 [19] 肺癌 PVT1 MiR-424-5p 抵抗 [40] FAM201A MiR-101 抵抗 [20] SBF2-AS1 MBNL3 抵抗 [41] Rpph1 Bax/caspase-3 抵抗 [21] FAM201A MiR-370 抵抗 [42] TUG1 MiR-144-3p 抵抗 [22] GAS5 MiR-21 增敏 [43] 肝癌 NEAT1_2 MiR-101-3p 抵抗 [23] linc00461 MiR-195 抵抗 [44] TP73-AS1 PTEN 抵抗 [24] CRNDE G1/S期 抵抗 [45] TUG1 PRC2 抵抗 [25-26] 宫颈癌 MALAT1 MiR-145 抵抗 [46] SUMO1P3 − 抵抗 [27] linc00958 MiR-5095 抵抗 [47] 乳腺癌 HOTAIR MiR-218 抵抗 [28] GAS5 MiR-106b 增敏 [48] MiR-449b-5p 抵抗 [29] HOTAIR Wntv信号通路 抵抗 [49] linc00963 DNA损伤修复 抵抗 [30] linc02582 miR-200C 抵抗 [31] linc00511 miR-324-3p 抵抗 [32] PCAT6 MiR-185-5p 抵抗 [33] 注:lncRNA为长链非编码RNA;MALAT1为肺腺癌转录本1;OIP5-AS1为Opa相互作用蛋白5反义转录本1;ROR为重编程调控因子;FAM201A为序列相似性家族201-成员A;Rpph1为核糖核酸酶P RNA组份H1;TUG1为牛磺酸上调基因1;NEAT1_2为核富集转录本1;TP73-AS1为p53依赖性凋亡调节物;SUMO1P3为小泛素样修饰蛋白1假基因3;HOTAIR为人类同源异型盒基因转录反义RNA;PCAT6为前列腺相关转录本6;EMT为上皮-间充质转化;YAP为Yes相关蛋白;Bax为Bcl-2相关X蛋白质;PTEN为人第10号染色体缺失的磷酸酶及张力蛋白同源的基因;PRC2为多梳蛋白抑制复合体 2;DNA为脱氧核糖核酸;TRPM2-AS为瞬时受体电位M2反义RNA;PVT1为浆细胞瘤变异易位1;SBF2-AS1为SBF2反义RNA1;GAS5为生长阻滞特异性转录物5;CRNDE为结直肠肿瘤差异表达基因;ERK为细胞外调节蛋白激酶;JNK为c-Jun氨基末端激酶;SOX2为Y染色体性别决定区相关的高迁移率族盒蛋白2;MBNL3为Muscleblind样蛋白3;−表示文献中无此内容 -
[1] Matsui M, Corey DR. Non-coding RNAs as drug targets[J]. Nat Rev Drug Dis, 2017, 16(3): 167−179. DOI: 10.1038/nrd.2016.117. [2] Ravasi T, Suzuki H, Pang KC, et al. Experimental validation of the regulated expression of large numbers of non-coding RNAs from the mouse genome[J]. Genome Res, 2006, 16(1): 11−19. DOI: 10.1101/gr.4200206. [3] Wang P, Li X, Gao Y, et al. LnCeVar: a comprehensive database of genomic variations that disturb ceRNA network regulation[J]. Nucleic Acids Res, 2019, 48(D1): D111−D117. DOI: 10.1093/nar/gkz887. [4] 胡悦, 黄瑞雪. 肿瘤放射治疗抵抗相关lncRNA的研究进展[J]. 毒理学杂志, 2019, 30(4): 327−331.
Hu Y, Huang RX. Advances in the study of lncRNA associated with tumor radiation therapy resistance[J]. J Toxicol, 2019, 30(4): 327−331.[5] 于多, 吕欣, 金顺子. 长链非编码RNA的作用机制及其与肿瘤和放射敏感性的研究进展[J]. 中华放射医学与防护杂志, 2014, 34(8): 627−630. DOI: 10.3760/cma.j.issn.0254-5098.2014.08.017.
Yu D, Lyu X, Jin SZ. Advances in the mechanism of action of long-stranded non-coding RNAs and their association with tumor and radiosensitivity[J]. Chin J Radiol Med Prot, 2014, 34(8): 627−630. DOI: 10.3760/cma.j.issn.0254-5098.2014.08.017.[6] Schmidbauer B, Menhart K, Hellwig D, et al. Differentiated thyroid cancer-treatment: state of the art[J/OL]. Int J Mol Sci, 2017, 18(6): 1292[2021-01-17]. https://www.mdpi.com/1422-0067/18/6/1292. DOI: 10.3390/ijms18061292. [7] 周宇杰, 徐细明. 长链非编码RNA在放射治疗中的研究进展[J]. 临床误诊误治, 2017, 30(9): 106−110. DOI: 10.3969/j.issn.1002-3429.2017.09.037.
Zhou YJ, Xu XM. Advances in the study of long-stranded non-coding RNA in radiation therapy[J]. Clin Misdiag Misther, 2017, 30(9): 106−110. DOI: 10.3969/j.issn.1002-3429.2017.09.037.[8] Yang F, Deng XX, Ma WX, et al. The lncRNA Firre anchors the inactive X chromosome to the nucleolus by binding CTCF and maintains H3K27me3 methylation[J]. Genome Biol, 2015, 16: 52. DOI: 10.1186/s13059-015-0618-0. [9] Hou Y, Zhang RX, Sun X. Enhancer lncRNAs influence chromatin interactions in different ways[J/OL]. Front Genet, 2019, 10: 936[2021-01-17]. https://www.frontiersin.org/articles/10.3389/fgene.2019.00936/full. DOI: 10.3389/fgene.2019.00936. [10] Antonicka H, Sasarman F, Nishimura T, et al. The mitochondrial RNA-binding protein GRSF1 localizes to RNA granules and is required for posttranscriptional mitochondrial gene expression[J]. Cell Metab, 2013, 17(3): 386−398. DOI: 10.1016/j.cmet.2013.02.006. [11] Chu C, Qu K, Zhong FL, et al. Genomic maps of long noncoding RNA occupancy reveal principles of RNA-chromatin interactions[J]. Mol Cell, 2011, 44(4): 667−678. DOI: 10.1016/j.molcel.2011.08.027. [12] Zhu JM, Chen SS, Yang BX, et al. Molecular mechanisms of lncRNAs in regulating cancer cell radiosensitivity[J]. Biosci Rep, 2019, 39(8): BSR20190590. DOI: 10.1042/BSR20190590. [13] Guo JH, Ding YH, Yang HB, et al. RETRACTED: aberrant expression of lncRNA MALAT1 modulates radioresistance in colorectal cancer in vitro via miR-101-3p sponging[J]. Exp Mol Pathol, 2020, 115: 104448. DOI: 10.1016/j.yexmp.2020.104448. [14] Liu RX, Zhang QT, Shen LP, et al. Long noncoding RNA lnc-RI regulates DNA damage repair and radiation sensitivity of CRC cells through NHEJ pathway[J]. Cell Biol Toxicol, 2020, 36(5): 493−507. DOI: 10.1007/s10565-020-09524-6. [15] Zou YM, Yao S, Chen XQ, et al. LncRNA OIP5-AS1 regulates radioresistance by targeting DYRK1A through miR-369-3p in colorectal cancer cells[J]. Eur J Cell Biol, 2018, 97(5): 369−378. DOI: 10.1016/j.ejcb.2018.04.005. [16] Yang PX, Yang Y, An WW, et al. The long noncoding RNA-ROR promotes the resistance of radiotherapy for human colorectal cancer cells by targeting the p53/miR-145 pathway[J]. J Gastroenterol Hepatol, 2017, 32(4): 837−845. DOI: 10.1111/jgh.13606. [17] Zhang JN, Ding LX, Sun GF, et al. Suppression of LINC00460 mediated the sensitization of HCT116 cells to ionizing radiation by inhibiting epithelial-mesenchymal transition[J]. Toxicol Res (Camb), 2020, 9(2): 107−116. DOI: 10.1093/toxres/tfaa010. [18] Chen WZ, Zhang YS, Wang HJ, et al. LINC00473/miR-374a-5p regulates esophageal squamous cell carcinoma via targeting SPIN1 to weaken the effect of radiotherapy[J]. J Cell Biochem, 2019, 120(9): 14562−14572. DOI: 10.1002/jcb.28717. [19] Yao Q, Yang J, Liu T, et al. Long noncoding RNA MALAT1 promotes the stemness of esophageal squamous cell carcinoma by enhancing YAP transcriptional activity[J/OL]. FEBS Open Bio, 2019, 9(8): 1392−1402[2021-01-17]. https://febs.onlinelibrary.wiley.com/doi/10.1002/2211-5463.12676. DOI: 10.1002/2211-5463.12676. [20] Chen MQ, Liu PP, Chen YG, et al. Long noncoding RNA FAM201A mediates the radiosensitivity of esophageal squamous cell cancer by regulating ATM and mTOR expression via miR-101[J/OL]. Front Genet, 2018, 9: 611[2021-01-17]. https://www.frontiersin.org/articles/10.3389/fgene.2018.00611/full. DOI: 10.3389/fgene.2018.00611. [21] Li ZY, Li HF, Zhang YY, et al. Value of long non-coding RNA Rpph1 in esophageal cancer and its effect on cancer cell sensitivity to radiotherapy[J]. World J Gastroenterol, 2020, 26(15): 1775−1791. DOI: 10.3748/wjg.v26.i15.1775. [22] Wang P, Yang ZB, Ye T, et al. LncTUG1/miR-144-3p affect the radiosensitivity of esophageal squamous cell carcinoma by competitively regulating c-MET[J]. J Exp Clin Cancer Res, 2020, 39(1): 7. DOI: 10.1186/s13046-019-1519-y. [23] Chen X, Zhang NB. Downregulation of lncRNA NEAT1_2 radiosensitizes hepatocellular carcinoma cells through regulation of miR-101-3p/WEE1 axis[J]. Cell Biol Int, 2019, 43(1): 44−55. DOI: 10.1002/cbin.11077. [24] Song W, Zhang JJ, Xia QX, et al. Down-regulated lncRNA TP73-AS1 reduces radioresistance in hepatocellular carcinoma via the PTEN/Akt signaling pathway[J]. Cell Cycle, 2019, 18(22): 3177−3188. DOI: 10.1080/15384101.2019.1671089. [25] Huang MD, Chen WM, Qi FZ, et al. Long non-coding RNA TUG1 is up-regulated in hepatocellular carcinoma and promotes cell growth and apoptosis by epigenetically silencing of KLF2[J/OL]. Mol Cancer, 2015, 14: 165[2021-01-17]. https://molecular-cancer.biomedcentral.com/articles/10.1186/s12943-015-0431-0. DOI: 10.1186/s12943-015-0431-0. [26] 孟碧, 王梦洁, 刘阳晨. LncRNA在消化道肿瘤放疗敏感性中的作用及机制[J]. 癌症进展, 2017, 15(7): 740−744. DOI: 10.11877/j.issn.1672-1535.2017.15.07.06.
Meng B, Wang MJ, Liu YC. The role and mechanism of lncRNA in the sensitivity of radiotherapy for gastrointestinal tumors[J]. Oncol Prog, 2017, 15(7): 740−744. DOI: 10.11877/j.issn.1672-1535.2017.15.07.06.[27] Zhou Y, He P, Xie XH, et al. Knockdown of SUMO1P3 represses tumor growth and invasion and enhances radiosensitivity in hepatocellular carcinoma[J]. Mol Cell Biochem, 2019, 450(1/2): 125−134. DOI: 10.1007/s11010-018-3379-8. [28] Hu XG, Ding D, Zhang JY, et al. Knockdown of lncRNA HOTAIR sensitizes breast cancer cells to ionizing radiation through activating miR-218[J]. Biosci Rep, 2019, 39(4): BSR20181038. DOI: 10.1042/BSR20181038. [29] Zhang SQ, Wang B, Xiao HW, et al. LncRNA HOTAIR enhances breast cancer radioresistance through facilitating HSPA1A expression via sequestering miR-449b-5p[J]. Thorac Cancer, 2020, 11(7): 1801−1816. DOI: 10.1111/1759-7714.13450. [30] Zhang N, Zeng X, Sun CN, et al. LncRNA LINC00963 promotes tumorigenesis and radioresistance in breast cancer by sponging miR-324-3p and inducing ACK1 expression[J/OL]. Mol Ther Nucleic Acids, 2019, 18: 871−881[2021-01-17]. https://linkinghub.elsevier.com/retrieve/pii/S2162253119303233. DOI: 10.1016/j.omtn.2019.09.033. [31] Wang BY, Zheng JL, Li R, et al. Long noncoding RNA LINC02582 acts downstream of miR-200c to promote radioresistance through CHK1 in breast cancer cells[J/OL]. Cell Death Dis, 2019, 10(10): 764[2021-01-17]. https://www.nature.com/articles/s41419-019-1996-0. DOI: 10.1038/s41419-019-1996-0. [32] Liu L, Zhu Y, Liu AM, et al. Long noncoding RNA LINC00511 involves in breast cancer recurrence and radioresistance by regulating STXBP4 expression via miR-185[J]. Eur Rev Med Pharmacol Sci, 2019, 23(17): 7457−7468. DOI: 10.26355/eurrev_201909_18855. [33] Shi R, Wu P, Liu M, et al. Knockdown of lncRNA PCAT6 enhances radiosensitivity in triple-negative breast cancer cells by regulating miR-185-5p/TPD52 axis[J/OL]. Onco Targets Ther, 2020, 13: 3025−3037[2021-01-17]. https://www.dovepress.com/knockdown-of-lncrna-pcat6-enhances-radiosensitivity-in-triple-negative-peer-reviewed-fulltext-article-OTT. DOI: 10.2147/OTT.S237559. [34] Han YY, Liu K, Xie J, et al. LINC00114 promoted nasopharyngeal carcinoma progression and radioresistance in vitro and in vivo through regulating ERK/JNK signaling pathway via targeting miR-203[J/OL]. Eur Rev Med Pharmacol Sci, 2020, 24(5): 2491−2504[2021-01-17]. https://www.europeanreview.org/article/20517. DOI: 10.26355/eurrev_202003_20517. [35] Jin C, Yan BC, Lu Q, et al. The role of MALAT1/miR-1/slug axis on radioresistance in nasopharyngeal carcinoma[J]. Tumour Biol, 2016, 37(3): 4025−4033. DOI: 10.1007/s13277-015-4227-z. [36] Qian W, Ren ZT, Lu XG. Knockdown of long non-coding RNA TUG1 suppresses nasopharyngeal carcinoma progression by inhibiting epithelial-mesenchymal transition (EMT) via the promotion of miR-384[J]. Biochem Biophys Res Commun, 2019, 509(1): 56−63. DOI: 10.1016/j.bbrc.2018.12.011. [37] Xiao YW, Pan JJ, Geng Q, et al. LncRNA MALAT1 increases the stemness of gastric cancer cells via enhancing SOX2 mRNA stability[J/OL]. FEBS Open Bio, 2019, 9(7): 1212−1222[2021-01-17]. https://febs.onlinelibrary.wiley.com/doi/10.1002/2211-5463.12649. DOI: 10.1002/2211-5463.12649. [38] Xiao J, Lin LL, Luo DK, et al. Long noncoding RNA TRPM2-AS acts as a microRNA sponge of miR-612 to promote gastric cancer progression and radioresistance[J/OL]. Oncogenesis, 2020, 9(3): 29[2021-01-17]. https://www.nature.com/articles/s41389-020-0215-2. DOI: 10.1038/s41389-020-0215-2. [39] Chen LJ, Yuan DF, Yang YC, et al. LincRNA-p21 enhances the sensitivity of radiotherapy for gastric cancer by targeting the β-catenin signaling pathway[J]. J Cell Biochem, 2019, 120(4): 6178−6187. DOI: 10.1002/jcb.27905. [40] Wang D, Hu Y. Long non-coding RNA PVT1 competitively binds microRNA-424-5p to regulate CARM1 in radiosensitivity of non-small-cell lung cancer[J/OL]. Mol Ther Nucleic Acids, 2019, 16: 130−140[2021-01-17]. https://linkinghub.elsevier.com/retrieve/pii/S2162253118303214. DOI: 10.1016/j.omtn.2018.12.006. [41] Yu ZW, Wang GB, Zhang CL, et al. LncRNA SBF2-AS1 affects the radiosensitivity of non-small cell lung cancer via modulating microRNA-302a/MBNL3 axis[J]. Cell Cycle, 2020, 19(3): 300−316. DOI: 10.1080/15384101.2019.1708016. [42] Liu AM, Zhu Y, Huang ZW, et al. Long noncoding RNA FAM201A involves in radioresistance of non-small-cell lung cancer by enhancing EGFR expression via miR-370[J]. Eur Rev Med Pharmacol Sci, 2019, 23(13): 5802−5814. DOI: 10.26355/eurrev_201907_18319. [43] Chen L, Ren P, Zhang YD, et al. Long non-coding RNA GAS5 increases the radiosensitivity of A549 cells through interaction with the miR-21/PTEN/Akt axis[J]. Oncol Rep, 2020, 43(3): 897−907. DOI: 10.3892/or.2020.7467. [44] Hou JQ, Wang YJ, Zhang HM, et al. Silencing of LINC00461 enhances radiosensitivity of lung adenocarcinoma cells by down-regulating HOXA10 via microRNA-195[J]. J Cell Mol Med, 2020, 24(5): 2879−2890. DOI: 10.1111/jcmm.14859. [45] Zhang M, Gao C, Yang Y, et al. Long noncoding RNA CRNDE/PRC2 participated in the radiotherapy resistance of human lung adenocarcinoma through targeting p21 expression[J]. Oncol Res, 2018, 26(8): 1245−1255. DOI: 10.3727/096504017X14944585873668. [46] Lu HZ, He Y, Lin L, et al. Long non-coding RNA MALAT1 modulates radiosensitivity of HR-HPV+ cervical cancer via sponging miR-145[J]. Tumor Biol, 2016, 37(2): 1683−1691. DOI: 10.1007/s13277-015-3946-5. [47] Zhao H, Zheng GH, Li GC, et al. Long noncoding RNA LINC00958 regulates cell sensitivity to radiotherapy through RRM2 by binding to microRNA-5095 in cervical cancer[J]. J Cell Physiol, 2019, 234(12): 23349−23359. DOI: 10.1002/jcp.28902. [48] Gao JB, Liu LY, Li GL, et al. LncRNA GAS5 confers the radio sensitivity of cervical cancer cells via regulating miR-106b/IER3 axis[J]. Int J Biol Macromol, 2019, 126: 994−1001. DOI: 10.1016/j.ijbiomac.2018.12.176. [49] Li N, Meng DD, Gao L, et al. Overexpression of HOTAIR leads to radioresistance of human cervical cancer via promoting HIF-1α expression[J/OL]. Radiat Oncol, 2018, 13(1): 210[2021-01-17]. https://ro-journal.biomedcentral.com/articles/10.1186/s13014-018-1153-4. DOI: 10.1186/s13014-018-1153-4. [50] Yang Z, Gu QY, Wang Y, et al. Heavy-ion carbon radiation regulates long non-coding RNAs in cervical cancer HeLa cells[J/OL]. J Cancer, 2019, 10(21): 5022-5030[2021-01-17]. https://www.jcancer.org/v10p5022.htm. DOI: 10.7150/jca.30846. [51] Fang YZ, Zhang L, Li ZH, et al. MicroRNAs in DNA damage response, carcinogenesis, and chemoresistance[J/OL]. Int Rev Cell Mol Biol, 2017, 333: 1−49[2021-01-17]. https://www.sciencedirect.com/science/article/abs/pii/S1937644817300266. DOI: 10.1016/bs.ircmb.2017.03.001. -





 下载:
下载: