-
化疗和异基因造血干细胞移植是行之有效的治疗急性白血病(acute leukemia,AL)的方法,随着医学技术的进步,大部分患者可获得完全缓解;但随着无病生存期的延长,仍有部分患者出现AL复发,这已成为AL治疗失败的主要原因[1]。临床上,AL的诊断不依赖于影像学检查方法,骨髓穿刺活检是确切诊断和复发监测的主要方法,但是其存在一定的风险[2-3]。PET/CT在淋巴瘤和实体肿瘤中的应用价值已得到广泛认可,对于可疑的AL髓外浸润灶,也有研究结果证实18F-FDG PET/CT能够比常规影像学方法检出更多的髓外浸润病灶[4-6]。
但关于18F-FDG PET/CT对AL髓内复发的诊断价值,学术界仍存在争议,有学者认为其价值取决于骨髓18F-FDG的摄取模式[7],也有研究者认为取决于18F-FDG的摄取程度[8]。本研究回顾性分析经骨髓移植术后临床可疑复发并行18F-FDG PET/CT显像的AL患者的图像及病历资料,重点探讨18F-FDG PET/CT对髓内复发的诊断价值。
-
回顾性分析2016年11月至2019年11月于河北燕达医院核医学科行18F-FDG PET/CT 检查的96例AL可疑复发患者的图像和病历资料。复发依据:包括但不限于骨髓活检发现不明异常细胞,RBC计数或WBC、血小板计数低于正常参考值。
纳入标准:(1)临床确诊AL,行异基因造血干细胞移植,骨髓穿刺活检提示达到完全缓解;(2)临床随访怀疑复发,但尚未开始治疗;(3)1周内已行骨髓穿刺活检;(4)可获得完整的病历记录和至少6个月的临床随访资料。排除标准:(1)1个月内曾接受造血细胞刺激因子或糖皮质激素治疗;(2)病历记录不完整或失访;(3)1周内未进行骨髓穿刺活检、缺乏病理资料;(4)中度及以上发热(体温大于38℃)。
96例患者中,10例因1个月内接受粒细胞刺激因子治疗(其中3例合并中度以上发热)而被排除;5例未接受骨髓穿刺活检被排除。最终共纳入患者81例,其中男性45例、女性36例,年龄3~55(25.14±15.07)岁;包括50例急性髓系白血病患者和31例急性淋巴细胞白血病患者。所有患者末次治疗(骨髓移植)距PET/CT检查时间为 30~90 d,中位时间38 d。本研究符合《赫尔辛基宣言》的原则。
AL完全缓解和复发的定义参照中华医学会血液学分会制定的《复发难治性急性髓系白血病中国诊疗指南(2017年版)》[9]。本研究以光镜下细胞形态学为复发标准,不包含分子生物学水平的复发。以骨髓穿刺活检的组织病理学检查结果为“金标准”(幼稚细胞比例>5%判定为复发,否则判定为无复发),将81例患者分为复发组(41例)和无复发组(40例),复查时间间隔为治疗后6周。
-
使用美国通用电气公司Discovery VCT PET/CT 显像仪,所有患者检查前均空腹至少6 h,将血糖控制在7.5 mmol/L 以下,取仰卧位,成人扫描范围自颅底至大腿上段,儿童及青少年(身高<120 cm)自颅底至足底。18F-FDG由南京江原安迪科正电子研究发展有限公司燕郊分公司提供,放射化学纯度>95%,按5.55 MBq/kg 静脉注射,患者休息50~60 min后显像。CT扫描参数:管电压140 keV,管电流通过 Smart CT 系统自动设定,矩阵512×512,层厚3.3 mm。PET扫描参数:2 min/床位,三维模式采集,采集完成后PET与CT均采用有序子集最大期望值法进行重建,重建参数:矩阵 128×128,层厚4.25 mm。用CT数据对PET图像进行衰减校正,经计算机处理后重建出(冠状面、矢状面、横断面)PET、CT及PET/CT融合图像,图像层厚3.0 mm。所有患者或家属均于检查前签署了知情同意书。
-
由2名有8年以上工作经验的核医学副主任医师对18F-FDG PET/CT图像进行分析,除骨髓穿刺活检结果外,允许其参考相应的临床实验室资料。在矢状面图像上,测量第4腰椎体的SUVmax作为中轴骨SUVmax;在冠状面图像上,测量股骨大转子水平股骨髓腔的SUVmax作为附肢骨的SUVmax;脊柱第4腰椎椎体的SUVmax作为骨髓的SUVmax。选择肝左右叶交界区,避开门静脉血管进行ROI测量,得到肝脏本底的SUVmax(记为肝脏SUVmax)。计算附肢骨SUVmax/中轴骨SUVmax和骨髓SUVmax/肝脏SUVmax比值。骨髓18F-FDG摄取以肝脏本底为参照,高于肝脏本底判定为阳性(其中,分布不均匀、多发灶性高代谢定义为多灶性摄取,放射性均匀判定为弥漫性摄取);等于或低于肝脏本底判定为阴性。病灶消失判断标准为原18F-FDG高摄取病灶摄取程度降低至与周围正常组织本底相等,低于肝实质本底,或者SUVmax≤0.8。以上述半定量参数及其不同的临界值和ROC曲线进行分析,计算AUC和诊断AL髓内复发的效能。
考虑到存在漏诊的可能,当18F-FDG PET/CT检出骨髓内局灶性高摄取,并经临床规范化疗后再次行18F-FDG PET/CT复查显示病灶消失,也判定为阳性病灶;若髂骨穿刺部位出现灶性18F-FDG异常摄取,则判定为阴性。以视觉判读法为参照,分析并计算 18F-FDG PET/CT诊断AL髓内复发的灵敏度、特异度和准确率,并观察其特征。
-
应用SPSS 19.0软件进行统计学分析。符合正态分布的计量资料以
$ \bar{{x}} $ ±s表示,2组间半定量参数的比较采用独立样本t检验(方差齐);计数资料的比较采用Pearson卡方检验。ROC曲线用于计算诊断的临界值。P<0.05为差异有统计学意义。 -
81例患者的组织病理学检查(PET/CT检查前1周内)结果显示,7例阴性患者的18F-FDG PET/CT显像检出骨髓阳性摄取病灶,其中2例经组织病理学检查结果证实为AL复发,其余5例经临床随访证实(经化疗后的18F-FDG PET/CT显像结果显示原摄取增高病灶消失)。由表1可知,复发组与无复发组间的性别分布,差异无统计学意义(P=0.081);复发组比无复发组年龄略大,且差异有统计学意义(P=0.040);2组均有6例低热患者,体温37.3~37.8℃;2组患者脾肿大发生率的差异无统计学意义(P=0.224)。
项目 复发组(n=41) 无复发组(n=40) 检验值 P值 年龄(岁, ${{\bar x} } \pm s$ 

28.51±8.94 21.70±14.70 t=2.075 0.040 性别[例(%)] χ2=1.321 0.081 男性 24(58.53) 21(52.50) 女性 17(41.16) 19(47.50) 骨髓SUVmax/肝脏SUVmax t=2.186 0.032 $\bar x $ 

1.20±0.56 0.89±0.74 极值范围 0.50~2.78 0.28~5.12 附肢骨SUVmax/中轴骨SUVmax t=3.477 0.001 $\bar x $ 

1.58±1.38 0.79±0.37 极值范围 0.33~6.07 0.25~1.95 中轴骨SUVmax t=3.367 0.001 $\bar x $ 

3.10±1.65 1.99±1.26 极值范围 1.00~7.80 0.70~8.20 发热[例(%)] 6(14.63) 6(15.00) χ2=68.900 0.754 脾肿大[例(%)] 2(4.87) 1(2.50) χ2=2.980 0.224 注:SUVmax为最大标准化摄取值 表 1 81例急性白血病患者的临床及影像学资料
Table 1. The clinical manifestations and imaging features of 81 patients with acute leukemia
-
复发组与无复发组的骨髓SUVmax/肝脏SUVmax比值分别为1.20±0.56、0.89±0.74,差异有统计学意义(t=2.186,P=0.032);2组附肢骨SUVmax/中轴骨SUVmax 比值分别为1.58±1.38、0.79±0.37,差异有统计学意义(t=3.477,P=0.001)。
-
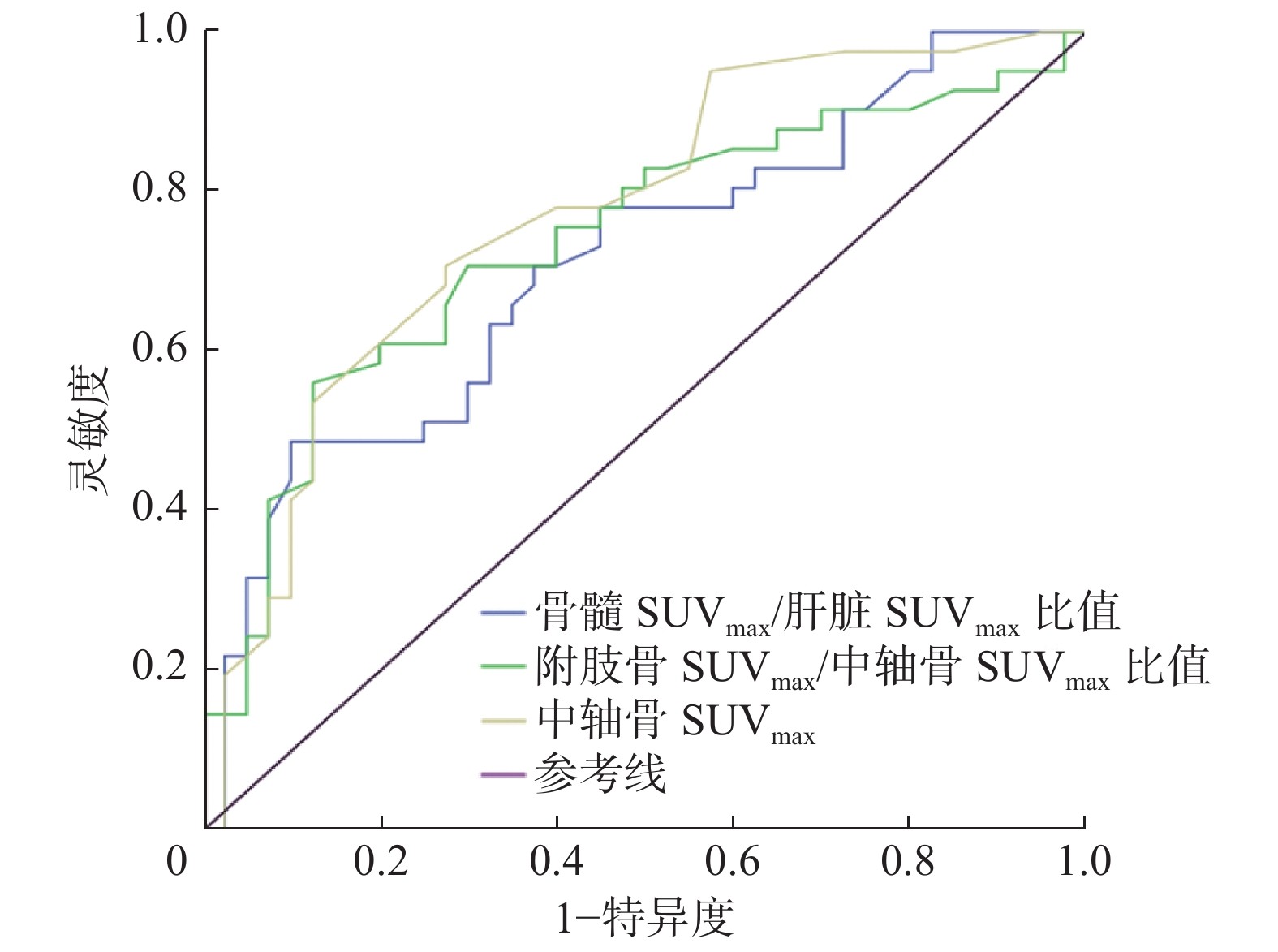
18F-FDG PET/CT代谢参数SUVmax诊断AL髓内复发的效能结果见表2;基于SUVmax的半定量参数诊断AL髓内复发灶的ROC曲线见图1。
参数 $\bar{{x} }$ 

AUC 95%CI 标准差 P值 临界值 灵敏度(%) 特异度(%) 准确率(%) 骨髓SUVmax/肝脏SUVmax比值 1.20±0.76 0.711 0.598~0.823 0.057 0.001 1.11 48.78(20/41) 90.00(36/40) 69.14(56/81) 附肢骨SUVmax/中轴骨SUVmax比值 1.43±1.24 0.738 0.628~0.848 0.056 <0.01 1.03 56.10(23/41) 87.50(35/40) 71.60(58/81) 中轴骨SUVmax 2.91±1.76 0.770 0.667~0.873 0.053 <0.01 2.05 70.73(29/41) 72.50(29/40) 71.60(58/81) 注:FDG为氟脱氧葡萄糖;PET为正电子发射断层显像术;CT为计算机体层摄影术;ROC为受试者工作特征;SUVmax为最大标准化摄取值;AUC为曲线下面积;CI为可信区间 表 2 81例急性白血病患者的18F-FDG PET/CT半定量参数及ROC曲线对髓内复发病灶的诊断效能
Table 2. Diagnostic efficacy of 18F-fluorodeoxyglucose PET/CT semiquantitative parameters and receiver operating characteristic curve in recurrent bone marrow lesions of 81 patients with acute leukemia
-
经组织病理学检查结果证实,共有41例髓内复发AL患者。以单发或多灶性骨髓摄取为髓内复发的诊断标准时,18F-FDG PET/CT的诊断灵敏度、特异度和准确率分别为71.43%(15/21)、100%(28/28)和87.76%(43/49);以弥漫性摄取为诊断标准时,其灵敏度、特异度和准确率分别为76.92%(20/26)、70.00%(28/40)和72.73%(48/66)。以多灶性摄取+弥漫性摄取为诊断标准时,灵敏度、特异度和准确率分别为85.37%(35/41)、70.00%(28/40)和77.78%(63/81)。在15例多灶性或孤立性摄取中,孤立性摄取2例,其余13例表现为多灶性摄取异常增高,典型病例见图2。复发组的20例弥漫性摄取表现为中轴骨及四肢骨的轻度或明显高于肝脏本底的摄取,且四肢骨髓腔的摄取范围累及长骨骨干和干骺端,尤其以双侧股骨和双侧肱骨更显著,大部分并非完全均匀性摄取,在均匀摄取增高的基础上同时伴有局灶性或结节状摄取(图3)。无复发组的弥漫性摄取呈双侧四肢长骨对称性分布,四肢骨髓腔摄取范围仅累及股骨或肱骨骨干的近段1/3~1/2区域(图4),其中6例合并有低热(体温37.3~37.8℃);髂骨的组织病理学检查结果显示:骨髓增生活跃,粒系细胞/红系细胞、粒系细胞、红系细胞、巨核细胞形态和各阶段细胞数比例未见异常,骨髓中未见异常幼稚细胞。18F-FDG PET/CT结果显示,12例假阳性,6例假阴性,其中2例合并中枢神经系统浸润。
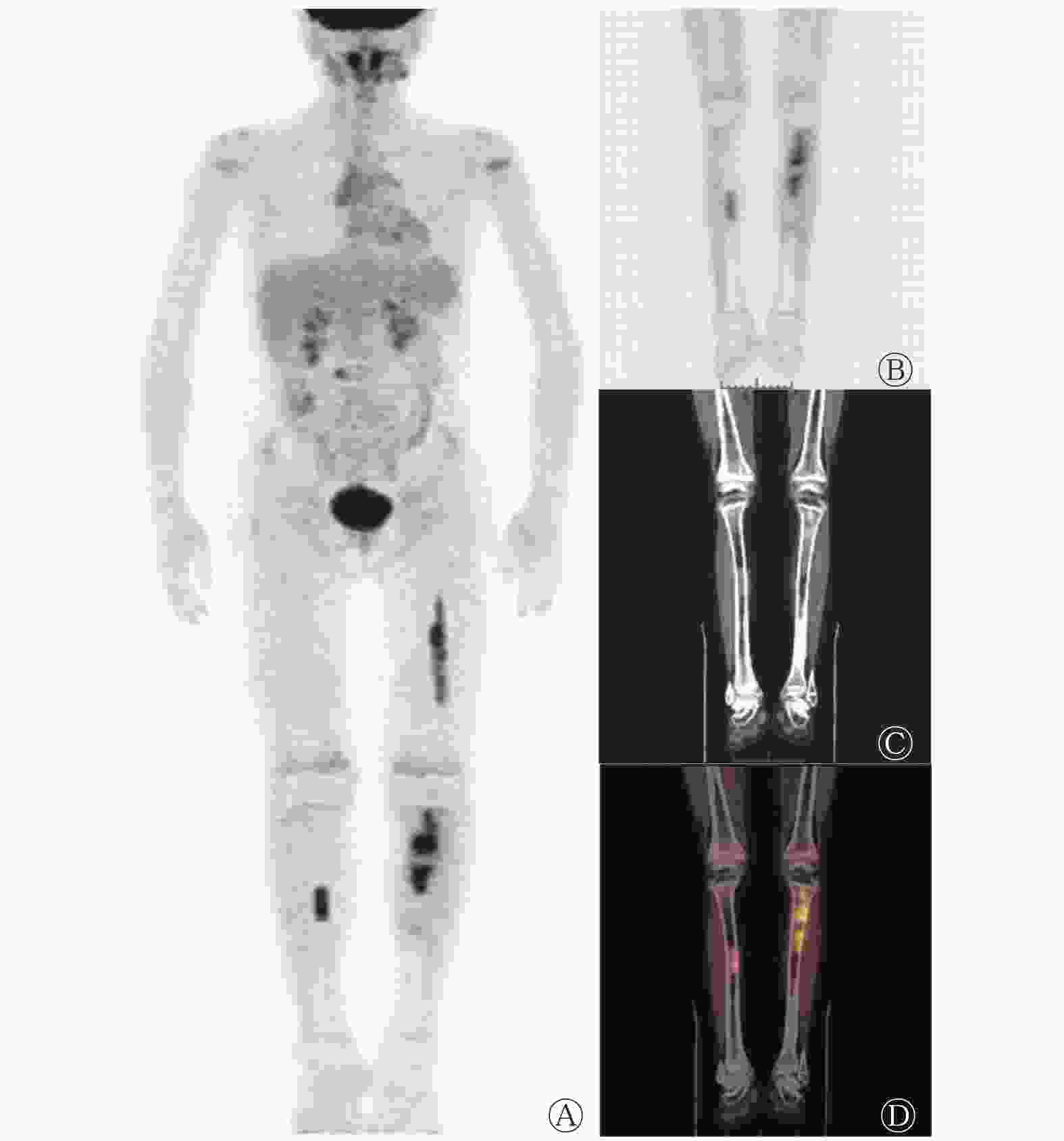
图 2 急性淋巴细胞白血病骨髓移植术后患者(女性,14岁)的18F-FDG PET/CT显像图
Figure 2. 18F-fluorodeoxyglucose PET/CT images of a patient (female, 14 years old) with acute lymphoblastic leukemia after bone marrow transplantation

图 3 急性淋巴细胞白血病骨髓移植术后患者(女性,32岁)的18F-FDG PET/CT显像图
Figure 3. 18F-fluorodeoxyglucose PET/CT images of a patient (female, 32 years old) with acute lymphoblastic leukemia after bone marrow transplantation
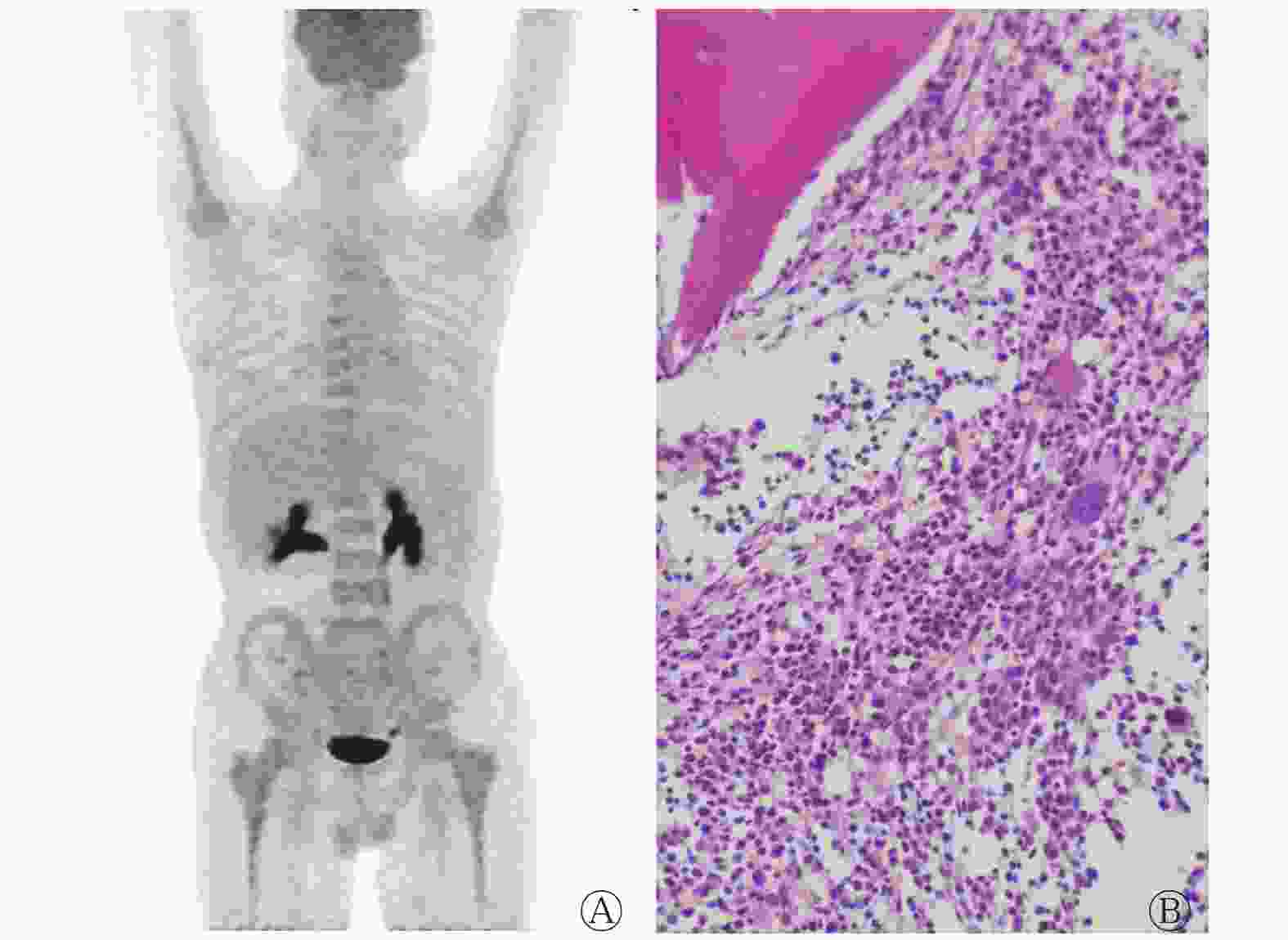
图 4 急性髓系白血病骨髓移植术后患者(男性,55岁)的18F-FDG PET/CT最大密度投影图(A)和组织病理学检查图(B,苏木精-伊红染色,×200)
Figure 4. 18F-fluorodeoxyglucose PET/CT maximum density projection imaging and histopathological examination image of a patient (male, 55 years old) with acute myeloid leukemia after bone marrow transplantation
AL复发组的主要表现为骨髓弥漫性摄取增高或多灶性摄取,二者总占比约为85.36%(35/41)。此外,视觉判读结果还显示,复发组骨髓弥漫性摄取18F-FDG的程度要高于无复发组;半定量测量结果显示,复发组患者的中轴骨SUVmax高于无复发组,且差异有统计学意义(4.16±2.03对1.54±0.54,t=3.768, P=0.003)。
-
AL复发是导致治疗失败的主要原因[10],尤其是髓外复发,早期诊断困难。早期全面评估髓内、外复发灶累及范围,有利于赢得最佳的治疗时机。既往有关18F-FDG PET/CT用于AL诊断多为个案报道,许多研究结果已证实其对AL髓外复发灶具有较高的诊断价值[11-12]。
而有关18F-FDG PET/CT对于髓内复发灶的诊断价值,学术界尚未达成一致。李河北等[13]发现,骨髓多灶性高摄取对AL髓内复发的诊断效能较高,准确率可达94.64%,而骨髓弥漫性摄取诊断AL髓内复发的灵敏度与准确率均不理想,仅为18.18%和39.29%,其认为骨髓弥漫性摄取对AL髓内复发诊断的临床价值有限,还需进一步深入研究。而其他一些研究结果表明,弥漫性骨髓摄取增高常提示骨髓恶性细胞浸润[14-15];Alam等[8]发现,骨髓摄取18F-FDG 的程度与恶性浸润的严重程度呈正相关:在骨髓超高摄取的亚组中,恶性浸润占93.50%;而在骨髓轻中度摄取的亚组中,恶性浸润仅占36.80%。Sachpekidis等[16]研究结果证实,骨髓轻度18F-FDG摄取多提示反应性增生,而明显高摄取常常与恶性肿瘤密切相关。事实上,一些良性病变或治疗干预均会导致骨髓弥漫性摄取增高(如骨髓炎症或感染、发热导致的骨髓反应性增生、近期使用粒细胞集落刺激因子等[17]),从而干扰准确判读,导致一些假阳性结果[18],降低了骨髓弥漫性摄取诊断AL复发的特异性。
本研究结果显示,AL复发组主要表现为骨髓弥漫性摄取增高或多灶性摄取,二者总占比约为85.36%。当以单发或多灶性骨髓摄取作为髓内复发的诊断标准时,灵敏度和特异度分别为71.43%和100%;当以弥漫性骨髓摄取为诊断标准时,灵敏度和特异度分别为76.92%和70.00%,较李河北等[13]的研究结果要高(灵敏度和特异度分别为18.18%和44.44%)。初步分析,可能与本研究制定的患者纳入标准以及患者的构成不同有关。
本研究以肝脏正常放射性本底为参照,采用了比值法,即计算骨髓SUVmax/肝脏SUVmax比值,ROC曲线分析结果显示,当以骨髓SUVmax/肝脏SUVmax≥1.11为诊断髓内复发标准时,灵敏度、特异度和准确率分别为48.78%、90.00%和69.14%;与Alam等[8]的研究结果(灵敏度为43.30%,特异度为95.70%)接近。Chen等[19]的荟萃分析结果显示,对于惰性非霍奇金淋巴瘤,尤其是弥漫性骨髓浸润类型,PET/CT检出骨髓浸润的灵敏度同样较低。Nakajo等[20]的研究结果提示,对慢性髓系白血病而言,骨髓弥漫性轻度摄取可能与白血病幼稚细胞与18F-FDG的亲和力低和骨髓中肿瘤细胞密度低有关。
除了采用比值法对复发组和无复发组的中轴骨摄取程度进行分析,我们还采用附肢骨SUVmax/中轴骨SUVmax比值来比较2组骨髓摄取分布上的差异。结果显示:复发组的附肢骨SUVmax/中轴骨SUVmax比值(1.58±1.38)高于无复发组(0.79±0.37),且差异有统计学意义;当以二者比值≥1.03作为髓内复发诊断标准时,18F-FDG PET/CT诊断的灵敏度和特异度分别为56.10%和87.50%。全身骨髓摄取出现分布上的差异有其生理基础:发热、贫血等良性病因导致的骨髓反应性增生常常发生于红骨髓聚集的中轴骨,从而在18F-FDG PET/CT上表现为脊柱、骨盆部位的弥漫性对称性摄取增高;而恶性肿瘤骨髓浸润通常更加广泛,不限于中轴骨,常同时累及附肢骨[7]。通过2种不同病因导致的18F-FDG PET/CT图像上骨髓摄取分布的差异,有助于对疾病的良恶性进行区分。
我们还发现,不均匀弥漫性摄取在AL复发患者中更为常见,与以往的研究结果一致;既往Arimoto等[7]的研究探讨了其产生机制,骨髓摄取相对浓聚区反映了该部位的白血病细胞聚集、数目较多,而摄取相对稀疏区可能由于骨髓内区域性微循环衰竭引起的低氧血症、局部骨髓坏死,从而导致局部白血病细胞数量减少或活性不足。Janssens等[21]的研究结果显示,白血病细胞的增殖速度可能会超过其血管生成速度并影响血管的正常结构,这是骨髓局限性坏死的诱因。遗憾的是,受医学伦理因素和穿刺取材条件的限制,本研究未获得患者的病理形态资料。
本研究的组织病理学结果证实有12例假阳性,经分析发现,其中6例(50.00%)患者临床有不同程度发热(37.3~37.8℃),推测骨髓弥漫性均匀摄取可能与发热导致的细胞因子刺激、应激状态有关。尹吉林等[22]的研究结果显示,近期使用升白细胞药物、恶性血液病和发热状态是骨髓弥漫性摄取最主要的3种原因,分组研究结果显示,发热组骨髓常常呈轻度18F-FDG摄取增高[骨髓平均标准摄取值(mean standardized uptake value,SUVmean)/纵隔血池SUVmean比值为2.0~3.0],而恶性血液系统疾病往往导致重度骨髓摄取增高(SUVmean比值>3.0)。其余6例无发热,呈现轻度弥漫性骨髓摄取,原因不明。本研究结果有6例假阴性,PET/CT表现为中轴骨低于肝实质本底的轻度摄取,推测其原因可能与骨髓中白血病细胞与18F-FDG的亲和力低或白血病细胞密度偏低有关;其中2例伴有中枢神经系统白血病浸润(经脑脊液细胞学检查结果证实),由于正常脑组织生理状态下放射性本底很高,因此,18F-FDG PET/CT阴性不能排除神经系统受累可能。
有研究者认为,骨髓穿刺活检阴性并不能排除白血病的骨髓受累,而造血干细胞移植也不能完全排除有髓外复发的可能性[23];毕竟骨髓穿刺活检仅能反映取材局部的病理形态学改变,并不能反映全身骨髓的病理生理情况,其局限性显而易见。既往研究结果显示,对于侵袭性淋巴瘤,18F-FDG PET/CT上局灶性的骨髓摄取高度提示骨髓浸润,有很高的灵敏度[24]。本研究有7例患者初次骨髓穿刺活检为假阴性,全身18F-FDG PET/CT显像呈现多灶性高摄取,符合AL复发的影像学表现,其中2例经再次病理取材证实,另5例经临床随诊影像学检查结果证实;18F-FDG PET/CT检查改变了17.50%的患者的临床决策。Kaya等[25]认为,对于临床可疑的骨髓移植术后复发患者,18F-FDG PET/CT显像可能比目前所谓的骨髓穿刺活检“金标准”更有价值。
本研究存在的局限性:(1)作为一项回顾性研究,难免出现选择偏倚;(2)由于纳入的样本中未成年群体占比较高(18岁以下患者占比44.4%),研究结果是否适用于其他年龄段,需要扩大样本量进一步验证;(3)由于纳入的患者数有限,未按不同白血病分型进行分组研究;(4)由于医学伦理和取材难度所限,并非所有阳性病灶均获得了组织病理学检查结果。
综上所述,18F-FDG PET/CT是一种诊断AL骨髓移植术后复发的客观、有效的检查方法。骨髓18F-FDG 摄取增高的程度、全身多灶性摄取模式是作出髓内复发诊断的重要依据,以肝脏放射性本底为参照的视觉判读法是诊断复发的简便而可靠的方法,具有较高的灵敏度和准确率,半定量参数分析是视觉判读法的重要补充。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明 王剑杰负责论文的撰写、最终版本的修订;张滨负责论文的审阅、修改意见的提出;马潞娜负责研究命题的提出、论文的结构设计;田智勇负责研究命题的提出、数据的获取和分析、图像的处理、论文最终版的审阅。
18F-FDG PET/CT 对急性白血病骨髓移植术后髓内复发灶的诊断价值
Diagnostic value of 18F-FDG PET/CT for the intramedullary relapse of acute leukemia after bone marrow transplantation
-
摘要:
目的 探讨18F-氟脱氧葡萄糖(FDG) PET/CT对急性白血病(AL)骨髓移植术后髓内复发灶的诊断价值,筛选可用于诊断其复发的半定量参数。 方法 回顾性分析2016年11月至2019年11月于河北燕达医院接受骨髓移植且疑为髓内复发的81例AL患者的18F-FDG PET/CT图像和病历资料,其中男性45例、女性36例,年龄3~55(25.14±15.07)岁。以骨髓活检的组织病理学检查结果为诊断复发的“金标准”,将患者分为复发组(41例)、无复发组(40例),测量并计算所有可疑复发病灶的最大标准化摄取值(SUVmax)及肝脏本底SUVmax,计算附肢骨SUVmax/中轴骨SUVmax和骨髓SUVmax/肝脏SUVmax比值,并以其不同的临界值和受试者工作特征(ROC)曲线进行分析,计算曲线下面积(AUC)和诊断复发的效能。以视觉判读法为参照,分析并计算18F-FDG PET/CT不同半定量参数诊断AL髓内复发灶的效能。2组间半定量参数的比较采用独立样本t检验;计数资料的比较采用Pearson卡方检验。 结果 81例AL患者中,复发组的中轴骨SUVmax高于无复发组(3.10±1.65对1.99±1.26,t=3.367,P=0.001);与无复发组比较,复发组的骨髓SUVmax /肝脏SUVmax比值(1.20±0.56对0.89±0.74)和附肢骨SUVmax /中轴骨SUVmax比值(1.58±1.38对0.79±0.37)均较高,且差异均有统计学意义(t=2.186、3.477,均P<0.05)。基于SUVmax的半定量指标的ROC曲线分析结果显示,以中轴骨SUVmax≥2.05作为判断髓内复发的标准时,其诊断AL复发的灵敏度、特异度和准确率分别为70.73%(29/41)、72.50%(29/40)和 71.60%(58/81),AUC为0.770。视觉判读法结果显示,以多灶性摄取+弥漫性摄取18F-FDG为髓内复发的诊断标准时,其诊断AL复发的灵敏度、特异度和准确率分别为85.37%(35/41)、70.00%(28/40)和77.78%(63/81)。 结论 18F-FDG PET/CT视觉判读法是诊断AL复发简便、可靠的方法,具有较高的诊断效能,基于SUVmax的半定量参数分析是视觉判读法的重要补充。 -
关键词:
- 白血病 /
- 复发 /
- 正电子发射断层显像术 /
- 体层摄影术,X 线计算机 /
- 氟脱氧葡萄糖F18 /
- 最大标准化摄取值
Abstract:Objective To explore the diagnostic efficacy of 18F-fluorodeoxyglucose(FDG) PET/CT on intramedullary relapse of acute leukemia, and screening parameters that can be used to give the diagnosis. Methods The 18F-FDG PET/CT imaging data of 81 patients (45 males and 36 females aged 3–55(25.14±15.07)years) who were clinically diagnosed with suspected intramedullary relapse of acute leukemia in Hebei Yanda Hospital from November 2016 to November 2019 were retrospectively analyzed. All the patients had received bone marrow transplantation. And the histopathological results of bone marrow biopsy were used as "golden standard" of intramedullary relapse. The patients were divided into relapse group (41 cases) and non-relapse group (40 cases). The maximum standardized uptake value (SUVmax) of all the suspected recurrent lesions and SUVmax of normal liver background (liver SUVmax) were measured and calculated. The ratio of appendicular skeleton SUVmax to that of axial skeleton and the ratio of axial skeleton SUVmax to that of normal liver background were calculated respectively. The different cut-off values and area under curve (AUC) based on receiver operating characteristic (ROC) curves were analyzed, and the diagnostic efficacy of 18F-FDG PET/CT on relapse of acute leukemia was explored preliminarily. Visual interpretation was applied as a reference criterion to explore the diagnostic efficacy of 18F-FDG PET/CT on the intramedullary relapse of acute leukemia based on different semiquantitative parameters. Differences in semiquantitative parameters between the two groups were compared by independent sample t-test for measurement data and Pearson chi-square test for qualitative data. Results Axial skeleton SUVmax of the relapse group was higher than that of the non-relapse group (3.10±1.65 vs. 1.99±1.26, t=3.367, P=0.001). Meanwhile, compared with non-relapse group, the ratio of axial skeleton SUVmax to normal liver background SUVmax (1.20±0.56 vs. 0.89±0.74), and the ratio of appendicular skeleton SUVmax to axial skeleton SUVmax (1.58±1.38 vs. 0.79±0.37) were higher than that of relapse group. Both difference has statistics significance (t=2.186, 3.477; both P<0.05). The ROC curve analysis of the semiquantitative index of SUVmax revealed that the sensitivity, specificity, and accuracy of relapse diagnosis were 70.73% (29/41), 72.50% (29/40), and 71.60% (58/81), respectively (AUC=0.770), when axial skeleton SUVmax≥2.05 was used as the criterion of intramedullary relapse. When multifocal+diffuse increased 18F-FDG uptake was used as the criterion of intramedullary relapse, visual evaluation-based results indicated sensitivity, specificity, and accuracy of 85.37% (35/41), 70.00% (28/40), and 77.78%(63/81), respectively. Conclusions Visual evaluation based on 18F-FDG PET/CT is a simple and reliable method for diagnosing acute leukemia relapse, and has high diagnostic efficacy. Based on SUVmax semi-quantitative parameter analysis is a useful supplement to visual evaluation. -
表 1 81例急性白血病患者的临床及影像学资料
Table 1. The clinical manifestations and imaging features of 81 patients with acute leukemia
项目 复发组(n=41) 无复发组(n=40) 检验值 P值 年龄(岁, ${{\bar x} } \pm s$ 

28.51±8.94 21.70±14.70 t=2.075 0.040 性别[例(%)] χ2=1.321 0.081 男性 24(58.53) 21(52.50) 女性 17(41.16) 19(47.50) 骨髓SUVmax/肝脏SUVmax t=2.186 0.032 $\bar x $ 

1.20±0.56 0.89±0.74 极值范围 0.50~2.78 0.28~5.12 附肢骨SUVmax/中轴骨SUVmax t=3.477 0.001 $\bar x $ 

1.58±1.38 0.79±0.37 极值范围 0.33~6.07 0.25~1.95 中轴骨SUVmax t=3.367 0.001 $\bar x $ 

3.10±1.65 1.99±1.26 极值范围 1.00~7.80 0.70~8.20 发热[例(%)] 6(14.63) 6(15.00) χ2=68.900 0.754 脾肿大[例(%)] 2(4.87) 1(2.50) χ2=2.980 0.224 注:SUVmax为最大标准化摄取值 表 2 81例急性白血病患者的18F-FDG PET/CT半定量参数及ROC曲线对髓内复发病灶的诊断效能
Table 2. Diagnostic efficacy of 18F-fluorodeoxyglucose PET/CT semiquantitative parameters and receiver operating characteristic curve in recurrent bone marrow lesions of 81 patients with acute leukemia
参数 $\bar{{x} }$ 

AUC 95%CI 标准差 P值 临界值 灵敏度(%) 特异度(%) 准确率(%) 骨髓SUVmax/肝脏SUVmax比值 1.20±0.76 0.711 0.598~0.823 0.057 0.001 1.11 48.78(20/41) 90.00(36/40) 69.14(56/81) 附肢骨SUVmax/中轴骨SUVmax比值 1.43±1.24 0.738 0.628~0.848 0.056 <0.01 1.03 56.10(23/41) 87.50(35/40) 71.60(58/81) 中轴骨SUVmax 2.91±1.76 0.770 0.667~0.873 0.053 <0.01 2.05 70.73(29/41) 72.50(29/40) 71.60(58/81) 注:FDG为氟脱氧葡萄糖;PET为正电子发射断层显像术;CT为计算机体层摄影术;ROC为受试者工作特征;SUVmax为最大标准化摄取值;AUC为曲线下面积;CI为可信区间 -
[1] Dholaria B, Savani BN, Hamilton BK, et al. Hematopoietic cell transplantation in the treatment of newly diagnosed adult acute myeloid leukemia: an evidence-based review from the American society of transplantation and cellular therapy[J]. Transplant Cell Ther, 2021, 27(1): 6−20. DOI: 10.1016/j.bbmt.2020.09.020. [2] Percival ME, Lai C, Estey E, et al. Bone marrow evaluation for diagnosis and monitoring of acute myeloid leukemia[J]. Blood Rev, 2017, 31(4): 185−192. DOI: 10.1016/j.blre.2017.01.003. [3] Abelson S, Collord G, Ng SWK, et al. Prediction of acute myeloid leukaemia risk in healthy individuals[J]. Nature, 2018, 559(7714): 400−404. DOI: 10.1038/s41586-018-0317-6. [4] Zhou WL, Wu HB, Wang LJ, et al. Usefulness and pitfalls of F-18-FDG PET/CT for diagnosing extramedullary acute leukemia[J]. Eur J Radiol, 2016, 85(1): 205−210. DOI: 10.1016/j.ejrad.2015.11.019. [5] de Bonilla Damiá Á, Fernández López R, Acevedo Báñez I, et al. 18F-FDG PET/CT for extramedullary relapse of acute leukemia of ambiguous lineage[J/OL]. Rev Esp Med Nucl Imagen Mol (Engl Ed), 2019, 38(6): 395−396[2020-10-21]. https://www.sciencedirect.com/science/article/abs/pii/S2253654X18302877?via%3Dihub. DOI: 10.1016/j.remn.2019.01.009. [6] Stölzel F, Lüer T, Löck S, et al. The prevalence of extramedullary acute myeloid leukemia detected by 18FDG-PET/CT: final results from the prospective PETAML trial[J]. Haematologica, 2020, 105(6): 1552−1558. DOI: 10.3324/haematol.2019.223032. [7] Arimoto MK, Nakamoto Y, Nakatani K, et al. Increased bone marrow uptake of 18F-FDG in leukemia patients: preliminary findings[J/OL]. Springerplus, 2015, 4: 521[2020-10-21]. https://springerplus.springeropen.com/articles/10.1186/s40064-015-1339-2. DOI: 10.1186/s40064-015-1339-2. [8] Alam MS, Fu L, Ren YY, et al. 18F-FDG super bone marrow uptake: a highly potent indicator for the malignant infiltration[J]. Medicine (Baltimore), 2016, 95(52): e5579. DOI: 10.1097/MD.0000000000005579. [9] 中华医学会血液学分会白血病淋巴瘤学组. 复发难治性急性髓系白血病中国诊疗指南(2017年版)[J]. 中华血液学杂志, 2017, 38(3): 183−184. DOI: 10.3760/cma.j.issn.0253-2727.2017.03.002.
Leukemia and Lymphoma Group, Branch of Hematology, Chinese Medical Association. The guidelines for diagnosis and treatment of acute myelogenous leukemia (relapse/refractory) in China (2017)[J]. Chin J Hematol, 2017, 38(3): 183−184. DOI: 10.3760/cma.j.issn.0253-2727.2017.03.002.[10] 中华医学会血液学分会干细胞应用学组. 中国异基因造血干细胞移植治疗血液系统疾病专家共识(Ⅲ)——急性移植物抗宿主病(2020年版)[J]. 中华血液学杂志, 2020, 41(7): 529−536. DOI: 10.3760/cma.j.issn.0253-2727.2020.07.001.
Stem Cell Application Group of Hematology Branch of Chinese Medical Association. Chinese consensus of allogeneic hematopoietic stem cell transplantation for hematological disease (Ⅲ)—acute graft-versus-host disease (2020)[J]. Chin J Hematol, 2020, 41(7): 529−536. DOI: 10.3760/cma.j.issn.0253-2727.2020.07.001.[11] Zhao ZX, Hu YE, Li JH, et al. Applications of PET in diagnosis and prognosis of leukemia[J]. Technol Cancer Res Treat, 2020, 19(19): 1−12. DOI: 10.1177/1533033820956993. [12] Zhang SX, Wang W, Kan Y, et al. Extramedullary infiltration of acute lymphoblastic leukemia in multiple organs on FDG PET/CT[J]. Clin Nucl Med, 2018, 43(3): 217−219. DOI: 10.1097/RLU.0000000000001964. [13] 李河北, 王茜, 赵赟赟, 等. 18F-FDG PET/CT对急性白血病髓内及髓外复发的诊断[J]. 中国医学影像学杂志, 2018, 26(2): 140−143, 147. DOI: 10.3969/j.issn.1005-5185.2018.02.015.
Li HB, Wang Q, Zhao YY, et al. Diagnosis of 18F-FDG PET/CT in intra and extramedullary relapse of acute leukemia[J]. Chin J Med Imaging, 2018, 26(2): 140−143, 147. DOI: 10.3969/j.issn.1005-5185.2018.02.015.[14] Wang XX, Huang XY, Zhang LJ, et al. Whole body FDG-PET/CT for the assessment of bone marrow infiltration in patients with newly diagnosed lymphoma[J]. Med Clín (Barc), 2020, 154(2): 61−65. DOI: 10.1016/j.medcli.2019.07.022. [15] Yousefi-Koma A, Shiravand Y, Qutbi M, et al. Diffuse skeletal uptake on 18F-fluoro-2-deoxy-d-glucose positron emission tomography/computed tomography scan in a patient with acute lymphoblastic leukemia: a typical superscan pattern resembling NaF positron emission tomography scan[J]. Indian J Nucl Med, 2019, 34(4): 326−328. DOI: 10.4103/ijnm.IJNM_106_19. [16] Sachpekidis C, Mai EK, Goldschmidt H, et al. 18F-FDG dynamic PET/CT in patients with multiple myeloma: patterns of tracer uptake and correlation with bone marrow plasma cell infiltration rate[J]. Clin Nucl Med, 2015, 40(6): e300−e307. DOI: 10.1097/RLU.0000000000000773. [17] Su K, Nakamoto Y, Nakatani K, et al. Diffuse homogeneous bone marrow uptake of FDG in patients with acute lymphoblastic leukemia[J]. Clin Nucl Med, 2013, 38(1): e33−e34. DOI: 10.1097/RLU.0b013e3182485277. [18] Yi C, Shi XC, Wang XY, et al. The alteration of 18F-FDG uptake in bone marrow after treatment with interleukin 11[J]. Clin Nucl Med, 2014, 39(10): 934−935. DOI: 10.1097/RLU.0000000000000491. [19] Chen YK, Yeh CL, Tsui CC, et al. F-18 FDG PET for evaluation of bone marrow involvement in non-Hodgkin lymphoma: a meta-analysis[J]. Clin Nucl Med, 2011, 36(7): 553−559. DOI: 10.1097/RLU.0b013e318217aeff. [20] Nakajo M, Jinnouchi S, Inoue H, et al. FDG PET findings of chronic myeloid leukemia in the chronic phase before and after treatment[J]. Clin Nucl Med, 2007, 32(10): 775−778. DOI: 10.1097/RLU.0b013e318148b467. [21] Janssens AM, Offner FC, Van Hove WZ, et al. Bone marrow necrosis[J]. Cancer, 2000, 88(8): 1769−1780. DOI: 10.1002/(SICI)1097-0142(20000415)88:8<1769::AID-CNCR3>3.0.CO;2-H. [22] 尹吉林, 王欣璐, 张金赫, 等. 18F-FDG PET/CT显像全身骨髓代谢弥漫增高原因分析[J]. 中华核医学杂志, 2011, 31(3): 151−154. DOI: 10.3760/cma.j.issn.0253-9780.2011.03.002.
Yin JL, Wang XL, Zhang JH, et al. Analysis on the reasons for diffuse 18F-FDG uptake by bone marrow using whole-body PET/CT[J]. Chin J Nucl Med, 2011, 31(3): 151−154. DOI: 10.3760/cma.j.issn.0253-9780.2011.03.002.[23] Adams HJA, Kwee TC, Fijnheer R, et al. Bone marrow FDG-PET/CT in Hodgkin lymphoma revisited: do imaging and pathology match?[J]. Ann Nucl Med, 2015, 29(2): 132−137. DOI: 10.1007/s12149-014-0920-z. [24] St-Pierre F, Broski S, Laplant B, et al. Maximizing FDG-PET/CT utility in staging of follicular lymphoma (FL): the role of spleen involvement and bone standardized uptake values[J]. Blood, 2019, 134(S1): S2811. DOI: 10.1182/blood-2019-131992. [25] Kaya Z, Akdemir OU, Atay OL, et al. Utility of 18-fluorodeoxyglucose positron emission tomography in children with relapsed/refractory leukemia[J]. Pediatr Hematol Oncol, 2018, 35(7/8): 393−406. DOI: 10.1080/08880018.2018.1557306. -






 下载:
下载: