-
随着社会与科技的进步,核技术被广泛应用于工业、农业、医学和军事等领域。电离辐射会对机体造成急性、慢性或持久性损伤。造血系统因其对辐射的敏感性使其在辐射损伤的治疗中起着重要作用。造血生长因子(例如粒细胞集落刺激因子和粒细胞-巨噬细胞集落刺激因子)目前已获得美国食品和药物管理局的批准用于治疗造血系统的辐射损伤[1]。然而,应用造血生长因子不仅会导致发烧、疼痛和呕吐等,而且会破坏造血干细胞(hematopoietic stem cell, HSC)的自我更新能力,从而加速HSC的耗竭并进一步影响造血系统的长期恢复。因此,造血系统辐射损伤的治疗方法研究仍需进一步开展。
西格列汀(sitagliptin)是广泛用于临床治疗2型糖尿病的药物[2-4]。前期研究结果表明,西格列汀可以降低急性胰腺炎、糖尿病心肌病、慢性脑灌注不足、心力衰竭和肝缺血再灌注等疾病中的氧化应激水平[5-9]。Broxmeyer等[10]发现,提前给予小鼠西格列汀或敲除二肽基肽酶4(DPP4),可增强辐射暴露后机体的造血能力恢复。然而,西格列汀在造血系统辐射损伤中的治疗效果和机制尚待研究。
本研究在观察西格列汀对正常小鼠外周血血象是否有影响的基础上,探究了西格列汀在小鼠造血系统辐射损伤中的治疗效果,为寻找造血系统辐射损伤的潜在治疗药物研究打下基础。
-
C57BL/6纯系小鼠,6~8周龄,雄性,体重20~22 g,购自北京华阜康实验动物中心,许可证号:SCXK(京)2014-0003。小鼠饲养于中国医学科学院放射医学研究所无特定病原体级动物房,自由饮用无菌水和进食无特定病原体级鼠繁殖饲料,饲养温度 18~25℃,相对湿度40%~70%。
-
Gammacell®40 Exactor 137Cs γ射线照射源购自加拿大Best Theratronics公司,剂量率为1.01 Gy/min;MEK-7222K全自动血液分析仪购自日本光电工业株式会社;Accuric 6型流式细胞仪购自美国BD公司。西格列汀购自美国默沙东公司。胎牛血清购自美国Gibco公司。2′,7′-二氯二氢荧光素-乙酰乙酸酯(DCFH-DA)购自上海碧云天生物技术有限公司;甲基纤维素培养基M3534购自加拿大Stem Cell Technologies公司;一抗和二抗购自美国eBioscience公司和Biolegend公司。
-
本课题组前期的预实验研究结果显示,与对照组相比,西格列汀单独给药组各项指标的差异均无统计学意义,因此,在本研究中,仅设置对照组。将15只C57BL/6雄性小鼠按照区组随机法分为对照组、照射组和西格列汀+照射组,每组5只。照射组和西格列汀+照射组小鼠均接受7 Gy 137Cs γ射线一次性全身照射。西格列汀+照射组于照射后2 h开始灌胃给药,给药剂量为10 mg/kg,每只0.2 mL,连续给药7 d,对照组和照射组给予等量生理盐水。照射后第30天颈椎脱位法处死小鼠,进行相关分析。
-
小鼠眼静脉丛取外周血,滴入到含有抗凝剂的EP管中,用血液分析仪测定WBC、RBC、血小板(platelet, PLT)计数和血红蛋白(hemoglobin,HGB)、红细胞比容(hematocrit,HCT)水平等指标。
-
无菌条件下取小鼠单侧股骨,用含2%胎牛血清的PBS冲洗后进行细胞计数。
-
取1×106个骨髓细胞,加入biotin标记的混合一抗(CD4、CD8、Ter119、CD11b、CD45R/B220和Gr-1),4℃避光孵育30 min,洗涤1次后弃上清,加入混合二抗(streptavidin-Percp、Sca1-PE和c-kit-APC)染色,4℃避光孵育30 min,洗涤1次后弃上清,重悬细胞,用流式细胞仪检测并统计造血祖细胞(hematopoietic progenitor cell, HPC)(lin−c-kit+Sca1−)和HSC(lin−c-kit+Sca1+)的百分比及数量。
-
取骨髓细胞,调整细胞浓度为2×105个/mL,加入至甲基纤维素培养基M3534中后缓慢接种到24孔培养板中,每组设置6个平行孔,置于细胞培养箱(37℃,5%CO2)中培养5 d后,计数粒细胞-巨噬细胞集落形成单位(colony-forming units granulocyte-macrophage,CFU-GM)的克隆数,以≥50个细胞群为阳性克隆,结果以每105个骨髓细胞生成的CFU-GM克隆数表示。
-
将骨髓细胞浓度调整为5×106个/mL,取100 μL细胞悬液加入2′,7′-二氯二氢荧光素二乙酸酯(DCFH-DA)探针。37℃细胞培养箱内孵育20 min,洗涤后用流式细胞仪检测,平均荧光强度表示细胞中活性氧水平。
-
应用GraphPad Prism 8.0软件对数据进行统计学分析。符合正态分布的计量资料以
$\bar{x}\pm s$ 表示,2组间的比较采用独立样本t检验(方差齐)。P<0.05为差异有统计学意义。 -
由表1可知,与对照组相比,照射组小鼠BMNC、外周血WBC、RBC、PLT计数和HGB、HCT水平均显著减少、降低,差异均有统计学意义(t=3.476~12.200,均P<0.05);与照射组相比,西格列汀+照射组小鼠的BMNC和WBC计数均显著增加,差异均有统计学意义(均P<0.05)。以上结果提示西格列汀可促进辐射暴露后的骨髓细胞及外周血的恢复。
组别 骨髓有核细胞
(×106个)白细胞
(×109个/L)红细胞
(×1012个/L)血小板
(×109个/L)血红蛋白
(g/L)红细胞比容
(%)对照组(n=5) 20.5±2.2 11.7±2.2 9.2±0.4 443.6±68.4 131.0±5.8 31.2±1.2 照射组(n=5) 8.0±1.0a 3.0±0.2a 7.9±0.6a 213.3±48.3a 117.6±6.4a 28.3±1.4a 西格列汀+照射组(n=5) 11.0±0.4ab 3.9±0.3ab 7.4±0.7a 362.0±66.7a 110.0±10.4a 26.8±2.0a 注:表中,a表示与对照组比较,t=2.510~12.200,均P<0.05;b表示与照射组比较,t=4.593、7.020,均P<0.05 表 1 西格列汀对7 Gy γ 射线全身照射后小鼠外周血血象及骨髓有核细胞的影响(
$\bar x $ Table 1. Effect of sitagliptin on peripheral blood hemogram and bone marrow nucleated cells of mice exposed to 7 Gy γ-ray whole-body irradiation (
$\bar x $ -
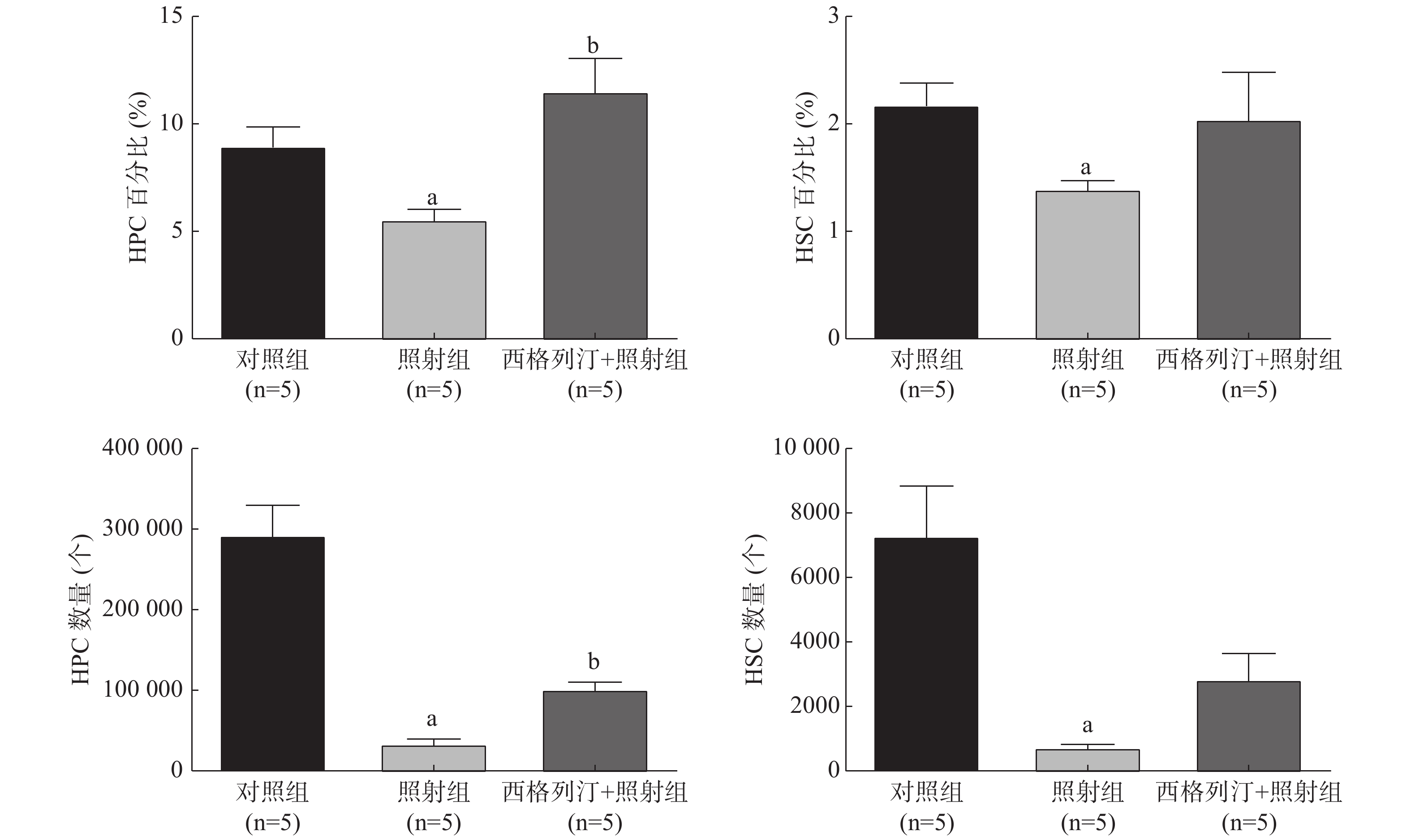
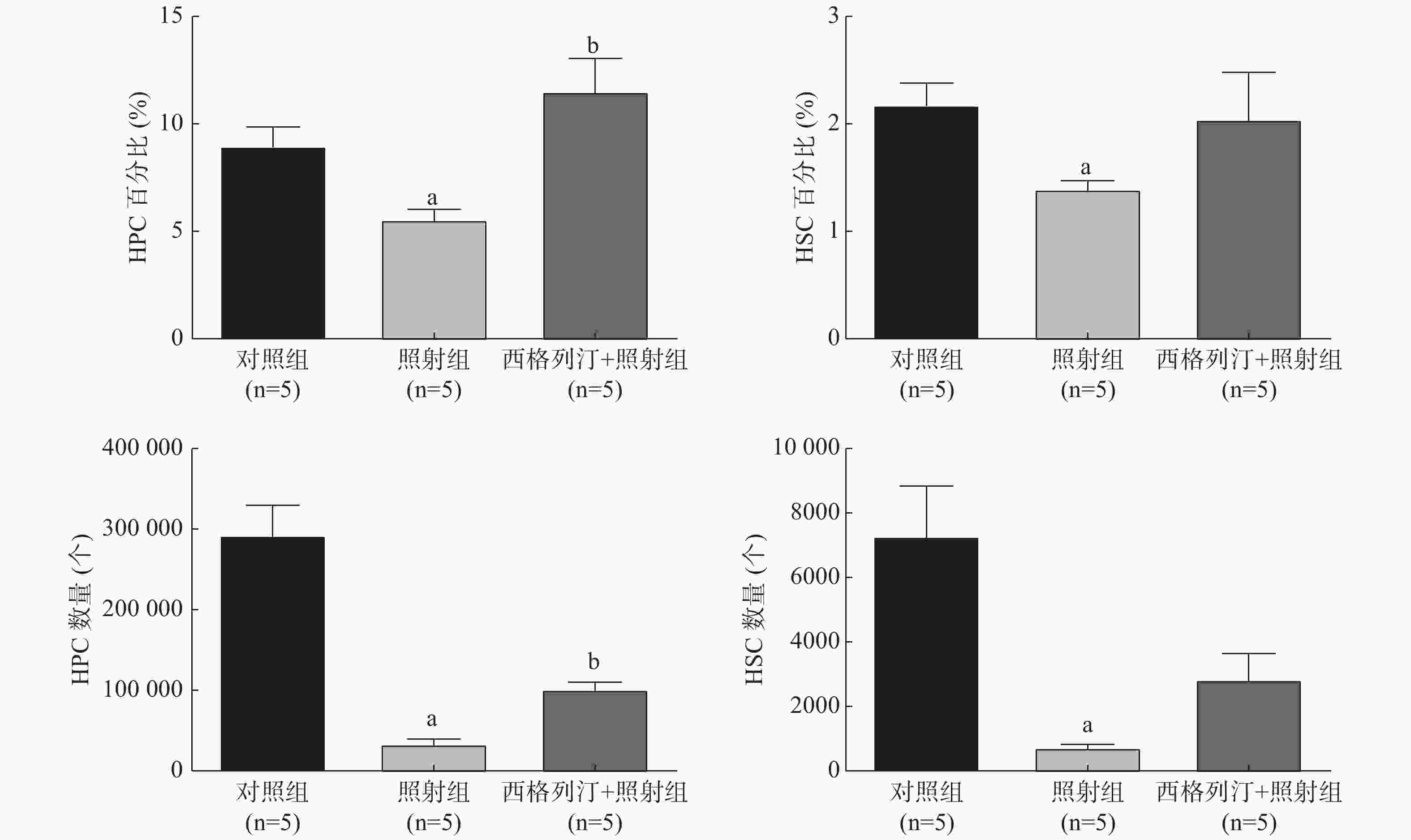
由图1可见,与对照组相比,照射组小鼠HSC和HPC的数量、百分比均显著减少、降低(均P<0.05),这表明电离辐射对HSC和HPC有一定的损伤作用;与照射组相比,西格列汀+照射组小鼠HPC的数量[(33 724.4±10 594.9)个对(101 637.6±17 240.5)个]、百分比[(5.6±1.0)%对(11.5±3.0)%]均增加,差异均有统计学意义(均P<0.05)。以上结果表明,西格列汀可缓解受照小鼠HPC和HSC的损伤,对辐射所致造血功能损伤有一定的治疗效果。
-
与对照组相比,照射组、西格列汀+照射组小鼠骨髓细胞CFU-GM均显著减少,且差异均有统计学意义(t=13.240、9.436,均P<0.05);与照射组相比,西格列汀+照射组小鼠骨髓细胞CFU-GM增加,且差异有统计学意义(t=2.964,P<0.05)(CFU-GM:对照组66.2±5.3、照射组30.8±3.9、西格列汀+照射组38.2±4.4)。以上结果表明,西格列汀治疗可提高7 Gy照射小鼠骨髓细胞的克隆形成能力,一定程度上能够恢复骨髓细胞的增殖功能。
-
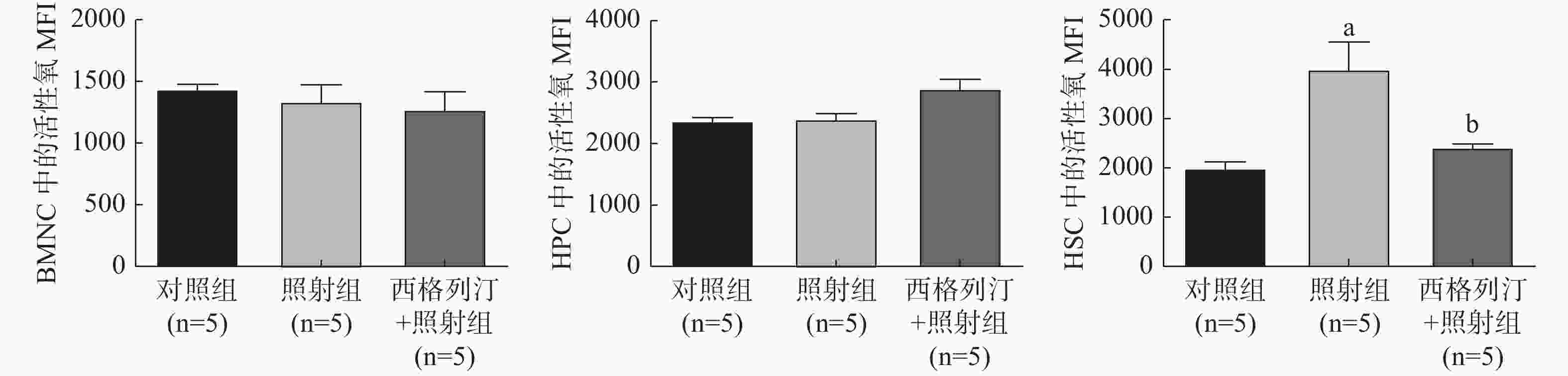
由图2可见,与对照组相比,照射组小鼠在受照后第30天HSC中的活性氧水平显著升高(P<0.05);与照射组相比,西格列汀+照射组小鼠HSC 中的活性氧水平显著降低(P<0.05)(HSC中的活性氧水平:对照组1980.6±309.3、照射组3994.5±1119.0、西格列汀+照射组2415.7±122.9)。这些结果提示西格列汀对电离辐射所致的造血系统辐射损伤的保护作用可能是通过降低HSC中活性氧水平实现的。
-
辐射防护“老药”的药代动力学及安全性资料已知,其新用途的开发可以大大节约研发周期和成本,被认为是新药开发中最有效、最快捷的策略之一[11]。西格列汀可抑制肠促胰岛激素(如胰高血糖素样肽-1)和葡萄糖依赖性促胰岛素多肽的降解,进而治疗糖尿病。近年来,有研究者发现西格列汀还具有抗氧化和消炎的作用,在动脉粥样硬化、炎症性肠病、心力衰竭和血管炎症等疾病中起作用[5, 12-13]。提前给予小鼠西格列汀,结果证实西格列汀可增强辐射暴露后机体的造血能力恢复[10]。而本研究在前期观察西格列汀对正常小鼠血象无显著影响的基础上,在小鼠接受7 Gy照射后给予西格列汀,以观察西格列汀对造血系统辐射损伤的治疗作用,并对其机制进行初步探讨。
我们前期利用C57/BL6小鼠研究不同剂量137Cs γ射线照射对HSC和HPC的影响,发现小鼠血细胞、HSC、HPC数量随照射剂量的增加而降低[14];本课题组前期观察了西格列汀对4 Gy辐射损伤的治疗作用[15],本研究观察了西格列汀对7 Gy亚致死剂量辐射损伤小鼠的治疗效果。造血系统对辐射高度敏感[16-17],成年个体造血功能主要由骨髓承担,BMNC数量可在一定程度上反映骨髓造血能力[18-19]。本研究结果表明,西格列汀可显著提高7 Gy受照小鼠的骨髓细胞和外周血WBC,这提示西格列汀对造血系统辐射损伤具有治疗作用。造血系统辐射损伤后发生功能障碍的原因之一是维持造血功能的HSC和HPC受到损伤。HSC是一类具有自我更新和多向分化能力的细胞,电离辐射可以引起HSC损伤,导致其数量减少,自我更新能力降低,导致骨髓的长期损伤[20-21]。在本研究中,我们使用流式细胞仪观察了HSC和HPC数量的变化,结果表明,西格列汀可显著增加受照小鼠中HPC和HSC的数量;进一步采用克隆集落形成实验评估骨髓细胞的增殖能力,结果表明西格列汀还可以促进造血细胞增殖能力的恢复。以上结果提示,西格列汀能有效治疗造血系统因辐射引起的损伤。
辐射引起的氧化应激是辐射损伤的重要原因。电离辐射会直接作用于水分子使其分解,导致大量细胞源性自由基的产生,过量的活性氧可引起生物大分子,如蛋白质、脂质和DNA的氧化,造成生物膜损伤,从而破坏细胞的结构和功能。我们在之前的实验中发现小鼠BMNC、HPC和HSC在接受6.5 Gy照射后细胞内的活性氧水平均有先升高后降低的趋势,在第28~56天,HSC的活性氧水平仍很高,HPC和BMNC的活性氧水平已经恢复正常[16]。在本研究中,我们观察了接受7 Gy照射后第30天的小鼠BMNC、HPC和HSC中活性氧水平,发现HSC中活性氧水平显著提升,而在其他两种细胞中不明显,这与前期的研究结果一致。而本研究结果显示,西格列汀治疗可降低受照小鼠HSC中活性氧水平,这提示西格列汀可通过调节HSC中活性氧水平来达到治疗造血系统辐射损伤的效果。
总之,本研究结果表明,西格列汀对造血系统辐射损伤具有治疗作用,可能主要是通过降低造血细胞活性氧水平来实现的。然而,其辐射防护作用的详细机制和最佳用法、用量等仍有待进一步探究。同时,积极开发辐射防护“老药”的新用途,为探索治疗电离辐射损伤作用的高效途径和开展对抗辐射的研究具有重要意义。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明 张远洋、王梅芳负责现场的取材及实验、数据的收集及整理、论文的撰写;董银萍、吴静负责实验方法的建立;王欣悦、李文璇负责现场的取材及实验;李德冠负责实验的设计与实施、论文的审阅。
西格列汀对小鼠造血系统辐射损伤的治疗作用
Therapeutic effect of sitagliptin on the radiation injury of the hematopoietic system in mice
-
摘要:
目的 探讨西格列汀对7 Gy γ射线照射后小鼠造血系统损伤的治疗作用。 方法 将15只C57BL/6小鼠按照区组随机法分为对照组、照射组、西格列汀+照射组,每组5只。照射组和西格列汀+照射组小鼠接受7 Gy 137Cs γ射线一次性全身照射,后者于照射后2 h开始灌胃西格列汀,给药剂量为10 mg/kg,连续给药7 d;对照组和照射组给予等量生理盐水。照射后第30天取外周血进行血象测定,颈椎脱位处死小鼠后取骨髓细胞测定有核细胞数、造血干细胞(HSC)和造血祖细胞(HPC)数量及其活性氧水平、粒细胞-巨噬细胞集落形成单位(CFU-GM)。2组间的比较采用独立样本t检验。 结果 与对照组比较,照射组小鼠的骨髓有核细胞、白细胞、红细胞、血小板计数和血红蛋白、红细胞比容水平均明显减少、下降(t=3.476~12.200,均P<0.05);HSC和HPC的数量及百分比均明显减少、降低(t=3.174~5.287,均P<0.05);HSC中活性氧水平明显升高(1980.6±309.3对3994.5±1119.0,t=3.904,P<0.05),骨髓细胞CFU-GM显著减少(66.2±5.3对30.8±3.9,t=13.240,P<0.05)。与照射组相比,西格列汀+照射组小鼠骨髓有核细胞[(8.0±1.0)×106个对(11.0±0.4)×106个,t=4.593,P<0.05]、白细胞数量[(3.0±0.2)×109个/L对(3.9±0.3)×109个/L,t=7.020,P<0.05]均增多;HPC数量[(33 724.4±10 594.9)个对(101 637.6±17 240.5)个,t=5.951,P<0.05]及百分比[(5.6±1.0)%对(11.5±3.0)%,t=4.163,P<0.05]均上升,HSC中活性氧水平降低(3994.5±1119.0对2415.7±122.9,t=2.375,P<0.05),骨髓细胞CFU-GM增加(30.8±3.9对38.2±4.4,t=2.964,P<0.05)。 结论 西格列汀对7 Gy γ射线照射后小鼠造血系统损伤有一定的治疗作用。 Abstract:Objective To investigate the therapeutic effect of sitagliptin on hematopoietic system injury in mice after 7 Gy γ-ray irradiation. Methods Fifteen C57BL/6 mice were randomly divided into a control group, an irradiation group, and a sitagliptin+irradiation group by using a randomized block design, with five mice in each group. The mice in the irradiation and sitagliptin+irradiation groups received 7 Gy 137Cs γ-ray total body irradiation. Sitagliptin was administered to the latter via gavage 2 h after the irradiation. The dose was 10 mg/kg, and gavage infusion was continuous. Sitagliptin administration lasted for 7 days. The control and irradiation groups were given the same volume of normal saline. On the 30th day after irradiation, peripheral blood was collected for blood routine examination. After the mice were sacrificed via cervical dislocation, bone marrow cells were collected to determine the numbers of nucleated cells, hematopoietic stem cells (HSC), and hematopoietic progenitor cells (HPC), along with their reactive oxygen species (ROS) levels. The number of colony-forming units granulocyte-macrophage (CFU-GM) clones was also determined. Data between two groups were compared via independent sample t-test. Results Compared with those of the control group, the numbers of bone marrow nucleated cells, white blood cells, red blood cells, platelets, hemoglobin, and hematocrit of the irradiation group were significantly reduced (t=3.476−12.200, all P<0.05). The number and percentage of HSC and HPC were significantly reduced (t=3.174−5.287, all P<0.05). The level of ROS in HSC increased significantly (1980.6±309.3 vs. 3994.5±1119.0, t=3.904, P<0.05). The number of bone marrow cell CFU-GM clones was significantly decreased (66.2±5.3 vs. 30.8±3.9, t=13.240, P<0.05). Compared with the irradiation group, the number of bone marrow nucleated cells ((8.0±1.0)×106 vs. (11.0±0.4)×106, t=4.593, P<0.05) and white blood cells ((3.0±0.2)×109/L vs. (3.9±0.3)×109/L, t=7.020, P<0.05) increased (t=4.593, P<0.05) in the sitagliptin+irradiation group. The number of HPC (33 724.4±10 594.9 vs. 101 637.6±17 240.5, t=5.951, P<0.05) and percentage ((5.6±1.0%) vs. (11.5±3.0)%, t=4.163, P<0.05) also increased. The ROS level in HSC decreased (3994.5±1119.0 vs. 2415.7±122.9, t=2.375, P<0.05), whereas the number of the bone marrow cell CFU-GM clones increased (30.8±3.9 vs. 38.2±4.4, t=2.964, P<0.05). Conclusion Sitagliptin exerts a certain therapeutic effect on hematopoietic system injury in mice after 7 Gy γ-ray irradiation. -
表 1 西格列汀对7 Gy γ 射线全身照射后小鼠外周血血象及骨髓有核细胞的影响(
$\bar x $ Table 1. Effect of sitagliptin on peripheral blood hemogram and bone marrow nucleated cells of mice exposed to 7 Gy γ-ray whole-body irradiation (
$\bar x $ 组别 骨髓有核细胞
(×106个)白细胞
(×109个/L)红细胞
(×1012个/L)血小板
(×109个/L)血红蛋白
(g/L)红细胞比容
(%)对照组(n=5) 20.5±2.2 11.7±2.2 9.2±0.4 443.6±68.4 131.0±5.8 31.2±1.2 照射组(n=5) 8.0±1.0a 3.0±0.2a 7.9±0.6a 213.3±48.3a 117.6±6.4a 28.3±1.4a 西格列汀+照射组(n=5) 11.0±0.4ab 3.9±0.3ab 7.4±0.7a 362.0±66.7a 110.0±10.4a 26.8±2.0a 注:表中,a表示与对照组比较,t=2.510~12.200,均P<0.05;b表示与照射组比较,t=4.593、7.020,均P<0.05 -
[1] Bunin DI, Bakke J, Green CE, et al. Romiplostim (Nplate®) as an effective radiation countermeasure to improve survival and platelet recovery in mice[J]. Int J Radiat Biol, 2020, 96(1): 145−154. DOI: 10.1080/09553002.2019.1605465. [2] Scott LJ. Sitagliptin: a review in type 2 diabetes[J]. Drugs, 2017, 77(2): 209−224. DOI: 10.1007/s40265-016-0686-9. [3] Rosenstock J, Allison D, Birkenfeld AL, et al. Effect of additional oral semaglutide vs sitagliptin on glycated hemoglobin in adults with type 2 diabetes uncontrolled with metformin alone or with sulfonylurea: the PIONEER 3 randomized clinical trial[J]. JAMA, 2019, 321(15): 1466−1480. DOI: 10.1001/jama.2019.2942. [4] Zhou Y, Guo ZY, Yan WJ, et al. Cardiovascular effects of sitagliptin — an anti-diabetes medicine[J]. Clin Exp Pharmacol Physiol, 2018, 45(7): 628−635. DOI: 10.1111/1440-1681.12953. [5] Zhou X, Wang WM, Wang C, et al. DPP4 inhibitor attenuates severe acute pancreatitis-associated intestinal inflammation via nrf2 signaling[J/OL]. Oxid Med Cell Longev, 2019, 2019: 6181754[2020-10-20]. https://www.hindawi.com/journals/omcl/2019/6181754. DOI: 10.1155/2019/6181754. [6] Wu Y, Xu M, Bao H, et al. Sitagliptin inhibits EndMT in vitro and improves cardiac function of diabetic rats through the SDF-1α/PKA pathway[J]. Eur Rev Med Pharmacol Sci, 2019, 23(2): 841−848. DOI: 10.26355/eurrev_201901_16899. [7] Pujadas G, De Nigris V, Prattichizzo F, et al. The dipeptidyl peptidase-4 (DPP-4) inhibitor teneligliptin functions as antioxidant on human endothelial cells exposed to chronic hyperglycemia and metabolic high-glucose memory[J]. Endocrine, 2017, 56(3): 509−520. DOI: 10.1007/s12020-016-1052-0. [8] Esposito G, Cappetta D, Russo R, et al. Sitagliptin reduces inflammation, fibrosis and preserves diastolic function in a rat model of heart failure with preserved ejection fraction[J]. Br J Pharmacol, 2017, 174(22): 4070−4086. DOI: 10.1111/bph.13686. [9] Abdel-Gaber SA, Geddawy A, Moussa RA. The hepatoprotective effect of sitagliptin against hepatic ischemia reperfusion-induced injury in rats involves Nrf-2/HO-1 pathway[J/OL]. Pharmacol Rep, 2019, 71(6): 1044−1049[2020-10-20]. https://www.sciencedirect.com/science/article/abs/pii/S173411401930194X. DOI: 10.1016/j.pharep.2019.06.006. [10] Broxmeyer HE, Hoggatt J, O'Leary HA, et al. Dipeptidylpeptidase 4 negatively regulates colony-stimulating factor activity and stress hematopoiesis[J]. Nat Med, 2012, 18(12): 1786−1796. DOI: 10.1038/nm.2991. [11] 任岩松, 沈舜义. 老药新用在新药研发中的意义[J]. 世界临床药物, 2013, 34(11): 687−692.
Ren YS, Shen SY. New indication of existing drugs and its significance in drug discovery[J]. World Clin Drugs, 2013, 34(11): 687−692.[12] He YH, Yang GD, Yao F, et al. Sitagliptin inhibits vascular inflammation via the SIRT6-dependent signaling pathway[J/OL]. Int Immunopharmacol, 2019, 75: 105805[2020-10-20]. https://www.sciencedirect.com/science/article/pii/S1567576919301109?via%3Dihub. DOI: 10.1016/j.intimp.2019.105805. [13] Sato N, Takasaka N, Yoshida M, et al. Metformin attenuates lung fibrosis development via NOX4 suppression[J/OL]. Respir Res, 2016, 17(1): 107[2020-10-20]. https://respiratory-research.biomedcentral.com/articles/10.1186/s12931-016-0420-x. DOI: 10.1186/s12931-016-0420-x. [14] 路璐, 李德冠, 张俊伶, 等. 不同剂量137Cs γ-射线辐射后造血干/祖细胞辐射敏感性差异研究[J]. 天津医药, 2016, 44(3): 314−317. DOI: 10.11958/20150115.
Lu L, Li DG, Zhang JL, et al. The difference in the radiosensitivity between hematopoietic stem and progenitor cells after different doses of 137Cs γ-radiation[J]. Tianjin Med J, 2016, 44(3): 314−317. DOI: 10.11958/20150115.[15] Wang MF, Dong YP, Wu J, et al. Sitagliptin mitigates total body irradiation-induced hematopoietic injury in mice[J/OL]. Oxid Med Cell Longev, 2020, 2020: 8308616[2020-10-20]. https://www.hindawi.com/journals/omcl/2020/8308616. DOI: 10.1155/2020/8308616. [16] 陈孟毅, 林帅, 吴丽贤, 等. 不同年龄小鼠造血系统辐射损伤与修复的比较观察[J]. 国际放射医学核医学杂志, 2019, 43(5): 442−449. DOI: 10.3760/cma.j.issn.1673-4114.2019.05.011.
Chen MY, Lin S, Wu LX, et al. Comparison of radiation damage and recovery of hematopoietic system in mice of different ages[J]. Int J Radiat Med Nucl Med, 2019, 43(5): 442−449. DOI: 10.3760/cma.j.issn.1673-4114.2019.05.011.[17] 张书琴, 崔明, 王滨, 等. 藿香正气合剂对γ射线照射小鼠的防护作用研究[J]. 国际放射医学核医学杂志, 2020, 44(3): 156−163. DOI: 10.3760/cma.j.cn121381-201912007-00004.
Zhang SQ, Cui M, Wang B, et al. Radioprotective effects of Huoxiang Zhengqi mixture on γ irradiation treated mice[J]. Int J Radiat Med Nucl Med, 2020, 44(3): 156−163. DOI: 10.3760/cma.j.cn121381-201912007-00004.[18] Akeem S, Lukman O, Eltahir K, et al. Bone marrow and peripheral blood cells toxicity of a single 2.0 Gy Cobalt60 ionizing radiation: an animal model[J]. Ethiop J Health Sci, 2019, 29(2): 195−202. DOI: 10.4314/ejhs.v29i2.6. [19] Liu CH, Tanaka K, Katsube T, et al. Altered response to total body irradiation of C57BL/6-Tg (CAG-EGFP) mice[J/OL]. Dose-Response, 2020, 18(3): 1559325820951332[2020-10-20]. https://journals.sagepub.com/doi/10.1177/1559325820951332. DOI: 10.1177/1559325820951332. [20] Gault N, Verbiest T, Badie C, et al. Hematopoietic stem and progenitor cell responses to low radiation doses—implications for leukemia risk[J]. Int J Radiat Biol, 2019, 95(7): 892−899. DOI: 10.1080/09553002.2019.1569777. [21] Cary L, Noutai D, Salber R, et al. Bone marrow endothelial cells influence function and phenotype of hematopoietic stem and progenitor cells after mixed neutron/gamma radiation[J/OL]. Int J Mol Sci, 2019, 20(7): 1795[2020-10-20]. https://www.mdpi.com/1422-0067/20/7/1795. DOI: 10.3390/ijms20071795. -





 下载:
下载: