-
食管癌是消化系统常见的恶性肿瘤之一,受其生物学特性的影响,食管癌的预后较差,易出现远处转移和(或)局部复发[1]。放疗是食管癌综合治疗中的重要手段,对局部晚期食管癌患者进行术前放疗,可有效地对食管病灶进行降期,提高术后的病理完全缓解(pathological complete response,pCR)率[2-3]。目前,放疗靶区的勾画主要依靠食管钡餐和胸部CT等共同决定,但无论哪种检查方法,都无法有效地将肿瘤信息直观地体现在靶区勾画中,易出现食管肿瘤包绕不完全和(或)危及器官受到过度照射的情况,直接影响患者的预后[4]。钛夹常用于消化道止血或穿孔,相关研究结果也证实,术前利用钛夹对肿瘤的边界进行定位可以提高手术过程中肿瘤的完整切除率[5],同时钛夹具有X射线不能穿透等特点,适用于肿瘤的放疗[6]。本研究对通过内镜下钛夹植入确定局部晚期食管癌术前放疗患者靶区勾画的上下界进行探讨,并分析该模式下放疗的效果。
-
回顾性分析2018年1月至2019年12月于联勤保障部队第九〇〇医院初诊的36例局部晚期食管癌患者的临床资料,其中男性23例、女性13例,年龄18~65(43.7±6.9)岁。随访时间12~30个月,无失访。纳入标准:(1)经组织病理学检查确诊为食管鳞癌;(2)美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)[7]评分0~1分;(3)经超声胃镜检查,肿瘤TNM分期为T3~T4;(4)经CT、腹部彩色超声、PET/CT等影像学检查无淋巴结转移;(5)肺功能、肝肾功能均正常,经胸外科会诊后有根治性手术指征。排除标准:(1)经影像学检查,出现远处脏器转移;(2)存在不可控制的基础疾病,如高血压、糖尿病等;(3)既往有肿瘤病史;(4)存在免疫系统功能缺陷或精神疾病病史。本研究经联勤保障部队第九〇〇医院伦理委员会批准(批准号:2017L004),所有患者及其家属均签署了知情同意书。
-
所有患者在放疗前均行电子胃镜(日本Olympus公司GIF-XQ260型)探查,具体流程如下:胃镜检查前30 min口服二甲硅油(自贡鸿鹤制药有限责任公司),胃镜检查过程中,连续观察肿瘤的位置、表面色泽、硬度、浸润深度和侵犯范围,对可疑食管病变部位予以0.9%氯化钠溶液(福建海王福药制药有限公司)冲洗,并均匀喷洒2.5%卢戈氏碘(山东拓普生物工程有限公司),碘染未着色的区域为食管病灶区、棕黑色区域为食管正常黏膜,在病灶区的上界和下界分别植入金属钛夹(日本Olympus公司HX-610-135L型)。
-
所有患者在钛夹植入前后均行CT引导下定位。采用热塑膜联合真空垫固定患者,使用CT定位机进行扫描,扫描设备为美国飞利浦公司的Brilliance TM Big Bore CT。扫描条件:管电压120 kV、管电流50 mA、扫描层厚3 mm。扫描范围自舌骨水平至肾极。将扫描的图像由CT模拟工作站传输至美国瓦里安公司 Eclipse TPS治疗计划系统,并分别对靶区和危及器官进行勾画。
-
所有患者的靶区勾画均由同一名副主任医师完成。钛夹植入前靶区勾画的原则: 大体肿瘤体积(gross tumor volume,GTV)定义为影像学检查上(食管钡餐、电子胃镜和胸部CT)可见的食管病灶;临床靶区体积(clinical tumor target,CTV)为GTV上下外放3 cm、其余方向外放0.5 cm,同时包含Ⅱ、Ⅲ、Ⅳ、Ⅵ、Ⅷ、Ⅸ区淋巴结引流区。
钛夹植入后靶区勾画的原则:GTV以钛夹植入标记作为上下界的范围;CTV为GTV上下外放3 cm、其余方向外放0.5 cm,同时包含Ⅱ、Ⅲ、Ⅳ、Ⅵ、Ⅷ、Ⅸ区淋巴结引流区。在钛夹植入前、后的CTV基础上分别向各方向均匀外放0.3 cm作为钛夹植入前的计划靶区体积(planning target volume,PTV)和钛夹植入后的PTV;PTV的放疗剂量为2.0 Gy/次,共20次,总剂量为40 Gy。正常组织和危及器官的勾画按照放射治疗肿瘤协作组(Radiation Therapy Oncology Group,RTOG)的标准[8],要求95%PTV接受>100%的处方剂量,危及器官的剂量限制为脊髓<45 Gy、50%心脏体积≤40 Gy、50%食管体积≤55 Gy、25%肺部体积≤20 Gy。采用6 mV X射线(美国瓦里安公司TrueBeam直线加速器)实施容积旋转调强放疗。
-
观察所有患者术后的R0切除率(肉眼和显微镜下均未见肿瘤残留)和pCR;比较钛夹植入前后的GTV、CTV、GTV长度、双肺V10和V20(V10和V20分别指接受大于10 Gy和20 Gy照射剂量的肺部体积占全肺体积的百分比)、脊髓和心脏的平均受照剂量。观察患者自钛夹植入后至随访结束是否出现胸痛、穿孔等不良反应。每周行胸部X射线检查,记录钛夹是否在位或者脱落;采用RECIST标准[9]评价患者接受钛夹植入放疗后的近期疗效,并记录行根治性手术的患者例数及术后pCR率。以钛夹植入前后GTV上界和下界误差为标准,将患者分为精确组和误差组,其中精确组为植入前后GTV上界和下界误差均<1 cm,误差组为植入前后GTV上界和下界误差均≥1 cm,并进一步评价影响钛夹植入前后误差的危险因素。
-
应用SPSS 13.0软件对数据进行统计学分析。符合正态分布的计量资料以
$\bar x $ ±s表示,方差齐的数据,如钛夹植入前后的肿瘤长径、GTV上界和下界误差的比较采用配对样本t检验,钛夹植入前后双肺V10和V20、脊髓和心脏平均受照剂量的比较采用独立样本t检验。采用χ2检验对精确组和误差组的临床病理特征进行单因素Logistic回归分析,采用Cox多因素回归模型分析影响靶区精确勾画的危险因素。P<0.05为差异有统计学意义。 -
36例患者在内镜下共植入72枚钛夹,且均可通过CT扫描观察到。自钛夹植入至放疗结束,所有患者均未出现出血、穿孔等不良反应。其中4例患者(11.1%)的上界钛夹在治疗过程中脱落,脱落时间为(16.4±3.6) d。所有患者均在放疗结束后4~6周接受食管癌根治术,术后R0切除率为100%,pCR率为52.8%(19/36)。
-
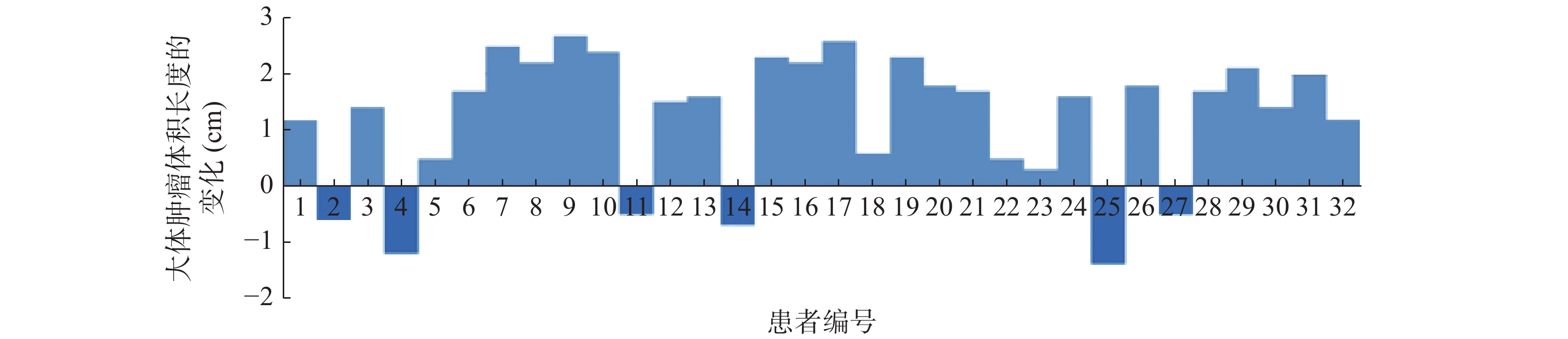
36例患者中,钛夹植入前后GTV长度一致的患者有4例,钛夹植入前GTV长度大于钛夹植入后GTV长度的患者有26例,仅有6例患者钛夹植入前的GTV长度小于钛夹植入后的GTV长度,32例患者钛夹植入前后GTV长度变化的情况见图1。36例患者钛夹植入前的GTV长度为(4.74±1.02) cm,大于钛夹植入后的(3.98±0.79) cm,二者的差异有统计学意义(t=9.472,P<0.05)。钛夹植入前的GTV为(28.87±3.21) cm3,大于钛夹植入后的(24.59±2.67) cm3,二者的差异有统计学意义(t=6.726,P<0.05)。钛夹植入前CTV为(72.46±6.37) cm3,大于钛夹植入后的(56.37±4.52) cm3,二者的差异有统计学意义(t=7.696,P<0.05)。
-
由表1可知,钛夹植入前双肺V10和V20、脊髓的受照剂量均显著高于钛夹植入后,且差异均有统计学意义(均P<0.05);钛夹植入前心脏的受照剂量高于钛夹植入后,但二者的差异无统计学意义(P>0.05)。
项目 双肺V10 (%) 双肺V20(%) 脊髓(Gy) 心脏(Gy) 钛夹植入前 21.64±1.57 14.87±2.32 28.87±3.21 6.47±0.68 钛夹植入后 17.32±0.96 11.69±1.84 24.59±2.67 6.24±0.72 t值 8.05 7.64 −2.43 1.37 P值 <0.01 <0.01 <0.01 0.62 注:V10为接受10 Gy照射剂量的肺体积占全肺总体积的百分比;V20为接受20 Gy照射剂量的肺体积占全肺总体积的百分比 表 1 36例食管癌患者钛夹植入前后危及器官受照剂量的 比较(
$\bar x \pm s $ Table 1. Comparison of organ at risk radiation dose before and after implantation of titanium clips in 36 patients with esophageal cancer (
$\bar x \pm s $ -
36例患者中,精确组和误差组的病例数分别为8例(22.2%)和28例(77.8%)。单因素Logistic回归分析结果显示,年龄、肿瘤位置、饮酒史、GTV长度与GTV的精确勾画存在相关性(均P<0.01),而与性别、ECOG评分、分化程度无相关性(均P>0.05)(表2)。
临床特征 精确组(n=8) 误差组(n=28) χ2值 P值 年龄 5.64 0.01 ≥50岁 2 20 <50岁 6 8 性别 0.55 0.45 男 6 17 女 2 12 肿瘤位置 11.57 <0.01 胸上段 5 3 胸中段 2 13 胸下段 1 12 饮酒史 13.33 <0.01 有 2 24 无 6 4 ECOG评分 0.02 0.87 0分 5 14 1分 3 14 GTV长度 8.23 <0.01 ≥5 cm 2 21 <5 cm 6 7 分化程度 0.04 0.97 低分化 3 12 中分化 2 9 高分化 3 7 注:ECOG为美国东部肿瘤协作组;GTV为大体肿瘤体积 表 2 影响食管癌患者GTV精确勾画的单因素Logistic 回归分析结果(例)
Table 2. Univariate Logistic regression analysis of influencing the precise delineation of gross tumor volume in patients with esophageal cancer (case)
-
将单因素Logistic回归分析中有统计学意义的年龄、肿瘤位置、饮酒史、GTV长度等纳入Cox多因素回归分析,结果显示,肿瘤位置和GTV长度是影响GTV精确勾画的独立危险因素(P<0.05,表3)。
变量 RR(95%CI) P值 年龄(≥50岁对<50岁) 0.487(0.265~1.310) 0.274 肿瘤位置
(上段对中下段)0.296(0.137~0.586) <0.001 GTV长度(≥5 cm对<5 cm) 2.313(1.280~4.875) 0.006 饮酒史(有对无) 0.872(0.473~1.662) 0.496 注:GTV为大体肿瘤体积;RR为相对危险度;CI为置信区间 表 3 影响食管癌患者GTV精确勾画的Cox多因素回归 分析结果
Table 3. Cox multivariate regression analysis of influencing the precise delineation of gross tumor volume in patients with esophageal cancer
-
局部晚期食管癌的治疗模式是目前研究的热点,多项临床研究证实放疗和化疗是局部晚期食管癌患者围手术期主要的干预手段[10],术前同步放化疗可有效改善患者的预后[11]。以肿瘤组织为靶点的术前新辅助治疗是围手术期治疗的关键[12],如何准确勾画食管病灶放疗的范围是研究的难点。
基于现代放疗技术(容积调强放疗等)的高剂量率照射可以改善食管癌患者的预后,但对照射靶区的精确度提出了更高的要求[13]。在传统的食管GTV勾画中,存在几何不确定性(肿瘤边界无法明确),在没有标记物标记下进行勾画,其纵向的偏差为1.44 cm,采用标记物可以显著减少GTV的变化[14]。钛夹作为一种新型材料,具有良好的定位作用,已广泛应用在直肠癌和乳腺癌等的根治性手术中,但在局部晚期食管癌术前放化疗中的使用鲜见相关报道[15-16]。本研究中36例食管癌患者在钛夹植入后均未见明显过敏反应,这与既往的研究结果不一致[17],可能与纳入患者的年龄、钛夹植入的部位和样本数偏少有关[18]。钛夹植入术后的不良反应是否会随着时间的延长而增加,尚需进一步的随访观察。钛夹在食管癌根治术中具有较好的术前定位作用,其准确率高达100%[19],本研究结果显示,钛夹植入后的食管病灶的长度和体积明显小于钛夹植入前,这可能与常规影像学检查无法有效鉴别肿瘤和溃疡有关,在胃肠钡餐中二者大多表现为食管狭窄、在CT检查中均可表现为食管黏膜增厚,这间接证实了基于影像引导下的放疗靶区勾画可能存在一定误差。使用钛夹标记肿瘤的边缘,可以改善肿瘤的放疗计划[20]。在标记物配准的前提下,计算机系统中肿瘤重建的精确度更高[21]。钛夹植入后,正常器官的受照剂量均显著降低,放疗技术和靶区范围的差异是其主要的原因[22],但因缺乏随机对照研究,受照剂量的降低是否会转化为放疗不良反应的减少,尚需进一步的研究。在随访过程中,4例患者的上界钛夹脱落,考虑与其饮食习惯有关。术后pCR率和R0切除率与Babic等[23]的研究结果基本一致,证实钛夹的植入并未影响放疗计划的实施。
一项Meta研究结果证实,对可行手术切除的局部晚期食管癌患者行术前同步放化疗可明显提高总生存时间[24],多项多中心随机对照研究也证实了这一观点,但术前同步放化疗存在增加术后并发症的风险[25]。对于如何减少术前同步放化疗导致的并发症,目前仍缺乏共识。本研究采用钛夹进行放疗前的定位,双肺、脊髓等正常器官的受照剂量均显著减少,其是否可以有效降低术后并发症的发生,尚需扩大样本量进一步研究。年龄是影响食管癌患者根治性治疗后长期生存的影响因素之一[26]。年龄≥50岁的食管癌患者靶区勾画的精确度低于年龄<50岁的患者,这可能与年龄越大,胃食管反流症发生率越高,食管病变进而在影像学上出现改变,从而降低食管病灶勾画的精确度有关[27]。食管上段靶区勾画的精确度明显优于食管中段和下段,这可能与食管弹性较好有关[28];另外,不同肺段的胸膜压力不同,也可能造成邻近中下肺的食管中下段出现压力的变化[29]。食管病灶越长,越容易受呼吸动度等因素的影响,出现靶区勾画误差的可能性越大,是否需每周行MRI定位,以确定靶区范围,提高靶区勾画的精确度,尚需进一步的研究[30]。食管癌的T分期主要与肿瘤负荷的大小有关,本研究主要探讨钛夹置入前后对靶区长度的影响,因此在单因素Logistic回归和Cox多因素回归分析中并未将T分期纳入研究。饮酒史是食管癌及食管病变的高危因素,由于在CT和(或)胃肠钡餐中未采用钛夹等植入物定位,因此可能出现类似食管癌的征象,这在很大程度上影响了靶区勾画的精确度。本研究中的多因素分析结果证实,肿瘤位置和GTV长度是影响靶区勾画精确度的独立危险因素,在放疗技术不断发展的背景下,靶区勾画应依靠更加精确的定位方法,如PET/CT、MRI和标记物等[14, 31]。
同步放化疗是可行手术切除的局部晚期食管癌患者围手术期重要的治疗方法,精确的放疗靶区勾画可以降低正常器官的受照剂量,减少正常组织的不良反应。本研究因受样本数的影响,且纳入对象均为鳞癌患者,可能会造成结论的偏倚,有待于进一步扩大样本量进行研究证实。内镜下钛夹植入在局部晚期食管癌术前放疗中的应用可精确引导CT定位下靶区勾画的范围,且临床证实安全有效。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明 蔡履娟、陈忠华负责研究命题的提出与设计、研究的具体实施、病例与数据的收集与汇总、数据的分析、论文的撰写与最终版本的修订;骆华春、傅志超负责命题的提出与设计、数据的分析、论文的起草与最终版本的修订;沈志勇、王鑫鹏负责研究的具体实施、病例与数据的收集与汇总;冯静、应文敏负责数据的分析。
内镜下钛夹植入对局部晚期食管癌术前放疗患者靶区勾画和剂量学参数的影响
Effect of endoscopic titanium clip labeling on target delineation and dosimetric parameters in preoperative radiotherapy for locally advanced esophageal carcinoma
-
摘要:
目的 探讨内镜下钛夹植入对局部晚期食管癌术前放疗患者靶区勾画和剂量学参数的影响。 方法 回顾性分析2018年1月至2019年12月于联勤保障部队第九〇〇医院经超声胃镜及组织病理学检查确诊为局部晚期食管鳞癌的36例患者的临床资料,其中男性23例、女性13例,年龄18~65(43.7±6.9)岁。放疗前所有患者均在内镜下分别于食管病灶的上界和下界行钛夹植入术,在钛夹植入前后均行CT扫描定位和靶区勾画,比较钛夹植入前后的大体肿瘤体积(GTV)长度、GTV、肿瘤临床体积(CTV)和危及器官受照剂量的差异。将36例患者按照GTV上界和下界的误差分为精确组(误差<1 cm)和误差组(误差≥1 cm),分析影响食管靶区勾画的因素。计量资料的比较采用配对样本t检验和独立样本t检验;采用χ2检验对精确组和误差组的临床病理特征进行单因素Logistic回归分析;采用Cox多因素回归模型分析影响靶区精确勾画的危险因素。 结果 36例患者均顺利在内镜下植入钛夹,4例(11.1%)出现上界钛夹脱落;术后病理完全缓解率为52.8%(19/36)。钛夹植入前患者GTV长度为(4.74±1.02) cm,大于钛夹植入后的(3.98±0.79) cm,二者的差异有统计学意义(t=9.472,P<0.05)。钛夹植入前患者的GTV和CTV分别为(28.87±3.21) cm3和(72.46±6.37) cm3,均大于钛夹植入后的(24.59±2.67) cm3和(56.37±4.52) cm3,且差异均有统计学意义(t=6.726、7.696,均P<0.05)。钛夹植入前的双肺V10、V20(接受10、20 Gy照射剂量的肺体积占全肺总体积的百分比)和脊髓的受照剂量均高于钛夹植入后[(21.64±1.57)%对(17.32±0.96)%、(14.87±2.32)%对(11.69±1.84)%、(28.87±3.21) Gy对(24.59±2.67) Gy],且差异均有统计学意义(t=8.05、7.64、−2.43,均P<0.01)。单因素Logistic回归分析结果显示,年龄、肿瘤位置、饮酒史、GTV长度与GTV的勾画精确度存在相关性(χ2=5.64、11.57、13.33、8.23,均P<0.01)。Cox多因素回归分析结果显示,肿瘤位置 [相对危险度(RR)=0.296,95%置信区间:0.137~0.586,P<0.001]和GTV长度(RR=2.313,95%置信区间:1.280~4.875,P<0.01)是影响GTV精确勾画的独立危险因素。 结论 内镜下钛夹植入在局部晚期食管癌术前放疗中具有重要价值,可精确引导CT定位下靶区勾画的范围并减少正常器官的受照剂量。 Abstract:Objective To investigate the effects of titanium clip implantation under endoscope on target delineation and dosimetric parameters in patients with locally advanced esophageal cancer treated with preoperative radiotherapy. Methods The clinical data of 36 patients with locally advanced esophageal squamous cell carcinoma confirmed by ultrasound gastroscopy and histopathology in the Joint Logistics Support Force Hospital 900 from January 2018 to December 2019 were retrospectively analyzed, including 23 males and 13 females, aged 18−65(43.7±6.9) years. All patients were treated with titanium clip implantation at the upper and lower boundaries of esophageal lesions under endoscopy before and after radiotherapy. CT scan localization and target delineation were performed before and after titanium clip implantation. Gross tumor volume (GTV) length, GTV, clinical target volume (CTV), and normal organ irradiation dose were compared before and after titanium clip implantation. The patients were divided into accurate group (error < 1 cm) and error group (error≥1 cm) according to the error value, and the influencing factors of esophageal target delineation were analyzed. Paired sample t-test and independent sample t-test were used to compare the error values of tumor length, diameter, upper bound and lower bound before and after titanium clip implantation, spinal cord, and heart as well as the difference of the average irradiation dose of double lung V10 and V20. χ2 test was used to analyze the clinical case characteristics of the accurate group and the error group by univariate logistic regression. Cox multivariate regression risk factor analysis was used to analyze the risk factors affecting the accurate delineation of the target area. Results Titanium clips were successfully placed under endoscope in all patients, but 4 cases (11.1%) had the upper boundary titanium clips falling off. The postoperative pathological complete response rate was 52.8% (19/36). The length of GTV before titanium clip implantation was (4.74±1.02) cm, which was higher than that after implantation (3.98±0.79) cm, and the difference was statistically significant (t=9.472, P<0.05). The GTV and CTV of the tumor before implantation were (28.87±3.21) cm3 and (72.46±6.37) cm3, respectively, which were higher than (24.59±2.67) cm3 and (56.37±4.52) cm3 after implantation. The differences were statistically significant (t=6.726, 7.696; both P<0.05). The irradiation doses of V10, V20 (the percentage of lung volume in total lung volume that received more than 10 Gy and 20 Gy irradiation dose, respectively), and spinal cord in both lungs before titanium clip implantation were higher than those after implantation ((21.64±1.57)% vs. (17.32±0.96)%, (14.87±2.32)% vs. (11.69±1.84)%, (28.87±3.21) Gy vs. (24.59±2.67) Gy), and the differences were statistically significant (t=8.05, 7.64, −2.43; all P<0.01). Univariate Logistic regression analysis showed that age, tumor location, drinking history, and GTV length were correlated with the accurate delineation of GTV (χ2=5.64, 11.57, 13.33, 8.23; all P<0.01). Cox multivariate regression analysis showed that tumor location and GTV length were independent risk factors affecting the accurate delineation of GTV (RR=0.296, 95%CI: 0.137~0.586; 2.313, 95%CI: 1.280~4.875; both P<0.01). Conclusions Endoscopic titanium clip implantation is of great value in preoperative radiotherapy for locally advanced esophageal cancer. It can accurately guide the delineation of the target area under CT localization and reduce the irradiation dose of normal organs. -
Key words:
- Esophageal neoplasms /
- Titanium clip /
- Radiotherapy /
- Target delineation /
- Radiation dose
-
表 1 36例食管癌患者钛夹植入前后危及器官受照剂量的 比较(
$\bar x \pm s $ Table 1. Comparison of organ at risk radiation dose before and after implantation of titanium clips in 36 patients with esophageal cancer (
$\bar x \pm s $ 项目 双肺V10 (%) 双肺V20(%) 脊髓(Gy) 心脏(Gy) 钛夹植入前 21.64±1.57 14.87±2.32 28.87±3.21 6.47±0.68 钛夹植入后 17.32±0.96 11.69±1.84 24.59±2.67 6.24±0.72 t值 8.05 7.64 −2.43 1.37 P值 <0.01 <0.01 <0.01 0.62 注:V10为接受10 Gy照射剂量的肺体积占全肺总体积的百分比;V20为接受20 Gy照射剂量的肺体积占全肺总体积的百分比 表 2 影响食管癌患者GTV精确勾画的单因素Logistic 回归分析结果(例)
Table 2. Univariate Logistic regression analysis of influencing the precise delineation of gross tumor volume in patients with esophageal cancer (case)
临床特征 精确组(n=8) 误差组(n=28) χ2值 P值 年龄 5.64 0.01 ≥50岁 2 20 <50岁 6 8 性别 0.55 0.45 男 6 17 女 2 12 肿瘤位置 11.57 <0.01 胸上段 5 3 胸中段 2 13 胸下段 1 12 饮酒史 13.33 <0.01 有 2 24 无 6 4 ECOG评分 0.02 0.87 0分 5 14 1分 3 14 GTV长度 8.23 <0.01 ≥5 cm 2 21 <5 cm 6 7 分化程度 0.04 0.97 低分化 3 12 中分化 2 9 高分化 3 7 注:ECOG为美国东部肿瘤协作组;GTV为大体肿瘤体积 表 3 影响食管癌患者GTV精确勾画的Cox多因素回归 分析结果
Table 3. Cox multivariate regression analysis of influencing the precise delineation of gross tumor volume in patients with esophageal cancer
变量 RR(95%CI) P值 年龄(≥50岁对<50岁) 0.487(0.265~1.310) 0.274 肿瘤位置
(上段对中下段)0.296(0.137~0.586) <0.001 GTV长度(≥5 cm对<5 cm) 2.313(1.280~4.875) 0.006 饮酒史(有对无) 0.872(0.473~1.662) 0.496 注:GTV为大体肿瘤体积;RR为相对危险度;CI为置信区间 -
[1] Siegel RL, Miller KD, Jemal AJ. Cancer statistics, 2020[J]. CA Cancer J Clin, 2020, 70(1): 7−30. DOI: 10.3322/caac.21590. [2] Pasquali S, Yim G, Vohra RS, et al. Survival after neoadjuvant and adjuvant treatments compared to surgery alone for resectable esophageal carcinoma: a network meta-analysis[J]. Ann Surg, 2017, 265(3): 481−491. DOI: 10.1097/SLA.0000000000001905. [3] Zhan M, Zheng HR, Yang Y, et al. Cost-effectiveness analysis of neoadjuvant chemoradiotherapy followed by surgery versus surgery alone for locally advanced esophageal squamous cell carcinoma based on the NEOCRTEC5010 trial[J]. Radiother Oncol, 2019, 141: 27−32. DOI: 10.1016/j.radonc.2019.07.031. [4] Zhang JQ, Zhang WC, Zhang BZ, et al. Clinical results of intensity-modulated radiotherapy for 250 patients with cervical and upper thoracic esophageal carcinoma[J]. Cancer Manag Res, 2019, 11: 8285−8294. DOI: 10.2147/CMAR.S203575. [5] Lin L, Wang M, Hong J, et al. Application of preoperative endoscopic ultrasonography-guided carbon nanoparticle tattooing combined with titanium clip labeling in esophagogastric junction adenocarcinoma[J]. Turk J Gastroenterol, 2019, 30(10): 935−936. DOI: 10.5152/tjg.2019.18427. [6] Lin N, Yu CW, Yang J, et al. Nano-carbon and titanium clip combined labeling assisted surgery before neoadjuvant radiotherapy and chemotherapy for rectal cancer[J]. Asian J Surg, 2020, 43(1): 383−384. DOI: 10.1016/j.asjsur.2019.09.003. [7] Neeman E, Gresham G, Ovasapians N, et al. Comparing physician and nurse Eastern Cooperative Oncology Group Performance Status (ECOG-PS) ratings as predictors of clinical outcomes in patients with cancer[J]. Oncologist, 2019, 24(12): e1460−e1466. DOI: 10.1634/theoncologist.2018-0882. [8] Wu AJ, Bosch WR, Chang DT, et al. Expert consensus contouring guidelines for intensity modulated radiation therapy in esophageal and gastroesophageal junction cancer[J]. Int J Radit Oncol Biol Phys, 2015, 92(4): 911−920. DOI: 10.1016/j.ijrobp.2015.03.030. [9] Eisenhauer EA, Therasse P, Bogaerts J, et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1)[J]. Eur J Cancer, 2009, 45(2): 228−247. DOI: 10.1016/j.ejca.2008.10.026. [10] Cai XW, Zeng Y, Feng W, et al. Randomized phase Ⅱ trial comparing tumor bed alone with tumor bed and elective nodal postoperative radiotherapy in patients with locoregionally advanced thoracic esophageal squamous cell carcinoma[J]. Dis Esophagus, 2019, 32(12): doz013. DOI: 10.1093/dote/doz013. [11] Zou BW, Pang J, Liu YM, et al. Postoperative chemoradiotherapy improves survival in patients with stage Ⅱ-Ⅲ esophageal squamous cell carcinoma: an analysis of clinical outcomes[J]. Thorac Cancer, 2016, 7(5): 515−521. DOI: 10.1111/1759-7714.12355. [12] Stiles BM, Kamel MK, Harrison SW, et al. Neoadjuvant therapy for locally advanced esophageal cancer should be targeted to tumor histology[J]. Ann Thorac Surg, 2019, 107(1): 187−193. DOI: 10.1016/j.athoracsur.2018.07.089. [13] Luo HS, Huang HC, Lin LX. Effect of modern high-dose versus standard-dose radiation in definitive concurrent chemo-radiotherapy on outcome of esophageal squamous cell cancer: a meta-analysis[J/OL]. Radiat Oncol, 2019, 14(1): 178[2020-10-17]. https://ro-journal.biomedcentral.com/articles/10.1186/s13014-019-1386-x. DOI: 10.1186/s13014-019-1386-x. [14] Machiels M, Jin P, Van Hooft JE, et al. Reduced inter-observer and intra-observer delineation variation in esophageal cancer radiotherapy by use of fiducial markers[J]. Acta Oncol, 2019, 58(6): 943−950. DOI: 10.1080/0284186X.2019.1588991. [15] Corsi F, Bossi D, Sartani A, et al. Radio-guided and clip-guided preoperative localization for malignant microcalcifications offer similar performances in breast-conserving surgery[J]. Breast J, 2019, 25(5): 865−873. DOI: 10.1111/tbj.13354. [16] Tamburini N, Grossi W, Sanna S, et al. Chest wall reconstruction using a new titanium mesh: a multicenters experience[J]. J Thorac Dis, 2019, 11(8): 3459−3466. DOI: 10.21037/jtd.2019.07.74. [17] Wegner U, Rainford S. Adverse reaction regarding titanium-based marker clip: case report of a potential complication[J]. Int Med Case Rep J, 2019, 12: 291−295. DOI: 10.2147/IMCRJ.S222484. [18] Wood MM, Warshaw EM. Hypersensitivity reactions to titanium: diagnosis and management[J]. Dermatitis, 2015, 26(1): 7−25. DOI: 10.1097/DER.0000000000000091. [19] Tan L, Feng J, Zhao Q, et al. Preoperative endoscopic titanium clip placement facilitates intraoperative localization of early-stage esophageal cancer or severe dysplasia[J/OL]. World J Surg Oncol, 2017, 15(1): 145[2020-10-17]. https://wjso.biomedcentral.com/articles/10.1186/s12957-017-1188-2. DOI: 10.1186/s12957-017-1188-2. [20] Bittermann G, Ermer M, Voss P, et al. Comparison of virtual and titanium clip marking of tumour resection margins for improved radiation planning in head and neck cancer surgery[J]. Int J Oral Maxillofac Surg, 2015, 44(12): 1468−1473. DOI: 10.1016/j.ijom.2015.07.013. [21] Han Y, Oakley E, Shafirstein G, et al. Reconstruction of a deformed tumor based on fiducial marker registration: a computational feasibility study[J]. Technol Cancer Res Treat, 2018, 17: 1533034618766792. DOI: 10.1177/1533034618766792. [22] Stieb S, McDonald B, Gronberg M, et al. Imaging for target delineation and treatment planning in radiation oncology: current and emerging techniques[J]. Hematol Oncol Clin North Am, 2019, 33(6): 963−975. DOI: 10.1016/j.hoc.2019.08.008. [23] Babic B, Fuchs HF, Bruns CJ. Neoadjuvant chemoradiotherapy or chemotherapy for locally advanced esophageal cancer?[J]. Chirurg, 2020, 91(5): 379−383. DOI: 10.1007/s00104-020-01150-6. [24] Chan KKW, Saluja R, Santos KD, et al. Neoadjuvant treatments for locally advanced, resectable esophageal cancer: a network meta-analysis[J]. Int J Cancer, 2018, 143(2): 430−437. DOI: 10.1002/ijc.31312. [25] Shapiro J, Van Lanschot JJB, Hulshof MCC, et al. Neoadjuvant chemoradiotherapy plus surgery versus surgery alone for oesophageal or junctional cancer (CROSS): long-term results of a randomised controlled trial[J]. Lancet Oncol, 2015, 16(9): 1090−1098. DOI: 10.1016/S1470-2045(15)00040-6. [26] Motoori M, Ito Y, Miyashiro I, et al. Impact of age on long-term survival in patients with esophageal cancer who underwent transthoracic esophagectomy[J]. Oncology, 2019, 97(3): 149−154. DOI: 10.1159/000500604. [27] Iuliano S, Minelli R, Vincenzi F, et al. Eosinophilic esophagitis in pediatric age, state of the art and review of the literature[J]. Acta Biomed, 2018, 89(S8): S20−26. DOI: 10.23750/abm.v89i8-S.7866. [28] Deka AC, Srinivasan V, Dutta AM, et al. Expression of elastic fiber in esophageal squamous carcinoma tissue[J]. J Cancer Res Ther, 2015, 11(2): 277−279. DOI: 10.4103/0973-1482.146119. [29] Yoshida T, Amato MBP, Grieco DL, et al. Esophageal manometry and regional transpulmonary pressure in lung injury[J]. Am J Respir Crit Care Med, 2018, 197(8): 1018−1026. DOI: 10.1164/rccm.201709-1806OC. [30] Defize IL, Boekhoff MR, Borggreve AS, et al. Tumor volume regression during neoadjuvant chemoradiotherapy for esophageal cancer: a prospective study with weekly MRI[J]. Acta Oncol, 2020, 59(7): 753−759. DOI: 10.1080/0284186X.2020.1759819. [31] Zhang MS, Wu AJ. Radiation techniques for esophageal cancer[J]. Chin Clin Oncol, 2017, 6(5): 45. DOI: 10.21037/cco.2017.06.33. -





 下载:
下载: